The paper describes diagnostic systems for identifying inherited thrombophilias which are under comprehensive study in many clinics in the world. Introduction of up-to-date test systems to medical practice will promote prompt and effective diagnosis and optimal therapy.
Л.И. Патрушев
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
L.I. Patrushev, M.M. Shemyakin & Yu.A. Ovchinnikov Institute of Bioorganic Chemistry
Тромбозирование как артериальных, так и венозных сосудов играет большую роль в патогенезе наиболее частых и опасных заболеваний человека. Смертность от ишемичсской болезни сердца (ИБС) и ишемичсекой болезни мозга (ИБМ) составляет 40 – 45%. Частота тромбозов артерий сердца при инфаркте миокарда ссотавляет 85 – 70%. Тромбозы сосудов мозга определяют развитие инсультов в 75 – 80% случаев. Тромбоэмболию легочной артерии (ТЭЛА) обнаруживают в 16% всех вскрытий, а диагностируют при жизни лишь в 30% случаев. Смертность от ТЭЛА бывает у 1 из 1000 живущих в год. Послеоперационные венозные тромбозы и тромбоэмболии составляют при абдоминальной хирургии 29%, в ортопедии при переломе бедра – 53%, операции бедра – 59%, а в нейрохирургии – 29%. Венозные тромбозы в общемедицинской практике наблюдают при инфаркте миокарда в 30 – 40% случаев, при сердечной недостаточности – в 70%, при инсульте – почти в 75% случаев.
ДВС-синдром, который лучше называть синдромом внутрисосудистого микросвертывания крови, можно обнаружить у каждого больного, страдающего хронической патологией. Все это является основанием для активных поисков причин внутрисосудистого тромбообразования.
Со времен Р. Вирхова хорошо известно, что тромбообразование в живом организме имеет место лишь при наличии определенных предпосылок: замедление кровотока, повреждение сосудистой стенки и склонность самой крови к свертыванию. Заболевания, протекающие с нарушениями кровообращения (гемодинамики), а также заболевания сосудов вне зависимости от их причины часто сопровождаются тромбообразованием. Гипотезы, объясняющие это, сводятся к тому, что при замедлении кровотока создаются возможности для концентрирования прокоагулянтных субстанций и потенцирования их тромботических свойств. При нарушении сосудистой стенки появляются возможности для активации тромбоцитарного и фибринформирующего компонентов крови за счет изменения электрического потенциала интимы, высвобождения тканевого фактора и нарушения противотромботических свойств самого сосуда. Под последним подразумевается снижение синтеза продуцируемых клетками эндотелия простациклина и других белков, препятствующих гемокоагуляции и способствующих тромболизу.
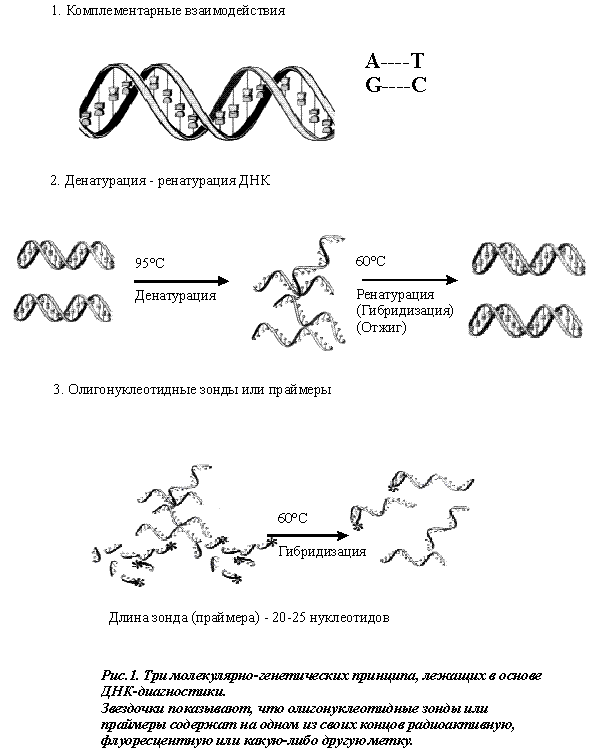
Все перечисленные в триаде Р. Вирхова причины тромбозов в случае их установления должны приводить к констатации у пациента тромбофилической (при наличии тромбозов) или предтромбофилической (при их отсутствии) ситуации.
Генетические причины патологии сосудов и характеристики сердечной недостаточности сегодня точно не известны, в связи с чем наличие этих проявлений должно трактоваться как случай приобретенной тромбофилии. В то же время дефекты факторов свертывания крови и фибринолиза, которые сопровождаются семейным анамнезом, должны относиться к истинным наследуемым тромбофилиям. Изменения этих факторов, которые сопровождаются наличием маркеров повышенного внутрисосудистого свертывания крови в отсутствие тромботического семейного анамнеза и встречаются при множестве заболеваний, должны быть расценены в качествте приобретенных тромбофилических состояний.
К известным факторам риска тромбообразования относятся: травма, возраст старше 40 лет, сердечная недостаточность, наличие новообразований, нефротический синдром, прием оральных контрацептивов, предсуществующие венозные тромбоэмболии, системная красная волчанка, тромбоцитоз, полицитемия, а также атеросклероз, васкулиты, гиперволемии (общие и регионарные). Наибольшие достижения сегодня получены в области изучения самого слабого положения Р. Вирхова – коагуляционного потенциала самой крови. Изучение молекулярных механизмов тромбообразования и фибринолиза позволяет с уверенностью говорить о том, что существуют наследуемые, а иногда и приобретенные в процессе жизни дефекты белков, которые и обусловливают предрасположенность того или иного человека к внутрисосудистому тромбообразованию, т. е. определяют наличие у него истинной тромбофилии. В отличие от первых двух причин, выдвигавшихся Р. Вирховом, эти дефекты наследуются и, значит, являются генетически детерминированными.
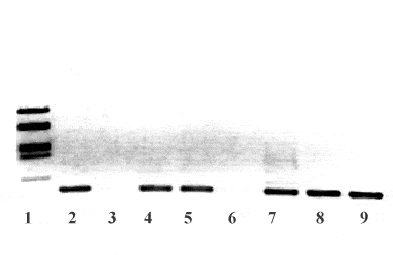
Рис. 2. Результаты ДНК-диагностики тромбофилий, обусловленных лейденской мутацией. Продукты ПЦР разделяли электрофорезом и окрашивали. Дорожки 2,4,5,7-9 – ДНК пациентов, содержащих мутацию, дорожки 3,6 – ДНК пациентов без мутации, дорожка 1 – молекулярные маркеры.
Начало поисков наследуемой тромбофилии было положено работами О. Эгеберга. В 1965 г. он описал норвежскую семью, в которой склонность к венозным тромбозам наблюдалась на протяжении нескольких поколений. Тромботические явления были отмечены в молодом возрасте. Изучение крови больных позволило обнаружить выраженное уменьшение (на 40 – 50%) антитромбина III. Более поздние исследования Г. Шаш показали возможность различных форм дефекта антитромбина III, который встречается довольно часто. У больных с повторными тромбозами его выявляли у 5 – 7%, при анализе лиц с однократно диагностированным венозным тромбозом он встречался в 1% случаев. Среди здоровых лиц его выявляют у 1 на 5000 обследованных.
Наледственные тромбофилии изучаются достаточно интенсивно во многих клиниках мира. Полученные результаты позволяют предполагать наличие наследственной тромбофилии у любого пациента в том случае, если у него или его кровного родственника имелись тромботические проявления в молодом возрасте.
В настоящее время обнаружены дефекты в генах следующих факторов свертывания крови, приводящие к наследственным тромбофилиям:
1. Антитромбин III (полное отсутствие или изменение количества).
2. Протеин С (полное отсутствие или изменение количества).
3. Протеин S.
4. Кофактор гепарина II.
5. Фибриноген.
6. Плазминоген.
7. Активатор плазминогена (t-РА).
8. Фактор Хакемана.
9. Факторы тромбоцитов.
10. Простациклин.
11. АРС-резистентность фактора V.
12. Гомоцистеинемия.
Причиной второго тромбофилического заболевания, возникающего в результате наследования дефекта белка, был дефект протеина "Си". Это явление было описано в 1981 г. Дж. Гриффином в США, а вскоре его наблюдали в Голландии и Австрии. Причиной тромбозов явилась неспособность ограничивать активность факторов V и VIII фибринообразования витамин К-зависимым белком, протеином С. Этот дефект наблюдается в 6 – 8% случаев повторных тромбозов, у 3% лиц, имевших первичный тромбоз глубоких вен, и у 0,2% здоровых лиц, т.е. в 10 раз чаще, чем дефект антитромбина III.
В 1984 г. П. Комп и С. Эсмон описали наследственную предрасположенность к тромбозам в результате дефицита протеина S.
Оказалось, что данный белок, так же как и протеин С, участвует в ингибировании активных факторов V и VIII. Частота этого дефекта у людей с тромбофилией колеблется по различным статистическим данным от 1 до 13% и отмечается у 1 – 2% лиц с первичным тромбозом глубоких вен.
Эти работы заставили многих клиницистов думать о наличии тромбофилий, однако более пристальное внимание к данной проблеме стало оказываться лишь после 1993 г., когда шведский ученый Бьерн Дельбек сообщил о семейной тромбофилии, возникшей в результате дефектного ответа плазмы больного на добавление к ней активированного протеина С. Этот феномен, получивший название "АРС–резистентность", был детально изучен многими авторами, что привело к важному открытию. Оказалось, что фактор V свертывания крови, который образуется в печени и мегакариоцитах, может иметь нарушение молекулярной структуры, заключающееся в замене аргинина в положении 506 его полипептидной цепи на глицин. Этот наследственный дефект оказался самым частым. У лиц с частыми тромбозами он встречается в 52% случаев, у пациентов с первичным тромбозом глубоких вен – в 20%, а среди здорового населения – в 3 – 7%. Весьма интересным является тот факт, что данные дефекты чаще всего встречаются у европейцев, а в азиатской популяции их частота уменьшается.
Согласно ранее приведенному списку, описаны случаи тромбофилий, обусловленные дефектами фибриногена, плазминогена, ингибитора тканевого активатора плазминогена, гепарин-кофактора II.
Гепарин-кофактор II был впервые описан в 1974 г. Бригиншоу и Шанберг и выделен в 1981 г. Толлефсеном и др., а в 1981 г. – двумя группами авторов – Траном, Марбелем и Дукеном, а также Силом и др. Брно и соавт. описали случаи тромбофилий у лиц, имеющих врожденное снижение уровня гепарин-кофактора II. Предполагают,что этот фактор обладает мощным антитромбиновым свойством и может активироваться дерматаном-сульфатом на поверхности стенок сосудов, что позволяет некоторым авторам рассматривать его в качестве "защитной системы второго эшелона".
Протеин S осуществляет свое действие, опосредуя прикрепление протеина С к мембранам тромбоцитов, что позволяет последнему взаимодействовать с активированными факторами Va и VIIIA, а также с комплексом факторов Ха - Va. Усиление фибринолитической активности при этом происходит за счет уменьшения активности ингибитора РАI-1.
Одним из внешних признаков, позволяющих предполагать у больных наличие дефицита протеина С, является появление кожных поверхностных некрозов, особенно в тех местах, где есть ибыток жировой ткани (липома). Это особенно характерно для лиц, принимавших оральные антикоагулянты.
Причиной тромбозов как следствия наследственной тромбофилии могут быть дефекты молекулы фибриногена. Любопытно, что дисфибриногенемии могут быть причиной не только тромбозов, но и геморрагий. Описаны генетические дефекты, проявляющиеся в нарушении структуры любой из трех цепей фибриногена Аa, Вb и y-цепи. Связь между дефектами молекулы и фенотипом тромбозов пока не ясна. Частота их невелика – 0,8% среди имевших тромботические явления.
У 19% лиц с ювенильными венозными тромбозами обнаруживают гипергомоцистеинемию. В большинстве случаев этот фенотип наследуем.
Частота тромбозов при тяжелой гипергомоцистеинемии изучается, хотя этот феномен встречается лишь у 1 на 300 000 жителей. Часты сообщения о том, что тромботические ситуации сочетаются с дефектом плазминогена и дисплазминогенемией. В то же время частота этой патологии составляет лишь 0,4% в популяции, а у лиц с тромбозами – 3%. Все изложенное заставляет вести детальные поиски причины тромбозов в каждом конкретном случае.
Повышенный риск венозного тромбоэмболизма, связанного с наличием у больного дефектного аллеля соответствующего гена, доказан для наследственного дефицита антитромбина III, протеина С, протеина S и фактора V, что в сумме является причиной более 50% случаев наследственных тромбофилий. Наследственные дефициты этих протеинов выявляют не только у лиц с тромбофилией, так как они могут протекать и без клинических проявлений. Эти факты позволяют предполагать, что дефицит лишь по одному протеину не всегда является достаточным условием развития тромбофилии и для формирования соответствующего фенотипа необходимо участие других факторов. Сочетание дефектов перечисленных факторов является нередким, и обычно это сочетание характеризуется более тяжелыми тромбофилиями, чем одиночные дефекты.
При изучении тромботического и геморрагического анамнеза у 77 лиц с наследственным дефицитом фактора XII Б. Дэммле и соавт. установили, что тромботические осложнения имелись лишь в 3 случаях, в то время как склонность к кровоточивости отмечена у 1 больной, у которой уровень фактора XII был в пределах 50% от нормы (XII:С – 52%, XII-Ar – 53%). Наблюдая за эффективностью профилактического назначения оральных антикоагулянтов у больных с дефицитом антитромбина III, протеина С, плазминогена и дисфибриногенемией, Жд. Финацци и соавт. (1989) не отметили тромбозов глубоких вен при уровне протромботического времени ИНР – 2,5 – 4,0; наблюдения за пациентами с дефицитом фактора V выявили случай рецидивирующего тромбоза вен нижних конечностей с ТЭЛА артерии у больного, имевшего снижение коагуляционного уровня фактора V и антигена фактора V соответственно до 12 и 10%.
Нефротический синдром также сопровождается тромботическими осложнениями в связи с тем, что гипоальбуминемия не позволяет формироваться фибриновому сгустку, к которому имеется тропность у плазминогена, и создавать условия контактирования плазминогена с его тканевым активатором.
Профилактика и лечение наследственных тромбофилий не являются чем-то особенным и могут успешно осуществляться имеющимися на вооружении клиницистов гепарином и оральными антикоагулянтами. В связи с этим основной проблемой этой части современной медицины являются выявление маркеров тромбофилий и отработка режимов противотромботической терапии (дозировки препаратов и длительности их назначения).
Можно предполагать, что предрасположенность к тромбозам детерминирована генетически во всех случаях их возникновения – и при поражении сосудов (в том числе и атеросклерозом), и при недостаточности кровообращения. Однако сегодня с достоверностью можно говорить о наличии генетических дефектов – мутаций в генах системы свертывания крови – лишь при этом типе тромбофилий.
Мутационные изменения в генах могут происходить на протяжении всей жизни человека. В том случае, если мутации возникают в геноме клеток зародышевой линии, все соматические клетки организма-потомка, развивающегося из мутантной зиготы, образовавшегося от слияния мутантных яйцеклетки и сперматозоида, будут содержать указанную мутацию. Чем позже в онтогенезе (индивидуальном развитии) человека возникает соматическая мутация, тем меньше размер клона мутантных клеток, заключенного во взрослом организме. Если же мутация доминантна, т. е. патологический мутантный признак, определяемый мутантным геном, проявляется даже при наличии в соматичсеких клетках копии нормального гена, полученного от другого родителя, развивается генетическое наследственное заболевание.
В случаях, когда мутация, определяющая мутантный фенотип, рецессивна (ее действие проявляется лишь в гомозиготном состоянии, при котором один и тот же мутантный ген получен от обоих родителей), можно говорить о предрасположенности организма к соответствующему заболеванию и носительстве мутантного гена. Организм, у которого действие рецессивной мутации маскируется функционированием другого полноценного аллеля, внешне (фенотипически) выглядит совершенно нормальным. Однако у него гораздо больший риск дать больное потомство в браке с носителем такого же мутантного гена, что является одной из причин запрета на близкородственные браки. С другой стороны, у носителей определенных мутантных генов в гетерозиготном состоянии может произойти соматическая мутация в соответствующем аллельном гене соматических клеток, что также станет причиной развития приобретенного генетического заболевания. Как известно, гены человека заключены в молекулах ДНК его хромосом, а изменения структуры ДНК, называемые мутациями, нарушают функционирование генов. В связи с этим выявление мутаций в конкретных генах человека является наиболее точным и прямым методом диагностики генетических заболеваний.
В основе всех методов ДНК-диагностики лежат три фундаментальных принципа молекулярной биологии (рис. 1). Это прежде всего существование комплементарных взаимодействий между двухцепочечными молекулами нуклеиновых кислот (первый принцип), которые после денатурации с последующей ренатурацией (второй принцип) позволяют им безошибочно находить друг друга и восстанавливать первоначальную структуру. Если же в процессе ренатурации нуклеиновых кислот добавить в пробы короткие молекулы одноцепочечной ДНК (зонды или праймеры), ковалентно соединенные с каким-либо меченым соединением (третий принцип), то они благодаря комплементарным взаимодействиям соединяются с тем участком нуклеиновой кислоты, который содержит последовательность нуклеотидов, строго соответствующую последовательности нуклеотидов зонда (или праймера). Наличие связавшейся с нуклеиновой кислотой метки с высокой точностью свидетельствует о присутствии в анализируемом образце искомых последовательностей нуклеотидов.
Разработанные недавно методы молекулярной биологии и особенно метод полимеразной цепной реакции (ПЦР) значительно облегчили проведение диагностики наследственных заболеваний. При этом мутации выявляются непосредственно в ДНК клинических образцов, чаще всего крови. Суть этой реакции заключается в том, что короткие фрагменты исследуемого гена (праймеры), добавленные к анализируемой ДНК, специфически связываются с поврежденным участком исследуемого гена и делают возможным многократное его воспроизведение с помощью специального фермента – ДНК-полимеразы. Образующийся при этом продукт ПЦР может быть легко обнаружен с помощью электрофореза. Его отсутствие отрицает искомую патологию.
Использовав эти возможности ПЦР, мы создали набор для диагностики тромбофилий, вызываемых резистентностью фактора V к активированному протеину С, т.е. для обнаружения лейденской мутации. Один из результатов диагностики представлен на рис. 2. Видно, что лишь в образцах ДНК с лейденской мутацией образуется продукт ПЦР (дорожки), тогда как в образцах без мутации он не синтезируется. Наши исследования показали, что в московской популяции венозные тромбозы, обусловленные лейденской мутацией, встречаются в 10% случаев. Мы полагаем, что внедрение этой и аналогичных тест-систем в клиническую практику для выявления наследственных тромбофилий будет способствовать осуществлению быстрой и эффективной диагностики, а также оптимальному подбору терапии.
Рекомендуемая литература:
1. Бокарев И.Н. (1991) Тромбофилические состояния и их клинические аспекты. Клин. мед., №8, 11–7.
2. Зыков Е.С., Патрушев Л.И., Каюшин А.Л., Коростелева М.Д., Мирошников А.И., Бокарев И.Н., Леонтьев С.Г., Кошкин В.М., Северин Е.С. (1997) Новые аллель-специфические праймеры для обнаружения мутации Leiden в экзоне 10 гена фактора V при тромбофилиях. Биоорган. химия, 23, 205–10.
3. Dahlback B. (1995) The protein C anticoagulant system: inherited defects as basis for venous thrombosis. Thromb Res 77;1–43.
4. Shikata H, Utsumi N, Kuivaniemi H, Tromp G. (1995) DNA-based diagnostics in the study of heritable and acquired disorders. J Lab Clin Med 125;421-32.












