Введение
Фиброаденома (ФА) — наиболее часто встречающаяся доброкачественная опухоль молочной железы (МЖ) у женщин репродуктивного возраста [1]. ФА чаще всего обнаруживается в возрасте до 35 лет, но может быть выявлена и позднее при профилактическом обследовании [2]. Опухоль состоит из фиброзной и железистой ткани в различных пропорциях и, как правило, имеет капсулу и четкие границы. Часто заболевание протекает бессимптомно и требует только динамического наблюдения. Однако наличие ФА может вызывать определенное беспокойство у женщин, приводящее к желанию избавиться от новообразования. Показаниями к оперативному лечению (хирургическое удаление или вакуумная аспирационная экстракция опухоли) являются быстрый рост ФА, атипичный вид опухоли при ультразвуковом исследовании (УЗИ), а также наличие симптомов и активное желание самой пациентки [3]. Хирургическое вмешательство — это инвазивный метод лечения, требующий выполнения разреза и нередко приводящий к формированю рубца как на поверхности кожи, так и в ложе опухоли. При удалении крупных новообразований также возможно появление деформации (дефекта/западения) контуров МЖ [1]. Вакуумная экстракция считается менее инвазивным вариантом терапии, однако при ее проведении часто не удается достичь полного (радикального) удаления всей опухолевой ткани, в связи с чем возможен повторный рост ФА [4].
Впервые замораживание как метод лечения опухолей МЖ описал еще в 1851 г. James Arnott, который для этих целей использовал охлажденный до очень низких температур (около -20 °С) гипертонический солевой раствор со льдом [5]. В 1960-е гг. были созданы первые экспериментальные криогенные установки, работавшие на жидком азоте. Первая коммерчески доступная система (второго поколения), основанная на методе накачки жидкого азота, была выпущена в 1991 г., однако существенным недостатком данной системы являлся очень большой диаметр криозондов (1 см и более). Стремительное развитие чрескожной криоабляции (ЧК) в последнее десятилетие связано с созданием в начале 2000-х гг. аргоно-гелиевых криогенных установок третьего поколения, в которых для охлаждения криозондов используется не жидкий азот, а находящийся под большим давлением аргон [5]. Изменение технологии охлаждения криозондов позволило уменьшить их диаметр до размеров обычной биопсийной иглы (17 G, или 1,5 мм), что сделало возможным безопасное использование ЧК для лечения различных новообразований [6–8]. В настоящее время ЧК под УЗ-контролем рассматривается как один из наиболее перспективных минимально инвазивных методов лечения ФА МЖ [9–11]. Преимуществами ЧК перед другими видами радикальной терапии ФА являются безболезненность, атравматичность, надежный мониторинг выполнения процедуры (путем визуализации ледяного шара), а также отсутствие рубцов на коже в месте вмешательства [2, 9–11]. Однако в отечественной литературе сведения о технических особенностях проведения ЧК ФА МЖ, а также о ее результатах в настоящее время практически отсутствуют.
Цель исследования — в рамках проспективного исследования изучить технические аспекты, а также непосредственные и ближайшие результаты применения ЧК под УЗ-контролем в лечении ФА МЖ диаметром до 30 мм на большой группе пациенток.
Материал и методы
В проспективное исследование были включены 29 пациенток с морфологически верифицированной одиночной ФА МЖ, которым с января 2016 г. по декабрь 2017 г. выполнили ЧК ФА МЖ. Возраст пациенток на момент операции составлял 22–51 год (в среднем — 32,2±1,17 года, медиана — 30,5 года).
Критериями включения в исследование были наличие отчетливо визуализируемой при УЗИ одиночной ФА диаметром ≤30 мм, характеризующейся ростом в течение последних 6 мес., а также желание пациентки. Размер ФА в наибольшем измерении (по длинной оси) варьировал от 13 до 30 мм, в среднем — 21,0±0,99 мм, медиана — 20,0 мм.
Процедуры криоабляции выполняли хирурги отделения рентгенохирургических методов диагностики и лечения (ОРХМДиЛ), имеющие стаж работы по специальности более 15 лет. Все врачи имели опыт использования чрескожной энергетической абляции (радиочастотной абляции, микроволновой абляции и криоабляции) для лечения первичных и метастатических опухолей различных локализаций более чем у 200 пациентов. Кроме того, все хирурги прошли дополнительное обучение по методике проведения ЧК ФА МЖ в соответствии с международной образовательной программой компании Galil Medical (США).
До начала процедуры с целью планирования вмешательства осуществляли тщательный осмотр пациенток, пальпацию и УЗИ МЖ. УЗИ выполняли на ультразвуковой диагностической системе Vivid I (GE HealthCare, США) линейным датчиком 8L RS (4,0–13,0 МГц). Полученные данные использовали для составления плана проведения ЧК в зависимости от объема МЖ, размеров и локализации ФА. При этом заранее определяли точку введения криозонда, траекторию таргетирования опухоли, длительность и интенсивность замораживания, а также возможность применения дополнительных манипуляций для защиты кожи и плевры от термического повреждения. У всех пациенток на проведение ЧК было получено добровольное письменное информированное согласие.
Во всех случаях процедуру абляции проводили амбулаторно в рентгеноперационной ОРХМДиЛ на аргоно-гелиевой криогенной установке SeedNet Gold (Galil Medical, США) с использованием криозонда IceSphereTM (Galil Medical, США) диаметром 17 G, или 1,5 мм (рис. 1).
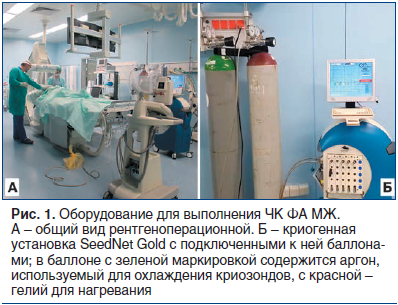
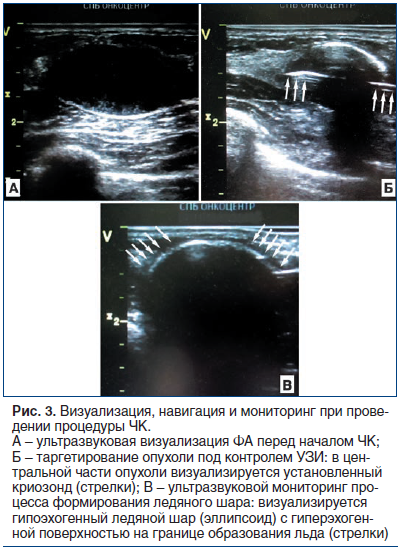
Первым этапом вмешательства под УЗ-контролем выполняли местную анестезию места пункции 20 мл 1% раствора лидокаина. После этого проверяли работоспособность криозонда in vitro путем погружения его рабочей части в физиологический раствор и включения криогенной установки в тестовом режиме (рис. 2 А). Точку входа криозонда на коже располагали по передней подмышечной линии или по маммарной складке. Также с целью обеспечения косметического эффекта введение криозонда в кожу производили только путем ее прокола, без использования дополнительного разреза. После этого под контролем УЗ осуществляли установку аппликатора в опухоль. При этом позиционирование криозонда выполняли таким образом, чтобы он проходил через центральную ось ФА по ее максимальному длиннику, а центр будущего ледяного шара (формируется в 12 мм от кончика аппликатора) располагался в центре опухоли (рис. 3 А, Б). После контрольного сканирования в разных проекциях и под разными углами озвучивания убеждались в том, что положение криозонда в опухоли адекватное, и начинали процесс ЧК.
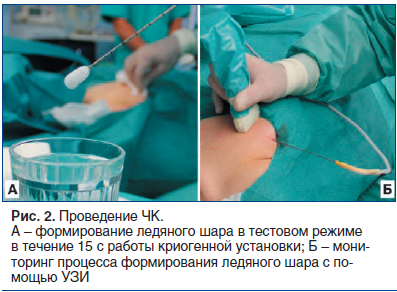
Криоабляцию осуществляли в 100% режиме подачи аргона при постоянном мониторинге формирования ледяного шара с помощью УЗИ в режиме реального времени (рис. 2 Б, рис. 3 В). Замораживание выполняли до тех пор, пока границы ледяного шара не выходили за границы опухоли как минимум на 3 мм по всей ее поверхности. Таким образом, при правильно проведенной процедуре ЧК размеры зоны абляции должны были превышать размеры ФА не менее чем на 6 мм. При близком предлежании опухоли к коже (менее 3 мм) для предотвращения ее термического повреждения (промораживания) к МЖ в зоне ЧК прикладывали стерильную хирургическую перчатку, наполненную горячим физиологическим раствором. При локализации опухоли недалеко от плевры использовали гидродиссекцию, заключавшуюся во введении 20–40 мл стерильного физиологического раствора в клетчатку МЖ между ФА и легким, что давало возможность отодвинуть опухоль и выполнить процедуру без термического повреждения плевры. После достижения целевых размеров ледяного шара подачу аргона прекращали и дожидались пассивного (т. е. без использования гелия) оттаивания всей зоны абляции, которое занимало 10–12 мин и мониторировалось с помощью УЗИ. Далее проводили второй цикл криоабляции (цикл замораживания — оттаивания) по аналогичной схеме, удаляли криозонд и выполняли механическую компрессию МЖ в течение 10–15 мин. После окончания процедуры на МЖ накладывали давящий бандаж и в течение 3 ч наблюдали пациентку в палате дневного пребывания. Дальнейшее динамическое наблюдение осуществляли по данным контрольных осмотров и результатов УЗИ, которые выполняли через 3, 6 и 12 мес. после вмешательства. В рамках исследования проспективно анализировали технический успех (и техническую эффективность) процедуры ЧК, число и виды осложнений, динамику уменьшения размеров (объема) зоны абляции, состояние кожи в месте входа (вкола) криозонда, а также общую удовлетворенность пациенток выполненным вмешательством.
Результаты исследования
За период с января 2016 г. по декабрь 2017 г. 29 пациенткам проведено 29 сеансов ЧК. Все проведенные процедуры ЧК были расценены как технически успешные (выполнен запланированный объем вмешательства) и технически эффективные — во всех случаях удалось достичь перекрытия опухоли ледяным шаром не менее чем на 3 мм от поверхности. Длительность замораживания (подачи аргона), потребовавшаяся для достижения целевых параметров абляции, варьировала от 4 до 14 мин в зависимости от размеров ФА и в среднем составила 7 мин 6 с ± 30 с (медиана — 6 мин 30 с). У 2 пациенток с близким расположением опухоли возле плевры потребовалось выполнение гидродиссекции для предотвращения термического повреждения последней. В 3 случаях в связи с поверхностной локализацией ФА для исключения промораживания кожи на время криоабляции к МЖ прикладывали стерильную хирургическую перчатку, заполненную горячим физиологическим раствором. Еще в 1 случае подкожного расположения опухоли потребовалось применение комбинированной методики в виде гидродиссекции и прогревания кожи.
В первые 3 сут после ЧК все пациентки отмечали минимальный дискомфорт, болезненность и отечность МЖ на стороне вмешательства, не требовавшие применения лекарственных препаратов. Только в 3 случаях (10,3%) после ЧК возникли умеренные боли в МЖ, сопровождавшиеся развитием гематомы в месте пункции и в месте выполненной абляции (рис. 4 А, Б). Боли были купированы в течение 1 сут после процедуры приемом нестероидных противовоспалительных препаратов. Гематомы исчезли самостоятельно в течение 2 нед. после вмешательства и не потребовали лекарственного или хирургического лечения.
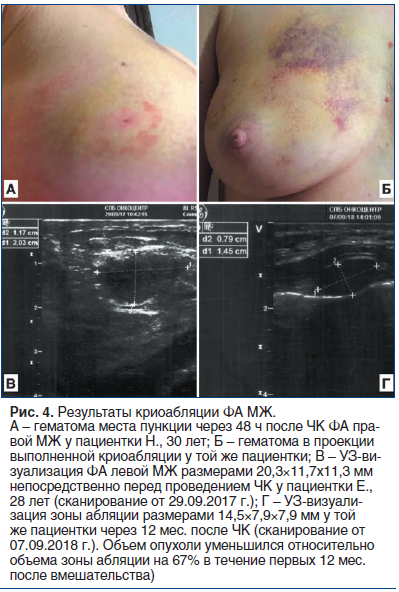
Уменьшение размеров зоны абляции в течение первого года после ЧК наблюдалось у 26 пациенток, что составило 89,7% случаев (рис. 4 В, Г). При этом по данным УЗИ объем зоны абляции уменьшился в среднем на 28%, 54% и 70% через 3, 6 и 12 мес. наблюдения соответственно. У 3 пациенток (10,3%) зона абляции не имела тенденции к уменьшению размеров, однако случаев ее увеличения или повторного появления ФА за период наблюдения отмечено не было. Только у 6 пациенток (20,7%) через 12 мес. после ЧК в МЖ пальпировалось резидуальное образование, соответствующее зоне выполненной абляции. До выполнения ЧК 9 пациенток (31,0%) жаловались на периодические ноющие боли в МЖ на стороне образования. Через 12 мес. после операции боли сохранялись только в 2 наблюдениях (6,9%), при этом интенсивность их существенно снизилась.
В процессе наблюдения не было выявлено ни одного случая появления рубцовой ткани на коже в месте входа (вкола) аппликатора. Через 1 год после вмешательства только у 2 пациенток (6,9%) в месте вкола на коже определялись минимальные изменения (неравномерная пигментация), в то время как в остальных случаях какие-либо следы выполненного вмешательства полностью отсутствовали.
Удовлетворенность пациенток результатами лечения (как косметическим, так и терапевтическим эффектом) через 3, 6 и 12 мес. после процедуры ЧК составила 93,1% (n=27), 93,1% (n=27) и 89,7% (n=26) соответственно.
Обсуждение
В проведенном нами исследовании у 26 из 29 пациенток (89,7%) после выполнения ЧК отмечено прогрессивное уменьшение размеров зоны абляции в течение первых 12 мес. наблюдения. Известно, что скорость и выраженность регресса зоны абляции зависят главным образом от соотношения железистой и фиброзной ткани, содержащейся в ФА [9]. Как было показано ранее, опухоли, состоящие преимущественно из железистой ткани, после ЧК подвергаются значительно более быстрой инволюции, чем ФА с высокой долей соединительнотканных волокон [9–11]. При этом уменьшение размеров зоны абляции происходит не только в первый год после процедуры ЧК, но и продолжается в течение следующих 12 мес. [2, 3, 9, 10]. Это позволяет надеяться на еще большее уменьшение объема зон абляции у наших пациенток в дальнейшем.
Высокая удовлетворенность пациенток результатами лечения в нашем исследовании была связана не только с хорошим терапевтическим, но и с очень хорошим косметическим эффектом, наблюдавшимся даже несмотря на то, что большинство образований было достаточно большого диаметра (в среднем — 21 мм). Связано это с тем, что после ЧК девитализированная ФА естественным образом реабсорбируется организмом и замещается здоровыми тканями. В связи с этим после ЧК не возникает деформации (дефекта/западения) контуров МЖ, даже в случаях лечения крупных новообразований [2, 9]. Кроме того, благодаря отсутствию разрезов на коже практически не остается никаких следов от выполненного вмешательства [10, 11].
ЧК обладает рядом неоспоримых преимуществ перед гипертермическими видами энергетического воздействия — радиочастотной, микроволновой и лазерной абляцией [6, 7]. Во-первых, проведение ЧК абсолютно безболезненно, в связи с чем не требует наркоза. Во-вторых, благодаря визуализации ледяного шара с помощью УЗИ возможен постоянный мониторинг процедуры, существенно повышающий ее прецизионность. В-третьих, в зоне абляции после ЧК не остается грубого рубца, значительно затрудняющего УЗИ- и МРТ-визуализацию МЖ в том случае, если пациентке необходимо дальнейшее динамическое наблюдение [10, 11].
Заключение
Таким образом, проведенное нами исследование показало, что ЧК под УЗ-контролем может рассматриваться как метод выбора для лечения ФА МЖ диаметром ≤30 мм. ЧК является наиболее перспективным минимально инвазивным, эффективным и безопасным методом терапии, сопровождающимся высокой удовлетворенностью пациенток косметическим и терапевтическим результатами вмешательства, что связано с возможностью выполнения операции в амбулаторном режиме, непродолжительным временем вмешательства, отсутствием разрезов, формирования рубца и деформации контуров МЖ в послеоперационном периоде. Применение местной анестезии, возможность интраоперационной УЗ- и послеоперационной динамической МРТ-визуализации наделяет ЧК неоспоримыми преимуществами перед другими видами лечения.












