Достоверных данных об истинной распространенности ВУИ нет. Однако, согласно данным ряда исследований, инфекционные заболевания выявляют у 50–60% госпитализированных доношенных и 70% недоношенных новорожденных [1]. Основной причиной ВУИ являются инфекционные урогенитальные заболевания матери, частота которых в структуре заболеваемости беременных сохраняется высокой в течение последних 10 лет и составляет 88–100 на 1000 беременных. К сожалению, в настоящее время мы не имеем достоверных сведений о вероятности заражения плода от инфицированной матери, но риск инфицирования плода различными микроорганизмами, выделенными у матери, колеблется от 5 до 70%, а данные о частоте реализации инфекции у новорожденного недостаточны и крайне противоречивы [2, 3].
Ранняя диагностика
Большой интерес представляет исследование роли про- и противовоспалительных цитокинов в патогенезе инфекционных заболеваний у новорожденных [15–17]. Во многих работах [18–20] сообщается о высокой диагностической и прогностической ценности определения уровней ФНО и
Доказано, что ПКТ является чувствительным маркером системной воспалительной реакции у новорожденных на
Цель настоящего исследования: повысить качество диагностики ВУИ и оптимизировать тактику ведения новорожденных высокого инфекционного риска в раннем неонатальном периоде путем применения алгоритма обследования с использованием доступных и информативных тестов.
Материалы и методы
Было проведено обследование 240 доношенных и 10 недоношенных новорожденных, родившихся у матерей с
Течение настоящей беременности осложнилось присоединением преэклампсии у 50 (20%) матерей, с такой же частотой была диагностирована анемия беременных, угроза прерывания беременности имела место примерно у половины (46%) пациенток. По результатам комплексной оценки нарушения функции фетоплацентарного комплекса были диагностированы у 100 (40%) беременных, многоводие — в 30 (12%) наблюдениях.
Роды были самопроизвольными в 160 (64%) наблюдениях, путем операции кесарева сечения родоразрешение было выполнено 86 (34,4%) беременным, у 4 (1,6%) рожениц была применена
Для выявления
Наряду со стандартным
Частота выделения представителей аэробной микрофлоры в мазках со слизистой носоглотки, из ануса у новорожденных высокого инфекционного риска в момент рождения составила от 40,2% (у клинически здоровых новорожденных) до 62,2% (у детей с тяжелыми формами ВУИ). Для тяжелых форм ВУИ была характерна высокая частота контаминации новорожденных представителями инфекций, передающихся половым путем:
Результаты исследования
На основании оценки клинических данных и показателей иммунитета с использованием перцентильной шкалы основных иммунологических показателей у обследованных новорожденных были выделены следующие варианты иммунного реагирования и состояния цитокинового статуса в раннем неонатальном периоде.
У новорожденных с тяжелыми формами ВУИ (обследовано 14 детей) были выявлены два варианта иммунного реагирования. Первый вариант (8 новорожденных) характеризовался активацией клеток врожденного и адаптивного иммунитета в сочетании с их незрелостью, повышением ИФН в сыворотке крови и способности лейкоцитов к продукции α-ИФН при низкой способности лимфоцитов к выработке γ-ИФН. У
Второй вариант (6 новорожденных) отличался отсутствием активации иммунитета и повышения ИФН, дефицитом фагоцитов, зрелых Т- и
Отличительными чертами иммунного ответа у новорожденных с локализованными
Состояние иммунитета у новорожденных с выявленными при ультразвуковых исследованиях морфологическими изменениями в ЦНС и внутренних органах (обследовано 8 детей) характеризовало законченный к моменту рождения инфекционный процесс. Иммунный ответ характеризовался повышением числа зрелых иммунокомпетентных клеток и уровня IgG, показатели ИФС не отличались от нормативных значений. Была снижена индуцированная продукция
Результаты микробиологического исследования у матерей (
У новорожденных с гипоксическими повреждениями ЦНС (обследовано 15 новорожденных) гипоксия являлась дополнительным повреждающим фактором, способствующим увеличению антигенной нагрузки, и в условиях низкого риска внутриутробного инфицирования (у 8 детей) приводила к активации клеток врожденного иммунитета без изменений в цитокиновом статусе. При сочетании гипоксии с микробной контаминацией у 7 новорожденных иммунный ответ характеризовался повышенным потреблением макрофагов из кровеносного русла, увеличением уровня IgM в сыворотке крови, усилением продукции провоспалительных цитокинов, снижением способности лимфоцитов к продукции γ-ИФН, что не исключало манифестацию ВУИ, клинические проявления которой на фоне симптомов повреждения ЦНС и проводимой противоинфекционной терапии могли быть стертыми.
Иммунный ответ у новорожденных со ЗВУР (обследовано 14 детей) характеризовался снижением количества клеток врожденного и адаптивного иммунитета (CD3+, CD20+, CD8+, CD16+, моноцитов). Были установлены два типа ИФС. Отличительными особенностями первого типа ИФС были отсутствие ИФН в сыворотке крови и высокая способность лимфоцитов к продукции γ-ИФ. Второй тип ИФС был сопряжен с повышением сывороточного ИФН (16 МЕ/мл) и низкой способностью лимфоцитов к продукции γ-ИФН (<4 МЕ/мл). Имелась статистически значимая зависимость (р=0,004) между вторым типом ИФС и частотой постнатальной инфекции у новорожденных со ЗВУР, которая составила 64,3% (заболели 9 новорожденных).
Показатели иммунитета и цитокинового статуса у клинически здоровых новорожденных без микробной контаминации (обследовано 17 детей) не отличались от нормативных значений. Микробная контаминация у клинически здоровых новорожденных (12 детей) иммунологически характеризовалась увеличением числа зрелых клеток адаптивного иммунитета (CD3+, CD20+, CD4+, CD8+, CD16+), уровня IgG, уменьшением числа клеток врожденного иммунитета (нейтрофилов и моноцитов), повышением способности лейкоцитов к продукции α-ИФН (128 МЕ/мл и 545,3 пкг/мл),
Иммунологическими критериями ранней диагностики тяжелых форм ВУИ у новорожденных являются: повышение уровня IgM более 1,0
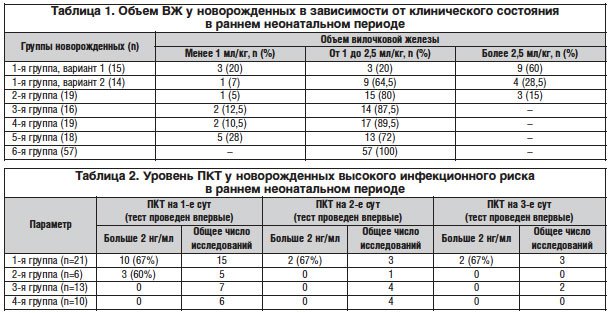
Поскольку основным органом иммунной системы у плода и новорожденного является тимус, были сопоставлены морфологические особенности ВЖ и иммунного статуса новорожденных группы высокого инфекционного риска для выявления информативных и доступных критериев ранней диагностики ВУИ и иммунной недостаточности. Проведенные исследования показали четкую взаимосвязь между объемом ВЖ, наличием и тяжестью клинических проявлений ВУИ и дефектами иммунитета у новорожденных в раннем неонатальном периоде (табл. 1).
Выявленная эхоскопически тимомегалия с объемом ВЖ более 2,5 мл/кг была статистически значимой для тяжелых форм ВУИ с нарушениями иммунного ответа в виде незрелости и активации клеток врожденного и адаптивного иммунитета с глубоким нарушением их эффекторных функций. Уменьшение объема ВЖ менее 1 мл/кг коррелировало с дисфункцией иммунитета в виде дефицита зрелых иммунокомпетентных клеток и недостаточности провоспалительного иммунного ответа, что клинически характеризовалось затяжным течением ВУИ и высокой частотой постнатальных
Учитывая диагностическую значимость ПКТ при системных инфекциях,
Новорожденные были разделены на 4 группы с учетом характера патологии.
В
Исследование ПКТ у новорожденных проводилось на
Повышение уровня ПКТ более 2 нг/мл в первые сутки жизни было статистически значимым для тяжелых форм ВУИ, сопровождающихся системной воспалительной реакцией и симптомами органной недостаточности. В то же время у новорожденных без симптомов
Заключение
Таким образом, в нашем исследовании показана четкая взаимосвязь между наличием и тяжестью клинических проявлений ВУИ, дефектами иммунитета, состоянием ВЖ и результатами полуколичественного
- Сидорова И.С., Макаров И.О., Матвиенко Н.А. Внутриутробные инфекции. М.: МИА, 2006. 176 с.
- Фризе К., Кахель В. Инфекционные заболевания беременных и новорожденных. Пер. с нем. М.: Медицина, 2003. 424 с.
- Неонатология – национальное руководство / Под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2008. 749 с.
- Ахматова Н.К., Киселевский М.В. Врожденный иммунитет: противоопухолевый и противоинфекционный. М.: Практическая медицина, 2008. 256 с.
- Akira S., Uematsu S., Takeuchi O. Pathogen recognition and innate immunity // Cell. 2006. Vol. 124 (4). P. 783–801.
- Липагина А.А. Диагностическое и прогностическое значение исследования белков острой фазы и иммуноглобулинов у новорожденных детей из группы риска по развитию гнойно-септических заболеваний: автореф. дис. на соиск. учен. степ. к.м.н. М., 2000.19 с.
- Hofer N., Zacharias E., Müller W., Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks // Neonatol. 2012. Vol. 102(1). P. 25–36.
- Бирюкова Т.В., Солдатова И.Г., Милева О.И. и др. Диагностическая информативность уровня прокальцитонина в сыворотке крови новорожденных при раннем неонатальном сепсисе // Вопросы практической педиатрии. 2007. № 3. С. 5–11.
- Casado-Flores J., Blanco-Quirós A., Asensio J. et al. Serum procalcitonin in children with suspected sepsis: a comparison with C-reactive protein and neutrophil count // Pediatr. Crit. Care Med. 2003. P.190–195.
- Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова, М.: Медицина для всех, 2001. С.182–194.
- Ганковская Л.В., Макаров О.В., Ковальчук Л.В. и др. Система цитокинов амниотической жидкости при внутриутробной инфекции // Новые технологии в перинатологии: материалы ежегодного конгресса специалистов перинатальной медицины. М., 2008. С. 19.
- Shozushima T., Takahashi G., Matsumoto N. et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diag¬nostic criteria of systemic inflammatory response syndrome // J. Infect. Chemother. 2011. Vol.17(6). P. 764–769.
- Adly A.A., Ismail E.A., Andrawes N.G., El-Saadany M.A. Circulating soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) as diagnostic and prognostic marker in neonatal sepsis // Cytokine. 2014. Vol. 65(2). P.184–191.
- Fanos V., Caboni P., Corsello G. et al. Urinary (1)H-NMR and GC-MS metabolomics predicts early and late onset neonatal sepsis // Early Hum. Dev. 2014. Vol. 90 (Suppl. 1). S78–S83.
- Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова. М.: Медицина для всех, 2001. С.182–194.
- Hoebe K., Janssen E., Beutler B. The interface between innate and adaptive immunity // Nat. Immunol. 2004. Vol. 5. P. 971–974.
- Ng P.C., Li K., Wong R.P. Proinflammatory and anti-inflammatory cytokine responses in preterm infants with systemic infections // Arch. Dis. Child. Fetal. Neonatal. Ed. 2003. P. 209–213.
- Володин Н.Н., Дегтярева М.В., Симбирцев А.С. и др. Роль про- и противовоспалительных цитокинов в иммунной адаптации новорожденных детей // Intern. J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185.
- Santana C., Guindeo M.C., Gonzakz G. Cord blood levels of cytokines as predictors of early neonatal sepsis // Acta Paediatr. 2001. Vol. 90. P.1176–1181.
- Witt A., Berger A., Gruber C.J., Petricevic L. et al. IL-8 concentrations in maternal serum, amniotic fluid and cord blood in relation to different within the amniotic cavity // J. Perinatal. Med. 2005. Vol. 33 (1). P. 22–26.
- Mehr S., Doyle L.W. Cytokines as markers of bacterial sepsis in newborn infants: a review // Pediatr. Infect. Dis. J. 2000. Vol. 19. P. 879–887.
- Pavcnik-Arnol M., Hojker S., Derganc M. Lipopolysaccharide-binding protein in critically ill neonates and children with suspected infection: comparison with procalcitonin, interleukin-6, and C-reactive protein // Intens. Care Med. 2004. Vol. 30(7). P.1454–1460.
- Черняховский О.Б., Абрамова И.В., Полянчикова О.Л. Внутриутробные инфекции у новорожденных, факторы риска // Российский вестник перинатологии и педиатрии. 2009. № 1. С. 80–88.
- McGuire W., Clerihew L., Fowlie P.W. Infection in the preterm infant // BMJ. 2004. Vol. 2. P. 329–341.












