Около 80% женщин испытывают во время беременности тошноту и рвоту, и лишь у 0,3–2% это состояние определяется как рвота беременных (РБ) (hyperemesis gravidarum) – «состояние выраженной тошноты и рвоты, ведущее к дегидратации, электролитным, кислотно-щелочным нарушениям и сопровождающееся снижением массы тела более 5%» [1]. РБ сопровождается угрозой отслойки хориона и плаценты, тяжелых послеродовых неврологических осложнений, увеличения процента преждевременных родов, задержки роста плода [2, 3].
В МКБ-10 РБ соответствует класс XV. Среди прочих вариантов выделяют чрезмерную РБ (O21), а также позднюю РБ (O21.2). Существует классификация РБ по степени тяжести. Причина РБ точно неясна, существует теория о нарушении взаимосвязи между нейрогуморальными, нейрорефлекторными механизмами регуляции в организме беременной женщины.
Известно, что Шарлотта Бронте, английская поэтесса и романистка, автор одного из самых знаменитых романов в мире «Джейн Эйр», погибла в 39-летнем возрасте на ранних сроках беременности. В январе 1855 г. состояние ее здоровья резко ухудшилось. В феврале врач, осматривавший писательницу, пришел к выводу, что симптомы недомогания свидетельствуют о начале беременности и не представляют опасности для жизни. Шарлотту мучили постоянная тошнота, отсутствие аппетита, чрезвычайная слабость, что привело к быстрому истощению. Однако только в последнюю неделю марта стало ясно, что Шарлотта умирает. Как предполагают многие биографы Шарлотты, она могла умереть от обезвоживания и истощения, вызванного тяжелым токсикозом.
Считается, что длительная рвота приводит к обезвоживанию, а потеря большого количества желудочного содержимого (прежде всего соляной кислоты) – к метаболическому алкалозу и гипокалиемии. При содержании калия в сыворотке крови <2 ммоль/л возможна смерть пациентки в результате фибрилляции желудочков или паралича дыхательных мышц. Однако анализ литературных данных и собственные клинические наблюдения, представленные ниже, свидетельствуют о том, что патогенез РБ может быть существенно более сложным, а лечение – не только симптоматическим.
Целью настоящей работы явились ознакомление практикующих врачей с клиническими наблюдениями развития РБ у пациенток в различные триместры беременности, сопровождающейся тяжелыми электролитными и метаболическими нарушениями, являющимися в свою очередь проявлениями альдостеронизма, а также изложение наиболее важных дифференциально-диагностических аспектов этой патологии. Неясность причин возникновения и механизмов развития синдрома объясняет большой интерес к каждому клиническому случаю.
Клинический случай № 1
Больная В., 24 года, первобеременная, поступила в МОНИИАГ 25.01.2010 г. на сроке 35 нед. с жалобами на тошноту, многократную рвоту желчью, горечь во рту, кожный зуд, полидипсию (до 5 л/сут), снижение аппетита, уменьшение массы тела, мышечную слабость. 17.01 отметила выраженную сонливость, слабость, снижение аппетита, рвоту, сначала до 2 р./сут, а с 20.01 – до 10–20 р./сут, тремор рук, снижение памяти. С 18.01 отметила резкое усиление жажды (потребление жидкости возросло до 5 л/сут) и тяги к соленой пище с употреблением до 2 л сильносоленых растворов в сутки (соленые помидоры, рассол). 22.01 отметила появление и нарастание кожного зуда. Потеря массы тела с 18.01 по 25.01 составила 8 кг.
Состояние при поступлении тяжелое. Tемпература тела – 36,7°C. Рост – 160 см. Масса тела – 57,3 кг. Кожные покровы и видимые слизистые иктеричны. Симптом «грязных локтей» (рис. 1). Тургор кожи снижен. Язык суховат, налета нет. В легких дыхание везикулярное, хрипов нет. Число дыхательных движений – 16 в 1 мин. Тоны сердца громкие, ритмичные, шумов нет. Частота сердечных сокращений – 64 в 1 мин. АД – 90/60 мм рт. ст. Отеков нет. Сухожильные рефлексы верхних и нижних конечностей снижены.

На ЭКГ от 26.01 и 27.01 (рис. 2): ритм синусовый, правильный. Нормальное направление электрической оси сердца. Ротация сердца левым желудочком вперед. По сравнению с анамнестической ЭКГ (от 25.08.2009 г.) отмечается нарастание выраженных изменений в миокарде, характерных для электролитных расстройств.

Общий анализ крови – без патологии. В анализе мочи – протеинурия до 0,55% при отсутствии мочевого осадка. В биохимическом анализе крови (табл. 1) определяются гиперферментемия, гипербилирубинемия за счет прямого и непрямого билирубина, выраженная гипокалиемия, а также повышение уровней креатинина и мочевины. Обращает на себя внимание относительная сохранность белковообразующей функции печени. 25.01 обследована на HBs Ag и Anti HCV (результат отрицательный).
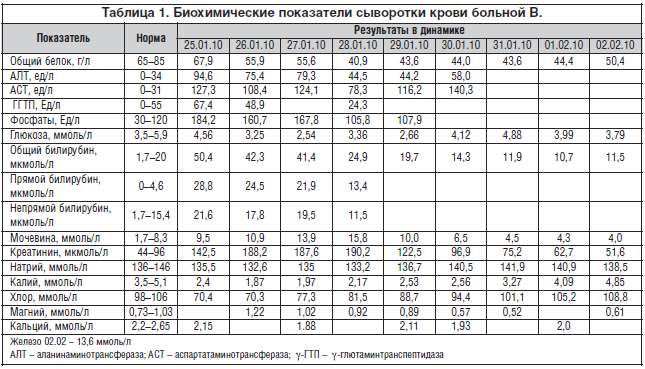
Уровень плацентарного лактогена при поступлении составил 427 нмоль/л (112,4% от нормы), -фетопротеина – 363,0 МЕ/л (163,5% от нормы), кортизола – 569 нмоль/л (101,7% от нормы), дегидроэпиандростерон-сульфата (ДГЭА–С) – 0,32 мкг/мл (при норме 0,8–3,9 мкг/мл), тестостерона – 4,3 нмоль/л (при норме 0,5–4,0 нмоль/л). Данные значения гормонального профиля существенно не превышали таковые при нормально протекающей беременности.
Таким образом, в клинической картине заболевания преобладал гипокалиемический синдром с мышечным поражением (мышечная слабость) и неврологическими нарушениями (снижение сухожильных рефлексов), отмечались признаки поражения печени по типу внутрипеченочного холестаза беременных и умеренной почечной недостаточности.
На фоне внутривенной дезинтоксикационной и инфузионной терапии (глюкозо-инсулино-калиевая смесь), заместительной терапии препаратами калия (до 12,0 г в виде раствора 4% хлористого калия в сутки), урсодезоксихолевой кислоты 250 мг 2 р./сут, магния оротата 2 таблетки 3 р./сут пациентка отметила исчезновение кожного зуда, тошноты, рвоты.
Через 2 сут от начала лечения отмечена положительная лабораторная динамика в виде снижения уровня билирубина (за счет обеих фракций) с нарастанием симптомов почечной недостаточности (уровень креатинина и мочевины) и гипокалиемии. 27.01 на сроке беременности 35 нед. было проведено родораз-решение путем кесарева сечения. Извлечен живой недоношенный мальчик, масса – 1870 г, рост – 43 см, оценка по шкале Апгар – 7–8 баллов. На ЭКГ после операции от 28.01 и 01.02 (рис. 2) отмечается положительная динамика со стороны сегмента ST-T, указывающая на нормализацию электролитно-метаболических расстройств.
В послеоперационном периоде больная продолжала получать 4% раствор хлористого калия в/в, урсодезоксихолевую кислоту 250 мг 2 р./сут, магния оротат по 2 таблетки 3 р./сут, спиронолактон 100 мг 4 р./сут, с 30.01 – по 50 мг 3 р./сут; с 01.02 спиронолактон и препараты калия были отменены. В послеродовом периоде отмечались нормализация биохимических показателей (исключая содержание магния в сыворотке крови), исчезновение слабости, улучшение аппетита, положительная динамика на ЭКГ (рис. 2). 29.01 анализ кислотно-основного состояния (КОС) (капиллярная кровь) выявил признаки метаболического алкалоза (pH – 7,571; Pсо2 – 38,6 мм рт. ст.; Pо2 – 76 мм рт. ст.). Выявлены снижение содержания кортизола (1207 нмоль/л при норме для раннего послеродового периода 1400–1600 нмоль/л) и повышение уровня альдостерона (1,65 нмоль/л при норме 0,1–0,8 нмоль/л) при повышенной активности ренина в плазме (АРП-ренин – 8,4 нг/мл/ч при норме 1,5–5,7 нг/мл/ч).
Пациентке 02.02 выполнена мультиспиральная компьютерная томография (МСКТ) органов брюшной полости. Отмечено, что надпочечники расположены обычно, инвертированной Y-образной формы, в размерах не увеличены, без дополнительных объемных образований.
Пациентка выписана 03.02 в относительно удовлетворительном состоянии, отмечала неустойчивость настроения, эпизоды депрессии. Рекомендовано продолжить прием магния оротата по 1 таблетке 3 р./сут.
У ребенка выявлены метаболический алкалоз и гипокалиемия с тенденцией к нормализации КОС и содержания электролитов (28.01: pH – 7,538; Pсо2 – 42,5 мм рт. ст., К+ – 2,84 ммоль/л; 29.01: pH – 7,435; Pсо2 – 54,2 мм рт. ст., К+ – 4,0 ммоль/л; 30.01: pH – 7,441; Pсо2 – 51,3 мм рт. ст., К+ – 4,54 ммоль/л; 31.01: pH – 7,395; Pсо2 – 51,0 мм рт. ст., К+ – 5,84 ммоль/л). Уровень кортизола составил 270 нмоль/л при норме для ребенка 1–7 дней жизни 55–304 нмоль/л, альдостерона – 2,32 нмоль/л (норма – 0,1–0,8 нмоль/л). 01.02 ребенок переведен на 2-й этап выхаживания в удовлетворительном состоянии.
Клинический случай № 2
Больная К., первобеременная, 39 лет, поступила в МОНИИАГ на сроке 16 нед. с жалобами на постоянную тошноту, рвоту, отвращение к еде, отсутствие самостоятельного стула в течение 1 мес. 18.10.2014 г. госпитализирована в гинекологическое отделение по месту жительства. Проводилась инфузионная терапия, получала калия и магния аспарагинат, метоклопрамид, домперидон. Несмотря на терапию, состояние ухудшалось: снижение веса составило 10 кг, продолжали отмечаться многократная рвота, слабость, отсутствие самостоятельного стула. По данным ультразвукового исследования брюшной полости патологии не выявлено. В лабораторных анализах выявлены гипокалиемия (2,62 ммоль/л), гипомагниемия (0,5 ммоль/л), гипербилирубинемия (22,5 мкмоль/л, за счет прямого билирубина – 9 мкмоль/л), АЛТ – 189,3 Ед/л (5-кратное превышение нормы), АСТ – 89 Ед/л (3-кратное превышение нормы). При анализе КОС капиллярной крови отмечен метаболический алкалоз (pH – 7,521; Pсо2 – 34,6 мм рт. ст.; Pо2 – 43,0 мм рт. ст.). На фоне проводимой инфузионной терапии в составе поляризующей смеси, сбалансированными растворами электролитов, раствором магния сульфата, а также препаратами магния оротата, метоклопрамидом, домперидоном, фосфолипидом, омепразолом – состояние пациентки без видимого улучшения. Переведена на сроке 17 нед. беременности для дообследования и лечения в отделение гастроэнтерологии и гепатологии МОНИКИ, где продолжилось проведение массивной заместительной терапии хлористым калием в/в (до 16–18 г/сут), магния оротатом (2 таблетки 3 р./сут). При эзофагогастродуоденоскопии от 07.11 выявлены: эзофагит, дуоденогастральный рефлюкс, гастродуоденит, рубцово-язвенная деформация двенадцатиперстной кишки. Содержание альдостерона (в покое) – 3,94 нмоль/л (норма для небеременных – 0,05–0,4 нмоль/л), активность ренина (в покое) – 15,0 пг/мл/ч (норма для небеременных – 0,32–1,84 пг/мл/ч).
В отделении у больной стали преобладать неврологические нарушения: слуховые, зрительные галлюцинации. Консультирована неврологом: энцефалопатия смешанного генеза, галлюцинации на фоне дисметаболических нарушений.
На фоне терапии отмечено уменьшение частоты рвоты до 1 раза утром, а затем – полное ее исчезновение, возрастание уровня сывороточного калия до 4,5 ммоль/л, уменьшение мышечной слабости, исчезновение галлюцинаций.
Пациентка выписана на сроке 20 нед. беременности с рекомендациями приема амилорида, препаратов калия, магния оротата и продолжения стационарного лечения. Однако на сроке 23 нед. беременности на фоне отказа от приема амилорида в амбулаторных условиях диагностирована антенатальная гибель плода.
Обсуждение
Таким образом, в клинической картине обоих случаев РБ, сопровождающей (что важно!) как I, так и III триместры беременности, на первый план выступали симптомы гипокалиемии и метаболического алкалоза, сохраняющиеся на фоне уменьшения или даже исчезновения тошноты и рвоты. В обоих клинических наблюдениях гипокалиемия и гипомагниемия с трудом поддавались медикаментозной коррекции, сопровождались ростом уровня трансаминаз и креатинина. Естественно, что объяснить такую клиническую и лабораторную картину простой потерей ионов калия с рвотой невозможно. В первом наблюдении удалось сохранить жизнь ребенку своевременным кесаревым сечением, во втором – наступила антенатальная гибель плода.
Этиология РБ точно неизвестна. Считается, что развитие тошноты и рвоты связано с высокой активностью трофобласта и выработкой гонадотропина, возможно, вторичного по отношению к повышению уровня человеческого хорионального гонадотропина в сыворотке крови [3, 4]. Противоречивые сведения получены в отношении уровня серотонина и гормонов щитовидной железы в сыворотке крови у пациенток с РБ [5, 6, 9, 20–22].
При физикальном обследовании обращало на себя внимание наличие у одной из пациенток симптома «грязных локтей» (симптом Бэра) – ороговение и утолщение эпидермиса в области локтей и колен, причиной которых могли быть как первичный гипотиреоз, так и нарушение чувствительности рецепторов коры надпочечников к адренокортикотропному гормону и гипоталамо-гипофизарных – к кортизолу. Лабораторные данные обследования в послеродовом периоде свидетельствовали о развитии гипотиреоза средней степени тяжести (обследована в Эндокринологическом научном центре), а низкий уровень кортизола по механизму обратной связи мог стимулировать образование кортикотропина (АКТГ) не только передней долей гипофиза матери, но и плацентой, децидуальной оболочкой, а также клеточными мембранами плода [6–9]. Известно, что рост содержания АКТГ у беременных не только повышает содержание эстрогена, но и в некоторой степени усиливает синтез и секрецию минералокортикоидов — дезоксикортикостерона и альдостерона.
Синдром гипокалиемии, отмеченный в приведенных клинических наблюдениях, причиной которого являлся гиперальдостеронизм, во многом обусловливал клиническую картину заболевания (нейромышечные и почечные проявления, изменения на ЭКГ). Известно, что калий – преимущественно внутриклеточный ион, хотя базовым показателем при оценке гомеостаза К+ является его уровень в сыворотке или плазме крови при нормальном диапазоне от 3,5 до 5 ммоль/л [10]. Электрокардиография является наиболее чувствительным методом оценки содержания этого иона в клетке. Известно, что содержание калия в организме регулируется альдостероном, уровень которого во время нормально протекающей беременности повышается многократно. Дифференциальная диагностика отдельных форм гиперальдостеронизма часто бывает затруднена в связи со сходными клиническими нейромышечными и почечными проявлениями на фоне повышенной секреции альдостерона [10].
Первичный гиперальдостеронизм (альдостерома или карцинома коры надпочечников, гиперплазия коры надпочечников, а также так называемый гиперальдостеронизм, корригируемый глюкокортикоидами, – семейный гиперальдостеронизм I типа всегда протекает с низким уровнем ренина и артериальной гипертензией [11], поэтому эти причины гипокалиемии у наших пациенток были исключены, в т. ч. проведением у одной из них МСКТ надпочечников.
Приняв за рабочую гипотезу развитие гиперальдостеронизма в обоих наблюдениях (уровень альдостерона был на верхней границе нормы для беременных), необходимо рассматривать только патогенетические варианты, протекающие с нормальным уровнем АД.
Важно отметить, что нормативные значения сывороточного содержания альдостерона для беременных точно неизвестны, но считается, что эти значения могут на порядок превосходить норму для небеременных женщин. Содержание же альдостерона при преэклампсии, например, достоверно снижается [12].
Другой причиной вторичного альдостеронизма может быть усиленная потеря калия вследствие нарушения функции почечных канальцев – при наследственных тубулопатиях (почечный канальцевый ацидоз, синдром Барттера, синдром Гительмана, синдром Лиддла и гипомагниемия). Самой часто встречающейся из этих тубулопатий является синдром Барттера (СБ), протекающий с нормальным или даже сниженным АД. В 1962 г. Барттер с соавт. описал синдром, позже названный его именем. СБ включает гипокалиемию, обусловленную потерей большого количества калия с мочой, метаболический алкалоз, повышение активности ренина плазмы, секрецию альдостерона и брадикинина [13]. В отечественной литературе крайне редко встречаются описания СБ [14].
Основное нарушение при СБ — снижение реабсорбции ионов хлора в толстом восходящем колене петли Генле. Увеличивающаяся в результате этого экскреция калия и возникающая гипокалиемия стимулируют образование простагландина E2 почечными клетками и простагландина I2 эндотелиальными клетками. Длительная стимуляция секреции ренина этими простагландинами приводит к гиперплазии юкстагломерулярного аппарата; развивается гиперренинемия и повышается уровень ангиотензина II в крови. И ангиотензин II, и альдостерон увеличивают количество почечного калликреина, который вызывает повышение содержания брадикинина в плазме крови, в то время как альдостерон еще больше увеличивает потерю калия с мочой. Увеличение содержания простагландинов и брадикинина обусловливает не только нормальные, но и сниженные цифры АД. Характерным проявлением СБ считается почечная недостаточность, являющаяся следствием нефропатии и очагового гломерулосклероза [15].
Описано развитие ложного СБ, в т. ч. у беременной, с тяжелой гипокалиемией во время длительного приема синтетических и галеновых препаратов лакрицы [16]. Эти препараты обладают противовоспалительным, спазмолитическим и отхаркивающим действием; используются в лечении язвенной болезни, аллергических дерматозов, болезни Аддисона, бронхитов и бронхиальной астмы. Содержащаяся в них глицирризиновая кислота имитирует эффекты минералокортикоидов, поэтому длительный прием названных средств приводит к развитию гипокалиемии. Самостоятельной причиной гипокалиемии может быть гипомагниемия, поскольку при дефиците ионов Mg2+ нарушается функция почечных канальцев, в т. ч. реабсорбция ионов К+. Самыми частыми причинами гипомагниемии являются алкоголизм, сахарный диабет, диарея, прием диуретиков и антибиотиков [10]. Анамнез заболевания пациенток позволял исключить как самостоятельные причины гипокалиемии действие лакрицы и первичную гипомагниемию.
Таким образом, синдромы Барттера, Лиддла и Гительмана могли бы рассматриваться в качестве причин заболевания у пациенток, однако отсутствие семейного анамнеза и определенной длительности течения заболевания, а при двух последних синдромах – артериальной гипертензии позволили отвергнуть эти синдромы в качестве причины болезни.
Состояние, сходное с СБ, было единственно обоснованной причиной заболевания у пациенток с нормальным уровнем АД, что подтверждалось длительным сохранением гипохлоремии и гипомагниемии. На выраженность электролитных и метаболических расстройств оказывали влияние поражение печени и гиперферментемия, отмечающиеся у 39,6 и 28,7% женщин с РБ соответственно [16], а также неукротимая рвота и избыток натрия в пище.
Лабораторное обследование подтвердило состояние высокоренинового альдостеронизма и гипокалиемического алкалоза. Обращали на себя внимание сходные гормональные и метаболические изменения у ребенка.
Связь между метаболическим алкалозом и содержанием калия в организме до конца не выяснена. Алкалоз часто сопутствует гипокалиемии, и наоборот. Алкалоз может вызывать гипокалиемию и дефицит калия в тканях, и наоборот, дефицит калия в организме способствует поддержанию состояния метаболического алкалоза путем стимуляции секреции угольной кислоты в почечных канальцах, а следовательно, усиления реабсорбции гидрокарбоната [10]. Может ли дефицит калия сам по себе приводить к метаболическому алкалозу, до сих пор неясно. Однако считается, что рвота обычно вызывает лишь незначительный или умеренный алкалоз. У описываемых нами пациенток развившийся метаболический алкалоз был выраженным и длительным, сохранялся при отсутствии рвоты и на фоне нормализации уровня калия в сыворотке крови, что свидетельствовало о его связи с гиперальдостеронизмом, сохраняющимся у одной из пациенток (другая – недообследована) в послеродовом периоде.
Кроме того, гипокалиемический алкалоз приводит к увеличению связывания кальция белками плазмы, снижению содержания ионизированного кальция, что также сопровождается парастезиями, судорогами, патологическими неврологическими симптомами Хвостека, Труссо и др., депрессией, психическими нарушениями [17–19]. Депрессия и психические нарушения, отмечаемые у обеих пациенток, связаны прежде всего с гипомагниемией и часто отмечаются при РБ [20–22].
В настоящее время в целом ряде работ описано течение СБ у беременных [23–25], а также развитие синдрома псевдо-Барттера у новорожденных. Существует единственное описание развития СБ у беременной на фоне сходных длительных пищевых нарушений [26].
Таким образом, патогенез гиперальдостеронизма и алкалоза, стимулируемых потерей калия с рвотой у беременных, сходен с патогенезом СБ, это состояние получило название «синдром псевдо-Барттера» [27].
Полученные нами результаты совпадают с данными литературы о возможности развития сходного с материнским состояния и у новорожденного. Авторами отмечается хороший эффект заместительной терапии в сроки от 8 дней до нескольких недель [16, 27, 28], более того – описаны способы пренатальной диагностики СБ [28].
Лечение РБ включает парентеральное введение жидкостей и ионов калия, витаминов группы В, использование дроперидола, ондансетрона (препаратов класса В или С для беременных), некоторое действие оказывают пероральные глюкокортикостероиды [4]. Однако длительная парентеральная терапия не является абсолютно безопасной. Ретроспективный анализ 166 пациенток с РБ, получавших в 16,3% случаев парентеральную терапию, выявил существенное увеличение количества серьезных осложнений (сепсис, инфекционный эндокардит, тромбофлебит и др.) [4].
Таким образом, с учетом возможности развития у пациенток с РБ синдрома псевдо-Барттера, весьма перспективным выглядит использование препаратов, тормозящих выработку альдостерона (спиронолактон или амилорид), а также индометацина, блокирующего образование простагландинов. К сожалению, спиронолактон из-за свойственного ему вирилизующего действия противопоказан у беременных, особенно в случае мужского пола плода (клинический случай № 2). Амилорид же широко используется у беременных с СБ [23].
Назначение индометацина, являющегося ингибитором простагландинсинтетазы, тормозящего вследствие этого образование простагландинов I2 и E2 и тем самым снижающего секрецию ренина и альдостерона, возможно у беременных, а также у новорожденных с синдромом псевдо-Барттера [29, 30]. Однако при использовании индометацина у новорожденных описаны случаи пневмоперитонеума на 30-й день после рождения вследствие перфорации кишечника, что требовало хирургического лечения [31].
Таким образом, на любом сроке беременности РБ может привести к развитию синдрома псевдо-Барттера (низкоренинового гиперальдостеронизма, протекающего с гипокалиемией, гипомагниемией и метаболическим алкалозом). Прогноз в отношении матери и плода при развитии этого осложнения может быть крайне неблагоприятным. Лечение должно быть длительным и принципиально последовательным, проводиться только в стационаре и включать наряду с симптоматической терапией амилорид и, возможно, индометацин. Побудительным мотивом к досрочному родоразрешению на фоне заместительной и симптоматической терапии должна быть объективная клинико-лабораторная оценка состояния больной. Вследствие того, что возможно развитие сходных нарушений у новорожденного, необходимо предъявлять особые требования к неонатальному этапу выхаживания.












