Введение
В настоящее время в гинекологической практике отмечается значительное увеличение частоты дисбиотических нарушений во влагалище и специфических вагинитов у женщин репродуктивного возраста. Данный факт, по всей видимости, связан с улучшением диагностических возможностей современных методов исследования (ПЦР–диагностика, культуральные методы). Нередко обнаружение условно–патогенной флоры является предпосылкой к необоснованному назначению антибактериальных препаратов, которые значительно усугубляют имеющиеся дисбиотические процессы во влагалище, а в последующем ведут к антибиотикорезистентности имеющейся флоры. Данный вопрос особенно актуален при обнаружении микоплазм в урогенитальном тракте женщин. Неправильная интерпретация полученных анализов и необоснованное назначение антибиотикотерапии нередко являются причиной возникновения так называемого «ятрогенного вагинита», требующего в дальнейшем проведения длительного лечения.
По современной классификации микоплазмы относятся к классу Mollicutes, выделяют по меньшей мере 11 видов микоплазм, патогенных для человека: М. bucale, M. faucium, M. fermentans, M. hominis, M. incognitis, M. liphophicum, M. pneumoniae, M. orale, M. salivarium, U. urealyticum, M. genitalium. Большинство из них колонизируют полость рта, глотку и верхние дыхательные пути. К группе урогенитальных микоплазм относятся: M. hominis, M. incognitis, M. genitalium, M. fermentans и U. urealyticum, вызывающие поражение мочеполовых органов [15]. Свойствами абсолютного патогена обладает M. genitalium, являющаяся причиной различных инфекционных осложнений со стороны урогенитального тракта у лиц обоего пола [13,22,25,27].
Некоторыми авторами урогенитальные микоплазмы рассматриваются как условно–патогенная микрофлора, которая способна вызвать заболевание лишь при определенных условиях. Обсуждается влияние микоплазмозов на развитие бесплодия, риск невынашивания беременности, преждевременных родов и перинатальных осложнений у плода, однако роль этих возбудителей в некоторых случаях остается сомнительной, т.к. наряду с микоплазмами выделяются другие возбудители – хламидии, вирусы простого герпеса, энтеровирусы, неспецифическая условно–патогенная микрофлора и др. В подобных случаях трудно определить место микоплазм в патологическом процессе, особенно когда акушерские и перинатальные осложнения возникают после проведенного, казалось бы, эффективного лечения [2,3,5,7,9,16,19,20,23,24].
Частое обнаружение микоплазм в урогенитальном тракте клинически здоровых женщин с современных позиций рассматривается как комменсализм микоплазм и нормальной флоры влагалища. Способность молликутов вступать в конкурентные отношения и проявлять патогенные свойства возможна при определенных неблагоприятных для макроорганизма условиях, что приводит к массивной диссеминации возбудителя [4,11,14,25]. Факторами, провоцирующими развитие инфекционного процесса, могут быть присоединение инфекции другой природы, изменение гормонального фона, беременность и роды, нарушения иммунного и, в частности интерферонового, статуса организма [5,6].
В составе микоплазм отсутствует ригидная клеточная мембрана со всеми ее компонентами, что обусловливает низкую индукцию антителогенеза и устойчивость возбудителя к химиопрепаратам, действующим на поверхностные структуры микробных клеток [15]. Вследствие незавершенного фагоцитоза, в процессе которого микроорганизмы не подвергаются внутриклеточному перевариванию, создаются условия для персистенции микоплазм в фагоцитах. Кроме того, наличие общих антигенных структур у микоплазм и клеток организма при длительном хроническом течении заболевания является причиной развития аутоиммунных процессов, приводящих к тяжелым осложнениям и требующих специфической терапии [10].
Для урогенитальных инфекций, вызываемых микоплазмами, характерно отсутствие патогномоничных клинических проявлений, что весьма осложняет диагностику и свидетельствует о необходимости применения методов лабораторной диагностики и получения эпидемиологических данных. Микоплазменные инфекции могут протекать остро, но чаще имеют хроническое стертое рецидивирующее течение. При этом характер патологического процесса в значительной степени определяется состоянием местных и системных эффекторов иммунной системы, дисбаланс которых осложняет течение инфекции и служит предпосылкой развития рецидивов, несмотря на проведение этиотропной терапии. Способность оказывать значительное влияние на показатели местного и системного иммунного гомеостаза обусловлена низкой иммуногенностью и склонностью к антигенной мимикрии микоплазм, возможностью изменения рецепторного аппарата клеточных мембран, индуцированием фосфолипазной активности, ведущей к повышению уровня простагландинов и цитотоксическим эффектам, а также супрессией интерферонового статуса [8,18,26].
Вышесказанное актуализирует необходимость комплексного подхода в лечении неспецифических вагинитов, ассоциированных с микоплазменной инфекцией. В течение последних лет в гинекологической и урологической практике с целью повышения эффективности стандартных схем этиотропной терапии с успехом применяется современный представитель иммуномодулирующих лекарственных средств для местного применения – Генферон. Данный препарат является комбинированным лекарственным средством, содержащим интерферон человеческий рекомбинантный α–2b, таурин и бензокаин. Интерферон–α как важнейший неспецифический компонент реакций врожденного иммунитета оказывает не только выраженное противовирусное, но и антибактериальное действие благодаря активной иммуномодуляции вследствие усиления клеточно–опосредованных реакций иммунной системы, что повышает эффективность иммунного ответа в отношении чужеродных агентов.
Таурин благодаря выраженному антиоксидантному действию играет роль антиокислителя, защищающего молекулу интерферона от действия активных форм кислорода. Ввиду наличия у таурина дополнительных терапевтических эффектов (противовоспалительного, противоотечного, репаративного, метаболического и др.) данный компонент лекарственной формы был отнесен к числу активных действующих веществ. Отдельного внимания заслуживает факт наличия у таурина (его монохлораминового производного TauNHCl) собственного иммуномодулирующего действия, которое обеспечивается иными по сравнению с интерфероном биологическими механизмами. В состав Генферона включен также бензокаин – местноанестезирующее вещество, которое устраняет болезненные ощущения, зуд, жжение при обострении воспаления, не оказывая общего влияния на организм.
Имеющиеся научные данные свидетельствуют о высоком терапевтическом потенциале и широком профиле безопасности препарата Генферон, что послужило предпосылкой для изучения его эффектов в рамках терапии неспецифических вагинитов, ассоциированных с M. hominis и U. urealyticum, в комбинации со стандартным антибактериальным лечением.
Цель исследования. Целью настоящего исследования являлось изучение эффективности применения препарата Генферон (ЗАО «Биокад», Россия) в составе комбинированной терапии вагинитов, ассоциированных с возбудителями класса Mollicutes.
Материалы и методы
Для реализации поставленной цели на базе пяти исследовательских центров было проведено двойное слепое рандомизированное плацебо–контролируемое сравнительное исследование в параллельных группах, в котором участвовали 80 женщин в возрасте от 18 до 52 лет с неспецифическим вагинитом, ассоциированным с M. hominis и/или U. urealyticum. Пациентки, лечившиеся в амбулаторных условиях, были рандомизированы в две равнозначные группы по 40 человек.
В 1–ю группу вошли 40 пациенток с верифицированным диагнозом неспецифического вагинита, ассоциированного с M. hominis и/или U. urealyticum, которые получали стандартную антибактериальную терапию (доксициклин в дозе 100 мг х 2 раза в сут. перорально в течение 10 дней) в сочетании с препаратом Генферон по 500 000 МЕ х 2 раза в сут. вагинально в течение 10 дней (параллельно стандартной терапии).
Во 2–ю группу вошли 40 пациенток с верифицированным диагнозом неспецифического вагинита, ассоциированного с M. hominis и/или U. urealyticum, которые получали стандартную антибактериальную терапию (доксициклин в дозе 100 мг х 2 раза в сут. перорально в течение 10 дней) в сочетании с плацебо х 2 раза в сут. вагинально в течение 10 дней (параллельно стандартной терапии). Плацебо представляло собой неотличимые по внешнему виду суппозитории, содержащие в своем составе все активные и вспомогательные компоненты оригинального препарата за исключением интерферона–α.
В рамках исследования было запланировано пять визитов. На скрининговом визите проводились: сбор демографических и клинических данных, анамнеза, сведений о сопутствующей терапии; физикальное и гинекологическое обследования; микроскопическое исследование мазка из влагалища; ПЦР–диагностика (на нуклеиновые кислоты M. hominis, U. urealyticum, вирус герпеса 1 и 2–го типов и C. trachomatis); культуральный метод диагностики, определение чувствительности выделенной микрофлоры к антибиотикам; определение хорионического гонадотропина в моче с целью исключения беременности.
Диагноз вагинита, ассоциированного с возбудителями класса Mollicutes, считался установленным при положительном результате ПЦР на М. hominis и/или U. urealyticum и при обнаружении данных возбудителей культуральным методом в количестве от 103 до 108 КОЕ/мл, а также при наличии воспалительной картины вагинального мазка. В качестве материала для исследования использовались соскобы эпителия влагалища и цервикального канала. Дополнительным критерием постановки диагноза являлись клинические признаки заболевания (если имела место манифестная форма): дискомфорт, зуд в области наружных половых органов и выделения из влагалища.
В исследование не включались женщины с диагностированными половыми инфекциями, ассоциированными с другими возбудителями (вирусы герпеса, C.trachomatis, трихомоноз и др.), бактериальным вагинозом, ВИЧ–инфекцией, сифилисом.
На первом визите (1–й день) выполнялось распределение в одну из групп терапии и пациентке присваивался рандомизационный номер. Рандомизация осуществлялась с помощью метода конвертов, составленных на основании рандомизационной таблицы с использованием сгенерированных компьютерной программой случайных чисел. Поскольку исследование являлось двойным слепым плацебо–контролируемым, ни пациентка, ни врач не знали, какой вид исследуемого средства (активный препарат – суппозитории Генферон 500 000 МЕ или плацебо) получала испытуемая. Прием исследуемых препаратов и лекарственных средств стандартной терапии осуществлялся начиная с первого визита (1–й день). На протяжении всего приема лекарственных средств женщинам предлагалось заполнять дневник, в котором они должны были отмечать все субъективные изменения в самочувствии.
Во время второго визита (11–й день), по окончании приема исследуемой терапии, пациенткам проводились повторные физикальное и гинекологическое обследования, микроскопическое исследование мазка из влагалища, культуральный метод диагностики, оценивалась приверженность к назначенному лечению и регистрировались нежелательные явления.
Во время третьего визита (21–й день) пациенткам выполнялись физикальное и гинекологическое обследования, микроскопическое исследование мазка из влагалища, регистрировались рецидивы заболевания, а также любые случаи нежелательных явлений.
Процедуры заключительного четвертого визита (41–й день) включали физикальное и гинекологическое обследования, ПЦР–диагностику, культуральный метод исследования, микроскопическое исследование мазка из влагалища, регистрировались также рецидивы заболевания.
Анализ результатов и статистическая обработка полученных данных
Основные клинические и демографические показатели, полученные в ходе исследования, обрабатывались по правилам описательной статистики. Эффективность проводимой терапии в исследуемых группах определяли по объективному клиническому ответу на нее в виде исчезновения клинических признаков заболевания (при наличии манифестной формы), анализу данных культурального исследования, ПЦР, а также по динамике воспалительной картины мазка по данным микроскопии. Статистическая обработка полученных результатов проводилась с помощью программы STATISTIСA 6.0. Определение типа имеющихся данных и вида их распределения выполнялось с помощью визуальной оценки графика их распределения и проверки статистической гипотезы о виде распределения с применением критериев Шапиро–Уилка и Лиллефорса.
Классический критерий Стьюдента применяли при одновременном нормальном распределении значений признаков и равенстве дисперсий в каждой группе (тест Левена). При нарушении хотя бы одного из условий использовали непараметрические критерии.
Непараметрические критерии Манна–Уитни, Колмогорова–Смирнова, Вилкоксона применяли для анализа количественных или порядковых признаков. Точный критерий Фишера (ТКФ) использовали для любых двумерных (прямоугольных) таблиц в том случае, если хотя бы в одной ячейке таблицы ожидаемых частот значение было меньше или равно 5. Критерий хи–квадрат (χ2) использовался в случае, если частоты во всех ячейках таблицы ожидаемых частот были больше или равны 5.
Если признак имел нормальное распределение данных, то меры центральной тенденции и рассеяния представлялись в формате среднее (среднеквадратичное) отклонение. Если признак имел распределение данных, отличное от нормального, то меры центральной тенденции и рассеяния представлялись как медиана (интерквартильный размах 25–75%).
Данные по безопасности анализировались у всех больных, получивших хотя бы одно введение препаратов. Для оценки факторов риска, связанных с исследуемой терапией, учитывались общее число нежелательных и серьезных нежелательных явлений; число больных, досрочно завершивших исследование вследствие развития нежелательных явлений; число больных с клинико–лабораторными отклонениями, возникшими в ходе исследования.
Результаты
После успешного прохождения скрининговых процедур в исследование были включены 80 женщин с установленным диагнозом неспецифического вагинита, ассоциированного с M. hominis и U. urealyticum, у которых обнаруживались данные возбудители методом ПЦР и рост в культуре в большом количестве (от 103 до 108 КОЕ/мл), и имелся воспалительный тип вагинального мазка. Участницы исследования были распределены в группы терапии (Генферон + антибактериальная терапия или плацебо + антибактериальная терапия) по 40 человек. Лечение, согласно протоколу, завершили все пациентки; данные всех 80 женщин включены в итоговый анализ эффективности и безопасности проводимой терапии.
Фоновые характеристики пациенток
Средний возраст всех рандомизированных пациенток составил 28,7±6,6 лет (мин.– 18, макс.– 52) без статистических различий между группами (в основной группе женщин, получавших в составе комплексной терапии Генферон, средний возраст составил 28,9±5,8 лет, в группе сравнения (плацебо + антибактериальная терапия) – 28,5±7,4 лет, p>0,05).
Анализ гинекологической заболеваемости показал, что практически у каждой пятой женщины отмечались неоднократные эпизоды вагинита/вульвовагинита, который в половине случаев имел кандидозную природу и рецидивирующий характер. Кроме того, в структуре гинекологической патологии преобладали эктопия шейки матки (13,75%), нарушение менструального цикла (11,25%), бесплодие (8,75%), эндометриоз (6,25%), гиперандрогения (5%). С меньшей частотой регистрировались случаи миомы матки (3,75%), поликистоза яичников (3,75%), привычного невынашивания беременности (2,5%), воспалительных заболеваний маточных труб и яичников (2,5%) и др. У нескольких пациенток основной группы и группы сравнения в анамнезе регистрировались случаи внематочной беременности (в 7,5 и 2,5% случаев соответственно), замершей беременности – у 2 (5%) пациенток группы сравнения, оперативное вмешательство по поводу кисты яичника проводилось у 2 (5%) женщин группы сравнения.
У 16 (20%) из включенных в исследование пациенток отмечались эпизоды перенесенных ранее урогенитальных инфекций. В большинстве случаев наблюдались инфекции, обусловленные мико– или уреаплазмами (у 15% в основной группе и у 12,5% в группе сравнения), по поводу которых женщины ранее уже получали терапию; некоторые пациентки сообщали о наличии в анамнезе эпизодов бактериального вагиноза, трихомоноза, хламидиоза и папилломавирусной инфекции.
Приведенные данные свидетельствуют о высокой частоте отягощенного акушерско–гинекологического анамнеза у пациенток с неспецифическим вагинитом, ассоциированным с M. hominis и U. urealyticum. Так, среди обследованных женщин у 71,3% регистрировались предшествующая инфекционно–воспалительная патология генитального тракта или осложнения предыдущих беременностей. Лишь у 32,5% участниц основной группы (Генферон + антибактериальная терапия) и у 25% женщин группы сравнения (плацебо + антибактериальная терапия) не отмечалось измененного преморбидного фона со стороны мочеполовой системы.
Динамика жалоб
При обращении к врачу 75% пациенток основной группы и 77,5% женщин группы сравнения предъявляли одну или несколько жалоб. В абсолютном большинстве случаев пациенток беспокоили умеренные или выраженные выделения из влагалища (67,5% в основной группе и 71,25% в группе сравнения), которые носили постоянный характер и в ряде случаев усиливались после менструации. Кроме того, женщины предъявляли жалобы на зуд (20 и 17,5% соответственно), жжение (12,5 и 11,25% соответственно) или чувство дискомфорта в области гениталий (5 и 7,5% соответственно). В единичных случаях наблюдались боли внизу живота, учащенное мочеиспускание, неприятный запах выделений.
25% пациенток, получавших Генферон в составе комплексной терапии неспецифического вагинита, ассоциированного с M. hominis и U. urealyticum, и 22,5% женщин группы сравнения при первичном обращении не отмечали никаких неприятных субъективных ощущений. Большинство случаев бессимптомного течения мико– или уреаплазмоза были диагностированы при профилактических осмотрах, в том числе в рамках прегравидарной подготовки.
По окончании предусмотренного курса терапии (на 11–й день) в абсолютном большинстве случаев женщины отмечали выраженную положительную субъективную динамику. Только у 5 (12,5%) женщин, получавших Генферон параллельно с антибактериальной терапией, и у 6 (15%) пациенток, применявших в сочетании с антибактериальным лечением плацебо, к этому сроку сохранялись жалобы на необильные выделения из влагалища, слабовыраженные зуд и жжение в области вульвы, дискомфорт. К моменту третьего визита (21–й день от начала лечения) женщины обеих исследуемых групп указывали на значительное улучшение состояния. Купирование симптоматики вульвовагинита на 41–й день от начала применения исследуемой терапии зарегистрировано в 100% случаев в основной группе и в 95% случаев в группе сравнения, у отдельных пациенток которой сохранялись жалобы на зуд и жжение в области вульвы и патологические выделения из влагалища (ТКФ, р=0,24).
Динамика изменений, выявленных в ходе
гинекологического осмотра
Результаты гинекологического осмотра женщин, выполненного в день скрининг–визита, показали наличие тех или иных отклонений в 65% случаев в основной группе и в 75% – в группе сравнения. Большинство обнаруженных изменений были представлены гиперемией слизистой влагалища (52,5 и 60% соответственно), отечностью слизистой влагалища (25 и 17,5% соответственно), гиперемией слизистой шейки матки и признаками эндоцервицита (22,5 и 15% соответственно). Гноевидные или бело–серые выделения при осмотре наблюдались у 27,5% женщин группы активного препарата и у 20% пациенток группы сравнения. Кроме того, у двух женщин основной группы и у такого же числа участниц группы сравнения отмечалась контактная кровоточивость шейки матки при взятии мазка. Также в ряде случаев наблюдались отечность и гиперемия вульвы, эктопия шейки матки.
Контрольные гинекологические осмотры после проведенного курса терапии обнаружили выраженную положительную динамику: основные визуальные признаки вагинальной инфекции (гиперемия, отечность слизистых, обильные выделения) значительно регрессировали в исследуемых группах без статистических различий между ними.
Динамика микроскопических изменений
вагинального мазка
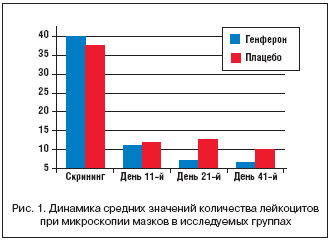
В день скрининг–визита у всех пациенток отмечалась воспалительная картина вагинального мазка. Наиболее показательным в определении выраженности воспаления является количество лейкоцитов. Так, в день обращения пациентки к врачу у участниц основной группы среднее количество лейкоцитов при микроскопии мазка составило 48 (18–50) в поле зрения, варьируя в значительных пределах – от 15–20 до 100 и более лейкоцитов в поле зрения. В группе женщин, получавших в составе стандартной терапии плацебо, в день скрининг–визита среднее содержание лейкоцитов составило 30 (16–50), что оказалось несколько меньше, чем в группе активного препарата, однако без статистической разницы (критерий Колмогорова–Смирнова, р>0,1).
К моменту окончания терапии (11–й день) у 27 (67,5%) женщин группы Генферона количество обнаруженных лейкоцитов в мазке было ≤10 в поле зрения, у 6 (15%) пациенток – варьировало в пределах 11–20 в поле зрения и у 7 (17,5%) – сохранялось умеренно повышенное количество лейкоцитов (более 20 в поле зрения). Среднее количество лейкоцитов в мазке в этой группе составило 6 (3–15). У участниц исследования, получавших плацебо в сочетании с антибактериальным препаратом, на втором визите не зарегистрировано повышенного уровня лейкоцитов в мазке (≤10) в 28 (70%) случаях, у 3 (7,5%) пациенток количество лейкоцитов находилось в пределах 11–20 в поле зрения, и у 9 (22,5%) женщин сохранялись уровни этих клеток в количестве более 20 в поле зрения. Среднее количество лейкоцитов в мазке в группе сравнения составило 5 (1–17,5).
Таким образом, на момент окончания терапии статистически значимых различий в содержании лейкоцитов в вагинальных мазках у пациенток, получавших Генферон или плацебо в составе комплексного лечения, не отмечалось, что отражает, по всей видимости, эффект антибактериальной терапии к моменту ее завершения. Несколько иная картина наблюдалась в катамнезе (21 и 41–й дни от начала лечения). Так, на 21–й день в группе активного препарата лишь у 1 (2,5%) женщины сохранялось увеличение уровня лейкоцитов выше 20 в поле зрения, у 33 (82,5%) пациенток количество лейкоцитов было в пределах нормы (составляя в среднем не более 5 в поле зрения) и у 6 (15%) – варьировало от 11 до 20. Среди пациенток группы сравнения в 4 (10%) случаях наблюдалось значительное возрастание количества лейкоцитов (до 45) в поле зрения, у 29 (72,5%) женщин оно не выходило за пределы нормы и у 4 (10%) – находилось в пределах 11–20 в поле зрения.
Среднее количество лейкоцитов в вагинальных мазках, выполненных на 21–й день от начала терапии, в группе Генферона составило 4 (1,5–10), в группе сравнения – 5,5 (3–15) (критерий Колмогорова–Смирнова >0,1). Тенденция к увеличению среднего содержания лейкоцитов в группе сравнения сохранялась и в последующем периоде наблюдения, а к 41–му дню от начала лечения имела статистически значимые различия с группой женщин, применявших в комплексной терапии Генферон (рис. 1). Так, среднее количество лейкоцитов в мазках на 41–й день в группе активного препарата составило 4 (1–10), в группе сравнения – 6,5 (3,5–13,5) (критерий Колмогорова–Смирнова, р<0,05).
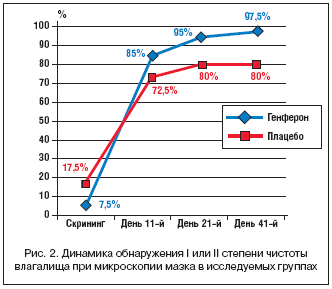
Оценка степени чистоты влагалища по данным микроскопического исследования вагинального мазка на момент скрининга показала преобладание у пациенток III степени чистоты мазка (у 40% в группе Генферона и 45% в группе сравнения, χ2, р>0,05), кроме того, выраженная воспалительная картина мазка с преобладанием кокковой флоры и наличием большого количества лейкоцитов (IV степень) была диагностирована в 22,5% случаев в каждой группе. Промежуточная II–III степень чистоты мазка на момент первого обращения к врачу была зафиксирована у 30% пациенток группы активного препарата и у 40% женщин группы сравнения (χ2, р>0,05).
В ходе последующего мониторинга микроскопической картины вагинального мазка в группе Генферона прослеживалась определенная тенденция к более динамичному уменьшению признаков воспаления и восстановлению вагинальной микрофлоры, характеризующаяся исчезновением кокковой флоры, обнаружением большого количества палочек Додерлейна и нормализацией уровня лейкоцитов (рис. 2). Так, на момент окончания терапии (день 11–й) I или II степень чистоты влагалища определялась у 34 (85%) женщин, получавших в комплексной терапии Генферон, и у 29 (72,5%) пациенток, применявших плацебо на фоне стандартного лечения (χ2, р>0,05). II–III или III степень чистоты к данному сроку диагностированы у 15 и 27,5% пациенток соответственно (χ2, р=0,17).
Начиная с 21–го дня общевоспалительные и дисбиотические нарушения микрофлоры влагалища имели достоверно меньшую выраженность в группе больных, применявших в комплексной терапии Генферон (рис. 2). К моменту третьего визита I или II степень чистоты влагалища без воспалительных признаков имели достоверно большее число женщин в основной группе – 38 (95%) человек по сравнению с 32 (80%) пациентками группы плацебо (ТКФ, р=0,04). II–III степень чистоты влагалища наблюдалась лишь у 2 (5%) пациенток группы Генферона, при этом не было зарегистрировано ни одного случая III степени, в то время как в группе сравнения промежуточная II–III или III степени чистоты мазка обнаруживались у 8 (20%) женщин (ТКФ, р=0,04).
Через месяц после окончания терапии (четвертый визит) наблюдавшаяся во время третьего визита более выраженная положительная динамика в группе активного препарата сохранялась, что свидетельствует о долгосрочной эффективности Генферона в терапии вагинитов (рис. 2). Так, I или II степень чистоты влагалища без признаков воспаления наблюдалась у 39 (97,5%) женщин группы Генферона и у 32 (80%) участниц, получавших плацебо (ТКФ, р = 0,01). Промежуточный II–III тип мазка зафиксирован лишь у 1 (2,5%) больной, применявшей Генферон, III степень чистоты не обнаруживалась ни у одной пациентки данной группы. В группе сравнения II–III или III степень чистоты влагалища на четвертом визите наблюдалась у 8 (20%) пациенток (ТКФ, р = 0,02).
Кроме того, на момент проведения второго визита в группе сравнения зарегистрировано два случая развития кандидозной инфекции, а также у двух пациенток – картина бактериального вагиноза с наличием классических ключевых клеток. На третьем визите у одной пациентки группы Генферона и у одной больной группы сравнения в мазках обнаруживались признаки кандидозной инфекции. На заключительном визите картина кандидозного вагинита с микроскопическим подтверждением наблюдалась у трех женщин, получавших в составе комплексной терапии плацебо, чего не было ни у одной пациентки, применявшей Генферон.
Динамика результатов ПЦР и культурального
исследования на M. hominis и U. urealyticum
При проведении ПЦР–исследования на M. hominis и U. urealyticum в день скрининг–визита в абсолютном большинстве случаев преобладало обнаружение U. urealyticum – у 75% женщин группы Генферона, и у 67,5% пациенток группы сравнения. Выявление M. hominis в качестве моновозбудителя наблюдалось лишь у 5% участниц в каждой группе, в то время как в ассоциации с U. urealyticum – у 20% пациенток, получавших комплексную терапию с Генфероном, и у 15% больных, применявших плацебо. Однако результаты культурального исследования на перечисленные возбудители показали следующее. В четырех случаях в группе активного препарата и в трех случаях в группе сравнения результаты ПЦР–диагностики не выявили нуклеиновых кислот M. hominis, но в посевах биоматериала этих пациенток обнаруживался рост как мико–, так и уреаплазм в диагностическом титре. У одной больной группы Генферона и у одной женщины группы сравнения не наблюдалось выраженного роста M. hominis в культуре, несмотря на положительный результат ПЦР на микоплазмы.
Контрольные культуральные исследования, выполненные на 11–й день от начала лечения, не выявили роста возбудителей класса Mollicutes ни у одной пациентки в обеих группах.
В отдаленном периоде после проведенного лечения результаты культурального и ПЦР–исследований, выполненных на заключительном визите (41–й день), показали положительные результаты на уреаплазму (ПЦР и количество в культуре 104 КОЕ/мл) у двух пациенток группы Генферона. В группе сравнения у одной женщины обнаруживался положительный результат ПЦР на U. urealyticum при отрицательном культуральном анализе; у одной пациентки, лечившейся от уреаплазменной инфекции, к 41–му дню имелся положительный ПЦР–анализ на U. urealyticum и рост в культуре ассоциации M. hominis и U. urealyticum в количестве 104 КОЕ/мл, что можно расценивать как рецидив уреаплазменной инфекции и суперинфекцию микоплазмами. Кроме того, в группе пациенток, получавших в составе комплексной терапии плацебо, зарегистрирован один случай суперинфицирования M. hominis у женщины, имевшей в день скрининга положительные результаты ПЦР и бактериологического исследования на U. urealyticum, а на 41–й день от начала специфического лечения – ПЦР и рост культуры микоплазмы в количестве 104 КОЕ/мл.
Анализ безопасности
В ходе настоящего исследования нежелательные явления, которые могли иметь хотя бы минимальную гипотетическую связь (по мнению исследователя) с используемой в рамках протокола терапией, зарегистрированы у трех пациенток, получавших в комплексной терапии Генферон + доксициклин, и у пяти женщин, получавших данный антибактериальный препарат в сочетании с плацебо. У одной пациентки основной группы на 5–е сутки от начала приема терапии отмечалось появление аллергической реакции в области верхней конечности в виде зудящих высыпаний по типу экземы, которые регрессировали после самостоятельного приема хлоропирамина. Данное нежелательное явление не потребовало отмены проводимой терапии, при повторном введении суппозиториев аллергическая реакция не возобновлялась. Связь возникновения нежелательного явления с проводимой терапией (Генферон + доксициклин) оценена исследователем как возможная. Кроме того, 2 пациентки основной группы предъявляли жалобы на тошноту после приема перорального антибактериального препарата (в одном случае у пациентки в анамнезе отмечался хронический гастрит), преимущественно в первые сутки приема терапии. Отмены проводимого лечения не потребовалось: у одной испытуемой нежелательное явление купировалось самостоятельно, у другой женщины, страдающей хроническим гастритом, тошнота была купирована после самостоятельного приема омепразола.
В группе сравнения (плацебо + доксициклин) 3 женщины отмечали появление тошноты, в одном случае сопровождавшейся диареей, в первые дни использования комплексной терапии, которые купировались без дополнительного лечения и не послужили причиной отмены проводимой терапии. Кроме того, одна пациентка отмечала появление узелковой сыпи на груди. Данное нежелательное явление не потребовало отмены терапии, его связь с проводимым лечением расценена как маловероятная. В одном случае в группе сравнения пациентка начиная с 7–го дня лечения предъявляла жалобы на зуд во влагалище и наружных половых органах при введении суппозиториев, который купировался после отмены плацебо.
Таким образом, можно констатировать, что использование суппозиториев Генферон в комплексной терапии неспецифических вагинитов характеризуется высокой безопасностью. Появление зудящих экзематозных элементов на коже верхней конечности определенно связать с применением Генферона довольно трудно, поскольку параллельно в терапии вагинита у пациентки использовался доксициклин. Кроме того, возникновение тошноты также является предвиденной побочной реакцией при приеме доксициклина, что подтверждается наличием данного нежелательного явления в группе пациентов, получавших плацебо совместно с изучаемым антибактериальным препаратом.
Резюмируя вышеизложенное, можно заключить, что нежелательные явления при использовании Генферона не превышают частоту возникновения таковых при применении плацебо, что служит дополнительным подтверждением безопасности и хорошей переносимости суппозиториев, содержащих интерферон–α, таурин и бензокаин.
Обсуждение результатов
Анализ проведенного исследования, а также современные литературные данные позволяют констатировать, что наличие уреа– и/или микоплазменного вагинита в абсолютном большинстве случаев не является монозаболеванием, а протекает на фоне различной сочетанной патологии урогенитального тракта и является частым спутником отягощенного акушерско–гинекологического анамнеза. Подтверждением этому являются данные, полученные в настоящем исследовании: более 70% женщин страдали различными инфекционно–воспалительными заболеваниями генитального тракта, в том числе патологией шейки матки, матки и ее придатков, рецидивирующими кольпитами, а также имели осложнения предыдущих беременностей, бесплодие. Как показал анализ микроскопии мазков, у всех включенных в исследование больных выявлялись воспалительные изменения, в ряде случаев с нарушением влагалищной микрофлоры, в том числе у женщин, не предъявляющих жалобы на момент скрининга. Таким образом, совершенно очевидным является факт, что мико– или уреаплазмозы не являются моносимптомными и сопровождают, а может быть являются причиной различных патологических состояний со стороны репродуктивной системы женщины.
Сложно однозначно ответить на вопрос, что является первичным – мико– или уреаплазменная инфекция, осложнениями которой могут быть воспалительные процессы в матке, маточных трубах с вовлечением яичников и, как следствие, бесплодие, или же первостепенен неблагоприятный преморбидный фон, наличие которого предопределяет оптимальные условия для активного размножения молликутов и реализации их патогенных свойств. Однако с точки зрения врача–клинициста главной задачей является не установление первопричинности имеющихся сочетанных патологических процессов со стороны мочеполовой системы, а адекватное лечение имеющегося заболевания. Таким образом, терапия вагинитов, ассоциированных с уреа– и микоплазмами, должна быть комплексной и направленной не только против возбудителя, но и на восстановление нарушенных процессов гомеостаза, являющихся звеньями порочного круга: хроническое воспаление обусловливает дисбаланс иммунорегуляторной системы организма и создает предпосылки для проявления истинно–патогенных свойств уреа– и микоплазм. В свою очередь, представители класса Mollicutes, по современным представлениям, являются комменсалами в составе урогенитальной флоры и приобретают клиническое значение при повышении определенного порога концентрации данных микроорганизмов. С другой стороны, активное воспаление усугубляет имеющиеся местные нарушения трофических, иммунорегуляторных и защитных механизмов слизистых урогенитального тракта, замыкая таким образом порочный круг инфекционно–воспалительного процесса.
С этих позиций становится определенно ясным, что воздействие как на возбудителя инфекции, так и на патофизиологические механизмы, которые могут быть как следствием, так и причиной воспалительного процесса, позволяет с определенной долей вероятности прогнозировать успешность терапии и профилактики развития повторных эпизодов инфекции.
Как показали результаты исследования, включение в комплексную терапию неспецифических вагинитов препарата Генферон, способного оказывать иммуномодулирующее, опосредованное антибактериальное, мембраностабилизирующее, антиоксидантное, репаративное и местноанестезирующее действие, увеличивает результативность лечения по сравнению с применением только антибактериальных средств.
Высокие показатели элиминации возбудителя в обеих исследованных группах по данным ПЦР и культурального исследований, а также единичные случаи рецидивирования микоплазменной инфекции позволяют говорить о правильно подобранном этиотропном лечении имеющегося заболевания, поскольку в исследование включались женщины, у которых обнаруженные возбудители имели подтвержденную чувствительность к доксициклину. Необходимость проведения культурального анализа, по нашему мнению, обусловлена не только возможностью определения концентрации возбудителя и его профиля антибиотикочувствительности, но и более точного определения этиологии заболевания, поскольку в ряде случаев ПЦР–исследование может давать ложноотрицательные результаты, в то время как при посеве обнаруживается рост микоплазм или уреаплазм как в монокультуре, так и в их ассоциации.
Наиболее важным аспектом исследования являлась оценка динамики воспалительных и дисбиотических изменений влагалищного мазка в различных группах пациенток. Анализ микроскопической картины вагинальных мазков, взятых на следующий день после окончания терапии, показал отчетливую положительную динамику в обеих исследуемых группах, что отражает эффект антибактериального препарата с доказанной к нему чувствительностью микроорганизмов. Однако в последующие дни наблюдения (через 10 и 30 дней после окончания курса лечения) в группе женщин, получавших в комплексной терапии препарат Генферон, выявлена более выраженная положительная динамика в купировании воспалительных изменений, имеющая статистически значимые различия с группой плацебо. Так, к моменту завершения исследования, в группе Генферона лишь у 1 (2,5%) женщины сохранялись слабовыраженные признаки воспаления и определялась II–III степень чистоты влагалищного мазка, в то время как в группе плацебо у 8 (20%) пациенток диагностирована II–II или III степень чистоты (р<0,05). Таким образом, на 41–й день исследования I или II степень чистоты вагинального мазка была диагностирована у 97,5% пациенток, применявших Генферон, и лишь у 80% участниц группы плацебо (р<0,05).
Полученные данные свидетельствуют о долгосрочном эффекте терапии Генфероном в купировании местных воспалительных и дисбиотических изменений, сохраняющемся даже через 1 мес. после окончания антибактериальной терапии.
Кроме того, после проведенной терапии на втором, третьем и четвертом визитах в группе плацебо отмечено развитие кандидозной инфекции в 6 случаях, бактериального вагиноза – в 2 случаях, в то время как в группе Генферона вульвовагинальная кандидозная инфекция обнаруживалась лишь у одной пациентки. Поскольку манифестация кандида–инфекции или бактериального вагиноза, как известно, происходит на фоне выраженных дисбиотических нарушений микрофлоры влагалища и изменений неспецифической резистентности организма, можно с определенной уверенностью сказать, что применение Генферона позволяет в большей степени, чем при использовании только стандартной антимикробной терапии, устранить указанные изменения.
Использование Генферона показало его хорошую переносимость и безопасность. Тщательный анализ всех случаев нежелательных явлений, возникших в период исследования, выявил наличие их гипотетически существующей связи с применяемым лечением у трех пациенток группы Генферона и у пяти женщин группы сравнения. Аллергическую реакцию и тошноту, наблюдавшиеся в группе активного препарата, однозначно связать с приемом Генферона не представляется возможным, поскольку терапия проводилась в комплексе с доксициклином, для которого данные реакции являются более ожидаемыми и описаны в утвержденной инструкции по применению препарата. Кроме того, в группе сравнения тошнота выявлялась с большей частотой, что является дополнительным свидетельством того, что причинным фактором возникновения данной нежелательной реакции является доксициклин. Один случай местной аллергической реакции в виде зуда во влагалище, зарегистрированный при введении суппозиториев–плацебо, вероятно, связан с повышенной чувствительностью к вспомогательным компонентам суппозиторной основы.
Таким образом, результаты исследования позволяют рекомендовать использование препарата Генферон в комплексной терапии неспецифических вагинитов, ассоциированных с обнаружением M. hominis и/или U. Urealyticum в диагностическом титре, по следующей схеме: по 1 суппозиторию 500 000 МЕ интравагинально 2 раза в сутки с 12–часовым интервалом в течение 10 дней параллельно стандартной терапии с использованием антибактериальных средств, чувствительность возбудителя к которым подтверждена данными культурального исследования.
Выводы
1. Использование препарата Генферон в комплексной терапии неспецифических вагинитов, ассоциированных с обнаружением M. hominis и/или U. Urealyticum в диагностическом титре, позволяет уменьшить признаки местных воспалительных и дисбиотических изменений в отдаленном периоде по сравнению с применением только стандартного антибактериального лечения.
2. Применение препарата Генферон в комплексной терапии неспецифических вагинитов позволяет уменьшить частоту возникновения вульвовагинального кандидоза, бактериального вагиноза, являющихся следствием сниженной неспецифической резистентности и дисбиоза влагалища, возникающих после курса антибиотикотерапии.
3. Использование Генферона в комплексной терапии неспецифических вагинитов характеризуется благоприятным профилем безопасности и хорошей переносимостью. Генферон может быть рекомендован к широкому применению в терапии неспецифических вагинитов в дозе 500 000 МЕ интравагинально 2 раза в сутки с 12–часовым интервалом в течение 10 дней параллельно стандартной терапии с использованием антибактериальных средств, чувствительность возбудителя к которым подтверждена данными культурального исследования.
Литература
1. Анкирская А.С. и др. Генитальные микоплазмы как фактор риска развития акушерской и перинатальной патологии // Вестник АМН СССР. – 1991. – № 6. – С. 17–19.
2. Башмакова М.А. Микоплазменные инфекции генитального тракта человека // Вестник АМН СССР. – 1991. – № 6. – С. 13–16.
3. Башмакова М.А., Савичева А.М. Генитальные микоплазмы и микоплазменные инфекции // Трудный пациент.– 2006. – № 2 (4). – С. 24–30.
4. Борисенко К.К., Тоскин И.А., Кисина В.И. О значении колонизации мочеполовых органов M. hominis и U. Urealyticum // ИППП. – 1999. – № 3. – С. 28–32.
5. Кисина В.И., Ширшова Е.В. Инфекции, передающиеся половым путем у женщин; существует ли связь генитальных микоплазм с патологией органов мочеполовой системы // Сonsilium medicum. – 2005. – № 7(7).
6. Кисина В.И., Прилепская В.Н., Соколовский Е.В. и др. Роль микоплазмы в урогенитальной патологии // Врач.– 2007. – № 2. – С. 3–6.
7. Кошелева Н.Г., Аржанова О.Н., Плужникова Т.А. Невынашивание беременности: этиопатогенез, диагностика и лечение. Учебное пособие. – СПб.: Научная литература, 2002.
8. Кулаков В.И., Манухин И.Б., Савельева Г.М. Гинекология. Национальное руководство. – М: ГЭОТАР–Медиа, 2007.
9. Мавров И.И. Нарушение репродуктивной функции у больных урогенитальным хламидиозом и уреаплазмозом // Вестник дерматол. – 1992. – № 11. – С. 72–75.
10. Прилепская В.Н., Абуд И.Ю. Урогенитальный микоплазмоз.www. medicus.ru
11. Прилепская В.Н., Быковская О.В. Уреаплазменная инфекция: клиника, диагностика, лечение. Патология шейки матки // Генитальные инфекции. – 2006. – № 1. – С. 46–52.
12. Прилепская В.Н., Кисина В.И., Соколовский Е.В., Савичева А.М. и др. К вопросу о роли микоплазм в урогенитальной патологии // Гинекология.– 2007. – № 9(1). – С. 31–38.
13. Раковская И.В. и др. Микоплазмы и микоплазмозы человека. Руководство для врачей. – М., 1999.
14. Тихомиров А., Сарсания С. Воспалительные заболевания органов малого таза. Современные особенности лечения // Врач. – 2005. – № 6. – С. 72–74.
15. Фофанова И.Ю. и др. Роль микоплазменной инфекции в акушерстве и гинекологии // Научный центр акушерства, гинекологии и перинатологии РАМН. – 2000. – № 3(2).
16. Цинзерлинг А.В., Вуду Г.А. Внутриутробный микоплазмоз. – Кишинев, 1986.
17. Badawy S.L., Westpfal E.M. Frequency of etiological factors and cost effectiveness of the work up for patients with history of recurrent pregnancy lost // Earlypregnancy. – 2000. – P. 256–260.
18. Baseman J.B., Lange M. et al. Interplay between mycoplasmas and host targetcells // Microbiol. Pathol. – 1995. – Vol. 2(19). – P. 47–63.
19. Blanchard A., Hentshel J., Duffy L. et al. Detection of Ureaplasmaurealyticum by polymerase chain reaction in the urogenital tract of adults, in amniotic fluid and respiratory tract of newborn // Clin. Infect. Dis. – 1993. – Vol. 17 (Suppl. 1). – P. 148–153.
20. Cram L.F., Zapata M.O., Toy E.S., Baker B. Genitourinary infections and their association with preterm labor // Am. Fam. Physician. – 2002. – Vol. 65 (2). – P. 241–248.
21. Gauthier D.W., Meyer W.J. et al. Expectant management of premature rupture of mempanes with amniotic fluid cultures positive for Ureaplasmaurealyticum alone // Am. J. Obstet. Gynecol. – 1994. – Vol. 70 (2). – P. 587–590.
22. Judlin P. Genital mycoplasmas // Gynecol. Obstet. Fertil. – 2003. – Vol.31(11). – P. 954–959.
23. Kataoka S., Yamada T., Chou K., Nishida R. Association between preterm birth and vaginal colonisation by Mycoplasma in early pregnancy // J. Clin. Microbiol. – 2006. – Vol. 44 (1). – P. 51–55.
24. Keane F., Thomas B., Gilroy C. et al. The association of Chlamydia trachomatis and Mycoplasma genitalium with non–gonococcal urethritis: observations on heterosexual men and their female partners // Int. J. STD AIDS. – 2000. – Vol. 11. – P. 435–439.
25. Razin S., Yogev D., Naot Y. Molecular biology and pathogenicity of mycoplasmas // Microbiol. and Molecular. Вiol. – 1998. – P. 1094–1156.
26. Taylor_Robinson D., Gilroy C.B., Hay P.E. Occurence of Mycoplasmsgenitalium in different populations and its clinical significance // Clin. Infect. Dis. – 1993. – Vol. 1 (suppl. 1). – P. 66–68.
27. Uuskula A., Kohl P.K. Genital Mycoplasmas, including Mycoplasma genitalium, as sexually transmitted agents // Int. J. STD AIDS. – 2002. – Vol. 13 (2). – P. 79–85.












