Диагностика КАФС
Трудности лечения КАФС связаны с одновременным, прогрессирующим развитием тромбозов с вовлечением многих жизненно важных органов и трудностями дифференциальной диагностики этого состояния. Так, клиническая картина КАФС во многом напоминает таковую при декомпенсированном ДВС-синдроме, сепсисе, септическом шоке, НЕLLР-синдроме, гемолитико-уремическом синдроме, тромботической тромбоцитопенической пурпуре, гепарин-индуцированной тромбоцитопении. Кроме того, в условиях прогрессирующего развития тромбозов результаты лабораторных исследований по обнаружению АФА могут быть отрицательными. Поэтому часто КАФС не диагностируется, из чего можно заключить, что истинная его частота значительно больше, чем это считается на сегодняшний день.Для облегчения диагностики КАФС и возможности как можно более раннего начала терапии возникла необходимость стандартизировать диагностические критерии КАФС.
Критерии классификации КАФС
10-й Международный Конгресс по антифосфолипидному синдрому в Таормине (Сицилия, 2002)1. Клинические проявления окклюзии сосудов трех или более органов и систем органов*.
2. Развитие клинических проявлений одновременно или с промежутком не более 1 недели.
3. Гистологическое подтверждение окклюзии сосудов мелкого калибра, по меньшей мере, в одном органе**.
4. Серологическое подтверждение наличия АФА (ВА и/или аКЛ и/или анти-b2-GPI)***.
Диагнозу КАФС соответствует наличие всех 4 указанных критериев.
Диагноз КАФС оценивается как вероятный при обнаружении:
– всех 4 критериев с вовлечением 2 органов или систем органов;
– всех 4 критериев при невозможности лабораторного подтверждения наличия АФА по истечении 6 недель после получения первых положительных лабораторных результатов (в случае ранней смерти пациента с неустановленным ранее диагнозом АФС);
– 1,2,4 критериев, если окклюзию мелких сосудов невозможно подтвердить гистологически;
– 1,3,4 критериев если третий эпизод развиваются позже одной недели, но в течение первого месяца после вторичного поражения, несмотря на антикоагулянтную терапию.
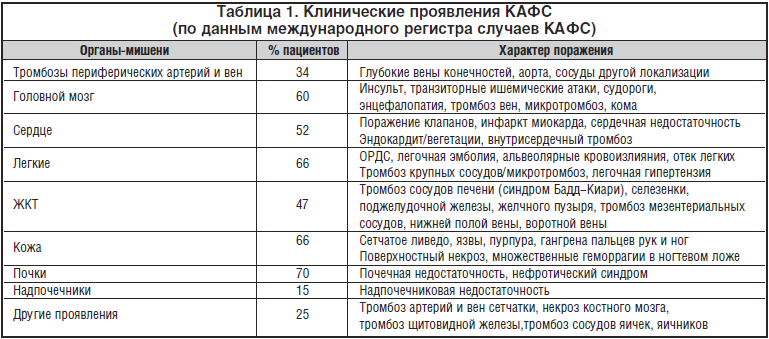
Клинические проявления КАФС
КАФС в 55% случаев развивается на фоне первичного АФС, у 30% пациентов – вторично при СКВ, а у 3% – на фоне других заболеваний соединительной ткани (ревматоидный артрит, склеродермия, системный некротизирующий васкулит) [Harris et al., 2004]. КАФС развивается как у женщин, так и мужчин, и хотя у женщин он наблюдается в 2 раза чаще; течение и исходы хуже у мужчин.При КАФС за короткий промежуток времени (в течение недели) происходит развитие множественных тромбозов различных органов. В противоположность некатастрофическому АФС наблюдается окклюзия сосудов мелкого калибра (хотя могут вовлекаться и более крупные сосуды), не характерны тромбозы глубоких вен. Помимо АФС, синдром тромботической микроангиопатии характерен для тромботической тромбоцитопенической пурпуры, гемолитико-уремического синдрома, ДВС-синдрома и НЕLLP-синдрома. Для КАФС наиболее характерны почечные, легочные, церебральные и гастроинтестинальные тромбозы. Часто встречаются атипичные для АФС тромбозы: надпочечниковые, селезеночные, тестикулярные, яичниковые, кожные, тромбозы поджелудочной железы, предстательной железы, костного мозга; тромбозы могут лежать в основе развития бескаменного холецистита, язв ЖКТ. У небольшого числа пациентов с КАФС развиваются тромбозы крупных сосудов (вен нижних конечностей, тромбозы коронарных и церебральных артерий), т.е. проявления, характерные для классического АФС. Характерен рецидив тромбозов несмотря на адекватную антикоагулянтную терапию.
В результате тромботической микроваскулопатии возникает острая мультиорганная недостаточность. Клинически это может проявляться нарушениями ЦНС, включая ступор, дезориентацию, параличи, развитием надпочечниковой недостаточности, ОРДС и дыхательной недостаточности, развитием инфарктов миокарда и ЖКТ (табл. 1). Практически у 80% пациентов поражаются почки с развитием почечной микроангиопатии и окклюзией мелких сосудов. Часто (в 60% случаев) выявляются и симптомы поражения головного мозга (инсульт, транзиторные ишемические атаки, судороги, кома), однако микротромбозы сосудов головного мозга могут развиваться и гораздо чаще, чем это диагностируется, и могут быть причиной развития энцефалопатии при КАФС. Более чем у половины пациентов с КАФС наблюдается поражение сердца. В большинстве случаев оно проявляется развитием аортальной и митральной недостаточности, которые могли сформироваться ранее на фоне СКВ или АФС. У 25% пациентов выявляется инфаркт миокарда. Некроз костного мозга является редким осложнением, которое описано у пациентов с метастатическими опухолями, ДВС-синдромом, развившимся после радио- или химиотерапии, у пациентов с септическим шоком. Теперь этот список пополнен еще и сообщениями о развитии некроза костного мозга при КАФС.
Патогенез КАФС
На сегодняшний день все больше данных свидетельствуют о ключевой роли синдрома системного воспалительного ответа (ССВО) в патогенезе КАФС. ССВО возникает не только при сепсисе; неинфекционные причины, в частности иммунноопосредованное поражение органов, являются мощнейшим стимулом к формированию системного воспаления. Гипотезу о том, что КАФС является проявлением системного воспалительного ответа, подтверждает наличие общих медиаторных каскадов, характерных как для сепсиса, так и для КАФС. К таким эндогенным медиаторам относятся прежде всего TNF-a, IL-1, фактор активации тромбоцитов PAF, вазодилатирующие простагландины, наличие активации комплемента и суперэкспрессия молекул адгезии на лейкоцитах, тромбоцитах и эндотелиальных клетках.Ключевую роль в патогенезе КАФС, также как и при ССВО, играет эндотелиальная дисфункция, проявляющаяся нарушением антитроботической и противовоспалительной активности эндотелия и приводящая к дисбалансу гомеостаза свертывающей системы крови с развитием прокоагулянтного состояния. Активирует эндотелиальные клетки и, вероятно, способствует образованию подготовительного сигнала для КАФС комплекс иммунных стимулов, включающий цитокины, компоненты комплемента и аутоантитела. Хорошо известно, что такие цитокины, как TNF-a, IL-1b, IFN-g являются важнейшими медиаторами активации эндотелиальных клеток. К активаторам эндотелиальных клеток относятся и компоненты комплемента (СЗb, СЗb и С5а), а также мембран-атакующий комплекс, представленный С5b-9. С5b-9 усиливает экспрессию эндотелиальных молекул адгезии, в особенности экспрессию тканевого фактора (ТF), что соответствует состоянию повреждения эндотелия и тромбофилии, характерных для КАФС. Компонент комплемента С1q является необходимым кофактором для активации эндотелия под действием иммунных комплексов.
Ключевым звеном патогенеза тромботических осложнений при АФС является дисрегуляция системы свертывания крови, активация процессов воспаления и развитием системной эндотелиальной дисфункции под действие антифосфолипидных антител. АФА обладают прокоагулянтной и провоспалительной активностью, реализуя свое влияние на гуморальном и клеточном уровне (табл. 2).
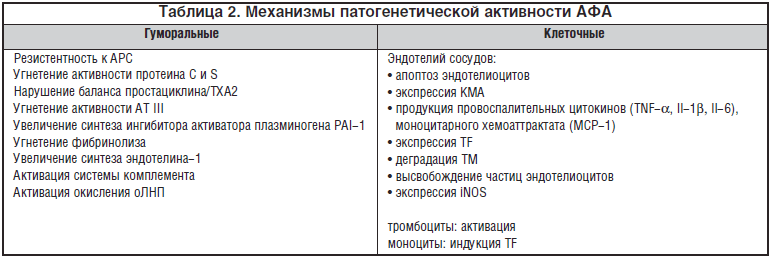
Для взаимодействия АФА с эндотелием необходимо присутствие анти-b2-гликопротеина (анти-b2-GPI), который взаимодействует с главным протеогликаном сосудистой стенки – гепаран сульфатом. Недавно была идентифицирована еще одна структура эндотелиальных клеток, ответственная за связывание b2-GPI – аннексин II, который служит рецептором эндотелиальных клеток для тканевого активатора плазминогена t-PA. Было показано, что анти-b2-GPI антитела, связываясь с мембранами эндотелиальных клеток, вызывают сходный эффект с провоспалительными цитокинами (TNF-a, IL-1) и ЛПС. Этот эффект реализуюется за счет увеличения экспрессии цитокинов и молекул адгезии в результате активации фактора транскрипции NF-kB. C активацией фактора NF-kB связано также увеличение экспрессии TF на эндотелиальных клетках и лейкоцитах, обладающего прокоагулянтными и провоспалительными свойствами.
Одним из проявлений эндотелиальной дисфункции при АФС является гиперэкспрессия индуцируемой NO-синтазы (iNOS). Следует отметить, что увеличение продукции NO является характерным для синдрома системного ответа на воспаление.
В развитии артериальных тромбозов также играют роль АФА к окисленным ЛНП, уровень которых коррелирует с риском инфаркта миокарда и прогрессированием атеросклероза сонных артерий. Содержание АФА к оЛНП также существенно выше у пациентов с артериальными тромбозами в анамнезе.
Влияние АФА на систему гемостаза проявляется в нарушении баланса между факторами свертывания, фибринолитической системой, тромбоцитами и эндотелием, снижении активности естественных антикоагулянтов, что создает условия для развития тромбофилитического состоянии и развития тромботических осложнений.
Главную роль в возникновении тромбофилии при АФС играют повреждения в системе протеина С. АФА ингибируют систему протеина С несколькими путями:
а) ингибируют формирование тромбина, который является активатором протеина С (тромбиновый парадокс);
б) ингибируют активацию протеина С через образование антител к тромбомодулину;
в) вызывают развитие приобретенной резистентности к активированному протеину С:
– через ингибирование сборки протеинов комплекса РС на анионных поверхностях фосфолипидных матриц,
– через прямую ингибицию АРС активности,
– через ингибицию кофакторов Vа и VIIIа;
г) антитела приводят к развитию приобретенного дефицита протеина С и/или протеина S. В норме 50% протеина S в плазме находится в связанном состоянии с компонентом комплемента СВ4b и не обладает биологической активностью. АФА повышают аффинность протеина S к СВ4b, что может приводить к приобретенному дефициту свободных уровней РS. Хотя в целом снижение уровней PC и PS у пациентов с АФС выявляется достаточно редко, эти случаи, вероятно, очень опасны в плане тромботических осложнений.
Аутоантитела, направленные против FVа защищают его от инактивации с помощью АРС. Замедленная деградация фактора Vа обусловливает так называемый фенотип АРС резистентности. В этом случае отсутствует истинная Лейденовская мутация, но фактор Vа, связанный с АФА, не ингибируется АРС, сохраняя свою прокоагулянтную активность. При этом нарушается не столько активация протеина С, сколько возникает резистентность к активированному протеину С.
Исследования последних лет показали, что низкие дозы тромбина преимущественно активируют РС. Эти и другие наблюдения привели к открытию так называемого «тромбинового парадокса»: тромбин обладает и анти-, и протромботическими свойствами в системе гемостаза (табл. 3). При низких концентрациях тромбина проявляется преимущественно активация РС и его антитромботические свойства, тогда как при более высоких концентрациях тромбин проявляет протромботическую активность. Низкие концентрации тромбина циркулируют в крови здоровых людей и поддерживают исходную активацию РС. Наличие АФА ингибирует эти низкие уровни формирования тромбина и снижает активность циркулирующего АРС.
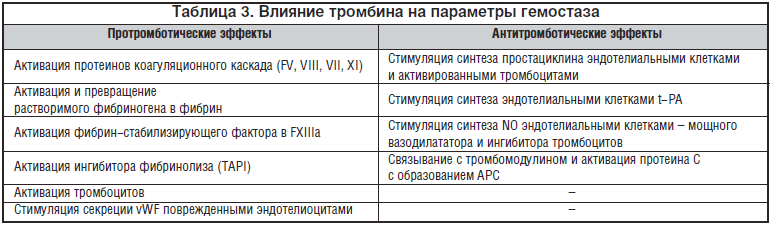
Важный вклад в развитие тромбофилии в результате повреждения системы протеина С вносит и снижение фибринолитической активности в результате отсутствия ингибирующего влияния АРС на ингибитор активатора плазминогена PAI-1. Кроме того, развитие тромбофилии при АФС обусловлено снижением активности важнейшего естественного антикоагулянта антитромбина III, вероятно, вследствие нарушения его взаимодействия с гепарин и гепарансульфатом в условии его конкуренции с АФА за связывание с этими компонентами мембран эндотелиальных клеток. Под действием АФА активированные эндотелиоциты экспонируют в больших количествах TF, vWF и фибронектин, что также увеличивает свертывающий потенциал крови.
Помимо эндотелиальных нарушений, одним из основополагающих механизмов тромбофилии при АФС является тромботическая тромбоцитопения, сопровождающаяся агрегацией тромбоцитов. Наличием тромбоцитарных тромбов у больных с АФС объясняется феномен «белого сгустка», который хирурги нередко обнаруживают у больных с АФС.
В настоящее время участие тромбоцитов в качестве мишеней АФА не вызывает сомнений. Идентификация маркеров активации тромбоцитов у большинства пациентов с АФС выявляет нарушенную регуляцию эйкозаноидов: ингибицию синтеза простациклина и/или повышение продукции ТХА2 тромбоцитами, а также повышение уровня Р-селектина и количества микрочастиц тромбоцитов.
Тромбоцитопения при АФС является по механизму развития тромботической и иммунной. Механизмы иммунных тромбоцитопений при различных патологических состояниях во многом сходны и, вероятно, универсальны. Основной момент патогенеза — возможность взаимодействия FcgRII рецептора тромбоцита с Fc-частью антитела, что ведет к трансдукции сигнала и активации тромбоцитов с реакцией освобождения и гиперагрегацией. Однако прямое взаимодействие FcgRII рецептора с Fc-частью антитела невозможно: необходим «посредник», выступающий в качестве антигенной мишени для антитела и локализованный на поверхности тромбоцита. При различных патологических состояниях, сопровождаемых иммунной тромбоцитопенией, антигенные мишени, равно как и антитела, различны. Так, при ГИТ в качестве антигенной мишени выступает комплекс гепарин-РF4, при АФС — комплекс между сывороточным белком-кофактором (b2-GPI, протромбин, возможно, другие белки) и отрицательно заряженными фосфолипидами.
Таким образом, после слабой активации тромбоцитов (в результате уже имевшего место тромбоза в анамнезе, при вирусной, бактериальной инфекции) отрицательно заряженные фосфолипиды экспонируются на поверхности тромбоцитов. Фосфолипид-связывающие протеины, такие как, например, b2-GPI, слабо связываются с отрицательно заряженными фосфолипидами, образуя антигенную мишень. Антифосфолипидные антитела стабилизируют эту связь путем образования комплекса с антигенной мишенью и дополнительно путем образования связи между FcgRII-рецептором и своей Fc-частью.
Большая занятость FcgRII-рецептора приводит к трансдукции сигнала и активации тромбоцитов. В результате происходит запуск арахидонового каскада с образованием значительных количеств ТхА2, ведущих к интенсивной необратимой внутрисосудистой агрегации тромбоцитов, вазоконстрикции и, следовательно, к нарушениям микроциркуляции. Агрегация тромбоцитов, в свою очередь, сопровождается реакцией высвобождения из них биологически активных веществ (ADP, серотонина), также оказывающих влияние на агрегацию тромбоцитов и микрочастиц-дериватов с прокоагулянтной активностью. Кроме того, существует и комплемент-опосредованный механизм активации тромбоцитов при АФС. Важную роль в патогенезе тромбофилии при АФС играют взаимоотношения АФА с другими клетками. К клеткам, с которыми АФА связываются через b2-GPI (а возможно и через другие кофакторы), относятся нейтрофилы, моноциты и клетки трофобласта.
Процессы тромбообразования и воспаления тесно связаны и потенцируют друг друга. Так, при КАФС массивный выброс провоспалительных цитокинов приводит к формированию протромбогенного фенотипа сосудистого эндотелия. Активированные тромбоциты являются источниками медиаторов воспаления (тромбоцитарный фактор роста, фактор 4 тромбоцитов, тромбоспондин). При связывании тромбоцитарного Р-селектина с лейкоцитарным рецептором (гликопротеиновым лигандом Р-селектина – PSLG-1) активируется транслокация фактора NF-kB в ядро и индуцируется синтез провоспалительных цитокинов, хемокинов и тканевого фактора. Циркулирующие факторы свертывания также обладают провоспалительным потенциалом. Так, взаимодействие комплекса TF-VIIa и FXа со специфическими рецепторами PARs (рецепторы, активируемые тромбином) приводит к увеличению экспрессии КМА и провоспалительных цитокинов (TNF-a, IL-1b, Il-6). Тромбин стимулирует экспрессию КМА на эндотелии и активирует хемотаксис лейкоцитов. Напротив, АТ III, связываясь с рецепторами моноцитов, предотвращает продукцию цитокинов и хемокинов. АРС при взаимодействии со специфическими рецепторами на эндотелии подавляет продукцию TNF-a и КМА.
Возникает вопрос: с чем связано мгновенное прогрессирующее развитие КАФС? Ведь долгие годы у пациентов возможна лишь бессимптомная циркуляция антифосфолипидных антител при отсутствии клинических проявлений.
Эти вопросы породили так называемую теорию «двойного удара», гипотезу о существовании дополнительного биологического фактора, необходимого для развития распространенной микроваскулопатии, активации эндотелия и массивного выброса цитокинов, характерных для КАФС.
Различные триггерные факторы, способствовавшие развитию КАФС, выявлены более чем у 45% пациентов с КАФС [R. Asherson, 2004]. В качестве такого фактора в большинстве случаев (35%) выступает инфекция. Кроме того, провоцирующим фактором для развития КАФС могут стать хирургические вмешательства (например, гистеэктомия, кесарево сечение, холецистэктомия), в том числе даже небольшие (экстракция зуба, РХПГ, кюретаж матки, биопсия), отмена антикоагулятнов, использование некоторых лекарственных препаратов (чаще всего оральных контрацептивов).
Возможной причиной развития КАФС является массивный выброс провоспалительных цитокинов, повреждение эндотелия, развитие прокоагулянтного состояния под действием инфекционного агента. Кроме того, микроорганизмы могут содержать химические структуры, сходные с определенными аминокислотными последовательностями или конформационными структурами белков человеческого организма. При этом феномене, названном антигенной мимикрией, наблюдается нарушение толерантности к аутоантигенам, развитие специфического иммунного ответа в ответ на воздействие патогенного агента и перекрестная реактивность по отношению к собственным структурам организма с формированием органных повреждений.
Интересен случай КАФС, описанный Nuuzelt у 31-летней женщины КАФС развился через год после беременности, сопровождавшейся HELLP-синдромом, что подтверждает единый патогенетический механизм этих состояний. При HELLP-синдроме в 70% случаев выявляются АФА, кроме того, у женщин с тяжелыми формами гестоза намного чаще, чем в общей популяции, выявляются другие дефекты гемостаза, в частности, при мутации FV Leiden и дефиците протеина S. Сочетание приобретенной тромбофилии, обусловленной АФС, с генетическими дефектами гемостаза существенно утяжеляет течение патологического процесса. При этом при определенных условиях возможна декомпенсация системы гемостаза и развитие КАФС. Так, у части пациентов в анамнезе присутствуют тромботические проявления, что свидетельствует о предсуществующем состоянии гиперкоагуляции и возможной роли наследственных тромбофилий в развитии КАФС.
Анализ данного случая позволяет сделать заключение, что под привычным диагнозом «Тяжелый гестоз. Преэклампсия» был замаскирован катастрофический АФС. Это подтверждают лабораторные данные – стойкая циркуляция ВА, высокий уровень антифосфолипидных антител, антител к b2-гликопротеину 1 и клинические проявления – развивающаяся картина мультиорганной недостаточности и гистологическое подтверждение окклюзии сосудов плаценты.
В этом случае КАФС был спровоцирован сразу несколькими факторами:
1) стойкая циркуляция ВА, высокий уровень АФА и антител к b2-GPI I;
2) наличие наследственной тромбофилии, которая способствует развитию тромботических осложнений и утяжеляет течение АФС;
3) триггером к развитию КАФС могла служить послеродовая инфекция (эндометрит);
4) пациентка относится к группе высокого риска в отношении оперативных вмешательств; даже несмотря на адекватную профилактику с помощью антикоагулянтов велик риск тромботических осложнений, включая КАФС; развитие КАФС могло спровоцировать уменьшение дозы фраксипарина после родоразрешения.
Клиническая картина КАФС во многом напоминает декомпенсированный ДВС-синдром. В обоих случаях имеет место реакция микроциркуляторного русла в виде стаза и микротромбозов, в периферической крови обнаруживается гипокоагуляция. У почти 70% пациентов с КАФС развивается тромбоцитопения (менее 100000/мкл), у четверти — гемолитическая анемия. Мы считаем, что признаки ДВС-синдрома могут развиваться практически во всех случаях КАФС, что обусловлено общими патогенетическими механизмами этих состояний. Так, в основе КАФС и ДВС-синдрома лежит универсальный патологический процесс – синдром системного воспалительного ответа. Как при КАФС, так и при синдроме ДВС выявляются сходные провоцирующие факторы (инфекция, травма, беременность), наблюдается развитие эндотелиальной дисфункции, выброс провоспалительных цитокинов и активация коагуляции.
Согласно Kitchens (1998) массивное тромбообразование влечет за собой прогрессирование тромбоза, которое авторы назвали «тромботическим штормом». В основе этого явления лежит прогрессирующая активация образования тромбина, угнетение фибринолиза за счет PAI-1, потребление антикоагулянтных факторов: протеина C и S, AT III, развитие массивного тканевого повреждения, выброса цитокинов, развитие ДВС-синдрома и системного ответа на воспаление (рис. 1).
![Рис. 1. Гипотеза «тромботического шторма» [Kitchens et al., 1998] Рис. 1. Гипотеза «тромботического шторма» [Kitchens et al., 1998]](/upload/medialibrary/a17/23-1.png)
Таким образом, высокий уровень АФА обусловливает формирование прокоагулянтного и провоспалительного потенциала, на фоне которого под действием дополнительных провоцирующих факторов (инфекция, травма, хирургическое вмешательство) реализуется декомпенсация системы гемостаза и развитие системного воспалительного ответа. Рассматривая КАФС с позиций синдрома системного ответа на воспаление, становится понятным колоссальное сходство клинических проявлений КАФС и сепсиса. Развивающийся синдром системного ответа на воспаление приводит к формированию распространенной тромботической васкулопатии, что, в свою очередь, объясняет широкий спектр клинических проявлений КАФС, обусловленных повреждением тканей и развитием мультиорганной недостаточности, включая нарушение функции почек, ОРДС, развитие церебральных нарушений (острый церебральный дистресс-синдром), снижение сократительной активности миокарда и развитие катехоламин-рефрактерной гипотензии.
Таким образом, проявления КАФС зависят от двух факторов:
1) органов, вовлеченных в процесс формирования тромбозов и распространенности тромбозов;
2) проявлений ССВО.
Именно на ликвидацию этих факторов должна быть направлена терапия КАФС.
Принципы терапии КАФС
КАФС – редко встречающееся состояние, изучение которого представляет значительные трудности. Проспективных контролируемых исследований с целью изучения КАФС на настоящий момент не проводилось, и наши знания о КАФС основываются только на описании клинических случаев и обзорных работах. В связи с недостаточным знанием этиопатогенеза КАФС оптимальная его терапия все еще не разработана.При подозрении на КАФС незамедлительно должна быть начата агрессивная терапия. Ранняя диагностика и начало адекватной терапии являются критическими для исхода КАФС. Следует отметить, что серологическое выявление маркеров АФС или обнаружение ВА требует времени или часто невозможно, а порой на фоне прогрессирующих тромбозов результаты лабораторных исследований могут быть отрицательными.
Учитывая, что КАФС является тромбофилическим расстройством с характерной распространенной микроваскулопатией, патогенетически обоснованной представляется терапия с использованием антикоагулянтов. Кроме того, терапия должна быть направлена на предотвращение образования и циркуляции медиаторов системного воспалительного ответа и тканевых повреждений (АФА, цитокинов, продуктов активации комплемента, антиэндотелиальных антител). Анализ комбинированной терапии показал, что лучшие результаты были получены (68% выживаемости) при комбинации антикоагулянтов, кортикостероидов, заместительной терапии свежезамороженной плазмой и внутривенном введении иммуноглобулина. В связи с этим на 10-м Международном конгрессе по АФС в Таормине был выработан алгоритм ведения больных с КАФС (рис. 2).
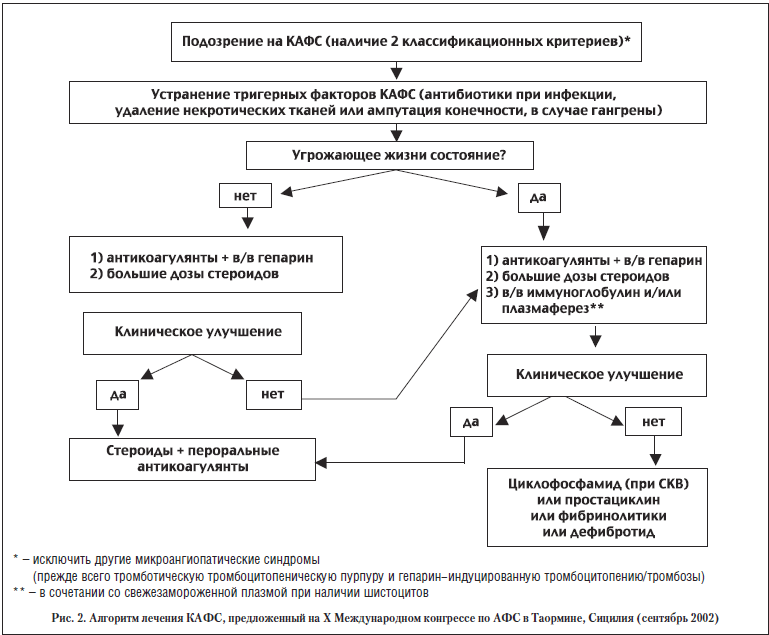
Терапию КАФС следует начинать с применения препаратов первого ряда (антикоаглянтов и кортикостероидов). При отсутствии клинического эффекта или при прогрессировании тромбозов несмотря на антикоагулянтную терапию применяют препараты второго ряда. При отсутствии клинического эффекта и прогрессивном ухудшении состояния пациента встает вопрос о применении препаратов третьего ряда, опыт использования которых ограничен и/или эффективность которых не известна (табл. 4).


Гепарин в 1000 раз увеличивает активность антитромбина III, что приводит к эффективному ингибированию тромбина, фактора X и IX. В достаточно высоких концентрациях гепарин способен оказывать дополнительное ингибирующее влияние на тромбин через гепарин-кофактор II. Некоторые ограничения антикоагулянтного эффекта гепарина связаны с невозможностью в комплексе с АТ III ингибировать тромбин и фактор X при фиксации последних на поверхности фибрина и фосфолипидов. Эффективность применения гепарина у пациентов с КАФС обусловлена не только его воздействием на систему гемостаза, но и, возможно, способностью адсорбировать АФА, предотвращать их связывание с клетками-мишенями и ингибировать активность комплемента.
Более предпочтительным представляется использование низкомолекулярного гепарина, так как он:
а) обеспечивают хороший антикоагулянтный эффект;
б) в меньшей степени нуждается в кофакторе (АТ III), когда в условиях КАФС угнетаются естественные антикоагулянтные пути;
в) уменьшает опасность развития ГИТ, поскольку НМГ практически не взаимодействует с тромбоцитами и фактором 4 тромбоцитов.
Противотромботическую активность НМГ длительно связывали исключительно с преобладанием анти-Xa активности над антитромбиновой активностью. Позднее выяснилось, что только 30% противотромботической активности НМГ осуществляется через АТ III и на 70% – через эффекты, связанные с эндотелием, в частности, с высвобождением естественного ингибитора внешнего пути свертывания TFPI. Активация тканевого фактора является ключевым этапом развития коагуляции и воспаления и является важной частью патогенеза гнойно-септических заболеваний, КАФС, ДВС-синдрома, что объясняет эффективность применения НМГ при этих состояниях. В последнее время пристальное внимание уделяется изучению влияния НМГ на процессы воспаления и возможность его применения для лечения различных заболеваний, включая воспалительные заболевания кишечника, бронхиальную астму, аутоиммунные и сердечно-сосудистые заболевания. Так, показана способность НМГ ингибировать адгезию лейкоцитов и экспрессию TNF-a.
Эффективность глюкокортикоидов обусловлена их способностью ингибировать развитие системного ответа на воспаление вследствие блокирования экспрессии NF-kB -фактора транскрипции большинства медиаторов воспаления. Следует отметить, что сами по себе глюкокортикоиды не влияют на риск развития повторных тромбозов.
Применение внутривенного иммуноглобулина может быть эффективным в связи с его способностью блокировать связывание антител с рецепторами макрофагов, увеличивать Т-клеточный супрессорный ответ и, возможно, уменьшать синтез и активировать метаболизм циркулирующих IgG, регулировать продукцию цитокинов и активацию системы комплемента. Иммуноглобулин применяется также для лечения тромботической тромбоцитопенической пурпуры и особенно эффективен у пациентов с тромбоцитопенией. С осторожностью и по возможности в минимальных дозах следует применять иммуноглобулин у пациентов при поражении почек, так как препарат может спровоцировать развитие почечной недостаточности. Особенно это касается лиц старше 65 лет, принимающих препараты с возможным нефротоксическим действием и при сепсисе.
В последнее время все больше данных за успешное применение плазмафереза при КАФС. Возможно, это связано с удалением АФА, провоспалительных цитокинов TNF-a, Il-1, Il-6, компонентов комплемента и других медиаторов воспаления, что препятствует прогрессированию воспалительного ответа, процессов коагуляции и повреждения тканей. Повторные плазмаферезы оправданы при наиболее рефрактерных случаях КАФС, когда остальная общепринятая терапия не приносит положительного результата.
Заместительная терапия свежезамороженной плазмой необходима, в особенности при явных признаках ДВС-синдрома и микроангиопатической гемолитической анемии (появление большого числа шистоцитов в периферической крови). Показано, что плазмаферез является наиболее эффективным методом терапии микроангиопатической гемолитической анемии, ассоциированной с АФС. При этом одна из основных целей заместительной терапии — восполнение уровня естественных антикоагулянтов и в первую очередь АТ III и протеина С.
Весьма эффективно применение концентратов АТ III и протеина С. Так, рекомбинантный активированный протеин С (Дротрекогин) обладает мощным антитромботическим (снижает уровень D-димера), противовоспалительным (снижает концентрацию Il-6) и фибринолитическим эффектом. Его эффективность доказана у пациентов с тяжелым сепсисом. В связи с ключевой ролью системного воспалительного ответа в патогенезе КАФС применение этого препарата обосновано и у пациентов с КАФС.
Сообщается об успешном применении фибринолитиков, простациклина, дефибротида, даназола, циклоспорина, азатиоприна и, наконец, спленэктомии в терапии КАФС.
Применение фибринолитиков не получило широкого распространения в связи с риском развития кровотечений. Использование этих препаратов возможно при неэффективности средств терапии первого и второго ряда. Роль циклофосфамида заключается в предотвращении «ребаунд»-продукции патогенных аутоантител аутоагрессивными лимфоцитами после проведения сеансов плазмафереза и/или на фоне обострения СКВ.
Патогенетической основой применения простациклина является его способность к вазодилатации и ингибированию функции тромбоцитов, однако простациклин нужно применять с осторожностью в связи с наличием данных о возможном развитии «рикошетных» тромбозов.
Дефибротид представляет собой щелочную соль односпиральной молекулы ДНК, является агонистом аденозиновых рецепторов А1 и А2 и обладает антитромботическими свойствами. Кроме того, дефибротид оказывает модулирующее влияние на эндотелий путем различных механизмов: 1) увеличение продукции PGI2 и PGE2; 2) ингибирование синтеза лейкотриена В4 (LTB4), обладающего протроботическими свойствами; 3) стимуляция фибринолиза вследствие ингибирования экспрессии PAI-1 и увеличения продукции t-PA; 4) уменьшение экспрессии эндотелина-1; 5) подавление системного воспалительного ответа путем ингибирования продукции цитокинов. Важно, что при применении дефибротида уровень цитокинов возвращается к нормальному уровню, тогда как при применении антагонистов TNF-a содержание цитокинов может снизиться до субминимальных значений, что может оказаться опасным у пациентов с мультиорганной недостаточностью. Хотя в литературе имеется только одно описание применения дефибротида при КАФС [Burcoglu-O’Ral et al., 2002], использование этого препарата представляется патогенетически обоснованным в связи с ведущей ролью эндотелиальной дисфункции при КАФС и может быть весьма перспективным для терапии этого угрожающего состояния.
Теоретически возможно применение и других антикоагулянтных препаратов, однако на практике они не были испытаны у пациентов с КАФС. Так, гирудин является наиболее мощным естественным ингибитором тромбина и особенно эффективен для лечения гепарин-индуцированной тромбоцитопении.
Таким образом, эффективными препаратами для лечения КАФС будут такие лекарственные средства, которые способны одновременно блокировать оба патогенетических механизма этого заболевания – прокоагулянтный и провоспалительный.
Важная роль отводится и неспецифической терапии, направленной на борьбу с проявлениями системного воспалительного ответа и мультиорганной недостаточности. При почечной недостаточности требуется проведение гемодиализа, ИВЛ – в случае дыхательной недостаточности, наиболее часто обусловленной развитием ОРДС, инотропная поддержка при нестабильной гемодинамике, антигипертензивная терапия в случае гипертензии, которая нередко выявляется при тромбозе почечных артерий и вен или при тромботической микроангиопатии и требует агрессивной терапии. В случае гипотензии, связанной с развитием дисфункции миокарда как проявления ССВО, микроангиопатией мелких сосудов миокарда, инфарктом надпочечников, для инотропной поддержки показано применение глюкокортикоидов.
Пути профилактики КАФС
Пациенты с АФС составляют группу очень высокого риска развития тромбоэмболических осложнений в периоперационном периоде. Даже минимальные инвазивные вмешательства (биопсия, кюретаж, экстракция зуба) могут спровоцировать развитие КАФС. Так, по данным Erkan et al. (2003), у 40% пациентов развитие КАФС было спровоцировано хирургическим вмешательством. Основными причинами развития тромботических осложнений в связи с хирургическими вмешательствами являются повреждение сосудистой стенки, стаз крови и отмена непрямых антикоагулянтов.С целью профилактики КАФС в периоперационном периоде рекомендуется:
• свести к минимуму период, в течение которого приостанавливается антикоагулянтная терапия;
• при отсутствии хирургических противопоказаний как можно раньше возобновить антикоагулянтную терапию в послеоперационном периоде, учитывая, что у пациентов с АФС возможно развитие тромбозов несмотря на применение стандартных адекватных схем антикоагулянтной терапии;
• применять антикоагулянты в дозах выше стандартных, т.к. у пациентов с АФС последние могут быть недостаточно эффективными;
• обеспечить эластическую компрессию для предупреждения явлений стаза в дистальных участках сосудистого русла.
В период отмены непрямых антикоагулянтов необходимо парентеральное введение антикоагулянтов, предпочтительно низкомолекулярного гепарина (НМГ), в адекватных дозах. Кроме того, необходимо внимательно относиться к лечению любого инфекционного заболевания, применяя адекватную антибиотикотерапию. Следует также помнить, что при АФС категорически противопоказано применение оральных контрацептивов и заместительной гормональной терапии.
На сегодняшний день важной остается проблема диагностики КАФС, которая немыслима без определения АФА. Поэтому определение АФА должно быть обязательным у всех беременных с гестозами, привычным невынашиванием, начальными проявлениями гнойно-септических заболеваний. У всех беременных с АФС и наследственной тромбофилией наиболее целесообразной является ранняя патогенетическая противотромботическая и противовоспалительная терапия с применением НМГ, как во время беременности, так и минимум в течение 6 недель после родов. Указанный подход позволяет осуществить профилактику потерь плода и тромботических осложнений, обеспечить более адекватное развитие плаценты, провести профилактику развития внутриутробной задержки развития плода, а также предотвратить развитие самого грозного осложнения АФС – катастрофической формы АФС.
Список сокращений
AT III – антитромбин III
аКЛ – антикардиолипин
АПФ – ангиотензинпревращающий фермент
АФА – антифосфолипидные антитела
АФС – антифосфолипидный синдром
ВА – волчаночный антикоагулянт
ГИТ – гепарин-индуцированная тромбоцитопения
ДВС–синдром – синдром диссеминированного внутрисосудистого свертывания
КАФС – катастрофический антифосфолипидный синдром
КМА – клеточные молекулы адгезии
ЛПС – липополисахарид
НМГ – низкомолекулярный гепарин
оЛНП – окисленные липопротеины низкой плотности
ОРДС – острый респираторный дистресс-синдром
СКВ – системная красная волчанка
ССВО – синдром системного воспалительного ответа
АРС – активированный протеин С
FV Leiden – лейденовская мутация фактора V
IFN – интерферон
IL – интерлейкин
МСР – моноцитарный хемоаттрактантный протеин
NOS – NO-синтазa
PAF – фактор активации тромбоцитов
PAI-1 – ингибитор активатора плазминогена-1
PC – протеин С
PF4 – пластинчатый фактор 4
PG – простагландины
PGI2 – простациклин
PS – протеин S
TF – тканевый фактор
TFPI – ингибитор пути тканевого фактора
TNF-a – тумор-некротизирующий фактор a
t-PA – активатор плазминогена тканевого типа
ТМ – тромбомодулин
TXA2 – тромбоксан А2
vWF – фактор фон Виллебрандта
b2-GPI – b2-гликопротеин












