Введение
Миома матки (ММ) является одним из наиболее распространенных гинекологических заболеваний, которое ассоциируется с высоким риском аномального маточного кровотечения, дисменореи, при этом на сегодняшний день не существует прогностических маркеров, позволяющих оценить степень ответа на лечение и риски рецидива или прогрессирующего течения заболевания [1], что в итоге ограничивает возможности персонифицированного выбора оперативной, лекарственной или комбинированной терапии [2].Цель нашего исследования — оценить отдаленные исходы пролонгированного лечения мифепристоном у пациенток с ММ в пременопаузе.
Материал и методы Дизайн исследования
С 2012 г. по апрель 2014 г. проведено проспективное долгосрочное исследование влияния пролонгированного лечения мифепристоном на течение ММ у женщин в пременопаузе.Критерии включения в исследование:
возраст 40 лет и старше в момент включения в исследование;наличие симптомной ММ (наличие хронического аномального маточного кровотечения);
пременопаузальный период («-2 стадия» по STRAW 10);
размеры доминантного миоматозного узла (эхографически определяемый диаметр) 4,0–5,5 см;
отсутствие в анамнезе полостных, в т. ч. выполненных лапароскопическим доступом, гинекологических операций;
отсутствие в анамнезе применения гормональной терапии ММ;
категорический отказ от хирургического лечения;
отсутствие противопоказаний к назначению мифепристона;
желание пациентки участвовать в исследовании и наличие информированного письменного согласия.
Критерии исключения из исследования:
возраст пациентки моложе 40 лет и старше 48 лет в момент включения в исследование;размеры доминантного миоматозного узла менее 4,0 см и более 5,5 см;
анемия тяжелой степени в момент включения в исследование (уровень гемоглобина менее 70 г/л);
применение гормональной терапии ММ в анамнезе;
сахарный диабет и другие нарушения углеводного обмена, некомпенсированное нарушение функции щитовидной железы и других желез внутренней секреции (гипофиз, надпочечники, паращитовидные железы), в т. ч. требующее назначения заместительной гормональной терапии;
психиатрические заболевания, алгоколизм, наркомания, злокачественные новообразования, лимфопролиферативные заболевания и гемобластозы в анамнезе;
индекс массы тела по Броку более 34,9 кг/м2 и менее 18,5кг/м2;
ВИЧ-инфекция, хронические вирусные гепатиты В
и/или C в анамнезе;
нежелание пациентки участвовать в исследовании или низкая комплаентность.
Этические правила и нормы
Исследование выполнено в соответствии с принципами Хельсинкской декларации Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека», законодательством Российской Федерации (Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств») и Правилами клинической практики в Российской Федерации, утвержденными приказом Минздрава России от 19.06.2003 № 266, и другими нормативными актами, содержащими требования к проведению клинических исследований и наблюдательных программ в Российской Федерации. Протокол наблюдения за пациентками и программа обследования были одобрены локальным этическим комитетом.Обследование пациенток перед включением в исследование
Всем пациенткам, соответствующим критериям включения (по данным анамнеза и ультразвукового исследования (УЗИ) трансвагинальным датчиком), до начала лечения, с целью выявления критериев исключения, выполнялось обследование: скрининговые клинические и эпидемиологические анализы; гормональное обследование на 2–5-й день менструального цикла (определение уровней фолликулостимулирующего гормона, эстрадиола, тиреотропного гормона, пролактина); определение уровней гликированного гемоглобина, железа в сыворотке крови, ферритина, опухоль-ассоциированных серологических маркеров (альфа-фетопротеин, раково-эмбриональный агент); маммография; УЗИ щитовидной железы, органов брюшной полости, почек и надпочечников; пайпель-биопсия эндометрия с последующим патоморфологическим исследованием, за исключением случаев, когда имелись результаты гистологического исследования эндометрия давностью до 1 года.
Для участия в дальнейшем наблюдении было отобрано 46 женщин в возрасте от 44 до 48 лет (средний возраст — 45,9±1,9 года) в момент включения в исследование, с одиночной или множественной ММ (табл. 1).
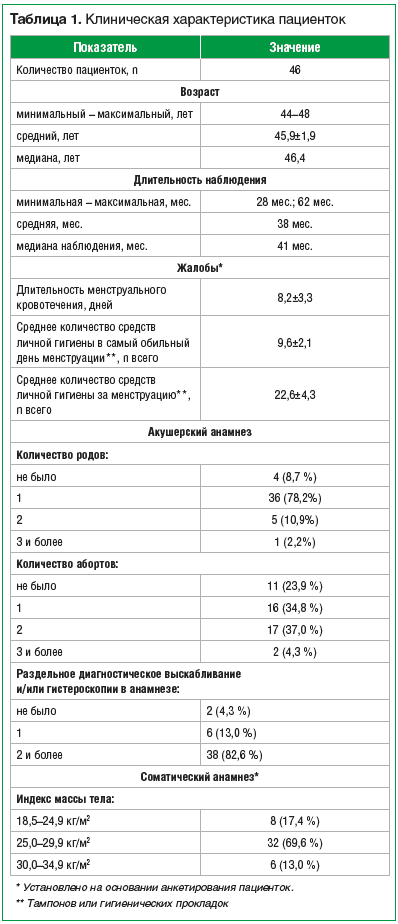
Режим приема мифепристона
Пациентки с ММ получали мифепристон по 50 мг через день (1 раз в 2 сут). Если пациентка по каким-либо причинам забывала принять таблетку, мифепристон принимался ежедневно до восстановления «календаря» приема препарата.Наблюдение за пациентками
Все включенные в исследование пациентки наблюдались 1 раз в 3 мес. в течение всего периода лекарственного лечения ММ и в течение года после прекращения приема мифепристона. Далее наблюдение за течением ММ осуществлялось 1 раз в 6 мес. до наступления менопаузы. В ходе наблюдения методом трансвагинального УЗИ оценивались линейные размеры матки (количество и объем визуализированных миоматозных узлов, наибольший диаметр каждого узла) (табл. 2). В период лекарственного лечения (через 3, 6, 9 и 12 мес. от начала) у всех пациенток проводился забор венозной крови для клинического анализа крови и анализа сывороточного железа, ферритина. После окончания лечения всем пациенткам выполнялась пайпель-биопсия эндометрия с последующим гистологическим исследованием.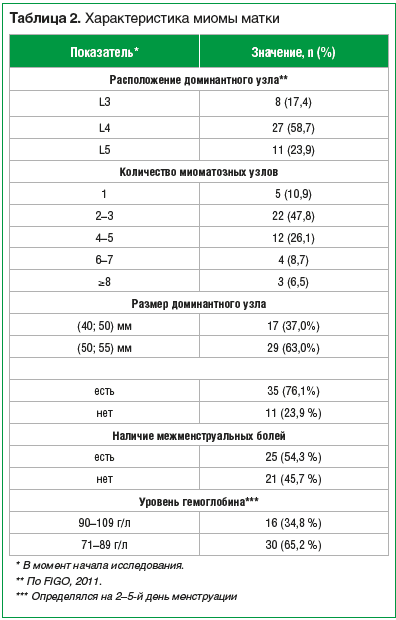
Статистический анализ результатов исследования
В проведенном клиническом исследовании не сравнивались разные режимы лечения, а оценивалась эффективность одного режима лекарственной терапии относительно исходных данных. При дальнейшем наблюдении (от окончания лечения до наступления менопаузы) никакие измеряемые показатели и статистические гипотезы предварительно не определялись. Описание количественных признаков, соответствующих нормальному распределению, представлено в виде среднего значения ± стандартное квадратичное отклонение; признаки, отличающиеся от нормального распределения — в виде медианы, качественные признаки — в виде долей (%) и абсолютных чисел. Метод определения достоверности сравниваемых признаков выбирался в зависимости от анализируемых данных. Результаты подвергали статистической обработке на персональном компьютере с помощью программ Excel, SPSS Statistics 22.0.Результаты исследования
Первичные результаты исследования
Все включенные в исследование пациентки завершили исследование согласно дизайну. Данные четырехкратного эхографического исследования органов малого таза, лабораторных и инструментальных исследований, динамика жалоб пациенток представлены в таблице 3.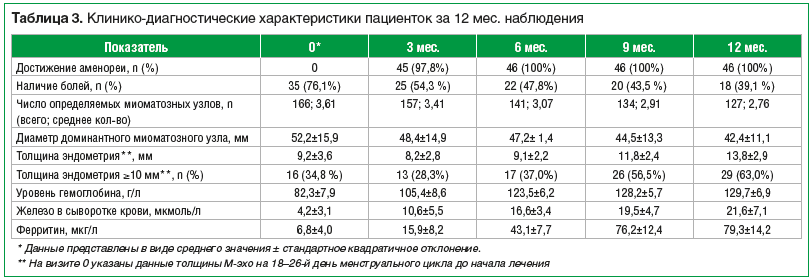
Несмотря на увеличение толщины М-эхо более 10 мм у 63,0% пациенток после 12 мес. лечения, по результатам патоморфологического исследования биоптата эндометрия во всех образцах данных за гиперпластические процессы или новообразования не получено.
Наблюдение за пациентками после окончания лекарственной терапии
После завершения лечения мифепристоном последующее наблюдение за пациентками проводилось до наступления менопаузы. Данные четырехкратного эхографического исследования представлены в таблице 4.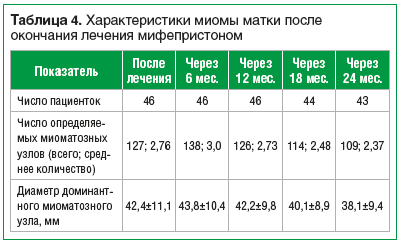
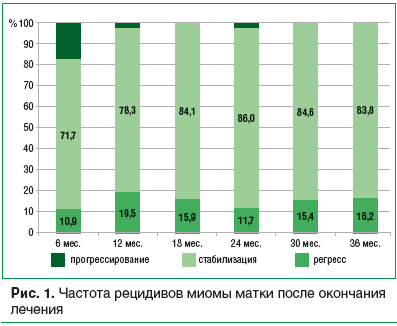
В целом за первые 36 мес. наблюдения суммарная частота рецидивов (увеличение одного или нескольких узлов на 20% и более) составила 21,7% (рис. 1). В 9 из 10 случаев прогрессирование в дальнейшем сменялось стабилизацией (6 случаев) и/или регрессией (3 случая), одной пациентке был назначен повторный 3-месячный курс мифепристона, после чего зарегистрирован частичный регресс ММ.
Обсуждение результатов
Высокий профиль безопасности и хорошая переносимость выгодно отличают мифепристон от агонистов гонадотропин-рилизинг-гормонов, поскольку он не влияет на минеральную плотность костной ткани и не вызывает других симптомов дефицита эстрогенов [3]. Возможные изменения эндометрия и яичников, связанные с действием мифепристона, носят транзиторный характер, не требуют дополнительных мер и самостоятельно разрешаются после завершения курса лечения [4]. В нашем исследовании после окончания лечения в течение 3-х лет последующий регресс ММ был зарегистрирован у 30,4% пациенток. В течение всего периода наблюдения ни одной из них не потребовалось хирургического лечения, лишь 1 (2,2%) женщине потребовался повторный 3-месячный курс мифепристона.Возможные негеномные эффекты и эпигенетическая регуляция экспрессии прогестерон-зависимых генов под влиянием мифепристона
Активация рецептора прогестерона (PR) в равной степени усиливает транскрипцию как ростовых (например, гена PCNA), так и проапоптотических факторов (bcl-2), что с учетом диаметрально противоположных клинических эффектов, возможно, предполагает наличие эпигенетических факторов, включая не только профили метилирования промоторных областей генов, но и посттранскрипционное (в основном, реализуемое через микроРНК-эффекты) и посттрансляционное (изменение на уровне третичной структуры протеинов, конъюгирование с небелковыми агентами и др.) регулирование [3]. Продемонстрировано, что клетки миометрия и миомы различаются по экспрессии некоторых микроРНК: miR-21 и miR-26а, участвующих в регуляции скорости роста клеток и активности каспаз [5].После связывания с лигандами или безлигандной активации через фосфорилирование ядерные PR, кроме соответствующих промоторных областей (PREs), также способны взаимодействовать с другими транскрипционными активаторами (SP1, AP1, FOXO1, p65 субъединицей NF-κB) и внутриклеточными киназами, например MAP-киназного пути. В злокачественно трансформированных клетках был обнаружен негеномный путь действия ядерных PR, активирующий сигнальные каскады EGFR/c-Src/Ras/Erk и PI3K/Akt [6]. Данное внутриклеточное взаимодействие позволяет активировать транскрипционные процессы в генах, не имеющих PRE-промоторов. В настоящее время определены специфические гены, экспрессия которых, в зависимости от набора тканеспецифичных клеточных факторов и/или типа лиганда ядерных PR, может быть активирована или, наоборот, подавлена: гены циклина D1, матриксных металлопротеаз
1, 2, 7, 9, Ets-1, FOXO 1, гликоделина, р21 и р27, а также другие гены, связанные с клеточной адгезией, пролиферативной активностью и особенностями иммунного ответа [7]. Реализуемые через PR негеномные эффекты подтверждаются данными Kovacs K.A. et al., которые выявили повышенные уровни фосфорилирования FOXO1 по Ser256 в клетках миомы, достоверно более высокие, чем в остальном миометрии [8]. По данным Yamagata Y. et al., клетки ММ отличаются по уровням экспрессии ДНК метилтрансфераз (1-го и 3-го типов), которые, в свою очередь, катализируют метилирование нуклеотидных остатков в составе ДНК, т. е. осуществляют эпигенетическое регулирование экспрессии генов [9].
Отсроченные эффекты пролонгированного режима лечения мифепристоном
С осознанием иерархии клеточных популяций макроорганизма предполагается, что изменение профиля экспрессии генов и/или особенности их эпигенетической регуляции способны создавать «прениши» для полипотентных эндометриальных клеток, повышенная миграционная способность которых, в т. ч. обусловленная изменением не только в самих клеточных элементах, но и за счет определенных свойств внеклеточного матрикса и/или особенностями иммунного ответа, может приводить к их транслокации в «пренишу» и формированию пролиферирующего клона лейомиоцитов [10]. Мифепристон, взаимодействуя с PR, способствует их связыванию с набором корепрессоров, тем самым антагонизируя действие прогестерона, что в итоге блокирует транскрипцию прогестерон-зависимых генов и потенциально приводит к изменению уровней экспрессии определенного числа генов и эпигенетических факторов, например микроРНК [11]. При длительном действии SPRM происходит постгеномная модификация участков ДНК, содержащих прогестерон-зависимые гены: метилирование ДНК и деацетилирование гистонов [10]. Подавление экспрессии прогестерон-зависимых генов приводит к ремоделированию внеклеточного матрикса за счет изменения качественного и количественного состава его белков.Не стоит игнорировать присущие только мифепристону и достигаемые посредством антагонистической активности в отношении глюкокортикоидных рецепторов вероятные иммуномодулирующие эффекты. Мифепристон блокирует вызванное введением интерлейкина (ИЛ)-1β повышение синтеза провоспалительных цитокинов (фактора некроза опухоли α, ИЛ-6) и усиление экспрессии концентраций интегрина MAC-1 (CD11b), нейротрофина p75, каждый из которых способствует пролиферации, дифференцировке и выживанию клеток [12].
Пролонгированный режим приема Гинестрила при лечении миомы матки отличается высоким профилем безопасности и может служить альтернативой хирургическому лечению у определенного контингента пациенток.












