–Я—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —П–Є—З–љ–Є–Ї–Њ–≤ (–Я–Э–ѓ) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б, –≤–Ї–ї—О—З–∞—О—Й–Є–є –≤—В–Њ—А–Є—З–љ—Г—О –∞–Љ–µ–љ–Њ—А–µ—О, –±–µ—Б–њ–ї–Њ–і–Є–µ, –≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ–Њ–≤, –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Г –ґ–µ–љ—Й–Є–љ –і–Њ 40 –ї–µ—В [1]. –Я—А–Є —Н—В–Њ–Љ –і–Њ —А–∞–Ј–≤–Є—В–Є—П –Я–Э–ѓ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –±—Л–ї–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ—Л –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–∞—П –Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–∞—П —Д—Г–љ–Ї—Ж–Є–Є. –І–∞—Б—В–Њ—В–∞ –Я–Э–ѓ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,5%, –∞ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –≤—В–Њ—А–Є—З–љ–Њ–є –∞–Љ–µ–љ–Њ—А–µ–Є вАФ –і–Њ 10% [2вАУ4]. –°—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і —В–µ–Њ—А–Є–є, –Њ–±—К—П—Б–љ—П—О—Й–Є—Е –њ—А–Є—З–Є–љ—Л –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —П–Є—З–љ–Є–Ї–Њ–≤: –њ—А–µ- –Є –њ–Њ—Б—В–њ—Г–±–µ—А—В–∞—В–љ–∞—П –і–µ—Б—В—А—Г–Ї—Ж–Є—П –Њ–Њ—Ж–Є—В–Њ–≤, —Е—А–Њ–Љ–Њ—Б–Њ–Љ–љ—Л–µ –∞–љ–Њ–Љ–∞–ї–Є–Є, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Є –і—А. –Ґ–Њ—З–љ–∞—П –њ—А–Є—А–Њ–і–∞ –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є —П–Є—З–љ–Є–Ї–Њ–≤ –љ–µ—П—Б–љ–∞ [5].
–Я–Э–ѓ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —А—П–і–Њ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤: –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –і–µ—Д–µ–Ї—В–∞–Љ–Є, –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М—О (—Д–µ—А–Љ–µ–љ—В–Њ–њ–∞—В–Є—П–Љ–Є), —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є (–≤ —В. —З. –њ—А–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е), –ї—Г—З–µ–≤—Л–Љ–Є, —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П–Љ–Є, –њ—А–Є–µ–Љ–Њ–Љ –∞–љ—В–Є–Љ–Є—В–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є, –і–µ–є—Б—В–≤–Є–µ–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –∞–≥–µ–љ—В–Њ–≤ –њ—А–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е, –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–љ–µ—И–љ–µ–є —Б—А–µ–і—Л, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б—В—А—Г–Ї—В—Г—А—Л –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ–Њ–≤ –Є/–Є–ї–Є –Є—Е –і–µ–є—Б—В–≤–Є—П [6вАУ8]. –•—А–Њ–љ–Є—З–µ—Б–Ї–Є–є —Б–∞–ї—М–њ–Є–љ–≥–Њ–Њ—Д–Њ—А–Є—В (–•–°–Ю) —П–≤–ї—П–µ—В—Б—П –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–µ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 65вАУ68% –≤—Б–µ—Е –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [9]. –Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–∞—Е —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є –∞–Ї—В–Є–≤–Є—А—Г—О—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –∞—Д—Д–µ—А–µ–љ—В–∞—Ж–Є—О —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е –Њ—В–і–µ–ї–Њ–≤ –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ-–≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ-—П–Є—З–љ–Є–Ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Н—В–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б–љ–Є–ґ–µ–љ–Є–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —П–Є—З–љ–Є–Ї–Њ–≤, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–µ—А–µ–і–Ї–Њ –љ–∞—А—Г—И–∞–µ—В—Б—П –њ—А–Њ—Ж–µ—Б—Б –Њ–≤—Г–ї—П—Ж–Є–Є, —Б–љ–Є–ґ–∞–µ—В—Б—П –њ—А–Њ–і—Г–Ї—Ж–Є—П —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞, –∞ —Н–њ–Є–Ј–Њ–і—Л –Њ–±–Њ—Б—В—А–µ–љ–Є—П –•–°–Ю —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –љ–∞—А—Г—И–µ–љ–Є—О –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —П–Є—З–љ–Є–Ї–µ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є —Н—В–Є –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ—П–≤–ї—П—О—В—Б—П —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Я–Э–ѓ [10] (–љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, –±–µ—Б–њ–ї–Њ–і–Є–µ–Љ, –≤—Л—Б–Њ–Ї–Є–Љ–Є —Г—А–Њ–≤–љ—П–Љ–Є —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ (–§–°–У) –Є –ї—О—В–µ–Є–љ–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ (–Ы–У), –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Н—Б—В—А–∞–і–Є–Њ–ї–∞, —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –і–µ—Д–Є—Ж–Є—В–∞ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤: –њ—А–Є–ї–Є–≤–∞–Љ–Є –ґ–∞—А–∞, –њ–Њ—В–ї–Є–≤–Њ—Б—В—М—О, –±–µ—Б—Б–Њ–љ–љ–Є—Ж–µ–є, —А–∞–Ј–і—А–∞–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ–∞–Љ—П—В–Є, —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є, –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є—В—М—Б—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є—П, –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є –ї–Є–њ–Є–і–Њ–≤ –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Ы–Я–Т–Я).
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –њ–Њ–ї–Є–њ–µ–њ—В–Є–і–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Є–Ј —Н–њ–Є—Д–Є–Ј–∞ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ (polypeptides of pineal gland вАФ PPG), –Є –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –ґ–µ–љ—Й–Є–љ —Б –љ–µ–є—А–Њ–≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є –љ–∞ —Д–Њ–љ–µ –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ–≤–∞—А–Є–∞–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –•–°–Ю.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Я–Њ–і –љ–∞—И–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М 45 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ 2 –≥—А—Г–њ–њ—Л. –У—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є 25 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –ї–µ—З–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –≤–Ї–ї—О—З–∞–ї–Њ –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Г—О –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О (–Ь–У–Ґ) –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –§–µ–Љ–Њ—Б—В–Њ–љ¬Ѓ 2 (–і–Є–і—А–Њ–≥–µ—Б—В–µ—А–Њ–љ + —Н—Б—В—А–∞–і–Є–Њ–ї) –њ–Њ 1 —В–∞–±–ї–µ—В–Ї–µ –≤ –і–µ–љ—М –≤ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Ю—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 20 –ґ–µ–љ—Й–Є–љ, –Ї–Њ—В–Њ—А—Л–Љ, –њ–Њ–Љ–Є–Љ–Њ –Ь–У–Ґ, —Б 16вАУ17-–≥–Њ –і–љ—П –њ–µ—А–≤–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –њ—А–Є–µ–Љ–∞ –§–µ–Љ–Њ—Б—В–Њ–љ–∞ 2 –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –≤–≤–Њ–і–Є–ї–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –њ–Њ–ї–Є–њ–µ–њ—В–Є–і–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Є–Ј —Н–њ–Є—Д–Є–Ј–∞ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ (–Я–Є–љ–µ–∞–Љ–Є–љ¬Ѓ). –°–Њ–і–µ—А–ґ–Є–Љ–Њ–µ —Д–ї–∞–Ї–Њ–љ–∞ –њ–µ—А–µ–і –Є–љ—К–µ–Ї—Ж–Є–µ–є —А–∞—Б—В–≤–Њ—А—П–ї–Є –≤ 1вАУ2 –Љ–ї 0,9% —А–∞—Б—В–≤–Њ—А–∞ –љ–∞—В—А–Є—П —Е–ї–Њ—А–Є–і–∞ –Є –≤–≤–Њ–і–Є–ї–Є –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ –і–Њ–Ј–µ 10 –Љ–≥ –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є —Г—А–Њ–≤–љ—П –§–°–У –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –Ї—Г—А—Б –њ–Њ–≤—В–Њ—А—П–ї–Є —З–µ—А–µ–Ј 3 –Љ–µ—Б. –Т—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –Я–Є–љ–µ–∞–Љ–Є–љ¬Ѓ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —В–µ–Љ, —З—В–Њ –Њ–љ —Б–њ–Њ—Б–Њ–±–µ–љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М –њ–Є–љ–µ–∞–ї–Њ—Ж–Є—В–Њ–≤ —Н–њ–Є—Д–Є–Ј–∞, —В–µ–Љ —Б–∞–Љ—Л–Љ —Г–≤–µ–ї–Є—З–Є–≤–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—О —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Љ–µ–ї–∞—В–Њ–љ–Є–љ–∞. –≠–љ–і–Њ–≥–µ–љ–љ—Л–є –Љ–µ–ї–∞—В–Њ–љ–Є–љ –Є–≥—А–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞ –Є–Љ–µ–љ–љ–Њ –≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–µ –љ–µ–є—А–Њ–љ–Њ–≤, —Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–Є—Е –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ-–Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–є –≥–Њ—А–Љ–Њ–љ (GnIH), –Є —В–Њ—А–Љ–Њ–Ј—П—Й–µ–Љ –і–µ–є—Б—В–≤–Є–Є GnIH –љ–∞ —Б–Є–љ—В–µ–Ј –Ї–Є—Б—Б–њ–µ–њ—В–Є–љ–∞ (KISS) –≤ –Њ–і–љ–Њ–Є–Љ–µ–љ–љ—Л—Е –љ–µ–є—А–Њ–љ–∞—Е, –≤—Е–Њ–і—П—Й–Є—Е –≤ –≥—А—Г–њ–њ—Г KNDy-–љ–µ–є—А–Њ–љ–Њ–≤ –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–∞ [2].
–Т —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ–њ–Є—Б–∞–љ –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Я–Є–љ–µ–∞–Љ–Є–љ¬Ѓ —Г –ґ–µ–љ—Й–Є–љ –≤ –Љ–µ–љ–Њ–њ–∞—Г–Ј–µ [2, 3]. –Ш –њ—А–Є–љ–Є–Љ–∞—П –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –Я–Э–ѓ —Б—Е–Њ–ґ–∞ —Б —А–∞–љ–љ–µ–є –Љ–µ–љ–Њ–њ–∞—Г–Ј–Њ–є, –∞ –љ–∞–ї–Є—З–Є–µ –•–°–Ю —Г—Б—Г–≥—Г–±–ї—П–µ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –њ–µ—А–µ–і–∞—З—Г –љ–µ—А–≤–љ—Л—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤ –Њ—В –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Ї —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ, —Г—Б–Є–ї–Є–≤–∞—П –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –љ–µ–є—А–Њ–≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, –Љ—Л –њ—А–Є–Љ–µ–љ–Є–ї–Є –µ–≥–Њ —Г –ґ–µ–љ—Й–Є–љ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ:
–±–µ—Б–њ–ї–Њ–і–Є–µ I –Є–ї–Є II —Б—В–µ–њ–µ–љ–Є; –њ–µ—А–≤–Є—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —П–Є—З–љ–Є–Ї–Њ–≤; –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –≤ –≤–Є–і–µ –≤—В–Њ—А–Є—З–љ–Њ–є –∞–Љ–µ–љ–Њ—А–µ–Є;
–љ–∞–ї–Є—З–Є–µ –≤–µ–≥–µ—В–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є;
–•–°–Ю –≤ —Б—В–∞–і–Є–Є —А–µ–Љ–Є—Б—Б–Є–Є —Б –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –Љ–∞—В–Њ—З–љ—Л—Е —В—А—Г–±, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є –і–∞–љ–љ—Л–Љ–Є –Ь–°–У/–≥–Є—Б—В–µ—А–Њ—Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є –Є/–Є–ї–Є –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є–Є —Б —Е—А–Њ–Љ–Њ—Б–∞–ї—М–њ–Є–љ–≥–Њ—Б–Ї–Њ–њ–Є–µ–є;
–љ–Њ—А–Љ–∞–ї—М–љ—Л–є –Ї–∞—А–Є–Њ—В–Є–њ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї;
–Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–Т—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –≤–µ–≥–µ—В–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (–њ—А–Є–ї–Є–≤—Л, –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є, –Ї–Њ–ї–µ–±–∞–љ–Є—П –Р–Ф, –њ–µ—А–µ–њ–∞–і—Л –љ–∞—Б—В—А–Њ–µ–љ–Є—П, —А–∞–Ј–і—А–∞–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М, —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є–µ –≤ –њ–Њ–Ї–Њ–µ –Є —В. –і.) –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–Љ—Г –Є–љ–і–µ–Ї—Б—Г –Ъ—Г–њ–њ–µ—А–Љ–∞–љ–∞ (–Ь–Ш–Ъ). –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –ґ–µ–љ—Й–Є–љ –Є–Ј—Г—З–∞–ї–Є –њ–Њ –і–∞–љ–љ—Л–Љ –∞–љ–∞–ї–Є–Ј–∞ —Н–ї–µ–Ї—В—А–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–≥—А–∞–Љ–Љ—Л (–≠–≠–У) —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ-–∞–њ–њ–∞—А–∞—В–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ ¬Ђ–Э–µ–є—А–Њ–љ-—Б–њ–µ–Ї—В—А¬ї (¬Ђ–Э–µ–є—А–Њ—Б–Њ—Д—В¬ї, –†–Њ—Б—Б–Є—П) —Б –Њ—Ж–µ–љ–Ї–Њ–є —З–∞—Б—В–Њ—В–љ–Њ-–∞–Љ–њ–ї–Є—В—Г–і–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—Б–љ–Њ–≤–љ—Л—Е —А–Є—В–Љ–Њ–≤ –≠–≠–У (–∞–ї—М—Д–∞-, –±–µ—В–∞-, —В–µ—В–∞- –Є –і–µ–ї—М—В–∞-—А–Є—В–Љ–∞) –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є —Б–њ–Њ–Ї–Њ–є–љ–Њ–≥–Њ, —А–∞—Б—Б–ї–∞–±–ї–µ–љ–љ–Њ–≥–Њ –±–Њ–і—А—Б—В–≤–Њ–≤–∞–љ–Є—П. –Ю–њ—А–µ–і–µ–ї—П–ї–Є —Г—А–Њ–≤–љ–Є –§–°–У –Є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Њ–±—К–µ–Љ–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –Є –Њ–±–µ–і–љ–µ–љ–љ–Њ—Б—В–Є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –≤—Л–њ–Њ–ї–љ—П–ї–Є –£–Ч–Ш –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ –љ–∞ –∞–њ–њ–∞—А–∞—В–µ GE LOGIQ E9 (General Electrik, –°–®–Р) (–і–∞—В—З–Є–Ї –≤–∞–≥–Є–љ–∞–ї—М–љ—Л–є: IвАУC5вАУ9d, —З–∞—Б—В–Њ—В–∞ 3,6вАУ9,0 –Ь–≥—А; –і–∞—В—З–Є–Ї –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–є: –°1вАУ6D, —З–∞—Б—В–Њ—В–∞ 1,7вАУ6,0 –Ь–≥—А).
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ—Л —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є 27 –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ-–і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (–≤ –њ–µ—А–≤—Г—О —Д–∞–Ј—Г –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞) –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П. –Ю–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –Є —З–µ—А–µ–Ј 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П.
–Т —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ–µ—В–Њ–і—Л –≤–∞—А–Є–∞—Ж–Є–Њ–љ–љ–Њ–є —Б—В–∞—В–Є—Б—В–Є–Ї–Є, –њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –†–∞–Ј–ї–Є—З–Є—П —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П ¬ЂEXCEL 2010¬ї –њ—А–Є –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є 95% (—А<0,05).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т—Б–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г: 35¬±1,8 –≥–Њ–і–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Є 36¬±1,3 –≥–Њ–і–∞ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 35,5¬±1,6 –≥–Њ–і–∞). –Т—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –≤–µ–≥–µ—В–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–∞—П –њ–Њ –Ь–Ш–Ъ, –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ –±–Њ–ї–µ–µ 40 –±–∞–ї–ї–Њ–≤. –Э–∞ –≠–≠–У –≤ 95% —Б–ї—Г—З–∞–µ–≤ –Њ—В–Љ–µ—З–∞–ї—Б—П –≤—Л—Б–Њ–Ї–Њ–∞–Љ–њ–ї–Є—В—Г–і–љ—Л–є –≥–Є–њ–µ—А—Б–Є–љ—Е—А–Њ–љ–љ—Л–є –∞–ї—М—Д–∞-—А–Є—В–Љ —Б –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –±–µ—В–∞-—А–Є—В–Љ–∞ –і–Њ—Б—В–Є–≥–∞–ї–Є –≤—Л—Б–Њ–Ї–Є—Е —Ж–Є—Д—А –Є –≤ 1,78 —А–∞–Ј–∞ –њ—А–µ–≤—Л—И–∞–ї–Є –Ј–љ–∞—З–µ–љ–Є—П —Г –Ј–і–Њ—А–Њ–≤—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (—А<0,05). –Т –њ–µ—А–µ–і–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤—Л—П–≤–ї—П–ї–Њ—Б—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ —В–µ—В–∞-—А–Є—В–Љ–∞. –°—А–µ–і–љ–Є–µ –∞–Љ–њ–ї–Є—В—Г–і–∞ –Є —З–∞—Б—В–Њ—В–∞ —В–µ—В–∞-–Ї–Њ–ї–µ–±–∞–љ–Є–є –±—Л–ї–Є –≤ 1,7 —А–∞–Ј–∞ –≤—Л—И–µ, —З–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —А–µ–∞–Ї—Ж–Є–Є –љ–∞ –Њ—В–Ї—А—Л–≤–∞–љ–Є–µ –≥–ї–∞–Ј —Г–Љ–µ–љ—М—И–µ–љ–Є—П –∞–Љ–њ–ї–Є—В—Г–і—Л –Є —З–∞—Б—В–Њ—В—Л –∞–ї—М—Д–∞-—А–Є—В–Љ–∞ –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –≤ 92,5% —Б–ї—Г—З–∞–µ–≤. –≠—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Њ –Њ –љ–∞—А—Г—И–µ–љ–Є–Є —А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Ї–Њ—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –њ–Њ–і–Ї–Њ—А–Ї–Њ–≤—Л—Е —Ж–µ–љ—В—А–Њ–≤ (—В–∞–±–ї. 1).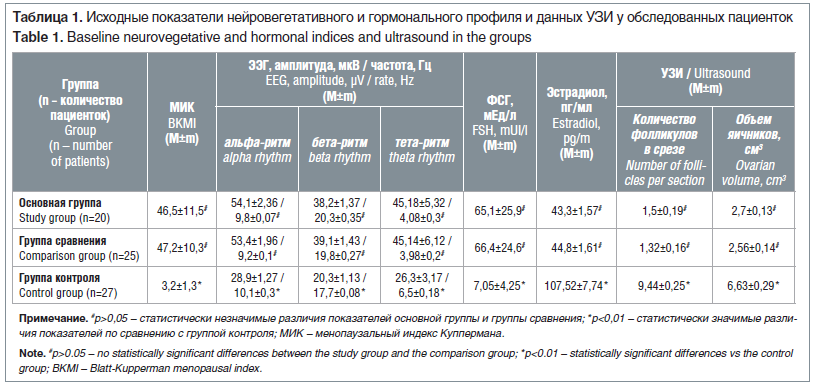
–Ш–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ —В–∞–±–ї–Є—Ж–µ –і–∞–љ–љ—Л—Е –≤–Є–і–љ–Њ, —З—В–Њ –Ј–љ–∞—З–µ–љ–Є—П –§–°–У –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Є –≤—Л—Б–Њ–Ї–Є–Љ–Є –Є –≤ 9 —А–∞–Ј –њ—А–µ–≤—Л—И–∞–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л, –∞ —Г—А–Њ–≤–љ–Є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –±—Л–ї–Є –≤ 1,7 —А–∞–Ј–∞ –љ–Є–ґ–µ, —З–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (—А<0,05). –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Д–Њ–љ–∞, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –Я–Э–ѓ, –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї–Є—Б—М –Є –і–∞–љ–љ—Л–Љ–Є –£–Ч–Ш, –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –µ–і–Є–љ–Є—З–љ—Л–µ —Д–Њ–ї–ї–Є–Ї—Г–ї—Л (–њ—А–Є–Љ–µ—А–љ–Њ –≤ 6 —А–∞–Ј –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П), –Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –≤ 2,5 —А–∞–Ј–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ј–і–Њ—А–Њ–≤—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е (—А<0,05).
–Я–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Њ—В–Љ–µ—З–∞–ї–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Є–ї–Є–≤–Њ–≤, –≥–Њ–ї–Њ–≤–љ—Л—Е –±–Њ–ї–µ–є, –Ї–Њ–ї–µ–±–∞–љ–Є–є –Р–Ф, —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є–є –≤ –њ–Њ–Ї–Њ–µ, –∞ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –і–∞–љ–љ–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М —Г 6 (24%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –°–Њ—Е—А–∞–љ—П—О—Й–Є–µ—Б—П –њ–µ—А–µ–њ–∞–і—Л –љ–∞—Б—В—А–Њ–µ–љ–Є—П –Є —А–∞–Ј–і—А–∞–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ—В–Љ–µ—З–∞–ї–Є 2 (10%) –њ–∞—Ж–Є–µ–љ—В–Ї–Є, —З—В–Њ –≤ 3,2 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАФ 8 (32%) (—А<0,05). –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ь–У–Ґ –Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –њ–Њ–ї–Є–њ–µ–њ—В–Є–і–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Є–Ј —Н–њ–Є—Д–Є–Ј–∞ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Ш–Ъ —Г –≤—Б–µ—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е (p<0,05), –љ–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Ь–Ш–Ъ –Њ–Ї–∞–Ј–∞–ї—Б—П –≤ 2,2 —А–∞–Ј–∞ –љ–Є–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—В–∞–±–ї. 2).
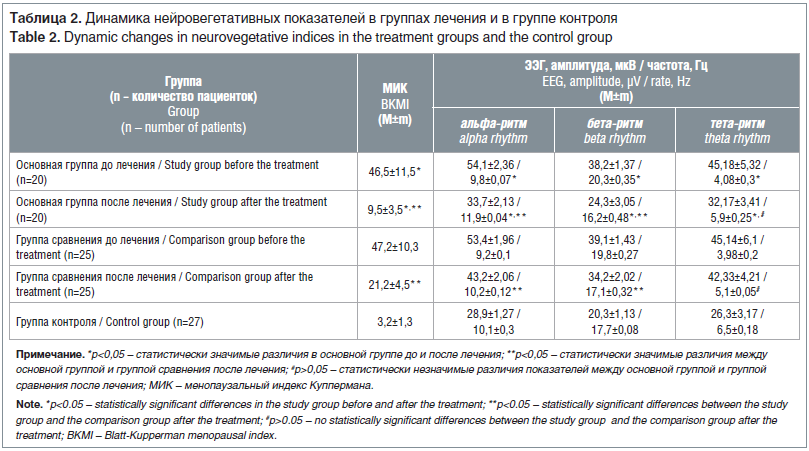
–І–µ—А–µ–Ј 6 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –±–Є–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Г 93% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –Р–Љ–њ–ї–Є—В—Г–і–∞ –∞–ї—М—Д–∞-–≤–Њ–ї–љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –≤ 1,6 —А–∞–Ј–∞, –∞ —З–∞—Б—В–Њ—В–∞ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –≤ 1,3 —А–∞–Ј–∞ (—А<0,05), —З—В–Њ –±—Л–ї–Њ –≤ 1,3 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П, –Є –њ—А–Є–±–ї–Є–ґ–∞–ї–Њ—Б—М –Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ (—А<0,05). –Я—А–Њ–Є–Ј–Њ—И–ї–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –±–µ—В–∞-—А–Є—В–Љ–∞ –Є –≤—Л—А–∞–≤–љ–Є–≤–∞–љ–Є–µ –∞–Љ–њ–ї–Є—В—Г–і—Л —В–µ—В–∞-–Ї–Њ–ї–µ–±–∞–љ–Є–є (—А<0,05), –њ—А–Є—З–µ–Љ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –Њ—В–ї–Є—З–Є–є (p>0,05) –±—Л–ї–Є –≤ 1,3 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —А–µ–∞–Ї—Ж–Є–Є –љ–∞ –Њ—В–Ї—А—Л–≤–∞–љ–Є–µ-–Ј–∞–Ї—А—Л–≤–∞–љ–Є–µ –≥–ї–∞–Ј —Г 69,8% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П —Г–Љ–µ–љ—М—И–∞–ї–Є—Б—М –∞–Љ–њ–ї–Є—В—Г–і–∞ –Є —З–∞—Б—В–Њ—В–∞ –∞–ї—М—Д–∞-—А–Є—В–Љ–∞, —З—В–Њ –љ–∞ 15,4% –Љ–µ–љ—М—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л вАФ 85,2% (—А<0,05). –Т—Л—П–≤–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –±–Є–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Г–Ї–∞–Ј—Л–≤–∞–ї–Є –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Є –њ–Њ–і–Ї–Њ—А–Ї–Њ–≤—Л—Е —Б—В—А—Г–Ї—В—Г—А –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞.
–Ю—Ж–µ–љ–Ї–∞ —Г—А–Њ–≤–љ–µ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Я–Э–ѓ –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –ї–µ—З–µ–љ–Є—П –≤—Л—П–≤–Є–ї–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –§–°–У –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –≤ 7,2 —А–∞–Ј–∞ –Є –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –≤ 5,6 —А–∞–Ј–∞, –њ—А–Є—З–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ—А–µ–≤—Л—И–∞–ї–Є –љ–Њ—А–Љ—Г –≤—Б–µ–≥–Њ –≤ 1,2 —А–∞–Ј–∞ –њ—А–Њ—В–Є–≤ 1,7 —А–∞–Ј–∞ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—А<0,05) (—В–∞–±–ї. 3).
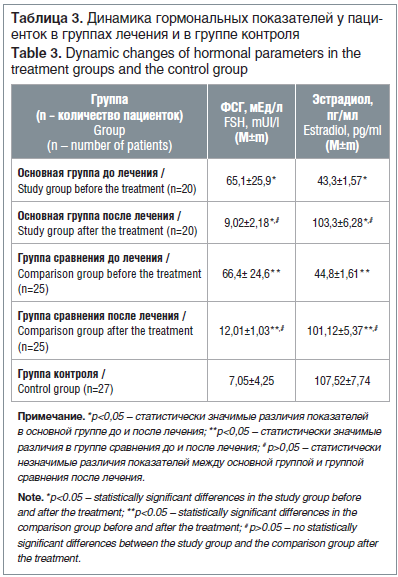
–Ф–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Г—А–Њ–≤–љ—П—Е –§–°–У –Є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, –Њ–і–љ–∞–Ї–Њ —Г—А–Њ–≤–љ–Є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е –њ–Њ–≤—Л—Б–Є–ї–Є—Б—М –≤ 2,3 —А–∞–Ј–∞ –Є –њ—А–Є–±–ї–Є–ґ–∞–ї–Є—Б—М –Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ (—А<0,05).
–Ф–∞–љ–љ—Л–µ –£–Ч–Ш –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ —З–µ—А–µ–Ј 6 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –≤—Л—П–≤–Є–ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ—А–Є–Љ–Њ—А–і–Є–∞–ї—М–љ—Л—Е —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≤ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –≤ 4,9 —А–∞–Ј–∞, –∞ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –≤ 2,6 —А–∞–Ј–∞, –њ—А–Є—З–µ–Љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ 2,1 —А–∞–Ј–∞ –њ—А–µ–≤—Л—И–∞–ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Є –њ—А–Є–±–ї–Є–ґ–∞–ї—Б—П –Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ (—А<0,05) (—В–∞–±–ї. 4).
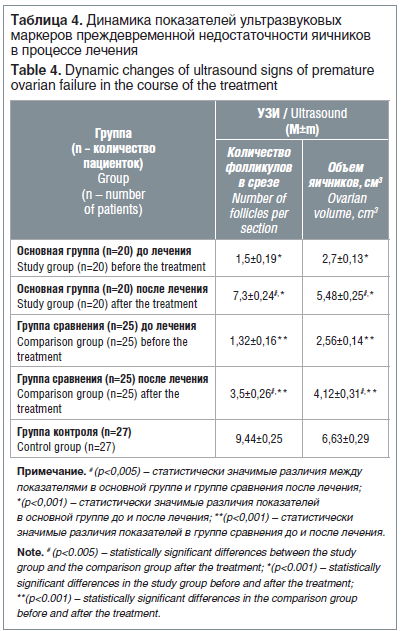
–Ю–±—К–µ–Љ —П–Є—З–љ–Є–Ї–Њ–≤–Њ–є —В–Ї–∞–љ–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е, –Њ–і–љ–∞–Ї–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ–љ –±—Л–ї –≤ 1,3 —А–∞–Ј–∞ –±–Њ–ї—М—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –Є –≤—Б–µ–≥–Њ –ї–Є—И—М –≤ 1,2 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ, –њ—А–Њ—В–Є–≤ 1,6 –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—А<0,05). –Ю—Ж–µ–љ–Ї–∞ –Њ–±—К–µ–Љ–∞ –Є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–∞, —З—В–Њ –љ–∞ —Д–Њ–љ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Я–Э–ѓ –Є –•–°–Ю –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ —П–Є—З–љ–Є–Ї–Њ–≤ –Є –њ–Њ—П–≤–ї—П–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≤, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –Ї–∞–Ї –і–ї—П —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞, —В–∞–Ї –Є –і–ї—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Б —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —П–є—Ж–µ–Ї–ї–µ—В–Ї–∞–Љ–Є –≤ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞—Е –≠–Ъ–Ю.
–Ю—В–і–∞–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л, –Є –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї—Б—П –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ—Л–є —Ж–Є–Ї–ї, –љ–Њ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–∞—Е –≠–Ъ–Ю –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї—Б—П –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В (–Є–Ј 10 –≤—Б—В—Г–њ–Є–≤—И–Є—Е –≤ –≠–Ъ–Ю –њ–µ—А–µ–љ–Њ—Б —Н–Љ–±—А–Є–Њ–љ–Њ–≤, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј —Б–≤–Њ–Є—Е —П–є—Ж–µ–Ї–ї–µ—В–Њ–Ї, –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ —В–Њ–ї—М–Ї–Њ —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї). –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –ґ–µ –≥—А—Г–њ–њ–µ —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –љ–∞—Б—В—Г–њ–Є–ї–Є —Б–њ–Њ–љ—В–∞–љ–љ—Л–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞–Ї–Њ–љ—З–Є–ї–Є—Б—М —А–Њ–і–∞–Љ–Є –≤ —Б—А–Њ–Ї, –∞ –Є–Ј 7 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –≤—Б—В—Г–њ–Є–≤—И–Є—Е –≤ –њ—А–Њ—В–Њ–Ї–Њ–ї –≠–Ъ–Ю, —Г 6 –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –љ–∞—Б—В—Г–њ–Є–ї–∞ —Б —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —П–є—Ж–µ–Ї–ї–µ—В–Ї–∞–Љ–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ь–У–Ґ (–§–µ–Љ–Њ—Б—В–Њ–љ¬Ѓ 2) –Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ PPG (–Я–Є–љ–µ–∞–Љ–Є–љ¬Ѓ) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Я–Э–ѓ –Є –•–°–Ю –њ—А–Є–≤–µ–ї–Њ –Ї –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г –≤ –≤–Є–і–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Ш–Ъ –≤ 4,9 —А–∞–Ј–∞. –Э–∞ —Д–Њ–љ–µ —Г—Б—В—А–∞–љ–µ–љ–Є—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±–Є–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г 93% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –њ–µ—А–µ–і–∞—З–Є –љ–µ—А–≤–љ—Л—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤ –Њ—В –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Ї —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ, —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–Є—Е GnIH –љ–µ–є—А–Њ–љ–Њ–≤, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–µ, –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Љ–µ–ї–∞—В–Њ–љ–Є–љ–∞ –љ–∞ —Д–Њ–љ–µ –Ь–У–Ґ –њ—А–Є–≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ–µ–є –§–°–У —Б –њ—А–µ–≤—Л—И–µ–љ–Є–µ–Љ –љ–Њ—А–Љ—Л –≤—Б–µ–≥–Њ –≤ 1,2 —А–∞–Ј–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ–µ–є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤ 2,3 —А–∞–Ј–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ. –Т—Л—А–∞–≤–љ–Є–≤–∞–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Д–Њ–љ–∞ –Њ–Ї–∞–Ј–∞–ї–Њ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≥–µ–љ–µ–Ј –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –µ–≥–Њ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є, —З—В–Њ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–Њ—Б—М —Г—Б–Є–ї–µ–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–∞ —А–µ–Ї—А—Г—В–Є–љ–≥–∞ –њ—А–Є–Љ–Њ—А–і–Є–∞–ї—М–љ—Л—Е —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≤ –≤ 4,9 —А–∞–Ј–∞. –≠—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—О –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Ї–∞–Ї —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є, —В–∞–Ї –Є –≤ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞—Е –≠–Ъ–Ю. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –§–µ–Љ–Њ—Б—В–Њ–љ¬Ѓ 2 –Є –Я–Є–љ–µ–∞–Љ–Є–љ¬Ѓ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —П–Є—З–љ–Є–Ї–Њ–≤ –љ–∞ —Д–Њ–љ–µ –•–°–Ю.–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
1–С—Г—А–Њ–≤–∞ –Э–∞—В–∞–ї—М—П –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є, –Ј–∞–≤–µ–і—Г—О—Й–∞—П —Г—З–µ–±–љ–Њ–є —З–∞—Б—В—М—О;
2–°–µ–ї–µ–Ј–љ–µ–≤–∞ –Ґ–∞—В—М—П–љ–∞ –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –≤—А–∞—З –∞–Ї—Г—И–µ—А-
–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥ –≤—Л—Б—И–µ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є, –≥–ї–∞–≤–љ—Л–є –≤—А–∞—З;
1,2–Р–±–Њ–ї–Њ–љ–Є–љ–∞ –Ю–Ї—Б–∞–љ–∞ –Т–Є–Ї—В–Њ—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –≤—А–∞—З –∞–Ї—Г—И–µ—А-–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥, —А–µ–њ—А–Њ–і—Г–Ї—В–Њ–ї–Њ–≥, –∞—Б—Б–Є—Б—В–µ–љ—В –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є.
1–§–У–С–Ю–£ –Т–Ю –Т–Њ–ї–≥–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 400131, –†–Њ—Б—Б–Є—П, –≥. –Т–Њ–ї–≥–Њ–≥—А–∞–і, –њ–ї. –Я–∞–≤—И–Є—Е –С–Њ—А—Ж–Њ–≤, –і. 1.
2–Ю–Ю–Ю ¬Ђ–Ы–Ф–Ъ ¬Ђ–Т–Є—В–∞–Э–Њ–≤–∞¬ї. 400137, –†–Њ—Б—Б–Є—П, –≥. –Т–Њ–ї–≥–Њ–≥—А–∞–і, –±—Г–ї—М–≤–∞—А 30-–ї–µ—В–Є—П –Я–Њ–±–µ–і—Л, –і. 32–±.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –С—Г—А–Њ–≤–∞ –Э–∞—В–∞–ї—М—П –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞, e-mail: natalia-burova@yandex.ru. –Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е. –Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 10.01.2019.
About the authors:
1Natalia A. Burova вАФ MD, PhD, Associate Professor of the Department of Obstetrics and Gynecology;
2Tatiana A. Selezneva вАФ MD, PhD, obstetrician-gynecologist Chief physician;
1,2Oksana V. Abolonina вАФ MD, PhD, obstetrician-gynecologist, reproductologist, Assistant of Obstetrics and Gynecology Department.
1Volgograd State Medical University. 1, Pavshikh Bortsov square, Volgograd, 400131, Russian Federation.
2LLC вАЬHealthcare Clinic вАЬVitaNovaвАЭ. 32B, Bul'var 30-letiya Pobedy, Volgograd, 400137, Russian Federation.
Contact information: Natalia A. Burova, e-mail: natalia-burova@yandex.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.01.2019.












