Наряду с традиционными представлениями о ведущей роли эстрогенов в патогенезе гормонозависимых заболеваний [1,3] в последние годы пересматривается отношение к прогестерону как стимулятору опухолевого роста [12]. Оба этих гормона принимают участие в патогенезе гиперпластической патологии матки, используя противоположные пути. Эстрогены стимулируют гиперплазию гладкомышечных клеток, прогестерон повышает митотическую активность клеток, инициирует продукцию факторов роста и их рецепторов, участвует в процессе дифференцировки гладкомышечных клеток [4,6]. Прогестероновым влиянием объясняется быстрый рост миом во время беременности [13].
В литературе последних лет большое значение в развитии гормонозависимых гиперпластических заболеваний матки придают роли тканевых рецепторов стероидных гормонов [15]. Синтез рецепторов в матке также имеет гормонозависимый характер и происходит под влиянием многих факторов: количества и соотношения половых гормонов и факторов роста, фазы менструального цикла, степени поражения патологическим процессом органа–мишени, нарушения обмена веществ и дисбаланса других гормонов [9,10,14].
Применяемая в настоящее время гормональная терапия имеет различную эффективность, вплоть до полной нечувствительности к лечению гормонами (это подтверждается и собственными наблюдениями авторов), что объясняется не только различным содержанием сывороточных половых гормонов, но и состоянием рецепторного аппарата матки. Отсутствие эффекта от проводимой консервативной терапии часто заканчивается гистерэктомией в репродуктивном возрасте со всеми последствиями развивающегося дефицита эстрогенов.
Для выяснения причин различия в чувствительности к лечению сочетанной с миомой патологии эндометрия нами проводилось изучение содержания рецепторов эстрадиола и прогестерона в ткани эндометрия и фиброматозных узлах и уровня половых гормонов в плазме крови.
Цель исследования. Обоснование выбора рациональной гормонотерапии у пациенток репродуктивного возраста и в перименопаузе на основании изучения содержания рецепторов эстрадиола и прогестерона в ткани эндометрия и фиброматозных узлов для выявления причин различия в чувствительности к гормонотерапии у пациенток с сочетанной гиперпластической патологией эндо– и миометрия.
Материал и методы исследования
Обследовано 164 больных репродуктивного возраста с сочетанными гиперпластическими процессами в эндо– и миометрии, находившихся на стационарном лечении и посещавших амбулаторный прием в женской консультации. Всем больным проведено иммуногистохимическое исследование гормональных рецепторов эндо– и миометрия и определение уровня яичниковых, гипофизарных и надпочечниковых гормонов в сыворотке крови. Возраст пациенток составил от 22 до 51 года (средний возраст – 39,5±1,2 лет). Жалобы носили весьма типичный для сочетанной патологии характер: гиперменструальный синдром, рецидивирующие метроррагии, болевой синдром. В анамнезе больных было от 1 до 22 беременностей; родов от 0 до 3; большая часть беременностей закончилась искусственным и самопроизвольным прерыванием. Среди сопутствующей генитальной патологии на первом месте были острые и хронические воспалительные заболевания половых органов (65%) и патология шейки матки у (40%). При оценке соматического статуса были выявлены заболевания печени (ЖКБ, холецистит, хронический вирусный гепатит), щитовидной железы (гипотиреоз), сердечно–сосудистой системы (артериальная гипертензия) и обмена веществ (ожирение, сахарный диабет).
Размеры миоматозной матки соответствовали 7–24–недельному сроку беременности. У 98 больных (60%) имели место небольшие интрамуральные и интерстицио–субсерозные узлы диаметром 1,5–5 см. 65 больных (40%) имели множественные опухоли больших размеров (12–24 недель).
В структуре гиперпластических процессов в эндометрии преобладала простая (железистая и железисто–кистозная) гиперплазия эндометрия, диагностированная у 82 пациенток (50%). Железистые и железисто–фиброзные полипы эндометрия выявлены у 23,3%. У 36,7% больных гиперпластические процессы имели характер рецидивирующих. У 12% (19 пациенток) наблюдалась атипическая гиперплазия эндометрия.
Исследовался материал, полученный во время оперативных вмешательств, а также соскобы эндометрия и эндоцервикса, полученные в результате диагностического выскабливания, произведенного на 10–14 день менструального цикла либо при поступлении в стационар по поводу маточного кровотечения. У 105 пациенток в ткани эндометрия и миометрия определяли содержание рецепторов половых гормонов иммуногистохимическим методом. Исследование проводилось в патологоанатомическом отделении 1–й городской клинической больницы г. Новосибирска.
Всем пациенткам проводилось определение содержания гипофизарных, яичниковых и надпочечниковых гормонов в сыворотке крови в позднюю фазу пролиферации менструального цикла радиоиммунологическим методом. По характеру гиперпластического процесса в эндометрии выделено три группы больных. В 1–ю группу вошли больные с миомами матки, сочетающимися с полипами эндометрия (42 человека). 2–ю группу составили 46 пациенток с железистой и железисто–кистозной гиперплазией эндометрия, впервые выявленной на фоне миомы матки. В 3–ю группу были включены 76 больных с рецидивирующей и атипической гиперплазией эндометрия в сочетании с миомой матки. Группу сравнения составили 30 женщин репродуктивного возраста, умерших от причин, не связанных с генитальной патологией, при отсутствии воспалительных и гиперпластических процессов в матке.
Средний возраст больных 1–й и 2–й группы составил 39,6±5,3 лет; больные 3–й группы находились в возрасте 45,6±4,7 лет. Длительность заболевания миомой матки у больных 1–й группы составила в среднем 2,8±2 года, 2–й группы – 2±1,2 года, в то время как представительницы 3–й группы болели в среднем в течение 4,5±3,6 лет.
Больные 1–й и 2–й группы не получали лечения гормонами. В анамнезе у больных 3–й группы было от 1 до 4 курсов гормонотерапии. На фоне лечения у данного контингента больных отмечалось прогрессирование заболевания.
В клинической картине заболевания у пациенток 1–й и 2–й групп преобладали симптомы, связанные с быстрым ростом и нарушением питания узлов миомы, в то время как у больных 2–й группы ведущими были нарушения менструальной функции – хронические метроррагии – и анемизация. У большинства пациенток 2–й и 3–й групп заболеванию сопутствовал хронический воспалительный процесс в области гениталий.
Иммуногистохимическое исследование рецепторов стероидных гормонов в эндометрии и фиброматозных узлах проведено на гистологических срезах с парафиновых блоков с полуколичественной оценкой окраски рецепторов пероксидазой следующим образом: учитывалась пропорция позитивных клеток (гетерогенность экспрессии рецепторов) и интенсивность реакции (от 0 до + + +) и далее по формуле:
Н = 3x + 2x + 1x,
Где Н – число баллов, цифры 3, 2, 1 – интенсивность окрашивания ядер, x – процент окрашенных ядер. В случае неравномерного окрашивания ядер оценка носила суммарный характер.
Для визуализации использовался микроскоп AXIOSKOP 2 PLUS фирмы ZEISS (Германия), оборудованный CCD–камерой AxioCam HRC. Компьютерная обработка проводилась с использованием программы Axiovision 3.1.
Статистический анализ данных проводили с использованием непараметрического критерия Уилкоксона – Манна – Уитни. В связи со сложностью математических расчетов указанные операции проводятся на компьютере с использованием программы BIOSTAT.
Обсуждение полученных результатов
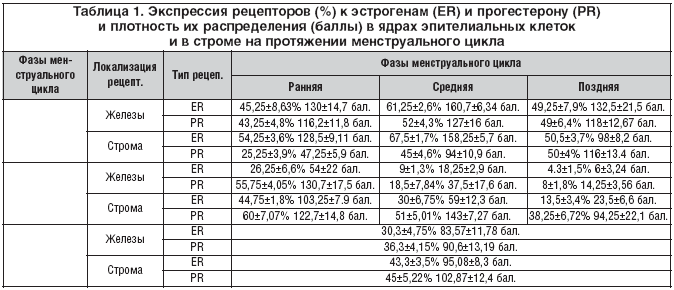
Для определения сравнительных данных в качестве контроля возникла необходимость гистологического и иммуногистохимического исследования эндометрия и миометрия в ходе нормального менструального цикла. Содержание рецепторов половых гормонов в ядрах эпителиальных клеток и в строме эндометрия на протяжении менструального цикла представительниц контрольной группы представлено в виде таблицы 1.
В ходе нормального менструального цикла при иммуногистохимическом исследовании в фазе ранней пролиферации отмечено 40% экспрессирующих ядер клеток эпителия к ER и PR с умеренно высокой плотностью распределения рецепторов и значительным (в 2 раза) превышением экспрессии рецепторов ER в строме по сравнению с PR. В средней стадии фазы пролиферации отмечена самая высокая плотность распределения рецепторов к половым стероидам. В поздней стадии фазы пролиферации в эпителии процент и плотность распределения рецепторов к ER и PR приближается к ранней стадии фазы пролиферации, в строме же продолжает увеличиваться процент экспрессирующих ядер к PR. Самые высокие показатели экспрессии к ER отмечены в средней стадии фазы пролиферации. Самая высокая экспрессия рецепторов к PR отмечена в эпителии в ранней стадии фазы секреции, в строме – в поздней стадии фазы пролиферации. Практически равное содержание рецепторов к ER и PR в железах и строме отмечено в поздней стадии фазы пролиферации и близкое к равному – в средней (отношение ER:PR=1:1). В фазе секреции отмечается снижение рецептивной активности к ER, особенно в железах, и постепенное уменьшение рецепторов к PR, вследствие чего соотношение ER:PR в железах меняется в сторону прогестероновых рецепторов (составляет 1:2) и остается таким на протяжении всей фазы секреции. В строме соотношение ER:PR нарастает с 1:1,4 до 1:3 (к концу менструального цикла). В фазе десквамации исследован 1 случай, рецепторов к ER и PR в ядрах желез и стромы не выявлено. В целом отношение средних значений экспрессирующих ядер к ER и PR в эпителии желез и стромы эндометрия на протяжении нормального цикла составляет 1:1.
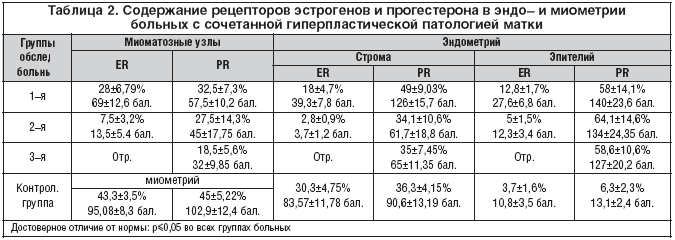
Количество рецепторов к ER и PR в миометрии коррелировало с показателями экспрессии к половым стероидам в эндометрии в ходе нормального менструального цикла, но с уменьшением числа экспрессирующих ядер к ER в 7–8 раз, к PR в 5–6 раз (табл. 2).
При сопоставлении полученных результатов обследованных групп больных и контрольной группы отмечено следующее: уровень рецепторов эстрогенов и прогестерона в ткани миометрия женщин контрольной группы значительно ниже количества рецепторов у больных в 1–й и 2–й группах. У больных 3–й группы количество прогестероновых рецепторов также превышает норму при полном отсутствии эстрогеновых рецепторов.
Наибольшее количество гормональных рецепторов выявлено в миометрии и миоматозных узлах больных 1–й группы, у больных 2–й группы отмеченное увеличение количества рецепторов выражено в меньшей степени. Соотношение ER:PR в эндометрии пациенток 1–й группы увеличено в сторону прогестерона в железах (1:1,4) и в строме (1:3). У больных 2–й группы это соотношение составляет 1:12 в железах и 1:17 в строме эндометрия. У пациенток 3–й группы на фоне полного отсутствия эстрогеновых рецепторов, как в эндометрии, так и в ткани миоматозных узлов, определяется высокий уровень прогестероновых рецепторов в эпителии желез и узлах миомы. Уровень гормональных рецепторов в строме эндометрия всех больных в целом ниже, чем в контрольной. Уровень эстрогеновых рецепторов в эпителии желез также значительно ниже, чем в контрольной (вплоть до полного отсутствия либо мозаичного распределения рецепторов у пациенток 3–й группы). Напротив, степень экспрессии прогестероновых рецепторов в эпителии всех больных превышает показатели контрольной группы. Наибольший уровень эстрогеновых рецепторов выявлен в эндометрии и миоматозных узлах больных с железистыми полипами, сочетающимися с миомой (1–я группа). Самый высокий уровень прогестероновых рецепторов обнаружен у молодых пациенток с впервые возникшей гиперплазией эндометрия (2–я группа). Наименьшее количество эстрогеновых и прогестероновых рецепторов обнаружено у больных рецидивирующей гиперплазией эндометрия на фоне лечения гестагенами, а также при сопутствующем воспалительном процессе (отрицательные значения и близкие к ним обнаружены при кандидозе). Нами исследовано также два препарата эндометрия без гиперпластических процессов, но при наличии эндометрита, при этом отмечено резкое снижение содержания рецепторов к ER и PR (5% в железах и 15% в строме) вплоть до полного отсутствия в одном случае.
Сравнение содержания рецепторов эстрогенов и прогестерона в эндометрии больных с сочетанной гиперпластической патологией матки показало, что уровень рецепторов у больных 1–й и 2–й группы наиболее близок к средней и началу поздней фазы секреции, у пациенток 3–й группы – к поздней фазе секреции и десквамации.
Выводы
1) Проведенный анализ экспрессии рецепторов стероидных гормонов в клетках желез и стромы эндометрия в различные стадии пролиферации и секреции в ходе нормального менструального цикла и при гиперпластических процессах в матке показал, что нарушение экспрессии стероидных гормонов является ведущим в формировании и рецидивировании гиперпластических процессов в эндометрии.
2) В ходе исследования самое высокое содержание рецепторов к эстрогенам и прогестерону в эпителии и строме нормального эндометрия обнаружено в средней и поздней стадии фазы пролиферации с показателем ER:PR практически равным 1, следовательно, эта фаза менструального цикла является оптимальной для забора материала для гистологического и иммуногистохимического исследования (в том числе и контрольных исследований в ходе лечения).
3) Прогестерон имеет решающее значение в развитии и прогрессировании сочетанной гиперпластической патологии эндо– и миометрия [4]. Большое количество рецепторов прогестерона в миоматозных узлах и гиперплазированном эндометрии больных всех групп подтверждает значение этого гормона в патогенезе заболевания.
4) Отсутствие рецепторов эстрогенов и прогестерона у больных рецидивирующими гиперпластическими процессами в эндометрии на фоне миомы ставит под сомнение возможность гормонального лечения данной категории больных и является следствием хронической локальной гиперэстрогении, а также, возможно, гиперпрогестеронемии с формированием порочного круга по типу «стимуляции потребления». Рекомендации по лечению у данной группы больных должны включать аблацию эндометрия, а также радикальное оперативное лечение.
5) Наличие миоматозных узлов усугубляет течение гиперпластических процессов в эндометрии [2]. Длительное воздействие гиперэстрогении на фоне миомы приводит к ингибированию синтеза и появлению мозаичности тканевых гормональных рецепторов, снижая эффективность гормонотерапии, и увеличивает риск рака эндометрия.
6) Целесообразно раннее начало лечения сочетанной гиперпластической патологии эндо– и миометрия. Необходимо отказаться от пассивного наблюдения за больными при выявлении миомы матки (даже небольших размеров), так как длительное существование локальной гиперэстрогении на фоне миомы приводит к развитию гиперпластической трансформации эндометрия. Высокий уровень тканевых рецепторов у больных с небольшой длительностью заболевания свидетельствует об эффективности гормонотерапии. При выявлении данной патологии необходимо решить вопрос об удалении фиброматозных узлов, по возможности лапароскопическим доступом, и назначении гормональной терапии гиперпластических процессов в эндометрии, например, Линдинета 30 – низкодозированного монофазного комбинированного орального контрацептива на основе гестодена.
7) Определение содержания гормональных рецепторов в матке больных сочетанной гиперпластической патологией эндо– и миометрия имеет большое значение в обосновании метода адъювантной терапии и прогнозировании исхода заболевания.
Литература
1. Бассалык Л.С. Рецепторы стероидных гормонов в опухолях человека. М., 1987.
2. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989.
3. Гилязутдинов И.А., Хасанов Р.Ш. Опухоли гормонально–зависимых и гормонопродуцирующих органов. М.: Медпресс–информ, 2003.
4. Ленис Н.Е., Корень Н.А. Дифференцированный подход к лечению миом матки с учетом определения содержания рецепторов к эстрогенам и прогестерону // Проблемы репродукции. №3. 2003. С. 24–29.
5. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические лекции по гинекологической эндокринологии. М.: Мед. информ. агентство, 2003.
6. Миома матки / Под ред. И.С. Сидоровой. М.: Мед. информ. агентство, 2003.
7. Руководство по эндокринной гинекологии / Под ред. Е.М. Вихляевой. М.: Мед. информ. агентство, 2000.
8. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М.: Медицина, 2003.
9. Стрижаков Н.В., Сергеев П.В., Лысенко О.Н. и соавт. Роль половых гормонов и их рецепторного аппарата при выборе методов лечения у пациенток с гиперпластическими процессами в эндометрии в сочетании с миомой матки // Акушерство и гинекология. №3. 1998. С. 30–33.
10. Уварова Е.В. Сочетанная доброкачественная патология эндометрия и миометрия у больных репродуктивного возраста. Автореф. дис... д–ра мед. наук. М., 1993.
11. Adams A., Hild–Petito S., Donnelly K. Regulation of estrogen and progesterone receptors in leiomyomas during the cycle. – American fertility society. 1993 Vol. 38, № 1, P 59–65..
12. Genton Y.C. Histopathology aspect of lesions. – Arch. Ob. Stet. Gynecol. 1994, 255. Supple. 2 P. 76–79.
13. Lieberman J.R., Wiznitzer A., Glezerman M. Estrogen and progesterone receptors in uterine artery of rats during and after pregnancy. – Eur. J. Obstet. Gynecol. Reprod. Biol. 1993, Vol. 51, P 158–166.
14. Richards P.A., Tiltman A.J. Anatomical variation of the estrogen receptor in the non–neoplastic myometrium of fibromyomatous uteri. – Virchows Arch., 1996, aug. Vol 193 № 8, P 265–275.
15. Wilsin E.A., Yang F., Rees E.D. Estradiol and progesterone binding in uterine leiomyomata and in normal uterine tissues. – Obstet. Gynecol. 1980, Vol. 55, P 347–353.












