Функционирование сосудистой системы, обеспечивающей приток крови к репродуктивным органам, напрямую взаимосвязано с коллагенообразованием, составом крови и способностью внеклеточного матрикса (ВКМ) обеспечивать взаимодействие клеточных структур кроветворения и соединительнотканных структур сосудистой стенки [1, 2]. В состав ВКМ входят структурные (коллаген, эластин) и адгезивные белки (фибронектин, ламинин, тенасцин, гемонектин), а также протеогликаны и гликопротеины, минералы (гидроксилапатит), жидкости (лимфа, плазма крови, содержащая свободные антигены). Эти компоненты не только обеспечивают структурную функцию организации тканей, но и участвуют в регуляции клеточных процессов, служат средой для миграции клеток и индукции их дифференцировки [3, 4], что в конечном итоге позволяет организму обеспечить как иммунологические механизмы, так и механизмы гемостатического баланса. Указанное равновесие способствует адекватности компенсаторных механизмов в маточно-плацентарном комплексе при беременности.
Соединительная ткань участвует в обеспечении процессов гемостаза и механизмах регуляции сосудистого тонуса. Эндотелий, выстилающий сосуды организма, в т. ч. маточные и яичниковые, представляет собой слой клеток, обеспечивающий метаболизм ВКМ, а наряду с этим и биосинтез цитокинов, процессы ангиогенеза и пролиферации гладкомышечных элементов сосудистой стенки. Сбалансированное взаимодействие клеточных структур кроветворения и соединительной ткани нарушается при влиянии стрессорных факторов, к которым в первую очередь относится беременность. Более того, аномальное коллагенообразование (АК), сопровождающееся генетическими дефектами свертывания крови [5], усугубляет его. Существующие при этом наряду с ангиодисплазиями гиперагрегационный синдром, резистентность Vа фактора к активированному протеину С, гипергомоцистеинемия [6] играют важную роль в сдерживании или усилении коагуляционного потенциала крови во время беременности. Кроме того, носительство мутаций и полиморфизмов в генах коагуляционного каскада (фибриногена, протромбина, V, IX, VII, VIII, XI, XII факторов свертывания), ингибитора активатора плазминогена, белка С, антитромбина III обусловливают склонность не только к формированию тромбозов [7], но и к неудачам беременности: невынашиванию, плацентарной недостаточности, преждевременной отслойке плаценты, эклампсии и внутриутробной гибели плода [8].
Нарушение синхронности эмбриогенеза и плацентации, кровоснабжения плодного яйца с ранних сроков беременности, недостаточность процессов децидуализации неразрывно связаны с функционированием соединительной ткани в репродуктивных органах. Ангиопатии в эмбриогенезе способствуют нарушению трансформации стромальных клеток в децидуальные и сопровождаются недостаточностью лютеиновой фазы цикла, снижением продукции прогестерона, -хорионического гонадотропина, плацентарного лактогена, что осложняет процессы имплантации бластоцисты и децидуальной трансформации эндометрия [9]. Возникающие гемореологические изменения у пациенток на фоне АК проявляются в виде обширных кровоизлияний, тромбозов межворсинчатого пространства плаценты, гиповаскуляризации ворсин, очагов фиброза и массивных отложений кальцификатов [10]. Увеличение процессов гиперкоагуляции в результате повышения уровня фактора Виллебранда, VIII, VII, V, X, XII факторов свертывания и фибриногена, усугубление венозного стаза вследствие гормональных и механических причин при беременности сопровождаются повреждением сосудистой стенки, что характеризует увеличение прокоагулянтного потенциала и продукции тромбина. Одновременное физиологическое при беременности снижение активности антикоагулянтной системы: резистентность к активированному протеину С, снижение уровня протеина S, угнетение фибринолитической системы, связанное с продукцией в плацентарном ложе ингибитора активатора плазминогена PAI-2 и увеличением экспрессии ингибитора активатора плазминогена PAI-I в эндотелии [11], у пациенток с АК усугубляется, что приводит к локальным и регионарным изменениям гемодинамики [12, 13]. Вместе с тем эндотелиальная дисфункция развивается на фоне гиперактивации симпатико-адреналовой системы, дисбаланса релаксирующих и констриктивных факторов в системе местной регуляции сосудистого тонуса, что приводит к более частому возникновению у таких пациенток преэклампсии, эклампсии и преждевременной отслойки нормально расположенной плаценты.
Нарушения васкуляризации, инволютивно-дистрофические и воспалительные процессы характеризуются снижением артериального притока и затруднением венозного оттока крови в межворсинчатом пространстве и изменениями реологических и коагуляционных свойств крови матери и плода (гиперкоагуляция, гиперагрегация, нарушения вязкости крови) [14]. В этом случае не наблюдается адекватного обеспечения метаболических потребностей плода, реактивности его сердечно-сосудистой и нервной систем и процессов гормоногенеза плаценты. В конечном итоге наблюдаются задержка внутриутробного развития и маловесность плода при рождении.
На фоне вышеперечисленных изменений в сосудах маточно-плацентарного комплекса у пациенток с АК отмечен дисбаланс макро- и микроэлементов, в большей мере обусловленный недостаточным содержанием эссенциальных металлов [15], что усугубляет реологический гомеостаз и нарушения метаболизма коллагена. О.А. Громовой, И.Ю. Торшиным (2009) показано, что АК ассоциируется с недостаточным содержанием в крови ионов кальция, магния, цинка [16, 17]. Ионы магния входят в состав основного вещества соединительной ткани и участвуют в регуляции ее метаболизма, активируя ферменты окислительного фосфорилирования в митохондриях, щелочную фосфатазу, участвующую в синтезе коллагена I типа, полимеразы рибоксинуклеиновой и дезоксирибонуклеиновой кислоты. В условиях магниевой недостаточности способность фибробластов продуцировать коллаген нарушается.
Известно, что для реализации внешнего и внутреннего пути свертывания крови необходимы ионы кальция, магния, цинка. Цинк образует с магнием фосфатные группы и входит в состав щелочной фосфатазы, способствуя синтезу коллагена 1-го типа, составляющего структурный коллаген каркаса плаценты [16]. Нарушения кальций-фосфорного метаболизма сказываются на состоянии фетоплацентарного комплекса. Перфузионная недостаточность в плаценте возникает в результате генерализованной вазоконстрикции из-за несоответствия внеклеточно-интраклеточно соотношения «кальций – магний» [17, 18]. Кальций входит в структуру прокоагуляционных белков, способствуя каскаду гемостазиологических реакций, усиливает действие витамина K (протромбин), являющегося основным фактором свертываемости крови. Кальций влияет на проницаемость клеточных мембран, требуется для транспортировки питательных веществ и иных соединений сквозь клеточные мембраны. Недостаточное его содержание в плазме крови обусловливает признаки гипокоагуляции, т. к. активация VII фактора происходит под влиянием Xа фактора в комплексе с тканевым фактором и ионами кальция. При образовании сгустка нерастворимого фибрина активация фактора XIII осуществляется тромбином (фактором IIа) в присутствии ионов кальция, а коагуляционный компонент фактора VIII С ускоряет активацию фактора IX.
Недостаточность магния в гестационном периоде может вызвать гематологические и тератогенные отклонения в развитии [19]. Магний является одним из важнейших минералов, которые необходимы для регуляции соотношения нуклеиновых кислот и синтеза белков, а также поддержания взаимодействия нервных и мышечных клеток. Магниевая терапия во время беременности способна уменьшить задержки роста плода и преэклампсии и увеличить вес при рождении [20]. Отмечено снижение количества госпитализаций у женщин, принимавших магний [20]. Биологический механизм действия добавок с магнием во время беременности до конца не ясен, и требуется дальнейшее изучение данного вопроса [21, 22].
Рассмотрение влияния магния на свертывающую систему позволяет выявить механизм улучшения маточно-плацентарного кровотока при использовании препаратов, содержащих магний, у женщин с АК. Дефицит микронутриентов, участвующих в каскаде гемостазиологических реакций, способствует у беременных с АК переходу из протромбогенного в тромбогенное состояние.
Магний замещает кальций в структурах прокоагуляционных белков, снижая их активность, оказывает антикоагулянтный эффект, уменьшает агрегацию тромбоцитов через ускорение протеолиза фактора Виллебранда, приводя к гипокоагуляции, снижает уровень тромбоксана А2, тем самым уменьшая поверхность тромба. Кроме того, ионы магния необходимы для нормальной работы витаминов группы В, т. к. служат кофакторами при образовании тиаминпирофосфата, который должен накопиться в организме, прежде чем начнется реализация эффекта витаминов этой группы [16]. Пиридоксин, фолиевая кислота и цианокобаламин, являясь синергистами, способствуют процессам метилирования дезоксирибонуклеиновой кислоты, участвуют в обезвреживании гомоцистеина, важны для роста клеток. Отклонения в процессе метаболизма метионина при недостаточном содержании магния приводят к накоплению гомоцистеина в организме пациенток с АК [15]. Магний принимает участие в ферментативных реакциях, в т. ч. с участием молекул, сберегающих энергию: аденозинтрифосфата, аденозиндифосфата. Магний нужен для синтеза белка, дезоксирибонуклеиновой кислоты, расщепления глюкозы, выведения из организма токсинов, усвоения витамина С, тиамина (В1) и пиридоксина (В6). Устойчивость структур клетки в процессе роста, процессы регенерации клеток организма во многом зависят от магния, который способствует поддержанию электрического потенциала мембран, проникновению через них ионов кальция, натрия, калия. Кальций нужен для сокращения гладких мышц кровеносных сосудов, магний же – для расслабления мускулатуры и расширения артерий.
Цинк принимает участие в синтезе и расщеплении белков, жиров и углеводов и необходим для поддержания активности лейкоцитов, синтеза антител, гормонов, что обусловливает способность сопротивляемости организма к инфекциям. Влияние на процесс сокращения мышц и поддержание кислотно-щелочного равновесия, элиминация свободных радикалов в крови, в целом функционирование иммунной системы в значительной мере обусловлены достаточным содержанием цинка.
Состояние эпителия репродуктивных органов напрямую зависит от кровоснабжения субэпителиальных слоев и действия фибробластов стромы, секретирующих компоненты ВКМ (предшественники белков коллагена и эластина) и колониестимулирующие факторы (гранулоциты, макрофаги). Несостоятельность соединительнотканных структур обусловливает не только изменения маточно-плацентарного комплекса, но и нарушение влагалищного биотопа, что проявляется более высокой частотой вирусно-бактериального инфицирования у пациенток с АК.
Изучение аспектов сохранения желанной беременности у пациенток с АК, связанных с нарушениями в системе гемостаза, явилось предметом настоящего исследования.
Цель – изучение особенностей плацентарных нарушений и уровня минералов в крови у пациенток с АК.
Материал и методы исследования: научно-исследовательская работа проводилась в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и правилами клинической практики в Российской Федерации, утвержденными приказом Минздрава РФ от 19.06.2003 г. № 266. В исследовании приняли участи 365 женщин в возрасте 18–24 лет.
В ходе исследования были определены 4 группы, включающие 365 беременных женщин в возрасте 18–24 лет: 1–я – пациентки с АК и расстройствами менструаций (РМ) в анамнезе, 2-я – пациентки с АК и без РМ, 3-я – пациентки без АК и РМ, 4-я – пациентки без АК и с РМ в анамнезе. Верификация АК у беременных устанавливалась при наличии фенотипических и висцеральных проявлений дисплазии соединительной ткани [22].
Проводились исследования: биохимическое исследование крови с определением уровней кальция, магния, щелочной фосфатазы; исследование параметров плазменно-коагуляционного гемостаза с использованием автоматического коагулометра Sysmex CA-1500 и набора реагентов фирмы Siemens (Германия) методом скрининговых коагуляционных тестов; определение маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином; определение нарушений обмена метионина по уровню гомоцистеина в плазме крови с помощью метода иммуноферментного анализа с использованием реагентов фирмы Axis-Shield PoC AS (Норвегия) по стандартным методикам; морфологическое исследование плаценты, пуповины, оболочек с помощью визуальных и микроскопических методик, использованием гистологического исследования при окраске гематоксилин-эозином. По доминирующему типу строения ворсин диагностировали степень морфологической зрелости плаценты с учетом классификации вариантов незрелости этого органа. Выявление инфекционных возбудителей генитального тракта: вируса простого герпеса 1, 2 типа (Herpes simplex), вируса папилломы человека (Human papilloma virus) (16, 18, 31, 33, 35, 36, 45, 51, 52, 58 типы), цитомегаловируса (Cytomegalovirus), хламидий (Chlamidia trachomatis), микоплазм (Mycoplasma genitalium) и уреаплазм (Ureaplasma urealyticum) осуществлялось методом полимеразной цепной реакции.
Статистическая обработка полученных данных проводилась с помощью пакета компьютерных программ Statisticа 6.1. Использовался дисперсионный анализ для проверки статистических гипотез. Применялся парный 2-выборочный t-тест для средних. Описание выборки производили с помощью подсчета медианы (Me), средних значений признака (M), среднеквадратичного отклонения (SD). Стандартным для проведенных исследований считался уровень значимости p, равный 0,05, 0,01, 0,001, 0,0001. Для решения поставленных задач использована система рейтинга доказательств, которая учитывала все необходимые условия для полноценного доказательного вывода.
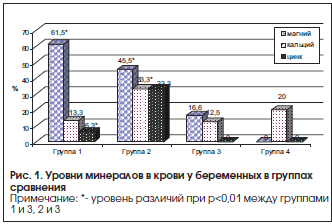
Результаты исследования: уровень магния в сыворотке крови у пациенток (M±m) в 1-й и 2-й группах составил 0,72±0,07 и 0,78±0,05 ммоль/л соответственно и оказался ниже нормативного в сравнении с пациентками 3-й и 4-й групп (0,82±0,05 и 0,81±0,04 ммоль/л). Магниевый дефицит превышал уже в I триместре беременности (p<0,05) у пациенток 1-й группы в 3,7 раза, 2-й группы – в 1,4 раза таковой показатель в 3-й группе, а в 4-й группе отсутствовал (рис. 1). Полученные данные обусловливают необходимость включения в профилактическую терапию приема магния у беременных с АК.
При исследовании уровня кальция отмечено, что каждая 4-я пациентка с АК (25,6%) имела гипокальциемию с начальных сроков беременности. Наименьший уровень кальция (M±m) имели пациентки 1-й группы (2,28±0,09 ммоль/л), тогда как в 2-й, 3-й, 4-й группах (p<0,05) уровень был достоверно выше (соответственно 2,35±0,17, 2,3±0,07, 2,34±0,11 ммоль/л). Магниево-кальциевое соотношение в сыворотке крови оказалось наименьшим (p<0,01) у пациенток в 1-й и 2-й группах (0,30 и 0,32), а в 3-й и 4-й группах в 1,2 раза соответственно выше (0,35 и 0,36).
На протяжении всех триместров беременности значения гомоцистеина оставались статистически более высокими у беременных с АК, что способствовало усилению каскада гемостатических реакций и усугублению нарушений маточно-плацентарного кровотока (рис. 2). Характерно, что гипергомоцистеинемия была выявлена в 2,1 раза чаще (p<0,01) в 1-й группе и в 2,3 раза – во 2-й (42,9 и 46,2%), чем в 3-й и 4-й группах (20,0 и 14,3%).
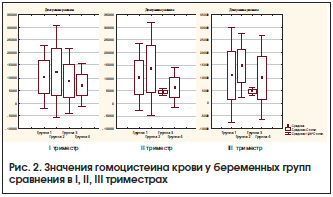
У женщин в 1-й и 2-й группах в I триместре беременности значения (M±m) гомоцистеина оказались выше (10,646±6,44 и 10,201±9,29 мкмоль/л) в 1,5 раза, чем у пациенток 3-й и 4-й групп (7,060±5,94 и 7,457±4,54 мкмоль/л) (рис. 2), во II триместре – в 2,1 раза выше (10,201±6,71 и 13,720±9,36 мкмоль/л), чем у пациенток 3-й и 4-й групп (4908±3,24 и 3,906±4,45 мкмоль/л), в III триместре в 1-й и 2-й группах значения уровня гомоцистеина составили 11,133±9,52 и 14,857±6,41 мкмоль/л, а в 3-й и 4-й группах – 5,206±3,45 и 5,301±4,09 мкмоль/л соответственно. Наименьшие значения гомоцистеина имели беременные 3-й группы.
Повреждающее действие гипергомоцистеинемии является следствием гомоцистеин-опосредованного окислительного стресса. Гомоцистеин окисляется в плазме крови, при этом образуется большое количество кислородсодержащих радикалов, повреждающих эндотелий, в результате чего снижается тромборезистентность сосудистой стенки, усиливается агрегация тромбоцитов, развивается тромбоваскулярная патология [23].
Плацентарная недостаточность характеризуется повышением уровня плацентарной щелочной фосфатазы и повышением энергетического обмена в ткани плаценты, компенсируя снижение кровотока. Угнетение активности указанного фермента коррелирует с отставанием роста и внутриутробным страданием плода и нарушением маточно-плацентарного и фетоплацентарного кровотока [24, 25]. Снижение уровня щелочной фосфатазы, фермента, в состав которого входят ионы цинка, выступающие в роли кофермента в реакциях дефосфорилирования, наблюдалось у каждой пятой пациентки в 1-й и 2-й группах с АК соответственно (19,6 и 19,2%), в то время как у беременных в 3-й и 4-й группах отсутствовало.
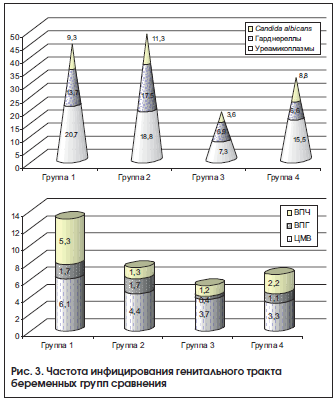
Наличие патогенных микроорганизмов (бактерий и вирусов) в генитальном тракте у беременных с АК (рис. 3), превышающее частоту в группах женщин, не имевших АК, характеризовалось более высокой частотой выявления грибов, гарднерелл и уреамикоплазм. Кроме того, инфицирование вирусами (вирусом простого герпеса, папилломы человека, цитомегаловирусом) более чем в 3 раза чаще наблюдалось у беременных с АК. Это усугубило гемокоагуляционный каскад и плацентарные нарушения микроциркуляции, которые характеризовались накоплением фибриноида плаценты, псевдоинфарктов и увеличением объема незрелой плацентарной ткани.
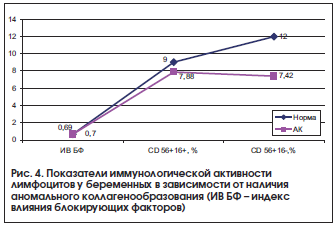
Существующая в организме система врожденного иммунитета (субклассы Т- и В-лимфоцитов, NK-клетки), ответственная за развитие воспалительных реакций на проникновение микробов при беременности к плаценте и плоду, характеризовалась снижением пролиферативной активности NK-клеток крови у беременных с АК (рис. 4). В данном случае применение препарата, содержащего ионы магния и пиридоксина, наиболее целесообразно, т. к. при этом наблюдается иммуномодулирующее воздействие на лимфоциты [26].
Формирование фетоплацентарной недостаточности, имеющее в основе эндотелиопатию, морфологические и функциональные изменения в плаценте сопровождались симметричным или асимметричным отставанием фетометрических параметров плода от гестационной нормы [25] не менее чем на 2 нед., снижением фетоплацентарного и маточно-плацентарного кровотока и внутриутробным страданием плода (рис. 5).
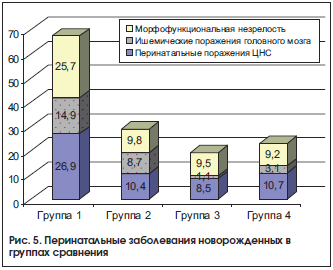
Анализ корреляций параметров системы гемостаза с изменениями плаценты показал, что наряду с более высоким уровнем фибриногена в плазме крови у беременных с АК морфоструктура плаценты характеризовалась сокращением площади межворсинчатого пространства и накоплением фибриноида. Прирост объема межворсинчатого фибриноида, очаговая фибриноидная альтерация хориального синцития и дистелектазы ворсин хориона выявлены в плацентах у каждой второй пациентки с АК на фоне значительного отставания формирования ворсинчатого дерева.
Повышение уровней тромбинемии вследствие активации свертывания и расслоения фибриногенового пула установлено у каждой третьей беременной 1-й и 2–й групп, что в 1,8 и 1,3 раза чаще в сравнении с беременными 3-й и 4-й групп. Характерной особенностью беременности у женщин с АК явилось наличие в 6,1 раза чаще первичной и в 3,4 раза – вторичной плацентарной недостаточности, в 1,9 раза – задержки внутриутробного развития плода, но только у женщин, имевших расстройства менструаций в анамнезе, возникли такие осложнения, как эклампсия (2,7%) во II и III триместрах и преждевременная отслойка плаценты в III триместре (2,4%).
Таким образом, нарушения плацентарной микроциркуляции у беременных с АК ассоциируются со снижением уровней минералов в крови и гемостазиологическими гиперкоагуляционными сдвигами, что необходимо учитывать при профилактике осложнений беременности. Применение препарата, восполняющего дефицит магния, в комбинации с пиридоксином (Магне В6), наиболее целесообразно в этой группе.












