–Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –±–Њ–ї–µ–Ј–љ–µ–є (–Ь–Ъ–С 10) –Њ—В–љ–Њ—Б–Є—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Ї «–±–Њ–ї–µ–Ј–љ—П–Љ –Ї–Њ—Б—В–љ–Њ––Љ—Л—И–µ—З–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є», –Є –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —З–µ—В–Ї–Њ –њ–Њ–Ј–Є—Ж–Є–Њ–љ–Є—А—Г–µ—В –µ–≥–Њ –Ї–∞–Ї –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–Ї–µ–ї–µ—В–∞. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Њ—В–љ–Њ—Б—П—В –Ї –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ, –∞ —Н—В–Њ–≥–Њ –≤–∞–ґ–љ–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –љ–µ—В.
–°–љ–Є–ґ–µ–љ–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ —Е—А—Г–њ–Ї–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є —П–≤–ї—П—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П –±–∞–ї–∞–љ—Б–∞ –Њ–±–Љ–µ–љ–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П –љ–∞–і –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ–±–∞ –Њ–љ–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ –≤–∞–ґ–љ—Л. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Н—В–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ—А–Њ—З–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Є –Њ–і–љ–∞ –Є —В–∞ –ґ–µ —Б—В–µ–њ–µ–љ—М –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Љ–Њ–ґ–µ—В –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—В—М—Б—П —А–∞–Ј–љ—Л–Љ–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П–Љ–Є –њ–Њ–љ–Є–ґ–µ–љ–Є—П –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є —Е—А—Г–њ–Ї–Њ—Б—В–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ –Ї–∞–Ї —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Є—Б—В–µ–Љ–љ–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–Ї–µ–ї–µ—В–∞ –Є–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –њ—А–Є –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ–∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Е—А—Г–њ–Ї–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є –≤ —Б–Є–ї—Г –љ–∞—А—Г—И–µ–љ–Є—П –±–∞–ї–∞–љ—Б–∞ –Њ–±–Љ–µ–љ–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П –љ–∞–і –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –њ–Њ–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ—З–љ–Њ—Б—В–Є –Ї–Њ—Б—В–Є –Є –љ–∞—А–∞—Б—В–∞—О—Й–Є–Љ —А–Є—Б–Ї–Њ–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [3,4].
–Я–µ—А–µ–ї–Њ–Љ—Л —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.
–≠—В–Є–Љ–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П–Љ–Є –њ–µ—А–µ–ї–Њ–Љ—Л, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В—Б—П. –Ю–љ–Є –Љ–Њ–≥—Г—В –Ј–∞—В—А–∞–≥–Є–≤–∞—В—М –ї—О–±—Г—О –Є–Ј —В—А—Г–±—З–∞—В—Л—Е –Ї–Њ—Б—В–µ–є, —В–µ–ї–∞ –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, —В–∞–Ј–Њ–≤—Л–µ –Ї–Њ—Б—В–Є –Є –і—А.
–Я–Њ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є, –љ–∞—Г—З–љ–Њ–є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –Т–Ю–Ч —Б—В–∞–≤–Є—В —Б–µ–≥–Њ–і–љ—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –љ–∞ —З–µ—В–≤–µ—А—В–Њ–µ –Љ–µ—Б—В–Њ –њ–Њ—Б–ї–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є, —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є, –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є –Є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є (—Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М) –њ–∞—В–Њ–ї–Њ–≥–Є–Є [2].
–Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –љ–µ —Й–∞–і–Є—В –љ–Є–Ї–Њ–≥–Њ. –Э–µ—В –љ–Є –Њ–і–љ–Њ–є —А–∞—Б—Л, –љ–Є –Њ–і–љ–Њ–є –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ—Б—В–Є, –љ–Є –Њ–і–љ–Њ–є —Б—В—А–∞–љ—Л, —Б–≤–Њ–±–Њ–і–љ—Л—Е –Њ—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –µ–≥–Њ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —А–∞—Б—В–µ—В, –Њ–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ —З–µ–≥–Њ —П–≤–ї—П–µ—В—Б—П –њ–Њ–≤–Ј—А–Њ—Б–ї–µ–љ–Є–µ –Є –њ–Њ—Б—В–∞—А–µ–љ–Є–µ –љ–∞—Б–µ–ї–µ–љ–Є—П. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В —В–∞–Ї–ґ–µ —Г—Е—Г–і—И–µ–љ–Є—О —Б—А–µ–і—Л –Њ–±–Є—В–∞–љ–Є—П, –љ–µ–Ј–і–Њ—А–Њ–≤–Њ–Љ—Г –Њ–±—А–∞–Ј—Г –ґ–Є–Ј–љ–Є (–љ–Є–Ј–Ї–∞—П —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є –і—А.), —Б –Ї–Њ—В–Њ—А—Л–Љ —Б–≤—П–Ј–∞–љ—Л –Њ–±—Й–µ–µ –њ–∞–і–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ј–і–Њ—А–Њ–≤—М—П, –Є–Љ–Љ—Г–љ–љ—Л–µ, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Є –Є–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П. –С–Њ–ї–µ–µ 80% –ґ–µ–љ—Й–Є–љ —Б—В–∞—А—И–µ 50 –ї–µ—В –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –ґ–µ–љ—Й–Є–љ—Л –Є –Љ—Г–ґ—З–Є–љ—Л —Б—В–∞—А—И–µ 75 –ї–µ—В –Є–Љ–µ—О—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –Ш —Н—В–Њ –µ—Й–µ –Њ–і–љ–Њ –Є–Ј –Њ—Б–љ–Њ–≤–∞–љ–Є–є –і–ї—П –Њ–±—А–∞–Ј–љ–Њ–≥–Њ –љ–∞–Ј–≤–∞–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ «–±–µ–Ј–Љ–Њ–ї–≤–љ–∞—П —Н–њ–Є–і–µ–Љ–Є—П» [2,3].
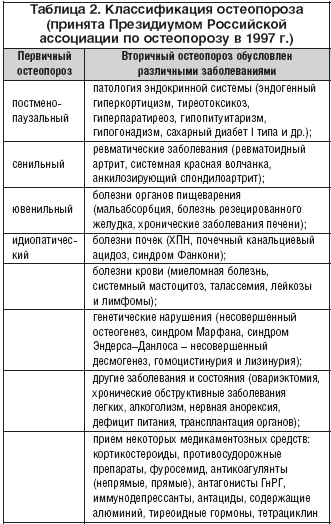
–Я–Њ —Б–∞–Љ—Л–Љ –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–Њ—З–љ—Л–Љ –њ–Њ–і—Б—З–µ—В–∞–Љ, —В–Њ–ї—М–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ —Б—В—А–∞–і–∞–µ—В –љ–µ –Љ–µ–љ–µ–µ 10 –Љ–ї–љ –∞–Љ–µ—А–Є–Ї–∞–љ—Ж–µ–≤, 80% –Є–Ј –љ–Є—Е – –ґ–µ–љ—Й–Є–љ—Л. –Ъ–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ—Л–µ –њ–µ—А–µ–ї–Њ–Љ—Л –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –њ–µ—А–µ–ї–Њ–Љ—Л —И–µ–є–Ї–Є –±–µ–і—А–∞ –Є –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –ї—Г—З–µ–≤–Њ–є –Ї–Њ—Б—В–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П —Г 40% –ґ–µ–љ—Й–Є–љ –Є 10% –Љ—Г–ґ—З–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 50 –ї–µ—В –Є —Б—В–∞—А—И–µ. –Ґ–Њ–ї—М–Ї–Њ –≤ –°–®–Р –µ–ґ–µ–≥–Њ–і–љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –Њ–Ї–Њ–ї–Њ 250 —В—Л—Б. —Б–ї—Г—З–∞–µ–≤ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —И–µ–є–Ї–Є –±–µ–і—А–∞ [9]. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 2.
–Ф–ї—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –њ–Њ—В–µ—А—П –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л, –Ї–Њ—В–Њ—А–∞—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ, —Б–Ї—А—Л—В–Њ –Є –Ј–∞—З–∞—Б—В—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –њ–Њ—Б–ї–µ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є, –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ–ї–µ—З–µ–≤–Њ–є –Ї–Њ—Б—В–Є –Є–ї–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –і—А—Г–≥–Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –≥–ї–∞–≤–љ—Л—Е –њ—А–Є—З–Є–љ –Є–љ–≤–∞–ї–Є–і–љ–Њ—Б—В–Є, —Б–љ–Є–ґ–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є —Б–Љ–µ—А—В–Є –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є.
–Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —П–≤–ї—П–µ—В—Б—П –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј (–Я–Ь–Ю), –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ—З–љ–Њ—Б—В–Є –Ї–Њ—Б—В–Є —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є –Ї–Њ—Б—В–љ—Л–є –Њ–±–Љ–µ–љ —Б –Є–љ—В–µ–љ—Б–Є–≤–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —А–µ–Ј–Њ—А–±—Ж–Є–Є —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –Є–ї–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ –Ї–Њ—Б—В–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є.
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М —Б–Њ—Б—В–Њ–Є—В –Є–Ј –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ I —В–Є–њ–∞ –Є —А—П–і–∞ –і—А—Г–≥–Є—Е –љ–µ–Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л—Е –±–µ–ї–Ї–Њ–≤. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Њ–Є—Б—Е–Њ–і—П—В –і–≤–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞: —А–µ–Ј–Њ—А–±—Ж–Є—П —Б—В–∞—А–Њ–є –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–Њ–≤–Њ–є –Ї–Њ—Б—В–Є, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ —Ж–Є–Ї–ї —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Я—А–Є —Н—В–Њ–Љ –Њ—Б—В–µ–Њ–±–ї–∞—Б—В—Л —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В –±–µ–ї–Ї–Њ–≤—Л–є –Љ–∞—В—А–Є–Ї—Б, –Ї–Њ—В–Њ—А—Л–є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є. –†–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–∞–Ї, –≤ –њ—Г–±–µ—А—В–∞—В–љ–Њ–Љ –Є –њ–Њ—Б—В–њ—Г–±–µ—А—В–∞—В–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ї–Њ—Б—В–љ–∞—П –Љ–∞—Б—Б–∞ –∞–Ї—В–Є–≤–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –і–Њ—Б—В–Є–≥–∞—П —Б–≤–Њ–µ–≥–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –≤ —Б—А–µ–і–љ–µ–Љ –Ї 20–30 –≥–Њ–і–∞–Љ. –° 35 –ї–µ—В —Г –ґ–µ–љ—Й–Є–љ –Є —Б 45 –ї–µ—В —Г –Љ—Г–ґ—З–Є–љ –љ–∞—З–Є–љ–∞–µ—В—Б—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В–µ—А—П –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л, –Ї–Њ—В–Њ—А–∞—П —Г –ґ–µ–љ—Й–Є–љ —А–µ–Ј–Ї–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ –њ–µ—А–≤—Л–µ 5–10 –ї–µ—В –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ (–Ї 65–70 –≥–Њ–і–∞–Љ) –њ–Њ—В–µ—А–Є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л —Б–љ–Є–ґ–∞—О—В—Б—П, —Б–Њ—Б—В–∞–≤–ї—П—П –≤ —Б—А–µ–і–љ–µ–Љ 0,3–0,5% –≤ –≥–Њ–і, –∞ –Ї 80 –≥–Њ–і–∞–Љ –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М —Г –ґ–µ–љ—Й–Є–љ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –љ–∞ 30% –Є –±–Њ–ї–µ–µ [1,2,12].
–≠–љ–і–Њ–≥–µ–љ–љ—Л–µ —Н—Б—В—А–Њ–≥–µ–љ—Л –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Љ–Њ–і—Г–ї—П—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Ј–Њ—А–±—Ж–Є–Є –Ї–Њ—Б—В–µ–є –њ–Њ—Б–ї–µ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –Э–∞ —Д–Њ–љ–µ –≥–Є–њ–Њ—Н—Б—В—А–Њ–≥–µ–љ–µ–Љ–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г—Б–Ї–Њ—А–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Ј–Њ—А–±—Ж–Є–Є –Ї–Њ—Б—В–µ–є. –≠—Б—В—А–Њ–≥–µ–љ—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А—П–Љ–Њ–µ –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б–Ї–µ–ї–µ—В. –Я–Њ—Б–ї–µ–і–љ–µ–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—Г—В–µ–Љ —Б–љ–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –∞–±—Б–Њ—А–±—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –µ–≥–Њ —А–µ–∞–±—Б–Њ—А–±—Ж–Є–Є –њ–Њ—З–Ї–∞–Љ–Є.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –љ–∞–ї–Є—З–Є–µ –≤—Л—Б–Њ–Ї–Њ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ –Ї—Г–ї—М—В—Г—А–µ –Ї–ї–µ—В–Њ–Ї –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –њ—А—П–Љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ –Ї–Њ—Б—В—М. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї–ї–µ—В–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —П–≤–ї—П—О—В—Б—П —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є –і–ї—П –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Ї–µ–ї–µ—В [3,6].
–Ю–± —Г—А–Њ–≤–љ–µ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Љ–Њ–ґ–љ–Њ —Б—Г–і–Є—В—М –њ–Њ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Љ–∞—А–Ї–µ—А–∞–Љ, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–Љ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –Љ–Њ—З–µ. –Ъ –Љ–∞—А–Ї–µ—А–∞–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Њ—В–љ–Њ—Б—П—В—Б—П –Ї–Њ—Б—В–љ—Л–є –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В —Й–µ–ї–Њ—З–љ–Њ–є —Д–Њ—Б—Д–∞—В–∞–Ј—Л, –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ, –°––Ї–Њ–љ—Ж–µ–≤–Њ–є –њ–µ–њ—В–Є–і –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ I —В–Є–њ–∞. –Ю—Б–љ–Њ–≤–љ—Л–µ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ —А–µ–Ј–Њ—А–±—Ж–Є—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –≤–Ї–ї—О—З–∞—О—В —Н–Ї—Б–Ї—А–µ—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П —Б –Љ–Њ—З–Њ–є, N––Ї–Њ–љ—Ж–µ–≤–Њ–є –њ–µ–њ—В–Є–і –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ I —В–Є–њ–∞, –њ–Є—А–Є–і–Є–љ–Њ–≤—Л–µ —Б–≤—П–Ј–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ [5].
–Я–Њ —А–∞—Б—З–µ—В–∞–Љ –і–µ–Љ–Њ–≥—А–∞—Д–Њ–≤, –µ—Б–ї–Є –љ–µ –±—Г–і—Г—В –њ—А–Є–љ—П—В—Л –Љ–µ—А—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ї 2050 –≥. –і–Њ—Б—В–Є–≥–љ–µ—В –Љ–∞—Б—И—В–∞–±–Њ–≤ —Н–њ–Є–і–µ–Љ–Є–Є. –Т 1990 –≥. –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–µ —З–Є—Б–ї–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ –Љ–Є—А–µ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 1,70 –Љ–ї–љ, –Є –њ—А–Є –љ—Л–љ–µ—И–љ–Є—Е —В–µ–Љ–њ–∞—Е —А–Њ—Б—В–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Ї 2050 –≥. –Њ–љ–Њ –Њ–ґ–Є–і–∞–µ—В—Б—П –љ–∞ —Г—А–Њ–≤–љ–µ 6,25 –Љ–ї–љ.
–Я–Ь–Ю —П–≤–ї—П–µ—В—Б—П –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –і–µ—Д–Є—Ж–Є—В –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л. –Т —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–Є–Ї–Њ–≤–Њ–є –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є –Є —Б–Ї–Њ—А–Њ—Б—В–Є –µ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ (—В–∞–±–ї. 3). –Я–Ь–Ю, –њ–Њ –Њ–±—А–∞–Ј–љ–Њ–Љ—Г –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О, – —Н—В–Њ «—В–Є—Е–∞—П —Н–њ–Є–і–µ–Љ–Є—П», –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –њ—А–Њ—В–µ–Ї–∞—О—Й–∞—П –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ –Є –љ–µ—А–µ–і–Ї–Њ –≤—Л—П–≤–ї—П—О—Й–∞—П—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —В–Њ–ї—М–Ї–Њ –љ–∞ —Б—В–∞–і–Є–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Њ—Ж–µ–љ–Ї–∞ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –µ–≥–Њ —А–∞–љ–љ–µ–≥–Њ —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є—П, —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ – —Г–ї—Г—З—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є.
–°–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Њ–≤–µ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ґ—А—Г–і–љ–Њ—Б—В—М –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –≤ 50% —Б–ї—Г—З–∞–µ–≤ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П (–њ–µ—А–µ–ї–Њ–Љ—Л –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ –Є —В—А—Г–±—З–∞—В—Л—Е –Ї–Њ—Б—В–µ–є – —И–µ–є–Ї–Є –±–µ–і—А–∞, –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ—А–µ–і–њ–ї–µ—З—М—П –Є –і—А.) —П–≤–ї—П—О—В—Б—П –Є –њ–µ—А–≤—Л–Љ–Є –µ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є. –•–∞—А–∞–Ї—В–µ—А–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ –њ–µ—А–µ–ї–Њ–Љ—Л —З–∞—Й–µ –≤—Б–µ–≥–Њ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —Б–њ–Њ–љ—В–∞–љ–љ–Њ –Є–ї–Є –њ—А–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є —В—А–∞–≤–Љ–µ (–љ–∞–њ—А–Є–Љ–µ—А, –њ–∞–і–µ–љ–Є–µ —Б –≤—Л—Б–Њ—В—Л –љ–µ –≤—Л—И–µ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–≥–Њ —А–Њ—Б—В–∞ –Є —В.–і.) [5,6].
–Э–µ—А–µ–і–Ї–Њ –њ–µ—А–≤—Л–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –±–Њ–ї—М –≤ —Б–њ–Є–љ–µ: –≥—А—Г–і–љ–Њ–Љ –Њ—В–і–µ–ї–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –њ–Њ—П—Б–љ–Є—З–љ–Њ––Ї—А–µ—Б—В—Ж–Њ–≤–Њ–є –Њ–±–ї–∞—Б—В–Є –Є–ї–Є –Ї—А–µ—Б—В—Ж–µ. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ—А–Є—З–Є–љ–Њ–є –±–Њ–ї–µ–є –Љ–Њ–≥—Г—В –±—Л—В—М –Љ–Є–Ї—А–Њ–њ–µ—А–µ–ї–Њ–Љ—Л —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є –Ј–Њ–љ—Л —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–µ –љ–∞–і–Ї–Њ—Б—В–љ–Є—Ж—Л –і–µ—Д–Њ—А–Љ–Є—А—Г—О—Й–µ–є—Б—П –њ–Њ—А–Њ–Ј–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –•–∞—А–∞–Ї—В–µ—А–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –њ—А–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–µ – —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —А–Њ—Б—В–∞ –±–Њ–ї—М–љ—Л—Е, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –і–≤–Є–ґ–µ–љ–Є–є –≤ –њ–Њ—П—Б–љ–Є—З–љ–Њ–Љ –Њ—В–і–µ–ї–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–ґ–љ—Л—Е —Б–Ї–ї–∞–і–Њ–Ї –љ–∞ –±–Њ–Ї–Њ–≤–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є –Є –і—А.
–Ь–µ—В–Њ–і—Л –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 4. –†–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –њ–µ—А–µ–ї–Њ–Љ—Л –≤ –≥—А—Г–і–љ–Њ–Љ –Є –њ–Њ—П—Б–љ–Є—З–љ–Њ–Љ –Њ—В–і–µ–ї–∞—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –і–µ—Д–Њ—А–Љ–∞—Ж–Є—О –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ї–Њ—Б—В–µ–є —В–∞–Ј–∞ –Њ—Ж–µ–љ–Є—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–∞—Е, —И–µ–є–Ї–µ –±–µ–і—А–∞, —В–∞–Ј–Њ–≤—Л—Е –Ї–Њ—Б—В—П—Е. –Ю–і–љ–Є–Љ –Є–Ј –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤ —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є–Є –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –µ–µ –љ–Є–Ј–Ї–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–∞—П –Њ–њ—А–µ–і–µ–ї—П—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л, –Ї–Њ–≥–і–∞ —Б—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –і–Њ—Б—В–Є–≥–љ–µ—В 20–40%, –њ–Њ—Н—В–Њ–Љ—Г —Г—Б—В–∞–љ–Њ–≤–Є—В—М –і–Є–∞–≥–љ–Њ–Ј –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Є –љ–∞—З–∞–ї—М–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Э–∞–њ—А–Њ—В–Є–≤, —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Є–µ –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А—Л –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ–њ—А–µ–і–µ–ї—П—В—М –њ–Њ—В–µ—А—О –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є (–Ь–Я–Ъ–Ґ) –љ–∞—З–Є–љ–∞—П —Б 2–3%. –Ю–і–љ–∞–Ї–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є–Є —П–≤–ї—П–µ—В—Б—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Ї–Њ—Б—В–µ–є –Є —Б—Г—Б—В–∞–≤–Њ–≤. –Я–Њ—Н—В–Њ–Љ—Г —Б—В–∞–љ–і–∞—А—В–љ–∞—П —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–∞—П –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—П —П–≤–ї—П—О—В—Б—П –≤–Ј–∞–Є–Љ–Њ–і–Њ–њ–Њ–ї–љ—П—О—Й–Є–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є [7,8].
–Ю–±—Й–Є–Љ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –і–ї—П –≤—Б–µ—Е —Д–Њ—А–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є —В–µ–љ–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ —Б–Ї–µ–ї–µ—В–∞. –Я—А–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–µ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –Є—Б—З–µ–Ј–∞–µ—В –љ–Њ—А–Љ–∞–ї—М–љ—Л–є —В—А–∞–±–µ–Ї—Г–ї—П—А–љ—Л–є —А–Є—Б—Г–љ–Њ–Ї –Ї–Њ—Б—В–Є, –≤ —В–µ–ї–∞—Е –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ —З–∞—Б—В–Є—З–љ–Њ –Є–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Є—Б—З–µ–Ј–∞–µ—В –њ–Њ–њ–µ—А–µ—З–љ–∞—П –Є —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –≤–µ—А—В–Є–Ї–∞–ї—М–љ–∞—П –Є—Б—З–µ—А—З–µ–љ–љ–Њ—Б—В—М. –Ф–ї—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Е–∞—А–∞–Ї—В–µ—А–љ—Л —Г—Б–Є–ї–µ–љ–Є–µ –і–≤–Њ—П–Ї–Њ–≤–Њ–≥–љ—Г—В–Њ—Б—В–Є —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –Є—Е –Ї–ї–Є–љ–Њ–≤–Є–і–љ–∞—П –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П. –Ю–і–љ–∞–Ї–Њ –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ—П–≤–ї—П—О—В—Б—П –њ—А–Є –њ–Њ—В–µ—А–µ –љ–µ –Љ–µ–љ–µ–µ 30–40% –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –і–ї—П —А–∞–љ–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і—А—Г–≥–Є–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Ь–Я–Ъ–Ґ —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤—Л–њ–Њ–ї–љ—П—О—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –±–µ–і—А–∞ –Є –њ–Њ—П—Б–љ–Є—З–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞. –Ъ–Њ—Б—В–љ—Г—О –Љ–∞—Б—Б—Г –Њ—Ж–µ–љ–Є–≤–∞—О—В –њ–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –Љ–Є–љ–µ—А–∞–ї–Њ–≤ –љ–∞ –µ–і–Є–љ–Є—Ж—Г –њ–ї–Њ—Й–∞–і–Є –Ї–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –≤ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ —Г –ї—О–і–µ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –њ–Њ–ї–∞ –Є –≤–Њ–Ј—А–∞—Б—В–∞ –Є –Ї –њ–Є–Ї–Њ–≤–Њ–є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б–µ. –Э–∞—А—П–і—Г —Б –∞–±—Б–Њ–ї—О—В–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є–Є –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є –≤—Л—З–Є—Б–ї—П—О—В—Б—П –Ґ– –Є Z––Ї—А–Є—В–µ—А–Є–Є –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –Є –≤–µ–ї–Є—З–Є–љ–∞—Е —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П (SD) [6]. –Ґ––Ї—А–Є—В–µ—А–Є–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є –Њ—В —Б—А–µ–і–љ–µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –Ь–Я–Ъ–Ґ –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –≤ –≤–Њ–Ј—А–∞—Б—В–µ 20–40 –ї–µ—В, –∞ Z––Ї—А–Є—В–µ—А–Є–є –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ —Б—А–µ–і–љ–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є, –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ–Є –і–ї—П –і–∞–љ–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –њ–Њ–ї–∞. –°–Њ–≥–ї–∞—Б–љ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –Т–Ю–Ч, –Ј–љ–∞—З–µ–љ–Є—П –Ь–Я–Ъ–Ґ, –Њ—В–Ї–ї–Њ–љ—П—О—Й–Є–µ—Б—П –њ–Њ –Ґ––Ї—А–Є—В–µ—А–Є—О –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ –1 SD, —А–∞—Б—Ж–µ–љ–Є–≤–∞—О—В—Б—П –Ї–∞–Ї –љ–Њ—А–Љ–∞, –Ј–љ–∞—З–µ–љ–Є—П –Њ—В –1 SD –і–Њ –2,5 SD – –Ї–∞–Ї –Њ—Б—В–µ–Њ–њ–µ–љ–Є—П, –њ—А–µ–≤—Л—И–∞—О—Й–Є–µ –2,5 SD – –Ї–∞–Ї –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ь–Я–Ъ–Ґ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Є–Љ–µ—О—В —В–∞–Ї–Њ–µ –ґ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Ї–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, —Г—А–Њ–≤–µ–љ—М –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї—М—В–∞. –Я—А–Є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П –њ—А–Њ—З–љ–Њ—Б—В—М –Ї–Њ—Б—В–Є –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –Њ—Б—В–∞–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є, —З—В–Њ–±—Л –≤—Л–і–µ—А–ґ–Є–≤–∞—В—М –Њ–±—Л—З–љ—Л–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ (—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ) –љ–∞–≥—А—Г–Ј–Ї–Є. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –Ґ––Ї—А–Є—В–µ—А–Є—П –Њ—В –1 SD –і–Њ –2,5 SD —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ—А–Є –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П—Е –њ–Њ –Ґ––Ї—А–Є—В–µ—А–Є—О –±–Њ–ї–µ–µ —З–µ–Љ –2,5 SD. –Ю–і–љ–∞–Ї–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Ь–Я–Ъ–Ґ –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ –2,5 SD —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –њ–µ—А–µ–ї–Њ–Љ—Л. –Я—А–Є—З–Є–љ–∞–Љ–Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ь–Я–Ъ–Ґ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Љ–Њ–≥—Г—В –±—Л—В—М –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є—П –∞–Њ—А—В—Л, –њ–µ—А–µ–і–љ–µ–є –њ—А–Њ–і–Њ–ї—М–љ–Њ–є —Б–≤—П–Ј–Ї–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –љ–∞–ї–Є—З–Є–µ –Њ—Б—В–µ–Њ—Д–Є—В–Њ–≤ –Є –і—А. [10,11].
–Ф–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–∞ —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є –њ—А–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–µ –љ–∞–Є–±–Њ–ї–µ–µ –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –Є–Љ–µ–љ–љ–Њ –≤ —И–µ–є–Ї–µ –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є – –≤ –њ–Њ—П—Б–љ–Є—З–љ—Л—Е –њ–Њ–Ј–≤–Њ–љ–Ї–∞—Е, –њ—П—В–Њ—З–љ—Л—Е –Ї–Њ—Б—В—П—Е. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ь–Я–Ъ–Ґ –≤ –љ–µ–љ–∞–≥—А—Г–ґ–∞–µ–Љ—Л—Е –Њ—В–і–µ–ї–∞—Е —Б–Ї–µ–ї–µ—В–∞ (–њ—А–µ–і–њ–ї–µ—З—М–µ, –Ї–Є—Б—В—М), –њ–Њ –Љ–љ–µ–љ–Є—О —А—П–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, –љ–µ —В–∞–Ї –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ, —В.–Ї. —Н—В–Є —Б–µ–≥–Љ–µ–љ—В—Л –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –Љ–µ–љ–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ—Г –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –љ–∞–њ—А—П–ґ–µ–љ–Є—О.
–Ф–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л —А–µ–Ј–Њ—А–±—Ж–Є–Є –Ї–Њ—Б—В–Є –Є –Ї–Њ—Б—В–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П. –°—А–µ–і–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ –Є–ї–Є –і–µ–Ј–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ –≤ –Љ–Њ—З–µ. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –Љ–µ–ґ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ–Є —Б–≤—П–Ј—П–Љ–Є, –Њ–±—А–∞–Ј—Г—О—Й–Є–Љ–Є—Б—П –Љ–µ–ґ–і—Г –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–∞–Љ–Є, –≤—Е–Њ–і—П—Й–Є–Љ–Є –≤ –њ–Њ–ї–Є–њ–µ–њ—В–Є–і–љ—Г—О —Ж–µ–њ—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞. –Ш–Ј––Ј–∞ –љ–∞–ї–Є—З–Є—П –њ–Є—А–Є–і–Є–љ–Њ–≤–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞ –њ–µ—А–µ–Ї—А–µ—Б—В–љ—Л–µ —Б–≤—П–Ј–Є –њ–Њ–ї—Г—З–Є–ї–Є –љ–∞–Ј–≤–∞–љ–Є–µ –њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ –Є –і–µ–Ј–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ. –Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Н—В–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—В–Њ—А–Њ–є —Г—В—А–µ–љ–љ–µ–є –њ–Њ—А—Ж–Є–Є –Љ–Њ—З–Є (—Б 7 –і–Њ 11 —З.). –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ –Є –і–µ–Ј–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ –≤ –Љ–Њ—З–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –љ–Њ –Є –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П —В–µ—А–∞–њ–Є–Є – –ї–µ—З–µ–љ–Є–µ —Б—З–Є—В–∞–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ, –µ—Б–ї–Є —Н–Ї—Б–Ї—А–µ—Ж–Є—П –њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –і–µ–Ј–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–Њ–ї–Є–љ–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П –љ–∞ 25% –Є –±–Њ–ї–µ–µ –≤ —В–µ—З–µ–љ–Є–µ 3–6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є [5,10].
–Ш–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ–Є –Є –і–Њ—Б—В—Г–њ–љ—Л–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є –Ї–Њ—Б—В–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —П–≤–ї—П—О—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Й–µ–ї–Њ—З–љ–Њ–є —Д–Њ—Б—Д–∞—В–∞–Ј—Л –Є –µ–µ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В–∞, –∞ —В–∞–Ї–ґ–µ —Г—А–Њ–≤–µ–љ—М –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞. –Ю—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤–Є—В–∞–Љ–Є–љ –Ъ––Ј–∞–≤–Є—Б–Є–Љ—Л–є –љ–µ–Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л–є –±–µ–ї–Њ–Ї –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Ї–Њ—В–Њ—А—Л–є –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–Љ –Љ–∞—В—А–Є–Ї—Б–µ –Ї–Њ—Б—В–Є –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 25% –љ–µ–Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞. –С–Њ–ї–µ–µ 90% —Б–Є–љ—В–µ–Ј–Є—А—Г–µ–Љ–Њ–≥–Њ –Ј—А–µ–ї—Л–Љ–Є –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–∞–Љ–Є –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞ —Г –ї–Є—Ж –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 70% —Г –ї—О–і–µ–є –Ј—А–µ–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Ї–Њ—Б—В–љ—Л–є –Љ–∞—В—А–Є–Ї—Б, –∞ –Њ—Б—В–∞–ї—М–љ–∞—П —З–∞—Б—В—М –њ–Њ–њ–∞–і–∞–µ—В –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Ї—А–Њ–≤–Є –Њ—В—А–∞–ґ–∞—О—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ґ–∞–Ї, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞ –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞ –≤ —Б–≤—П–Ј–Є —Б –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤. –Т–Є—В–∞–Љ–Є–љ D3 —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞ –≤ –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–∞—Е –Є –њ–Њ–≤—Л—И–∞–µ—В –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ –Ї—А–Њ–≤–Є. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є –±–Њ–ї–µ–Ј–љ—П—Е, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ (–±–Њ–ї–µ–Ј–љ—М –Я–µ–і–ґ–µ—В–∞, –њ–µ—А–≤–Є—З–љ—Л–є –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј, –њ–Њ—З–µ—З–љ–∞—П –Њ—Б—В–µ–Њ–і–Є—Б—В—А–Њ—Д–Є—П, –і–Є—Д—Д—Г–Ј–љ—Л–є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–є –Ј–Њ–± –Є –і—А.). –Я—А–Є –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Љ–∞—А–Ї–µ—А–Њ–≤ —А–µ–Ј–Њ—А–±—Ж–Є–Є –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ –Є–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —Г—А–Њ–≤–љ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–Њ—Б—В–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П [6]. –§–Њ—А–Љ—Г–ї–Є—А–Њ–≤–Ї–∞ –і–Є–∞–≥–љ–Њ–Ј–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г–Ї–∞–Ј–∞–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 5.
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –Ь–Я–Ъ–Ґ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 2–3% –Ј–∞ –≥–Њ–і –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –°—В–∞–±–Є–ї—М–љ—Л–Љ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ, –Ї–Њ–≥–і–∞ –љ–µ—В –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ї–Њ—Б—В–µ–є, –љ–Њ –љ–µ –≤—Л—П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ь–Я–Ъ–Ґ –Є–ї–Є –µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ (±2%). –Я—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞) –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ—А–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ј–∞ –њ–µ—А–Є–Њ–і –ї–µ—З–µ–љ–Є—П –Є/–Є–ї–Є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Ь–Я–Ъ–Ґ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 3% –Ј–∞ –≥–Њ–і. –Ю—Ж–µ–љ–Ї–∞ –і–Є–љ–∞–Љ–Є–Ї–Є —В–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –≤–∞–ґ–љ–∞ –і–ї—П –њ—А–Є–љ—П—В–Є—П —А–µ—И–µ–љ–Є—П –Њ –і–∞–ї—М–љ–µ–є—И–µ–є —В–µ—А–∞–њ–Є–Є [8].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П—О—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ї–Њ—Б—В–µ–є –њ—А–Є 3–5––ї–µ—В–љ–µ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ь–Я–Ъ–Ґ, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–Њ–µ —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—Б—В–љ—Л—Е —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Є—Е –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Њ–≤, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞.
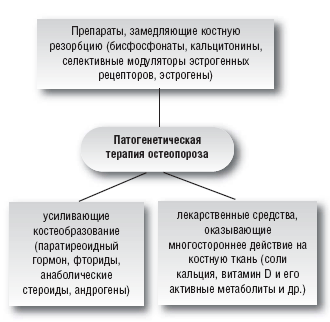
–Ю—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П, —В.–µ. –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –Ї–Њ—Б—В–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ь–Я–Ъ–Ґ, —Г–ї—Г—З—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –Ї–Њ—Б—В–Є –Є —Б–љ–Є–ґ–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –≠—В–Њ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е (–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е) –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ (–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П).
–°—А–µ–і–Є –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–і–∞—О—В –Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ—Л–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–∞–Љ, –Њ—В–Ї–∞–Ј—Г –Њ—В –≤—А–µ–і–љ—Л—Е –њ—А–Є–≤—Л—З–µ–Ї (–Ї—Г—А–µ–љ–Є–µ, –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї—А–µ–њ–Ї–Њ–≥–Њ –Ї–Њ—Д–µ, —В—П–ґ–µ–ї—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –љ–∞–≥—А—Г–Ј–Ї–Є), –Ј–∞–љ—П—В–Є—П–Љ —Д–Є–Ј–Ї—Г–ї—М—В—Г—А–Њ–є (–ї–µ—З–µ–±–љ–∞—П –≥–Є–Љ–љ–∞—Б—В–Є–Ї–∞, –њ–ї–∞–≤–∞–љ–Є–µ). –°—О–і–∞ —В–∞–Ї–ґ–µ –Њ—В–љ–Њ—Б—П—В—Б—П –Є –Љ–µ—А—Л –њ–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ–∞–і–µ–љ–Є–є – –Њ—В–Љ–µ–љ–∞ —Б–љ–Њ—В–≤–Њ—А–љ—Л—Е, —Б–µ–і–∞—В–Є–≤–љ—Л—Е –Є –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ј—А–µ–љ–Є—П, –ї–µ—З–µ–љ–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤, –∞ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є – –љ–Њ—И–µ–љ–Є–µ –њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤ –±–µ–і—А–∞. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П —В–∞–Ї–ґ–µ –≤ –∞–і–µ–Ї–≤–∞—В–љ–Њ–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –Ї–∞–ї—М—Ж–Є—П, –і—А—Г–≥–Є—Е –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ —Б –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –њ–Є—В–∞–љ–Є—П [13].
–Ю—Б–љ–Њ–≤–Њ–є –ї—О–±–Њ–є —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D [4,9,14].
–Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–Є – –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ—Л–є –≤–Њ –≤—А–µ–Љ–µ–љ–Є –Є –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ –њ—А–Њ—Ж–µ—Б—Б, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–µ–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–µ –≤–µ—Й–µ—Б—В–≤–∞ –Њ—В–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –≤ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–є –Љ–∞—В—А–Є–Ї—Б. –Ь–Є–љ–µ—А–∞–ї—М–љ–∞—П —Д–∞–Ј–∞ —Н—В–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б–Њ—Б—В–Њ–Є—В –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є–Ј –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞, —Б–Ї–Њ—А–Њ—Б—В—М –µ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ —З–Є—Б–ї–µ –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –Є–Њ–љ–Њ–≤ –і–∞–љ–љ—Л—Е –Љ–Є–љ–µ—А–∞–ї–Њ–≤ –≤ –њ–ї–∞–Ј–Љ–µ –Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є.
–Т –Ї–Њ—Б—В—П—Е —Б–Ї–µ–ї–µ—В–∞ –Ї–∞–ї—М—Ж–Є–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ —Д–Њ—Б—Д–∞—В–∞–Љ–Є – –°–∞3(–†–Ю4)2 (85%), –Ї–∞—А–±–Њ–љ–∞—В–∞–Љ–Є – –°–∞–°–Ю3 (10%) –Є —Б–Њ–ї—П–Љ–Є –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –Ї–Є—Б–ї–Њ—В – –ї–Є–Љ–Њ–љ–љ–Њ–є –Є –Љ–Њ–ї–Њ—З–љ–Њ–є (–Њ–Ї–Њ–ї–Њ 5%). –Т–љ–µ –Ї–Њ—Б—В–µ–є —Б–Ї–µ–ї–µ—В–∞ –Ї–∞–ї—М—Ж–Є–є —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –≤ –Ї–ї–µ—В–Ї–∞—Е [6].
–Т —Д–Њ—Б—Д–∞—В–µ –Ї–∞–ї—М—Ж–Є—П, –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–Љ –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–Љ —Б–Њ–µ–і–Є–љ–µ–љ–Є–Є, –±–ї–Є–Ј–Ї–Њ–Љ –Ї –≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–њ–∞—В–Є—В—Г – –°–∞10(–†–Ю4)6(–Ю–Э)2, –љ–µ–Ї–Њ—В–Њ—А–∞—П —З–∞—Б—В—М –Є–Њ–љ–Њ–≤ –°–∞2+ –Ј–∞–Љ–µ—Й–µ–љ–∞ –Є–Њ–љ–∞–Љ–Є Mg2+ –Є –µ—Й–µ –Љ–µ–љ—М—И–∞—П —З–∞—Б—В—М –Є–Њ–љ–Њ–≤ –Ю–Э – –Є–Њ–љ–∞–Љ–Є —Д—В–Њ—А–∞, –њ–Њ–≤—Л—И–∞—О—Й–Є–Љ–Є –њ—А–Њ—З–љ–Њ—Б—В—М –Ї–Њ—Б—В–Є.
–Ь–Є–љ–µ—А–∞–ї—М–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–≤–љ–Њ–≤–µ—Б–Є—П —Б –Є–Њ–љ–∞–Љ–Є –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–∞—В–∞ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є. –Ъ–ї–µ—В–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Љ–Њ–≥—Г—В —Г—Б–Ї–Њ—А—П—В—М –Њ—В–ї–Њ–ґ–µ–љ–Є–µ –Є–ї–Є, –љ–∞–њ—А–Њ—В–Є–≤, —А–∞—Б—В–≤–Њ—А–µ–љ–Є–µ –Є –≤—Л–Љ—Л–≤–∞–љ–Є–µ –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–Є –ї–Њ–Ї–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е —А–Э, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Њ–љ–Њ–≤ –°–∞2+, –Э–†–Ю42– –Є —Е–µ–ї–∞—В–Њ–Њ–±—А–∞–Ј—Г—О—Й–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є. –Т –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б–Њ–і–µ—А–ґ–Є—В—Б—П 1–2 –Ї–≥ –Ї–∞–ї—М—Ж–Є—П, 98% –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ —Б–Ї–µ–ї–µ—В–∞, —З—В–Њ —А–∞–≤–љ–Њ –њ—А–Є–Љ–µ—А–љ–Њ 2% –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Њ–Ї–Њ–ї–Њ 30 –Љ–Њ–ї—М). –Т –Ї—А–Њ–≤–Є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П –љ–∞—Е–Њ–і–Є—В—Б—П –љ–∞ —Г—А–Њ–≤–љ–µ 9–11 –Љ–≥/100 –Љ–ї (2,2–2,8 –Љ–Љ–Њ–ї—М/–ї), –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є – –Њ–Ї–Њ–ї–Њ 20 –Љ–≥/100 –Љ–ї. –†–µ–≥—Г–ї—П—Ж–Є—П –Њ–±–Љ–µ–љ–∞ –Ї–∞–ї—М—Ж–Є—П –Љ–µ–ґ–і—Г –≤–љ–µ– –Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В—М—О –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ–∞—А–∞—В–Є—А–µ–Њ—В—А–Њ–њ–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–Њ–Љ, –∞ —В–∞–Ї–ґ–µ 1,25––і–Є–Њ–Ї—Б–Є—Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї–Њ–Љ. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Њ–љ–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –≤–ї–µ—З–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞. –Т –≤–Є–і–µ —А–µ–∞–Ї—Ж–Є–Є –љ–∞ —Н—В–Њ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В—Л —Г—Б–Є–ї–Є–≤–∞—О—В —А–∞—Б—В–≤–Њ—А–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ –Ї–Њ—Б—В—П—Е –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є. –Я—А–Є —Н—В–Њ–Љ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—П –Є–Њ–љ–Њ–≤ –°–∞2+ –≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–∞—Е, –Є –≤ –Є—В–Њ–≥–µ –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є–Њ–љ–Њ–≤ –Ї–∞–ї—М—Ж–Є—П, –љ–∞–њ—А–Њ—В–Є–≤, —Б–µ–Ї—А–µ—В–Є—А—Г–µ—В—Б—П –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ, —Б–љ–Є–ґ–∞—О—Й–Є–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Є–Њ–љ–Њ–≤ –°–∞2+ –Ј–∞ —Б—З–µ—В –µ–≥–Њ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤.
–Т —А–µ–≥—Г–ї—П—Ж–Є–Є —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –∞–Ї—В–Є–≤–љ–Њ–µ —Г—З–∞—Б—В–Є–µ –њ—А–Є–љ–Є–Љ–∞–µ—В –≤–Є—В–∞–Љ–Є–љ D. –Ю–љ —В—А–µ–±—Г–µ—В—Б—П –і–ї—П —Б–Є–љ—В–µ–Ј–∞ –Ї–∞–ї—М—Ж–Є–є—Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—Й–Є—Е –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Є–Њ–љ–Њ–≤ –°–∞2+ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О – –≤ –њ–Њ—З–Ї–∞—Е. –Ф–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ [9]. –Ґ–Є—А–Њ–Ї—Б–Є–љ –Є –∞–љ–і—А–Њ–≥–µ–љ—Л –њ–Њ–≤—Л—И–∞—О—В, –∞ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л –њ–Њ–љ–Є–ґ–∞—О—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є–Њ–љ–Њ–≤ –°–∞2+ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ъ–∞–ї—М—Ж–Є–є –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б –њ–Є—Й–µ–є. –Ъ–∞–ї—М—Ж–Є–є –њ–Є—Й–Є –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ –њ–Њ –і–≤—Г–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ: –љ–∞—Б—Л—Й–∞–µ–Љ–Њ–Љ—Г (—З—А–µ—Б–Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г) – —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –љ–∞—З–∞–ї—М–љ–Њ–Љ –Њ—В–і–µ–ї–µ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, –Є –љ–µ–љ–∞—Б—Л—Й–∞–µ–Љ–Њ–Љ—Г – –њ–∞—Б—Б–Є–≤–љ–∞—П –і–Є—Д—Д—Г–Ј–Є—П –Є–Ј –њ—А–Њ—Б–≤–µ—В–∞ –Ї–Є—И–Ї–Є –≤ –Ї—А–Њ–≤—М –Є –ї–Є–Љ—Д—Г. –Ю–±—К–µ–Љ –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П —П–≤–ї—П–µ—В—Б—П —Д—Г–љ–Ї—Ж–Є–µ–є –Љ–љ–Њ–≥–Є—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е, –Њ–і–љ–∞ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е – –≤–Њ–Ј—А–∞—Б—В. –Т –њ–µ—А–≤—Л–µ –і–љ–Є –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П —Г—Б–≤–∞–Є–≤–∞–µ—В—Б—П –њ–Њ—З—В–Є –≤–µ—Б—М –њ–Њ–ї—Г—З–∞–µ–Љ—Л–є –Ї–∞–ї—М—Ж–Є–є, –Є –і–∞–ї–µ–µ –≤ –њ–µ—А–Є–Њ–і —А–Њ—Б—В–∞ –µ–≥–Њ —Г—Б–≤–Њ–µ–љ–Є–µ –Њ—Б—В–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ. –Т –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Њ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П —Б –Љ–∞–Ї—Б–Є–Љ—Г–Љ–Њ–Љ —Б–Ї–Њ—А–Њ—Б—В–Є —Б–љ–Є–ґ–µ–љ–Є—П –Ї 60 –≥–Њ–і–∞–Љ.
–°–ї–µ–і—Г—О—Й–∞—П, –≤–ї–Є—П—О—Й–∞—П –љ–∞ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –њ–µ—А–µ–Љ–µ–љ–љ–∞—П, – —А–∞—Ж–Є–Њ–љ. –Т—Б–∞—Б—Л–≤–∞–љ–Є–µ –±–Њ–ї—М—И–µ –њ—А–Є —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Њ–Ї–∞–ї–Њ—А–Є–є–љ–Њ–є –±–µ–ї–Ї–Њ–≤–Њ–є –њ–Є—Й–Є –Є –љ–Є–ґ–µ – —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–є. –Т—Б–∞—Б—Л–≤–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Ј–∞–Љ–µ–і–ї—П–µ—В—Б—П –њ—А–Є –Љ–љ–Њ–≥–Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, —В–∞–Ї–Є—Е –Ї–∞–Ї —В–Є—А–µ–Њ—В–Њ–Ї—Б–Є–Ї–Њ–Ј, –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї, –Ї–Є—И–µ—З–љ–Є–Ї–∞, –≥–∞—Б—В—А–Њ– –Є —Н–љ—В–µ—А–Њ—Н–Ї—В–Њ–Љ–Є—П –Є –і—А.
–Т–Њ –≤–Ј—А–Њ—Б–ї–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –Њ–Ї–Њ–ї–Њ 670 –≥ —Д–Њ—Б—Д–Њ—А–∞ (1% –Љ–∞—Б—Б—Л —В–µ–ї–∞), –Ї–Њ—В–Њ—А—Л–є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є –Ї–ї–µ—В–Њ—З–љ—Л–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –Њ–±–Љ–µ–љ. –Ю–Ї–Њ–ї–Њ 90% —Д–Њ—Б—Д–Њ—А–∞, –њ–Њ–і–Њ–±–љ–Њ –Ї–∞–ї—М—Ж–Є—О, —В–∞–Ї–ґ–µ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —Б–Ї–µ–ї–µ—В–µ. –Т–Љ–µ—Б—В–µ —Б –Ї–∞–ї—М—Ж–Є–µ–Љ –Њ–љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—Б–љ–Њ–≤—Г —В–≤–µ—А–і–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Ї–Њ—Б—В–Є. –Т –Ї–Њ—Б—В—П—Е —Д–Њ—Б—Д–Њ—А –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ —В—А—Г–і–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–Љ —Д–Њ—Б—Д–∞—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П (–і–Њ 2/3) –Є —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–Љ–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ–Є (–і–Њ 1/3). –С–Њ–ї—М—И–∞—П —З–∞—Б—В—М –Њ—Б—В–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Д–Њ—Б—Д–Њ—А–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –≤–љ—Г—В—А–Є –Ї–ї–µ—В–Њ–Ї, –Є —В–Њ–ї—М–Ї–Њ 1% – –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є. –Я–Њ—Н—В–Њ–Љ—Г —Г—А–Њ–≤–µ–љ—М —Д–Њ—Б—Д–Њ—А–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–µ –Њ—В—А–∞–ґ–∞–µ—В –µ–≥–Њ –Њ–±—Й–µ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [12].
–Т—Б–∞—Б—Л–≤–∞–љ–Є–µ 70–90% –Њ–±—К–µ–Љ–∞ —Д–Њ—Б—Д–Њ—А–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –Њ—В–Ї—Г–і–∞ –Њ–љ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –њ–µ—З–µ–љ—М, –≥–і–µ —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—П, —З–∞—Б—В–Є—З–љ–Њ –Њ—В–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –≤ –≤–Є–і–µ –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е —Б–Њ–ї–µ–є, –њ–µ—А–µ—Е–Њ–і—П—Й–Є—Е –Ј–∞—В–µ–Љ –≤ –Ї—А–Њ–≤—М –Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –Ї–Њ—Б—В–љ–Њ–є –Є –Љ—Л—И–µ—З–љ–Њ–є (—Б–Є–љ—В–µ–Ј –Ї—А–µ–∞—В–Є–љ—Д–Њ—Б—Д–∞—В–∞) —В–Ї–∞–љ—М—О. –Ъ–∞—З–µ—Б—В–≤–Њ–Љ –Њ–±–Љ–µ–љ–∞ —Д–Њ—Б—Д–∞—В–Њ–≤ –Ї—А–Њ–≤–Є –Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞—З–µ—Б—В–≤–Њ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Њ–Ї–Њ—Б—В–µ–љ–µ–љ–Є—П, –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Ї–Њ—Б—В–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –≤ –њ—А–Є–љ—Ж–Є–њ–µ. –°–Ї–µ–ї–µ—В —П–≤–ї—П–µ—В—Б—П —А–µ–Ј–µ—А–≤—Г–∞—А–Њ–Љ –љ–µ–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–Њ—Б—Д–Њ—А–∞: –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Њ–љ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –љ–µ–µ –Є–Ј —Б–Ї–µ–ї–µ—В–∞ –Є, –љ–∞–Њ–±–Њ—А–Њ—В, –Њ—В–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –≤ —Б–Ї–µ–ї–µ—В–µ –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ. –Я—А–Њ—Ж–µ—Б—Б—Л –Њ–±–Љ–µ–љ–∞ –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞ —В–µ—Б–љ–Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ—Л –і—А—Г–≥ —Б –і—А—Г–≥–Њ–Љ. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –і–ї—П —Г—Б–≤–Њ–µ–љ–Є—П —Б –њ–Є—Й–µ–є —П–≤–ї—П–µ—В—Б—П —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —Д–Њ—Б—Д–Њ—А–∞ –Є –Ї–∞–ї—М—Ж–Є—П 1:1–1,5.
–У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, —Б–љ–Є–ґ–∞—П —Б–µ–Ї—А–µ—Ж–Є—О –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О —Д–Њ—Б—Д–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —З–µ—А–µ–Ј —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ —Б –Ї–∞–ї—М—Ж–Є–µ–Љ –њ—А–Є–≤–Њ–і—П—В –Ї –µ–≥–Њ –Њ—В–ї–Њ–ґ–µ–љ–Є—О –≤ —В–Ї–∞–љ—П—Е –Є –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є. –У–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –≤–Є—В–∞–Љ–Є–љ–∞ D. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П –Є–Ј –Ї–Њ—Б—В–µ–є –Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –Є–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–∞—В–Њ–≤.
–Ш–Ј–±—Л—В–Њ–Ї —Д–Њ—Б—Д–∞—В–Њ–≤ —Н–Ї—Б–Ї—А–µ—В–Є—А—Г–µ—В—Б—П —Б –Љ–Њ—З–Њ–є (—Д–Њ—Б—Д–∞—В—Г—А–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞), –њ—А–Є —Н—В–Њ–Љ –≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–∞—Е –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—П –Ї–∞–ї—М—Ж–Є—П, —З—В–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ –Ї—А–Њ–≤–Є.
–У–Є–њ–Њ—Д–Њ—Б—Д–∞—В–µ–Љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г—Б–Є–ї–µ–љ–Є–µ–Љ —Б–µ–Ї—А–µ—Ж–Є–Є —В–Њ–ї—М–Ї–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D, —З—В–Њ —Б–љ–Є–ґ–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –Є, –Ї–∞–Ї —А–µ–Ј—Г–ї—М—В–∞—В, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –У–Є–њ–Њ—Д–Њ—Б—Д–∞—В–µ–Љ–Є—П –њ—А–Є–≤–Њ–і–Є—В —В–∞–Ї–ґ–µ –Ї —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–±—Б–Њ—А–±—Ж–Є–Є —Д–Њ—Б—Д–∞—В–∞ –Є –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ.
–Ш–Ј–±—Л—В–Њ–Ї –Ї–∞–ї—М—Ж–Є—П –≤—Л–≤–Њ–і–Є—В—Б—П —Б –Љ–Њ—З–Њ–є, —В.–Ї. –≤–Є—В–∞–Љ–Є–љ D –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і–µ–є—Б—В–≤–Є–µ–Љ –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ —Г—Б–Є–ї–Є–≤–∞–µ—В –µ–≥–Њ —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –≤ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Њ–њ–Є—Б–∞–љ–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Д–Њ—Б—Д–∞—В–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П.
–Т–Є—В–∞–Љ–Є–љ D –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –і–ї—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ —Ж–µ–ї–Њ–Љ. –Ю–љ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤, –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –љ–µ–≥–Њ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –њ–Є—Й–µ–є, –љ–Њ –Є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –≤ –Ї–Њ–ґ–µ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤—Л—Е –ї—Г—З–µ–є [6,7,13].
–Т–Є—В–∞–Љ–Є–љ D3 – —Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї –Є–ї–Є –≤–Є—В–∞–Љ–Є–љ D2 – —Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А—Г—О—В—Б—П –≤ –њ–µ—З–µ–љ–Є, –Њ–±—А–∞–Ј—Г—П 25––≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ –Ї—А–Њ–≤–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 20 –і–Њ 50 –љ–≥/–Љ–ї. –Я–Њ—Б–ї–µ–і–љ–Є–є –љ–µ –Њ–±–ї–∞–і–∞–µ—В –љ–Є–Ї–∞–Ї–Њ–є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –≤ –њ–Њ—З–Ї–∞—Е –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г 1,25––і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ–∞ D3 – –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Б–ї–µ–і–љ–Є–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –≥–Њ–Љ–µ–Њ–Ї–Є–љ–µ–Ј–∞ –Ї–∞–ї—М—Ж–Є—П —З–µ—А–µ–Ј –µ–≥–Њ —А–µ–≥—Г–ї—П—Ж–Є—О –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –Ї–Њ—Б—В—П—Е. –Т –Ї–Є—И–µ—З–љ–Є–Ї–µ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї —А–µ–≥—Г–ї–Є—А—Г–µ—В –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞, –∞ –≤ –Ї–Њ—Б—В—П—Е – –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є—О –≤–љ–Њ–≤—М –Њ–±—А–∞–Ј—Г—О—Й–µ–є—Б—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ґ—А–∞–љ—Б–њ–Њ—А—В –Ї–∞–ї—М—Ж–Є—П —З–µ—А–µ–Ј –Ї–ї–µ—В–Ї–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ —Д–Њ—Б—Д–Њ—А–∞. –Т —В–Њ—З–Ї–∞—Е —А–Њ—Б—В–∞ –Ї–Њ—Б—В–µ–є –Ї–∞–ї—М—Ж–Є–є –≤—Б—В—Г–њ–∞–µ—В –≤ —Б–≤—П–Ј—М —Б –љ–µ–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Д–Њ—Б—Д–∞—В–∞–Љ–Є. –Ю—Б—В–µ–Њ–±–ї–∞—Б—В—Л –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Д–Њ—Б—Д–∞—В –Ї–∞–ї—М—Ж–Є—П –і–ї—П –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є.
–Я–Њ–Љ–Є–Љ–Њ —Г—Б–Є–ї–µ–љ–Є—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П —Д–Њ—Б—Д–Њ—А–∞ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї —В–Њ—А–Љ–Њ–Ј–Є—В –µ–≥–Њ –њ–Њ—В–µ—А—О –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—Б–≤–Њ–µ–љ–Є—О –Љ–∞–≥–љ–Є—П –Ї–∞–Ї –њ–∞—А—В–љ–µ—А–∞ –Ї–∞–ї—М—Ж–Є—П –≤–Њ –≤—Б–µ—Е –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є—П—Е.
–° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ –Ї–∞–ї—М—Ж–Є–є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –µ–і–Є–љ–Є—Ж–µ–є –Ї–Њ—Б—В–µ–є —Б–Ї–µ–ї–µ—В–∞ (99% –≤—Б–µ–≥–Њ –Ї–∞–ї—М—Ж–Є—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є), –Њ–љ –Є–≥—А–∞–µ—В –Ј–љ–∞—З–Є–Љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (–Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є).
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –і–Њ—Б—В—Г–њ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–∞ –Ї–Њ—Б—В–љ–Њ–є –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є–Є [13]. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –∞–≤—В–Њ—А—Л –Њ—В–Љ–µ—З–∞—О—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –Ь–Я–Ъ–Ґ (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 0,25% –≤ –≥–Њ–і) –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Њ–±—А–∞—Й–∞—О—В –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –≤–ї–Є—П–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –љ–∞ –Ї–Њ—Б—В–љ—Г—О –Љ–∞—Б—Б—Г –±—Л–ї–Њ –±–Њ–ї–µ–µ –Њ—В—З–µ—В–ї–Є–≤—Л–Љ –≤ –њ–µ—А–≤—Л–є –≥–Њ–і –ї–µ—З–µ–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Г—З–∞—Б—В–Ї–∞—Е —Б–Ї–µ–ї–µ—В–∞, –≥–і–µ –њ—А–µ–Њ–±–ї–∞–і–∞–µ—В —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–∞—П –Ї–Њ—Б—В—М. –Ь–µ—В–∞–∞–љ–∞–ї–Є–Ј 20 –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ–Њ—В–µ—А–Є –Ь–Я–Ъ–Ґ —Г –ї–Є—Ж, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–∞–ї—М—Ж–Є—П, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ 1% –≤ –≥–Њ–і, –∞ —Г —В–µ—Е, –Ї—В–Њ –љ–µ –њ–Њ–ї—Г—З–∞–ї –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–ї—М—Ж–Є—П, —Н—В–Є –њ–Њ—В–µ—А–Є –њ—А–µ–≤—Л—И–∞–ї–Є 1% –≤ –≥–Њ–і [9].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –і–Њ 2500 –Љ–≥ –≤ —Б—Г—В. –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є—Г—А–Є—О –Є–ї–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–∞–Љ–љ–µ–є –≤ –њ–Њ—З–Ї–∞—Е. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Ж–Є—В—А–∞—В–∞ –Ї–∞–ї—М—Ж–Є—П, –љ–µ –≤–ї–Є—П—О—Й–µ–≥–Њ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б –љ–µ—Д—А–Њ–ї–Є—В–Є–∞–Ј–∞. –Я—А–Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–Њ–±–ї—О–і–∞—В—М –≤–Њ–і–љ—Л–є —А–µ–ґ–Є–Љ (1,2–1,5 –ї –ґ–Є–і–Ї–Њ—Б—В–Є –≤ —Б—Г—В–Ї–Є) –Є –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—В—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –њ–Њ–≤–∞—А–µ–љ–љ–Њ–є —Б–Њ–ї–Є, —В.–Ї. –Є–Ј–±—Л—В–Њ–Ї –љ–∞—В—А–Є—П –њ–Њ–≤—Л—И–∞–µ—В —Н–Ї—Б–Ї—А–µ—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П —Б –Љ–Њ—З–Њ–є. –І–∞—Б—В—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Ј–∞–њ–Њ—А–Њ–≤. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г–≤–µ–ї–Є—З–Є—В—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –≤–Њ–і—Л –Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П.
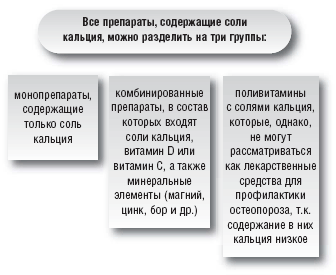
–Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –Њ—В–і–∞—О—В –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б–Њ–ї–µ–є –Ї–∞–ї—М—Ж–Є—П —Б –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–∞–Љ–Є, —В.–Ї. –Њ–љ–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Њ—Б—В–µ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Я—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ–Є —Н—В–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П—О—В—Б—П –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Є –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б. –Т—Е–Њ–і—П—Й–Є–µ –≤ —Б–Њ—Б—В–∞–≤ —Б–Њ–ї–Є –Ї–∞–ї—М—Ж–Є—П –Є –і—А—Г–≥–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ—А–Є–і–∞—О—В –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ—Г –Є –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ—Г –Р–і–≤–∞–љ—Б —Ж–µ–ї—Л–є —А—П–і –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ (—В–∞–±–ї. 6 –Є 7).
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥—А—Г–њ–њ—Л –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (–Њ—Б—В–µ–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞). –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –љ–∞—З–Є–љ–∞—В—М –≤—Б–µ–Љ –ґ–µ–љ—Й–Є–љ–∞–Љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, –Є–Љ–µ—О—Й–Є–Љ –і–≤–∞ –Є –±–Њ–ї–µ–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М 2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є, —В.–Ї. –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е –љ–∞–±–ї—О–і–∞–µ—В—Б—П –ї—Г—З—И–∞—П –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ—Б—В—М –Ї–∞–ї—М—Ж–Є—П. –Я—А–µ–њ–∞—А–∞—В –ї—Г—З—И–µ –њ—А–Є–љ–Є–Љ–∞—В—М –≤ –Њ–±–µ–і–µ–љ–љ–Њ–µ –≤—А–µ–Љ—П –Є –≤–µ—З–µ—А–Њ–Љ (–≤–Њ –≤—А–µ–Љ—П –µ–і—Л), —З—В–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —Г—Б–Ї–Њ—А–µ–љ–љ—Г—О –њ–Њ—В–µ—А—О –Ї–∞–ї—М—Ж–Є—П –≤–Њ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ–µ –љ–Њ—З–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Ж–Є—А–Ї–∞–і–љ–Њ–≥–Њ —Г—Б–Ї–Њ—А–µ–љ–Є—П —А–µ–Ј–Њ—А–±—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Ї–Њ—Б—В–Є. –° —Г—З–µ—В–Њ–Љ —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ –Ї–∞–Ї –≤ –≤–∞—А–Є–∞–љ—В–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, —В–∞–Ї –Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є.








–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–∞–љ–љ–Є–Ї–Њ–≤–∞ –Ь.–С., –С–Њ–љ–і–∞—А—О–Ї –Ґ.–Ю., –Т–µ—А—В–Ї–Є–љ –Р.–Ы. –Є –і—А. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ –≤ –Њ–±—Й–µ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ // –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. – 2006. – вДЦ 25. – –°. 1794–1798.
2. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш., –Э–Є–Ї–Є—В–Є–љ—Б–Ї–∞—П –Ю.–Р., –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј – —Б–Њ—Ж–Є–∞–ї—М–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞ XXI –≤–µ–Ї–∞ // –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. – 2007. – вДЦ4. – –°. 315–318.
3. –У–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—П –Њ—В –њ—Г–±–µ—А—В–∞—В–∞ –і–Њ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј—Л / –Я–Њ–і —А–µ–і. –≠.–Ъ. –Р–є–ї–∞–Љ–∞–Ј—П–љ–∞. ––Ь.: –Ь–Х–Ф–њ—А–µ—Б—Б–Є–љ—Д–Њ—А–Љ, 2007. – 495 —Б.
4. –Ч–Њ—В–Ї–Є–љ –Х.–У., –Ъ–Њ—Б—Г–ї—М–љ–Є–Ї–Њ–≤–∞ –Х.–Э. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –Њ—В –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ –Ї –ї–µ—З–µ–љ–Є—О // –Ь–µ–і–ї–∞–є–љ —Н–Ї—Б–њ—А–µ—Б—Б. – 2007. – вДЦ1 (190). – –°. 56–59.
5. –Ъ–Є—И–Ї—Г–љ –Р.–Р. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є. – –Ь.: –У–≠–Ю–Ґ–Р–†––Ь–µ–і–Є–∞, 2007. – 800 —Б.
6. –Ы–µ—Б–љ—П–Ї –Ю.–Ь., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –2––µ –Є–Ј–і., –њ–µ—А–µ—А–∞–±. –Є –і–Њ–њ.– –Ь.: –У–Х–Ю–Ґ–Р–†––Ь–µ–і–Є–∞, 2009.
7. –Э–Њ–≤–Є–Ї–Њ–≤–∞ –Т.–Р., –Р—Г—В–ї–µ–≤–∞ –§.–†., –•–Њ—Б–µ–≤–∞ –Х.–Э. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ // –У–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—П. – 2012. –вДЦ1.– –Ґ. 14. – –°. 4–7.
8. –Ґ–∞—В–∞—А—З—Г–Ї –Ґ.–§. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Ф–∞–љ–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л. –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –Ј–і–Њ—А–Њ–≤—М—П –ґ–µ–љ—Й–Є–љ—Л вДЦ 3/1, –°–њ–µ—Ж–≤—Л–њ—Г—Б–Ї «–Ч–У–Ґ –Є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є—П», 2009.
9. Bolland M.J., Grey A., Avenell A. et al. // BMJ. 2011. Vol. 19. P. 342:d2040. doi: 10.1136/bmj.d2040. Review.
10. Chen Y.H., Wu Y.W., Yang W.S. et al. Relationship between Bone Mineral Density and Serum Osteoprotegerin in Patients with Chronic Heart Failure // PLoS One. 2012. Vol. 7(8):e44242.
11. Cheng M.H., Chen J.F., Fuh J.L. et al. Osteoporosis treatment in postmenopausal women with pre–existing fracture // Taiwan J. Obstet. Gynecol. 2012. Vol. 51(2). P. 153–166.
12. Nikander R., Sievanen H., Heinonen A. et al. Targeted exercise againstosteoporosis: A systematic review and meta–analysis for optimising bone strength throughout life // BMC Med. 2010. Vol. 21. P.8:47. Review.
13. Pereira R.M., Carvalho J.F., Paula A.P. et al. // Rev. Bras. Reumatol. 2012. Vol. 52(4). P. 580–593. English, Portuguese.
14. Walsh G.M. Treatment options for postmenopausal osteoporosis // Ther. Clin. Risk Manag. 2012. Vol. 8. P. 367–368.












