В настоящее время известно около 200 различных генотипов ВПЧ, которые обнаруживают в тканях различных патологических образований организма человека, однако более 40 разновидностей ВПЧ выявляются преимущественно в эпителии аногенитальной области. Известно, что у большинства инфицированных ПВИ протекает бессимптомно в транзиторной форме. При этом
Частота развития цервикальной внутриэпителиальной неоплазии в 10 раз превышает частоту развития аналогичной патологии во влагалище или вульве. Это связано с тем, что зона трансформации шейки матки имеет специфический риск канцерогенности при ПВИ, поскольку ВПЧ тропен к клеткам в состоянии метаплазии [9, 20]. Важно отметить, что ВПЧ эволюционно выработал различные способы «обхода» иммунологического надзора со стороны макроорганизма, при этом в ряде случаев отмечается хроническое рецидивирующее течение инфекции с возможной малигнизацией процесса. Длительная активация экспрессии вирусных онкогенов инициирует многостадийный процесс генетических и эпигенетических нарушений, способствующих опухолевой прогрессии. Доказано, что папилломавирусная инфекция является ведущей причиной рака шейки матки [14, 18].
Как показывают исследования, для развития рака шейки матки, помимо персистенции ВПЧ в интегрированной форме, необходимо наличие кофакторов (наличие онкогенного генотипа, сочетание нескольких генотипов вируса, существенная вирусная нагрузка, курение, длительный прием гормональных препаратов, сопутствующие урогенитальные инфекции, снижение неспецифической резистентности организма, влияние генетических факторов
В диагностике
В настоящее время существует мнение, что диагностика, направленная на прогнозирование патологии шейки матки, должна основываться на цитологическом скрининге, подкрепленном
Подход к ведению больных с ПВИ гениталий и заболеваниями шейки матки в практической работе
Выбор тактики лечения
К сожалению, достичь полного излечения от ПВИ не всегда возможно, в связи с этим общепринятой целью терапии является удаление очага поражения, а не полная элиминация возбудителя, а точнее прекращение выделения его из очагов поражения (учитывая, что методология диагностики заключается в исследовании клеток соскоба, взятого из этих зон) [23]. Это обусловлено тем, что вирус находится не только в аномальном эпителии, но и во внешне здоровых тканях по периферии очага. В связи с этим оптимальным стоит считать комплексное лечение, включающее не только локальное воздействие на патологически измененные ткани, но и неспецифическую противовирусную терапию [1, 10, 18, 20].
Помимо различных методик деструкции арсенал медикаментозных средств лечения может включать в себя антисептики, антибактериальные и противовирусные препараты для ликвидации воспалительного процесса шейки матки и влагалища; гормональные препараты — при сопутствующих нарушениях функции яичников, а также иммуномодуляторы. Известно, что в основе любого хронического
Среди данной группы средств интерес представляет инозина пранобекс (Изопринозин), который является синтетическим производным пурина и обладает иммуномодулирующей активностью и противовирусным действием. Изопринозин оказывает стимулирующее влияние на активность цитотоксических
Инозин пранобекс является одним из наиболее изученных системных иммуномодуляторов, он включен в Европейское руководство по лечению бородавок и кондилом, а также в Российский протокол ведения пациенток с ПВИ. Препарат способствует подавлению репликации ВПЧ в эпителиальных клетках и выведению вируса из организма [10, 16, 19, 21, 28].
По мнению
В условиях многопрофильного медицинского центра г. Нижнего Новгорода было обследовано и пролечено 65 пациенток репродуктивного возраста с патологией шейки матки на фоне ПВИ: эктропионом и эктопией (с обширной зоной трансформации), CIN легкой степени, плоскими кондиломами, гиперкератозом (лейкоплакией) и стойким, клинически выраженным хроническим цервицитом. Они были равномерно распределены на 2 клинические группы. В
Целью исследования стала оценка эффективности лечения различных заболеваний шейки матки на фоне ПВИ у женщин репродуктивного возраста на основе анализа ближайших и отдаленных результатов.
Пациенткам проведено стандартное обследование — диагностика ИППП молекулярными методами,
Процедуры радиоволновой биопсии и аргоноплазменной коагуляции (аблации) проводились на отечественном аппарате «Фотек
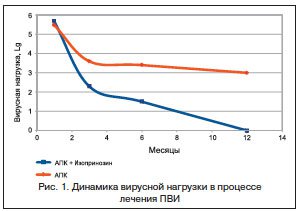
Контрольный осмотр, расширенная кольпоскопия, определение ВПЧ с вирусной нагрузкой проводились через 1,5–2 мес. после операции и далее в динамике через 3–6 и 12 мес. Было установлено, что в группе с комбинированным лечением (АПК и Изопринозин) средняя продолжительность заживления шейки матки после процедуры составила 44±3,2 дня, что сопоставимо со скоростью эпителизации у женщин без ПВИ [11]. В группе контроля в 68,5% случаев имела место вялая замедленная регенерация шеечного эпителия (56±2,4 дня), что, по всей видимости, было обусловлено влиянием активной вирусной инфекции и неадекватной иммунной реакцией тканей. Судя по всему, в подобной ситуации репаративный процесс может замедляться и извращаться, поэтому полноценного разрешения не происходит и нормальная структура тканей не восстанавливается в течение длительного времени.
Через 3 и 6 мес. в
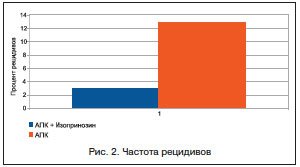
В контрольной группе клиническая эффективность лечения патологии шейки матки с помощью АПК по данным кольпоскопии и цитологии составила 87,1%, при этом прекращение вирусовыделения из очага в течение 3–6 мес. было достигнуто лишь в 61,3% наблюдений. Рецидивы в виде появления
Обсуждая полученные результаты, стоит отметить, что локальная деструкция очагов поражения позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, тогда как в окружающих тканях остаются в латентном состоянии резервуары ВПЧ или других возбудителей, которые могут являться основой для дальнейшего рецидива и персистенции инфекции. Учитывая, что во всех случаях у обследованных нами пациенток в качестве этиологических факторов имели место высокоонкогенные генотипы ВПЧ, длительная стойкая персистенция ПВИ могла быть ассоциирована с высокой вероятностью озлокачествления патологического процесса. В связи с этим есть основания полагать, что адекватная иммунотерапия наряду с аблацией шейки матки способствует полноценной санации инфекционного очага и эпителизации, что закономерно снижает частоту рецидивов и повышает эффективность лечения. Изопринозин прямо и косвенно, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя персистированию вируса, а также влияя на клиническую манифестацию инфекции.
Что касается побочных эффектов в процессе приема Изопринозина, то они наблюдались лишь у 3 из 34 обследованных пациенток, что составило 8,8%. Среди жалоб отмечали тошноту, боли в эпигастрии, кожные аллергические реакции. Однако ни в одном случае побочные эффекты не стали поводом для отмены препарата и самостоятельно нивелировались через несколько дней. В целом отмечена хорошая переносимость Изопринозина, а поскольку серьезные побочные реакции и осложнения не были зарегистрированы, этот факт является отражением высокого профиля безопасности данного иммуномодулятора.
Немаловажен и тот факт, что при использовании технологии АПК не происходит перегрева, дымообразования и обугливания тканей (карбонизации), а отсутствие задымленности способствует хорошей визуализации операционного поля и снижает негативное влияние на врача, производящего процедуру [3, 12, 13].
Таким образом, результаты проведенного исследования свидетельствуют о высокой эффективности и безопасности сочетания аблативного вмешательства с использованием аргоновой плазмы и назначения иммуномодулирующей терапии Изопринозином. При этом в большинстве случаев достигается адекватная деструкция очага, быстрейшее заживление послеоперационной раны, а также существенно снижается вероятность рецидивирования и малигнизации патологического процесса за счет прекращения выделения ВПЧ. Отдельно стоит отметить важность и необходимость соблюдения рекомендованных курсовых дозировок при назначении Изопринозина для полноценной реализации его лечебного эффекта и во избежание дискредитации метода нарушением использования препарата.
Выводы
Проблема ПВИ далека от окончательного разрешения, и многие вопросы составляют предмет проводимых в настоящее время научных работ. Сложности обусловлены значительной распространенностью инфекции, выявлением новых генотипов ВПЧ и существенными различиями в их злокачественной потенции, изменениями напряженности противовирусного иммунитета организма, который, в конечном счете, определяет стабильность излечения или время наступления рецидива. Накопленные сведения о механизме
Перспективные диагностические и
Статья создана при поддержке ООО «Тева»
За дополнительной информацией обращаться:
OOO «Тева» Россия, 119049, Москва,
ул. Шаболовка, д.10 корп. 2
Тел.:+7.495.6442234,
факс: +7.495.6442235
FIRE-ISOgyn-ART-030315-MEDIA-1296-020316
- Андосова Л.Д., Конторщикова К.Н., Качалина Т.С. и др. Папилломавирусная инфекция и заболевания шейки матки. Учебное пособие. Н. Новгород: Изд-во НГМА, 2011. 108 с.
- Бебнева Т.Н., Прилепская В.Н. Профилактика рака шейки матки: скрининг (обзор литературы) // Доктор.Ру. 2009. № 6(50). С. 11–17.
- Белокриницкая Т.Е., Белокриницкая И.А., Белокриницкая Н.И. и др. Оценка эффективности лечения заболеваний шейки матки аргоноплазменной коагуляцией у нерожавших женщин // Матер. междунар. практич. конференции «Профилактика рака шейки матки: взгляд в будущее». М., 2008. С. 8–9.
- Вакцины для профилактики рака шейки матки / Под ред. П.Л. Стерна, Г.С. Китченера; пер.с англ. / Под общ. ред. Г.Т. Сухих, В.Н. Прилепской. – 2-е изд. М.: МЕДпресс-информ, 2011. 192 с.
- Говорун В.М., Шкарупета М.М., Портнова Н.И., Байцур М.В. Папилломавирусная инфекция: пособие для врачей. М., 2009. 55 с.
- Мынбаев О.А., Елисеева М.Ю. Вспомогательная иммунотерапия ВПЧ-ассоциированных поражений кожи и слизистых оболочек (обзор литературы) // Гинекология. 2011. Т. 13(3). С. 32–41.
- Заболевания шейки матки: современные методы диагностики и лечения / Под ред. Т.С. Качалиной. Н. Новгород: изд-во НГМА, 2006. 94 с.
- Клинышкова Т.В., Каратюк Т.И., Турчанинов Д.В. и др. Дифференцированный подход к ведению больных с цервикальной интраэпителиальной неоплазией с позиции прогнозирования // Гинекология. 2009. Т. 13 (4). С. 40–44.
- Ковчур П.И., Бахлаев И.Е. Рак шейки матки: пособие для врачей. – 2-е изд., доп. Петрозаводск: изд-во ПетрГУ, 2011. 160 с.
- Макаров И.О., Шеманаева Т.В., Шешукова Н.А. Опыт применения изопринозина в лечении патологии шейки матки воспалительной этиологии // Consilium Medicum. 2010. Т. 13 (6). С. 16–18.
- Мотовилова Т.М., Качалина О.В., Пономарева И.В. Клинический опыт использования метода аргоноплазменной аблации в лечении патологии шейки матки в репродуктивном возрасте // Трудный пациент. 2013. № 8–9. С. 8–10.
- Никитин Н.Д., Кулавский В.А., Симакова Е.Л. Лечение патологии шейки матки методом аргоноплазменной коагуляции. Сборник научных статей // Широкополосная радиоволновая хирургия в акушерстве и гинекологии. Екатеринбург, 2012. С. 76.
- Оламова А.О., Роговская С.И., Бебнева Т.Н. и др. Лечение доброкачественных заболеваний шейки матки методом радиоволновой аргоноплазменной аблации // Сборник материалов III междисциплинарной научно-практической конференции «Урогенитальные инфекции и репродуктивное здоровье: клинико-лабораторная диагностика и терапия». М., 2010.С. 58.
- Патология шейки матки и генитальные инфекции / Под ред. В.Н. Прилепской. М.: МЕДпресс-информ, 2008. 384 с.
- Петров Р.В., Хаитов М.Р., Андреев С.М. и др. Иммуногенные свойства рекомбинантных и синтетических пептидов ВПЧ // Докл. Биох. биофиз. 2008. Т. 421. С. 185–190.
- Подзолкова Н.М., Роговская С.И., Фадеев И.Е. Папилломавирусная инфекция: что нового? // Гинекология. 2011. Т. 13(5). С. 39–45.
- Полонская Н.Ю., Юрасова И.В., Егорова О.В. Профилактические осмотры и цитологический скрининг шейки матки. М.: Академия, 2008. 80 с.
- Прилепская В.Н., Костава М.Н. Возможности терапии папилломавирусной инфекции // РМЖ. 2009. № 17 (1). С. 16–19.
- Роговская С.И. Актуальные вопросы диагностики и лечения патологии шейки матки. // Медицинские аспекты здоровья женщины. 2012. № 5 (57). С. 5–8.
- Роговская С.И. Папилломавирусная инфекция и патология шейки матки. М.: ГЭОТАР-Медиа, 2009. 198 с.
- Протокол ведения больных с ПВИ шейки матки высокого онкогенного риска // Протоколы ведения больных. Инфекции, передаваемые половым путем. М.: Ньюдиамед, 2011. С. 285–331.
- Семенов Д.М., Занько С.Н., Дмитраченко Т.И. Папилломавирусная инфекция. Санкт-Петербург: Диалект, 2008. 84 с.
- Соловьев А.М. Иммунотерапия изопринозином как адьювантный или самостоятельный способ лечения больных папилломавирусной инфекцией // Вест. дерматол. и венерол. 2011. № 5. С. 146–151.
- Хаитов Р.М., Хаитов М.Р., Шиловский И.П. Интерфероны третьего типа // Успехи современной биологии. 2010. № 2. С.147–153.
- Шкарупета М.М., Портнова Н.И., Байцур М.В. Папилломавирусная инфекция: пособие для врачей / Под ред. В.М. Говоруна. М., 2009. 55 с.
- Brown D. HPV type 6/11/16/18 vaccine: first analysis of cross-protection against persistent infection, cervical intraepithelial neoplasia (CIN), and adenocarcinoma in situ (AIS) caused by oncogenic HPV types in addition to 16/18. The 47th Annual Interscience Conference on Antimicrobial Agents and Chemotherapy. 2007, Sep. 17-20.
- Castellsagu'e X., Diaz M., de Sanjose S. et al. Worldwide human papillomavirus etiology of cervical adenocarcinoma and its cofactors: implications for screening and prevention // J. Natl. Cancer. Inst. 2006. Vol. 98. P. 303–315.
- Georgala S., Katoulis A.C., Befon A. et al. Oral inosiplex in the treatment of cervical condilomata acuminate: a randomized placebo-controlled trial // BJOG. 2006. Vol. 113 (9). P. 1088–1091.
- Mao C., Balasubramanian A., Yu M. et al. Evaluation of a new pl6INK4a ELISA test and a high-risk HPV DNA test for cervical cancer screening: Results from proof-of-concept study // Int. J. Cancer. 2007. Vol. 120. P. 2435–2438.
- Winer R.L., Kiviat N.B., Hughes J.P. et al. Development and duration of human papillomavirus lesions after initial infection // J. Infect. Dis. 2005. Vol.191. P. 731–738.












