–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—А–∞—З–∞–Љ–Є-–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–∞–Љ–Є –Њ–±—Й–µ–њ—А–Є–Ј–љ–∞–љ—Л –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞ –Љ–µ—В–Њ–і–∞ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є –і–ї—П –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П —Б–µ–Љ—М–Є –Є —Г–ї—Г—З—И–µ–љ–Є—П –Ј–і–Њ—А–Њ–≤—М—П –ґ–µ–љ—Й–Є–љ—Л, –њ—А–Њ–і–Њ–ї–ґ–∞—О—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ –Є –≤–љ–µ–і—А–µ–љ–Є–µ –љ–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–Ј–і–∞–≤–∞–µ–Љ—Л—Е –Ї–∞–Ї –њ—Г—В–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –љ–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, —В–∞–Ї –Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ–Њ–Є—Б–Ї–∞ –љ–Њ–≤—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –Є –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. [11, 13].
–†–∞–Ј—А–∞–±–Њ—В–Ї–∞ –њ–µ—А–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ –љ–∞—З–∞–ї–∞—Б—М –≤ –У–µ—А–Љ–∞–љ–Є–Є, –≤ 50-—Е –≥–Њ–і–∞—Е –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Љ–µ–≤—И–Є—Е—Б—П –≤ —В–Њ –≤—А–µ–Љ—П —Б–≤–µ–і–µ–љ–Є–є –Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є–Є –Њ–≤—Г–ї—П—Ж–Є–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –Њ —В–Њ–Љ, —З—В–Њ –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–Љ. –Т 1952 –≥–Њ–і—Г –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –≥–µ—Б—В–∞–≥–µ–љ—Л –Є –≤ –Ї–Њ–љ—Ж–µ –њ—П—В–Є–і–µ—Б—П—В—Л—Е –≥–Њ–і–Њ–≤ –љ–∞—З–∞–ї–Є—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –∞—Б–њ–µ–Ї—В–µ –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –Њ–≤—Г–ї—П—Ж–Є—О –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М. –Т—Б–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л –Љ–Њ–ґ–љ–Њ —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ —З–Є—Б—В–Њ –≥–µ—Б—В–∞–≥–µ–љ–љ—Л–µ –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –≥–µ—Б—В–∞–≥–µ–љ-—Н—Б—В—А–Њ–≥–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ—А–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л (–Ъ–Ю–Ъ) –±–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ—Л, –ї—Г—З—И–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—В –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ—Л–є —Ж–Є–Ї–ї –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–µ—Б—В–∞–≥–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є –њ–Њ—Н—В–Њ–Љ—Г –њ—А–Є–Љ–µ–љ—П—О—В—Б—П —З–∞—Й–µ.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Н—Б—В—А–Њ–≥–µ–љ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –Ъ–Ю–Ъ —П–≤–ї—П–µ—В—Б—П —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї, –∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –≥–µ—Б—В–∞–≥–µ–љ—Л (=–њ—А–Њ–≥–µ—Б—В–∞–≥–µ–љ—Л=–њ—А–Њ–≥–µ—Б—В–Є–љ—Л). –Я–Њ—Н—В–Њ–Љ—Г –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞—Е –њ—А–Є –њ—А–Є–Љ–µ—А–љ–Њ —А–∞–≤–љ—Л—Е –і–Њ–Ј–∞—Е —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞ (20-30 –Љ–Ї–≥/—Б—Г—В) –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, –≤–ї–Є—П–љ–Є–Є –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ, –Ї–Њ–љ—В—А–Њ–ї–µ –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –Є –њ—А. –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≥–µ—Б—В–∞–≥–µ–љ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ. –Т–ї–Є—П–љ–Є–µ –Ъ–Ю–Ъ –љ–∞ –Њ–±–Љ–µ–љ –≤–µ—Й–µ—Б—В–≤ —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Б–ї–Њ–ґ–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Є—Б—В–µ–Љ–∞–Љ–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Я—А–Є —Н—В–Њ–Љ –Љ–љ–Њ–≥–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –њ—А–Њ—В–Є–≤–Њ–љ–∞–њ—А–∞–≤–ї–µ–љ—Л, –∞, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–Є –≤–Ј–∞–Є–Љ–љ–Њ –≤–ї–Є—П—О—В –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –і—А—Г–≥ –і—А—Г–≥–∞. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≥–µ—Б—В–∞–≥–µ–љ—Л —Б–љ–Є–ґ–∞—О—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ —В–Ї–∞–љ—П—Е («down - regulation»), –∞ —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –Є–Ј–Љ–µ–љ—П—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Ж–Є—В–Њ—Е—А–Њ–Љ-–†-450-–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –њ–µ—З–µ–љ–Є, —З—В–Њ —Б–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤—Б–µ—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Я–Њ –і–∞–љ–љ—Л–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ –≥–µ—Б—В–∞–≥–µ–љ—Л –Є–Љ–µ—О—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–Љ –њ–Њ–і–±–Њ—А–µ –і–Њ–Ј —Н—Б—В—А–Њ–≥–µ–љ–љ–Њ–≥–Њ –Є –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ –Ъ–Ю–Ъ —Б —Г—З–µ—В–Њ–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –≥–µ—Б—В–∞–≥–µ–љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б–Њ–Ј–і–∞–љ–Є–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞ —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Є–ї–Є, –љ–∞–њ—А–Њ—В–Є–≤, —В–∞–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Љ–Є–Љ–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–Ј–∞—З–∞—В–Њ—З–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–Њ–≥ –±—Л –Ї–Њ—А—А–Є–≥–Є—А–Њ–≤–∞—В—М —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞.
–С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Є—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ (–≥–µ—Б—В–∞–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В), –∞ —В–∞–Ї–ґ–µ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ–Є (–Њ—Б—В–∞—В–Њ—З–љ—Л–є –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є –Є–ї–Є –љ–∞–Њ–±–Њ—А–Њ—В, –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В), –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ–Є, –Љ–Є–љ–µ—А–∞–ї–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ–Є, –Є–љ–Њ–≥–і–∞ —Н—Б—В—А–Њ–≥–µ–љ–љ—Л–Љ–Є –Є –і—А. —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є. –Т —Ж–µ–ї–Њ–Љ, –≤—Б–µ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –≥–µ—Б—В–∞–≥–µ–љ—Л –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ—Л –Є –Љ–µ–љ–µ–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л (–Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є—А–Њ–і–љ—Л–Љ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–Љ. –Я—А–Є —Н—В–Њ–Љ —А–µ—Ж–µ–њ—В–Њ—А–љ—Л–є –њ—А–Њ—Д–Є–ї—М —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ —А–∞–Ј–ї–Є—З–µ–љ (—Б—А–Њ–і—Б—В–≤–Њ –Ї —В–µ–Љ –Є–ї–Є –Є–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, —Б–Є–ї–∞ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П, —Е–∞—А–∞–Ї—В–µ—А –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П - –∞–Ї—В–Є–≤–∞—Ж–Є—П –Є–ї–Є –±–ї–Њ–Ї–∞–і–∞ —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є –і—А.). –°–ї–µ–і—Г–µ—В –Њ—Б–Њ–±–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ —А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –≥–µ—Б—В–∞–≥–µ–љ–∞, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ in vitro, –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О –Ї–Њ—А—А–µ–ї–Є—А—Г—О—В —Б —А–µ–∞–ї—М–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≥–µ—Б—В–∞–≥–µ–љ–∞ in vivo. –Э–µ—В –њ—А—П–Љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –њ–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—О —Б –≥–µ—Б—В–∞–≥–µ–љ–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є in vitro –Є –і–∞–љ–љ—Л–Љ–Є in vivo –њ–Њ –і–Њ–Ј–∞–Љ, –њ–Њ–і–∞–≤–ї—П—О—Й–Є–Љ –Њ–≤—Г–ї—П—Ж–Є—О (—В–∞–±–ї. 1 –Є 2). –Я–Њ—Н—В–Њ–Љ—Г –і–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ in vitro, –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –і–∞–љ–љ—Л–є –≥–µ—Б—В–∞–≥–µ–љ, –Ї–∞–Ї —Н—В–Њ –Є–љ–Њ–≥–і–∞ –і–µ–ї–∞–µ—В—Б—П (4). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є–≥—А–∞–µ—В —А–Њ–ї—М –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Є –њ–µ—А–≤–Є—З–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤ –њ–µ—З–µ–љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П —Г —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ (—А–Є—Б. 1).



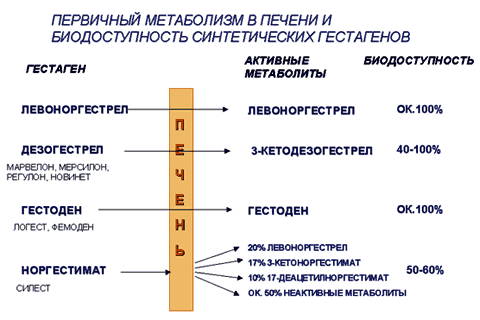
–†–Є—Б.1 –Я–µ—А–≤–Є—З–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤ –њ–µ—З–µ–љ–Є –Є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ - –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е 19-–љ–Њ—А—В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ «—В—А–µ—В—М–µ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П» –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Н—В–Є –≥–µ—Б—В–∞–≥–µ–љ—Л —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є–Љ–µ—О—В –Љ–љ–Њ–≥–Њ –Њ–±—Й–µ–≥–Њ, –∞ —Б –і—А—Г–≥–Њ–є - —А—П–і —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є. –Т –†–Њ—Б—Б–Є–Є –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ—Л –Є –њ–Њ—Н—В–Њ–Љ—Г –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –Є–љ—В–µ—А–µ—Б –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–≤–∞ –≥–µ—Б—В–∞–≥–µ–љ–∞ - –≥–µ—Б—В–Њ–і–µ–љ (–≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –Ъ–Ю–Ъ «–§–µ–Љ–Њ–і–µ–љ», «–Ы–Њ–≥–µ—Б—В») –Є –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї (–≤ —Б–Њ—Б—В–∞–≤–µ –Ъ–Ю–Ъ «–Ь–∞—А–≤–µ–ї–Њ–љ», «–Ь–µ—А—Б–Є–ї–Њ–љ», «–Э–Њ–≤–Є–љ–µ—В», «–†–µ–≥—Г–ї–Њ–љ»).–У–µ—Б—В–Њ–і–µ–љ - –љ–∞–Є–±–Њ–ї–µ–µ —Б–Є–ї—М–љ—Л–є –Є –њ—А–Є —Н—В–Њ–Љ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –≥–µ—Б—В–∞–≥–µ–љ [19, 27]. –У–µ—Б—В–Њ–і–µ–љ —П–≤–ї—П–µ—В—Б—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ, –љ–µ —В—А–µ–±—Г–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є –љ–µ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –њ–µ—А–≤–Є—З–љ–Њ–Љ—Г –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ—Г –≤ –њ–µ—З–µ–љ–Є, –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –µ–≥–Њ –±–ї–Є–Ј–Ї–∞ –Ї 100% (—А–Є—Б. 1). –°–Њ–Ј–і–∞–љ–Є–µ –≥–µ—Б—В–Њ–і–µ–љ–∞ –≤ 1981 –≥. –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –≤ –Ъ–Ю–Ъ –і–Њ —Б–∞–Љ–Њ–є –љ–Є–Ј–Ї–Њ–є –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –≤–µ–ї–Є—З–Є–љ—Л - 75 –Љ–Ї–≥/—Б—Г—В [2, 5, 11].
–Ф–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї —В—А–µ–±—Г–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤ –њ–µ—З–µ–љ–Є (–∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В - 3 –Ї–µ—В–Њ–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї) –Є –Њ–±–ї–∞–і–∞–µ—В –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О (—А–Є—Б.1) [19]. –° —Г—З–µ—В–Њ–Љ —Н—В–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–љ–∞—П –і–Њ–Ј–∞ –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї–∞ –≤ –Љ–Њ–љ–Њ—Д–∞–Ј–љ—Л—Е –Ъ–Ю–Ъ - 150 –Љ–Ї–≥/—Б—Г—В.
–°—Г—Й–µ—Б—В–≤—Г–µ—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є in vitro —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б—В–µ—А–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є [15, 29]. –Т —А–∞–±–Њ—В–µ U. Fuhrmann, E. Slater [15] –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≥–µ—Б—В–Њ–і–µ–љ –Є 3-–Ї–µ—В–Њ–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї –Љ–Њ–≥—Г—В —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ—А–Њ—Б—В–∞—В—Л –Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ —В–Є–Љ—Г—Б–∞ —Б–Є–ї—М–љ–µ–µ, —З–µ–Љ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ (—В–∞–±–ї. 3). –У–µ—Б—В–Њ–і–µ–љ –Є 3-–Ї–µ—В–Њ-–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї –Њ—В–ї–Є—З–∞—О—В—Б—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В—А–Њ–њ–љ–Њ—Б—В–Є –Ї –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ; –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≥–µ—Б—В–Њ–і–µ–љ –Є–Љ–µ–µ—В —Б—Е–Њ–і—Б—В–≤–Њ —Б –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–Љ. –Э–Њ, –Ї–∞–Ї —Г–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, —Б–∞–Љ –њ–Њ —Б–µ–±–µ —Д–∞–Ї—В —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –µ—Й–µ –љ–µ –≥–Њ–≤–Њ—А–Є—В –Њ —В–Њ–Љ, –±—Г–і—Г—В –ї–Є —А–µ—Ж–µ–њ—В–Њ—А—Л –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ—Л –Є–ї–Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ—Л. –Ю —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≥–Њ—А–Љ–Њ–љ–∞ —Б —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –Љ–Њ–ґ–љ–Њ —Б—Г–і–Є—В—М, –Њ—Ж–µ–љ–Є–≤–∞—П –Є–љ–і—Г–Ї—Ж–Є—О —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Ф–Э–Ъ, –Ј–∞–≤–Є—Б—П—Й—Г—О –Њ—В –і–∞–љ–љ–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Є–љ–Є—Ж–Є–Є—А–Њ–≤–∞—В—М —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –≥–µ—Б—В–∞–≥–µ–љ—Л —А–∞—Б–њ–Њ–ї–Њ–ґ–Є–ї–Є—Б—М –≤ –њ–Њ—А—П–і–Ї–µ —Г–±—Л–≤–∞–љ–Є—П —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ: 3-–Ї–µ—В–Њ–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї > –≥–µ—Б—В–Њ–і–µ–љ > –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ (–Ј–∞–Љ–µ—В–Є–Љ, —З—В–Њ, –Є–Љ–µ–љ–љ–Њ —Н—В–Є –і–∞–љ–љ—Л–µ –ї—Г—З—И–µ –Њ—В—А–∞–ґ–∞—О—В –∞–љ–і—А–Њ–≥–µ–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—В–µ—А–Њ–Є–і–Њ–≤, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і–∞–љ–љ—Л—Е –њ–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—О —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є). –Я—А–Є –Њ—Ж–µ–љ–Ї–µ –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –≤ —Ж–µ–ї–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ (–Љ—Л—И–Є) –љ–µ –љ–∞–є–і–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥–µ—Б—В–Њ–і–µ–љ–Њ–Љ –Є –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї–Њ–Љ –≤ –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ–і—А–Њ–≥–µ–љ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ [8]. –•–Њ—В—П —Б–∞–Љ–Є –њ–Њ —Б–µ–±–µ –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї –Є –≥–µ—Б—В–Њ–і–µ–љ –Є–Љ–µ—О—В –љ–µ–±–Њ–ї—М—И—Г—О –Њ—Б—В–∞—В–Њ—З–љ—Г—О –∞–і—А–Њ–≥–µ–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–Њ–Љ –≤ —Б–Њ—Б—В–∞–≤–µ –Ъ–Ю–Ъ in vivo —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В–µ–Љ, —З—В–Њ –Ъ–Ю–Ъ –њ–Њ–і–∞–≤–ї—П—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г –Ы–У, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —Б–Є–љ—В–µ–Ј –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –≤ —П–Є—З–љ–Є–Ї–∞—Е, –Є —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –≤ –њ–µ—З–µ–љ–Є —В—А–∞–љ—Б–њ–Њ—А—В–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –Ї—А–Њ–≤–Є, –њ–µ—А–µ–љ–Њ—Б—П—Й–µ–≥–Њ –њ–Њ–ї–Њ–≤—Л–µ —Б—В–µ—А–Њ–Є–і—Л (–У–°–Я–°). –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–≤–Њ–±–Њ–і–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –≤ –Ї—А–Њ–≤–Є. –Я–Њ —А–∞–Ј–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Ъ–Ю–Ъ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ 20-30 –Љ–Ї–≥ —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞, –≤—Л–Ј—Л–≤–∞—О—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –У–°–Я–° –≤ –Ї—А–Њ–≤–Є –њ—А–Є–Љ–µ—А–љ–Њ –≤ 1,5-3 —А–∞–Ј–∞. –Ч–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –У–°–Я–° –њ—А–Є –њ—А–Є–µ–Љ–µ –Ъ–Ю–Ъ —Б —А–∞–Ј–љ—Л–Љ–Є –≥–µ—Б—В–∞–≥–µ–љ–∞–Љ–Є –љ–µ—В [20, 26].
–Я—А–Є–≤–µ–і–µ–љ–љ—Л–µ —Д–∞–Ї—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Њ—Ж–µ–љ–Ї–∞ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ —Б–∞–Љ–Є—Е –њ–Њ —Б–µ–±–µ –љ–µ –Љ–Њ–ґ–µ—В –і–∞—В—М –њ—А–∞–≤–Є–ї—М–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ–± –∞–љ–і—А–Њ–≥–µ–љ–љ—Л—Е –Є–ї–Є –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤–∞—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –≥–µ—Б—В–∞–≥–µ–љ –Є —Н—Б—В—А–Њ–≥–µ–љ. –Ю—Ж–µ–љ–Є–≤–∞—В—М –Є —Б—А–∞–≤–љ–Є–≤–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е –љ–∞ –±–Њ–ї—М—И–Є—Е, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –°—А–∞–≤–љ–Є–≤–∞—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Ї–Є –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Є –≥–µ—Б—В–Њ–і–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Ъ–Ю–Ъ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –≥–Є–њ–µ—А–∞–љ–і—А–Њ–≥–µ–љ–Є–є, –љ–µ —Б–ї–µ–і—Г–µ—В –Ј–∞–±—Л–≤–∞—В—М, —З—В–Њ –≤ –Є–љ—Б—В—А—Г–Ї—Ж–Є—П—Е –њ–Њ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –љ–µ—В —В–∞–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї–∞–Ї –∞–Ї–љ–µ, –≥–Є—А—Б—Г—В–Є–Ј–Љ, –∞–љ–і—А–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –∞–ї–Њ–њ–µ—Ж–Є—П –Є–ї–Є —Б–µ–±–Њ—А–µ—П. –Ш—Б—В–Є–љ–љ—Л–Љ –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–Њ–Љ —Б –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Ї–Њ—В–Њ—А—Л–є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є, —П–≤–ї—П–µ—В—Б—П —Ж–Є–њ—А–Њ—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В. –Ю–љ –њ—А—П–Љ–Њ –±–ї–Њ–Ї–Є—А—Г–µ—В –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Њ—А–≥–∞–љ–∞—Е-–Љ–Є—И–µ–љ—П—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ –њ—А–Є–µ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ —Ж–Є–њ—А–Њ—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В –Є —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї (–Ф–Є–∞–љ–µ - 35) –Є–љ–≥–Є–±–Є—А—Г–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ–Њ–≤ –≥–Є–њ–Њ—Д–Є–Ј–Њ–Љ –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Г—А–Њ–≤–µ–љ—М –≥–ї–Њ–±—Г–ї–Є–љ–∞, —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ –њ–Њ–ї–Њ–≤—Л–µ —Б—В–µ—А–Њ–Є–і—Л —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–∞–Ї –Њ–±—Й–µ–є, —В–∞–Ї –Є —Б–≤–Њ–±–Њ–і–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Ж–Є–њ—А–Њ—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В–∞ —Б —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–Є–ї—М–љ—Л–Љ –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, —З—В–Њ –љ–∞—И–ї–Њ –Њ—В—А–∞–ґ–µ–љ–Є–µ –≤ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П—Е –њ–Њ –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О - –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є—П —Г –ґ–µ–љ—Й–Є–љ —Б —П–≤–ї–µ–љ–Є—П–Љ–Є –∞–љ–і—А–Њ–≥–µ–љ–Є–Ј–∞—Ж–Є–Є [14].
–†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—П –і—А—Г–≥–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≥–µ—Б—В–Њ–і–µ–љ –Є 3-–Ї–µ—В–Њ-–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї –њ—А–Є–Љ–µ—А–љ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ –∞–Ї—В–Є–≤–Є—А—Г—О—В —А–µ—Ж–µ–њ—В–Њ—А—Л –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ј–∞–Љ–µ—В–љ–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ 3-–Ї–µ—В–Њ-–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї–∞ –Є –≥–µ—Б—В–Њ–і–µ–љ–∞ –Ї –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –Є—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М in viv–Њ, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–∞—П –њ–Њ –Є–љ–≤–Њ–ї—О—Ж–Є–Є —В–Є–Љ—Г—Б–∞ —Г –Ї—А—Л—Б, –±—Л–ї–∞ –њ—А–µ–љ–µ–±—А–µ–ґ–Є–Љ–Њ –Љ–∞–ї–∞ (–≤ 3000 —А–∞–Ј —Б–ї–∞–±–µ–µ –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–∞). –Я–Њ–і–Њ–±–љ–Њ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ—Г, –≥–µ—Б—В–Њ–і–µ–љ –Є–љ–≥–Є–±–Є—А—Г–µ—В –Є–љ–і—Г–Ї—Ж–Є—О –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–Љ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≤ –Ї–ї–µ—В–Ї–∞—Е COS-1, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —З–µ–ї–Њ–≤–µ–Ї–∞, –∞ 3-–Ї–µ—В–Њ-–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–µ–∞–Ї—В–Є–≤–µ–љ [15]. –Я—А–Є —Н—В–Њ–Љ —Б–∞–Љ –≥–µ—Б—В–Њ–і–µ–љ –љ–µ –∞–Ї—В–Є–≤–Є—А—Г–µ—В –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л. –Т —Б—А–Њ–і—Б—В–≤–µ 3-–Ї–µ—В–Њ–і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї–∞ –Є –≥–µ—Б—В–Њ–і–µ–љ–∞ –Ї –≥–µ—Б—В–∞–≥–µ–љ–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ —З–µ–ї–Њ–≤–µ–Ї–∞, –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є –≥—А—Л–Ј—Г–љ–Њ–≤ —Б—Г—Й–µ—Б—В–≤—Г—О—В –≤–Є–і–Њ–≤—Л–µ —А–∞–Ј–ї–Є—З–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–∞–Є–±–Њ–ї—М—И–µ–Љ —Б—Е–Њ–і—Б—В–≤–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –≥–µ—Б—В–Њ–і–µ–љ–∞ –Є–Ј –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е 19-–љ–Њ—А—В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Б –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–Љ. –Э–∞–ї–Є—З–Є–µ —Г –≥–µ—Б—В–Њ–і–µ–љ–∞ –∞–љ—В–Є–Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ–Є—В—М –Љ–µ–љ—М—И—Г—О —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —В–∞–Ї–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –Ї–∞–Ї –љ–∞–њ—А—П–ґ–µ–љ–Є–µ –Љ–Њ–ї–Њ—З–љ—Л—Е –ґ–µ–ї–µ–Ј, –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞–Љ–Є [18].
–Я—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Н—Б—В—А–Њ–≥–µ–љ–∞ –Є –≥–µ—Б—В–∞–≥–µ–љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є—Е –≤–Ј–∞–Є–Љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –і—А—Г–≥ –і—А—Г–≥–∞. –Я–Њ—Н—В–Њ–Љ—Г —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–µ —Б–≤–Њ–є—Б—В–≤ —Н—Б—В—А–Њ–≥–µ–љ–љ–Њ–≥–Њ –Є –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Њ—В–і–µ–ї—М–љ–Њ –љ–µ –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–µ–і—Б–Ї–∞–Ј–∞—В—М —В–Њ—З–љ–Њ —Е–∞—А–∞–Ї—В–µ—А —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤. –Т —З–∞—Б—В–љ–Њ—Б—В–Є –≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞—Е —Е–∞—А–∞–Ї—В–µ—А –≤–ї–Є—П–љ–Є—П –≥–µ—Б—В–∞–≥–µ–љ–∞ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ –Ї–ї–µ—В–Ї–∞—Е-–Љ–Є—И–µ–љ—П—Е –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –Є–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –≥–µ—Б—В–Њ–і–µ–љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –∞–љ—В–Є—Н—Б—В—А–Њ–≥–µ–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –њ–Њ–і–∞–≤–ї—П—П –≥–Є–њ–µ—А–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ –Ї–ї–µ—В–Ї–∞—Е —Н–љ–і–Њ–Љ–µ—В—А–Є—П. –Я—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ (–љ–Њ—А—Н—В–Є—Б—В–µ—А–Њ–љ, –љ–Њ—А—Н—В–Є–љ–Њ–і—А–µ–ї, –љ–Њ—А–≥–µ—Б—В—А–µ–ї, –ї–µ–≤–Њ–љ–Њ—А–≥–µ—Б—В—А–µ–ї, –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї, –≥–µ—Б—В–Њ–і–µ–љ) –Є–Ј–Љ–µ–љ—П—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М a- –Є b-—Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ –Ї—Г–ї—М—В—Г—А–µ –Ї–ї–µ—В–Њ–Ї COS 7 –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –љ–Њ—А—Н—В–Є—Б—В–µ—А–Њ–љ, –љ–Њ—А—Н—В–Є–љ–Њ–і—А–µ–ї –Є –і–µ–Ј–Њ–≥–µ—Б—В—А–µ–ї —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В a-—Н—Б—В—А–Њ–≥–µ–љ–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, –∞ –љ–Њ—А–≥–µ—Б—В—А–µ–ї, –ї–µ–≤–Њ–љ–Њ—А–≥–µ—Б—В—А–µ–ї, –љ–Њ—А—Н—В–Є–љ–Њ–і—А–µ–ї –Є –љ–Њ—А—Н—В–Є—Б—В–µ—А–Њ–љ - –∞–Ї—В–Є–≤–љ–Њ—Б—В—М b-—Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [23]. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –≥–µ—Б—В–∞–≥–µ–љ, –Ї–Њ—В–Њ—А—Л–є –љ–µ –≤–ї–Є—П–ї –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ —Н—В–Є—Е –Ї–ї–µ—В–Ї–∞—Е - –≥–µ—Б—В–Њ–і–µ–љ. –£—З–Є—В—Л–≤–∞—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —Н—Б—В—А–Њ–≥–µ–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Д–∞–Ї—В–Њ—А —А–Є—Б–Ї–∞ —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —Н—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–∞–Є–±–Њ–ї—М—И–µ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≥–µ—Б—В–Њ–і–µ–љ–∞ –≤ –∞—Б–њ–µ–Ї—В–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –≤–ї–Є—П—В—М –љ–∞ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Ї–ї–µ—В–Њ–Ї-–Љ–Є—И–µ–љ–µ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Є–Ј—Г—З–µ–љ–љ—Л–Љ–Є –≥–µ—Б—В–∞–≥–µ–љ–∞–Љ–Є. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –і–∞–љ–љ—Л–µ –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –≥–µ—Б—В–Њ–і–µ–љ–∞ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —А–Њ—Б—В –Ї–ї–µ—В–Њ–Ї —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —З–µ–ї–Њ–≤–µ–Ї–∞ [10].
–Т –Ї–ї–Є–љ–Є–Ї–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤ –і–Њ–ї–ґ–µ–љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—В—М –≤—Л—Б–Њ–Ї—Г—О –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–љ—Г—О –љ–∞–і–µ–ґ–љ–Њ—Б—В—М, —Е–Њ—А–Њ—И–Є–є –Ї–Њ–љ—В—А–Њ–ї—М –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞, –±—Л—В—М —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є. –С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–µ—Б—В–Њ–і–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –і–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е [6, 7, 9, 17, 25, 26, 28]. –Т–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞ –і–Њ 20 –Љ–Ї–≥ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –≥–µ—Б—В–Њ–і–µ–љ–Њ–Љ –љ–µ —Б–љ–Є–ґ–∞–µ—В –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–љ–Њ–є –љ–∞–і–µ–ґ–љ–Њ—Б—В–Є [11]. –С–ї–∞–≥–Њ–і–∞—А—П 100% –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –≥–µ—Б—В–Њ–і–µ–љ –Є–Љ–µ–µ—В —Б—В–∞–±–Є–ї—М–љ—Г—О —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї—Г—О –Ї—А–Є–≤—Г—О, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Е–Њ—А–Њ—И–Є–є –Ї–Њ–љ—В—А–Њ–ї—М –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –і–∞–ґ–µ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј–Њ–є —Н—Б—В—А–Њ–≥–µ–љ–∞. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–∞ –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ «–Љ–∞–ґ—Г—Й–Є—Е» –Є «–њ—А–Њ—А—Л–≤–љ—Л—Е» –Љ–µ–ґ–Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ—Л—Е –Ї—А–Њ–≤—П–љ–Є—Б—В—Л—Е –≤—Л–і–µ–ї–µ–љ–Є–є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ 20 –Љ–Ї–≥ —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б 75 –Љ–Ї–≥ –≥–µ—Б—В–Њ–і–µ–љ–∞.
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≥–µ—Б—В–Њ–і–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –ї–Є–њ–Є–і–Њ–≤, —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –Є —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, –Є–Љ–µ—О—В –Љ–∞–ї–Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б—П—В—Б—П –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є [10, 12, 13, 16, 26].
–Я–Њ–ї–љ—Л–є —Б–њ–Є—Б–Њ–Ї –ї–Є—В–µ—А–∞—В—Г—А—Л –Т—Л –Љ–Њ–ґ–µ—В–µ –љ–∞–є—В–Є –љ–∞ —Б–∞–є—В–µ http://www.rmj.ru
–≠—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї+–≥–µ—Б—В–Њ–і–µ–љ –
–Ы–Њ–≥–µ—Б—В (—В–Њ—А–≥–Њ–≤–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ)
(Schering AG)
1. –С–µ–ї–Њ—Г—Б–Њ–≤ –Ѓ.–С., –Ь–Њ–Є—Б–µ–µ–≤ –Т.–°., –Ы–µ–њ–∞—Е–Є–љ –Т.–Ъ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—П –Є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П. –Ь.. 1997 –≥, 532 —Б.
2. –Ъ—Г–Ј—М–Љ–Є–љ –Р.–Р., –Я—А–Є–ї–µ–њ—Б–Ї–∞—П –Т.–Э., –Ы–µ–і–Є–љ–∞ –Р.–Т. –Ъ–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П. –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї.-1998.-–Ґ.6, вДЦ5. –°. 312-316.
3. C–µ—А–≥–µ–µ–≤ –Я.–Т., –®–Є–Љ–∞–љ–Њ–≤—Б–Ї–Є–є –Э.–Ы., –Я–µ—В—А–Њ–≤ –Т.–Ш. –†–µ—Ж–µ–њ—В–Њ—А—Л —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤., –Ь.1999, 640 —Б.
4. –°–µ—А–Њ–≤ –Т.–Э., –Э–Є–Ї–Є—В–Є–љ –°.–Т. –Э–Њ–≤—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –ї–µ—З–µ–±–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ . –У–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—П, —В.2, вДЦ6, —Б. 180-183.
5. –®–Є–Љ–∞–љ–Њ–≤—Б–Ї–Є–є –Э.–Ы. –Ш–і–µ–∞–ї—М–љ–Њ–µ —Б–Њ—З–µ—В–∞–љ–Є–µ —Б–≤–µ—А—Е–љ–Є–Ј–Ї–Є—Е –і–Њ–Ј —Б—В–µ—А–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –≤ –љ–Њ–≤–Њ–Љ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–љ–Њ–Љ –Љ–Њ–љ–Њ—Д–∞–Ј–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ –Ы–Њ–≥–µ—Б—В–µ. ,–Я–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–µ–Љ—М–Є, 1999, вДЦ 2, —Б.30-32.
6. Archer D.F., Gast V.J. An investigation of ovulation inhibition with a low-dose combined oral contraceptive containing 75 mkg gestodene and 20 mkg ethinylestradiol. Gynecol. Endocrinol.,1998, Vol.12, suppl.4., P.7-12.
7. Bloemenkamp K.W.M., Helmerhorst F.M., Dersjant-Roorda M.D., et al A comparative clinical investigation of two low-dose oral contraceptives containing either 75 mkg gestodene or 150 mkg desogestrel combined with 20 mkg ethinylestradiol: effect on hemostasis, lipid metabolism and carbohydrate metabolism Gynecol.Endocrinol. 1998, Vol.12, P.21-30.
8. Brown T.R., Bullock L., Bardin C.W. In vitro and in vivo binding of the androgen receptor of mouse kidney: correlation with biological activities. Endocrinology, 1979, Vol.105, P.1281-1290 Gynecol.Endocrinol. 1998, vol.12., suppl.4.p.21-30.
9. Bruni V., Croxatto H., De La Cruz J. et al. A comparison of cycle control and effect on well-being of monophasic gestodene-, triphasic gestodene- and monophasic desogestrel-containing oral contraceptives. Gynecol.Endocrinol. 2000, vol.14, P.90-98.
10. Colletta A. A., Wakefield L.M., Howell F.V. et al. THE GROWTH INHIBITION OF HUMAN BREAST CANCER CELLS BY A NOVEL SYNTHETIC PROGESTIN INVOLVES THE INDUCTION OF TRANSFORMING GROWTH FACTOR BETA . J.Clin.Invest., 1991, Vol.87, P.277-283.
11. Dusterberg B., Ellman H., Muller U., Rowe E., Muhe B. : A three-year clinical investigation into efficacy, cycle control and tolerability of a new low-dose monophasic oral contraceptive containing gestodene. Gynecol.Endocrinol 1996. Vol.10.,P.33-39
12. Endricat J., Jaques M., Mayerhofer M, et al. A Twelve-Month Comparative clinical investigation of two low-dose oral contraceptives containing 20 mkg ethinylestradiol/75 mkg gestoden and 20 mkg ethynilestradiol/150 mkg desogestrel, with respect to efficacy, cycle control and tolerance. Contraception. 1995, Vol. 52, P. 229- 35
13. Endricat J., Dustenberg B., Ruebig A. et al. Comparison of efficacy, cycle control, and tolerability of two low-dose oral contraceptives in a multicenter cllinical study. Contraception, 1999, Vol.60, P.269-274.
14. Erkkola R., Hirvonen E., Luikku J. et al. Ovulation inhibitors containing cyproterone acetate or desogestrel in the treatment of hyperandrogenic symtoms. Acta obstet gynecol.Scand. 1990, Vol.69, P.61-65.
15. Fuhrmann U., Slater E.P., Fritzemeier K-H. Characteriazation of the novel progestin gestodene by receptor binding studies and transactivation assays. Contraception, 1995, Vol.51, P.45-52.
16. Gast M.J. , Grabb G. A review of cycle control with a low-dose oral contraceptive containing 75 mkg gestodene and 20 mkg ethinylestradiol . Gynecol.Endocrinol.,1998,vol.12, suppl.4.p.31-37.
17. Hammond G.L., Bocchinfuso W.P., Orava M., Smith C.L., van den End Enk A. Serum distribution of two contraceptive progestins: 3-ketodesogestrel and gestodene. Contraception, 1994, 1994, Vol.50, P.301-318.
18. Kirkman R.J.E., Clinical comparison of two low dose oral contraceptives in women older than 30 years . Adv. Contracept. 1991, Vol.7, Suppl.2, P.63-76.
19. Kuhl H. Comparative pharmacology of newer progestogens. Drugs.1996, Vol.51, P.189-215.
20. Mango DF., Ricci S., Manna P., et al. Clinical and hormonal effects of ethinylestradiol combined with with gestodene and desogestrel in young women with acne vulgaris. Contraception, 1996, Vol. 53, P.163-170.
21. Paoletti A.M., Orru M, Floris S. et al. Evidence that treatment with monophasic oral contraceptive formulations containing ethinylestradiol plus gestoden reduces bone resorption in young women. Contraception, 2000, Vol.61., P.259-263.
22. Pasqualini J.R. Progestins: presents and future. J Steroid Biochem Molec Biol., 1996, Vol.59, P.357-363
23. Rabe T., Bohlmann M.K., Rehberger-Schneider S., Prifti S. Induction of estrogen receptor-( and -( acyivities by synthetic progestins. Gynecol.Endocrinol., 2000, Vol.14, P.118-126.
24. Rosenberg M.J., Waugh M.S., Higgins J.E. The effect of desogestrel, gestodene, and other factots on spotting and bleeding. Contraception. 1996, Vol.53, P.85-89.
25. Schnidler A.E. Role of progestins in the premenopausal climacteric. Gynecol.Endocrinol., 1999, Vol.13, (Supp; 6), P.35-40.
26. Short M., Endrikat J.in: Lopes P & Killick S R (eds.), The new option in low-dose oral contraception - Expanding the gestodene choice, New York/London: Parthenon 1996 (pp 37-47), Proceedings of a Symposium held at the 15th World Congress on Fertility and Sterility, Montpellier, France, September 1995.
27. Tyrer L. Introduction of the pill and its impact. Contraception, 1999, Vol.59, suppl.59., P.11S-16S.
28. Van Heusden A.M., Fauser B.C.J.M., Spielmann D. A comparative clinical investigation of endocrine parameters with two low-dose oral contraceptives containing either 75 mcg gestodene or 150 mcg desogestrel combined with 20 mcg ethinylestradiol. Ginecol.Endocrinol.,1998,vol.12,,suppl.4., p.13-19.
29. K.Pollow.,M.Juchem .Gestodene: a novel synthetic progestin- characterization of binding to receptor and serum proteins. Contraception.,1989,vol40,No3












