 –Ф–ї—П —Ж–Є—В–Є—А–Њ–≤–∞–љ–Є—П. –Ч–∞—А–Њ—З–µ–љ—Ж–µ–≤–∞ –Э.–Т., –Ы–Њ–≥—Г—В–Њ–≤–∞ –Ы.–°., –Ф–ґ–Є–і–ґ–Є—Е–Є—П –Ы.–Ъ. –Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ—Л–Љ–Є –Є–љ—В—А–∞—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–Љ–Є –љ–µ–Њ–њ–ї–∞–Ј–Є—П–Љ–Є –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є // –†–Ь–Ц. 2016. No 5. –°. 305вАУ311.
–Ф–ї—П —Ж–Є—В–Є—А–Њ–≤–∞–љ–Є—П. –Ч–∞—А–Њ—З–µ–љ—Ж–µ–≤–∞ –Э.–Т., –Ы–Њ–≥—Г—В–Њ–≤–∞ –Ы.–°., –Ф–ґ–Є–і–ґ–Є—Е–Є—П –Ы.–Ъ. –Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ—Л–Љ–Є –Є–љ—В—А–∞—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–Љ–Є –љ–µ–Њ–њ–ї–∞–Ј–Є—П–Љ–Є –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є // –†–Ь–Ц. 2016. No 5. –°. 305вАУ311.
–Т –†–Њ—Б—Б–Є–Є –†–®–Ь –Ј–∞–љ–Є–Љ–∞–µ—В 2-–µ –Љ–µ—Б—В–Њ –њ–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Б—А–µ–і–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є —Г –ґ–µ–љ—Й–Є–љ –і–Њ 45 –ї–µ—В –Є 1-–µ вАУ –њ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –њ–Њ—В–µ—А—П–љ–љ—Л—Е –ї–µ—В –ґ–Є–Ј–љ–Є. –Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –Њ–±–Њ–Ј–љ–∞—З–Є–ї—Б—П —А–Њ—Б—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –†–®–Ь —Г –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ 29 –ї–µ—В. –Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 12 –ї–µ—В –≤ –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–є –Њ–±–ї–∞—Б—В–Є (–Ь–Ю) –љ–∞–±–ї—О–і–∞–µ—В—Б—П —А–Њ—Б—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –†–®–Ь —Б 7,9 –і–Њ 21,1 –љ–∞ 100 —В—Л—Б. –ґ–µ–љ—Б–Ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П. –Т 2014 –≥. –≤ –Ь–Ю –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ 799 —Б–ї—Г—З–∞–µ–≤ –†–®–Ь. –°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ 12,3% –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е –ґ–µ–љ—Й–Є–љ —Г–Љ–µ—А–ї–Є –Њ—В –†–®–Ь –љ–∞ 1-–Љ –≥–Њ–і—Г –љ–∞–±–ї—О–і–µ–љ–Є—П. –°–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –†–®–Ь –≤ –Ь–Ю, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —В–∞–Ї–ґ–µ –≤—Л—А–Њ—Б–ї–∞, –≤ 2007 –≥. –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 4,7 –љ–∞ 100 —В—Л—Б. –ґ–µ–љ—Й–Є–љ, –∞ –≤ 2014 –≥. вАУ —Г–ґ–µ 7,3.
–Ъ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є–Љ –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–Љ—Г –†–®–Ь, –Њ—В–љ–Њ—Б—П—В –і–Є—Б–њ–ї–∞–Ј–Є–Є —Н–њ–Є—В–µ–ї–Є—П –Є–ї–Є —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ—Л–µ –Є–љ—В—А–∞—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –љ–µ–Њ–њ–ї–∞–Ј–Є–Є (CIN). –Ю–љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Ї–∞–Љ–±–Є–∞–ї—М–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є—Е –∞—В–Є–њ–Є–Є, —Г—В—А–∞—В–Њ–є –њ–Њ–ї—П—А–љ–Њ—Б—В–Є –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –≥–Є—Б—В–Њ—Б—В—А—Г–Ї—В—Г—А—Л [1вАУ3].
–Я–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –Т–Ю–Ч, ¬Ђ–і–Є—Б–њ–ї–∞–Ј–Є—П вАУ —Н—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —З–∞—Б—В—М —В–Њ–ї—Й–Є —Н–њ–Є—В–µ–ї–Є—П –Ј–∞–Љ–µ—Й–µ–љ–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є —Б —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –∞—В–Є–њ–Є–Є, —Г—В—А–∞—В–Њ–є —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Є –њ–Њ–ї—П—А–љ–Њ—Б—В–Є –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б—В—А–Њ–Љ—Л¬ї.
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –≤ –Љ–Є—А–µ CIN I —Б—В–µ–њ–µ–љ–Є, –њ–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 30 –Љ–ї–љ —Б–ї—Г—З–∞–µ–≤, –∞ CIN IIвАУIII —Б—В–µ–њ–µ–љ–Є вАУ 10 –Љ–ї–љ [4, 5]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г—О—В CIN II —Б—В–µ–њ–µ–љ–Є, —З–∞—Б—В–Њ—В–∞ –њ–µ—А–µ—Е–Њ–і–∞ CIN –≤ –Ї–∞—А—Ж–Є–љ–Њ–Љ—Г in situ (CIS) –≤–∞—А—М–Є—А—Г–µ—В –Њ—В 40 –і–Њ 64%.
–Т 2008 –≥. –У. –¶—Г—А –•–∞—Г–Ј–µ–љ—Г –Є–Ј –Э–µ–Љ–µ—Ж–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–∞–Ї–∞ –≤ –У–µ–є–і–µ–ї—М–±–µ—А–≥–µ –Э–Њ–±–µ–ї–µ–≤—Б–Ї–Є–є –Ї–Њ–Љ–Є—В–µ—В –њ—А–Є—Б—Г–і–Є–ї –њ—А–µ–Љ–Є—О –њ–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –Є –Љ–µ–і–Є—Ж–Є–љ–µ –Ј–∞ –Њ—В–Ї—А—Л—В–Є–µ –≤–Є—А—Г—Б–Њ–≤ –њ–∞–њ–Є–ї–ї–Њ–Љ—Л —З–µ–ї–Њ–≤–µ–Ї–∞ (–Т–Я–І), –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –†–®–Ь [6вАУ9]. –Ю–і–љ–∞–Ї–Њ –≤–њ–µ—А–≤—Л–µ —В–µ–Њ—А–Є—О –Њ —А–Њ–ї–Є –≤–Є—А—Г—Б–Њ–≤ –≤ –њ–Њ—П–≤–ї–µ–љ–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ —А–Њ—Б—В–∞ –Є–Ј–ї–Њ–ґ–Є–ї —А–Њ—Б—Б–Є–є—Б–Ї–Є–є —Г—З–µ–љ—Л–є –Ы.–Р. –Ч–Є–ї—М–±–µ—А –≤ 1935 –≥. [5, 10].
–Я–∞–њ–Є–ї–ї–Њ–Љ–∞–≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П
–Я–∞–њ–Є–ї–ї–Њ–Љ–∞–≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П (–Я–Т–Ш) —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј —Б–∞–Љ—Л—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є, –њ–µ—А–µ–і–∞—О—Й–Є—Е—Б—П –њ–Њ–ї–Њ–≤—Л–Љ –њ—Г—В–µ–Љ, —Б–њ–Њ—Б–Њ–±–љ–Њ–є –≤—Л–Ј—Л–≤–∞—В—М: —А–∞–Ї –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, —В–∞–Ї–Є–µ –µ–≥–Њ –≤–Є–і—Л, –Ї–∞–Ї –њ–ї–Њ—Б–Ї–Њ–Ї–ї–µ—В–Њ—З–љ—Л–є –†–®–Ь, –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ–∞ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є, —А–∞–Ї –≤—Г–ї—М–≤—Л –Є –≤–ї–∞–≥–∞–ї–Є—Й–∞, –њ–Њ–ї–Њ–≤–Њ–≥–Њ —З–ї–µ–љ–∞ –Є –∞–љ—Г—Б–∞; —А–∞–Ї –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є, –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л–µ –Ї–Њ–љ–і–Є–ї–Њ–Љ—Л, –∞ —В–∞–Ї–ґ–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–є –њ–∞–њ–Є–ї–ї–Њ–Љ–∞—В–Њ–Ј –≥–Њ—А—В–∞–љ–Є.
–Ъ–∞–ґ–і—Л–є –≥–Њ–і –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В—М –Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Я–Т–Ш –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В—Б—П –Є, –њ–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч, —Б–Њ—Б—В–∞–≤–ї—П—О—В –Њ–Ї–Њ–ї–Њ 2,5вАУ3,0 –Љ–ї–љ —Б–ї—Г—З–∞–µ–≤. –С–Њ–ї–µ–µ 660 –Љ–ї–љ –ї—О–і–µ–є –љ–∞ –њ–ї–∞–љ–µ—В–µ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –Т–Я–І [3].
–Ш–Ј–≤–µ—Б—В–љ–Њ –Њ–Ї–Њ–ї–Њ 200 —В–Є–њ–Њ–≤ –Т–Я–І. –°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Љ–µ–і–Є—Ж–Є–љ–∞ –Њ–њ–Є—Б—Л–≤–∞–µ—В –±–Њ–ї–µ–µ 70 —А–∞–Ј–љ–Њ–≤–Є–і–љ–Њ—Б—В–µ–є –Т–Я–І, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Њ–ґ–Є –Є–ї–Є —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї —Г —З–µ–ї–Њ–≤–µ–Ї–∞. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є –Њ–љ–Ї–Њ–≥–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –Т–Я–І –і–µ–ї—П—В—Б—П –љ–∞ –≥—А—Г–њ–њ—Л:
вАУ –љ–Є–Ј–Ї–Њ–≥–Њ –Њ–љ–Ї–Њ–≥–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (6, 11, 42, 43, 44 –Є –і—А.);
вАУ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Њ–љ–Ї–Њ–≥–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (16, 18, 31, 33, 35, 39, 45, 48, 51, 52, 58, 56, 59, 68).
–°—А–µ–і–Є –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –†–®–Ь 70вАУ80% —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ–ї–Њ—Б–Ї–Њ–Ї–ї–µ—В–Њ—З–љ—Л–є —А–∞–Ї, –∞ 10вАУ25% вАУ –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ–∞. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –≥–µ–љ–Њ—В–Є–њ—Л –Т–Я–І –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –†–®–Ь вАУ 16, 18, 45, 31 –Є 33.
–Р–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј –ґ–µ–ї–µ–Ј–Є—Б—В–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї—Б–∞ [11, 12], –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П —Г 30% –ґ–µ–љ—Й–Є–љ –Љ–Њ–ї–Њ–ґ–µ 35 –ї–µ—В –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–ї–Њ–ґ–љ–Њ—Б—В—М—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –±–Њ–ї—М—И–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–љ–љ–µ–≥–Њ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є—П [13, 14]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –Є–Ј—Г—З–µ–љ–Є—О –†–®–Ь (IBSCC) –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Т–Я–І, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ 16-–≥–Њ –Є 18-–≥–Њ —В–Є–њ–Њ–≤, —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ 97% –Њ–±—А–∞–Ј—Ж–Њ–≤ –†–®–Ь.
–Т–Я–І –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ–Њ–і–≥—А—Г–њ–њ–µ –Р —Б–µ–Љ–µ–є—Б—В–≤–∞ Papoviridae, –њ–Њ—А–∞–ґ–∞—О—Й–µ–є —З–µ–ї–Њ–≤–µ–Ї–∞, –Ї—А—Г–њ–љ—Л–є —А–Њ–≥–∞—В—Л–є —Б–Ї–Њ—В –Є –њ—В–Є—Ж. –Ь–µ–ї–Ї–Є–є –Ф–Э–Ъ-—Б–Њ–і–µ—А–ґ–∞—Й–Є–є –≤–Є—А—Г—Б, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В—Л –Ї–Њ–ґ–Є, —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї –≥–µ–љ–Є—В–∞–ї–Є–є –Є –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–Њ–≤ (–≥–Њ—А—В–∞–љ—М, –±—А–Њ–љ—Е–Є, —А–Њ—В–Њ–≤–∞—П –њ–Њ–ї–Њ—Б—В—М, –≥–ї–∞–Ј–∞), –љ–µ –Є–Љ–µ–µ—В –≤–љ–µ—И–љ–µ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –У–µ–љ–Њ–Љ –≤–Є—А—Г—Б–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –і–≤—Г—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ї–Њ–ї—М—Ж–µ–≤–Є–і–љ–Њ —Б–Ї—А—Г—З–µ–љ–љ–Њ–є –Ф–Э–Ъ. –Т –њ—А–Њ—Ж–µ—Б—Б–µ —А–µ–њ–ї–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –Њ–љ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В –Њ—В 8 –і–Њ 10 –±–µ–ї–Ї–Њ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤. –†–∞–љ–љ–Є–µ –±–µ–ї–Ї–Є –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—В —А–µ–њ–ї–Є–Ї–∞—Ж–Є—О, —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –Є –Ї–ї–µ—В–Њ—З–љ—Г—О —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—О, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Ј–∞ –Њ–љ–Ї–Њ–≥–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤–Є—А—Г—Б–∞ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Њ–љ–Ї–Њ–±–µ–ї–Ї–Є –Х-6 –Є –Х-7. –Я—Г—В—М —А–∞–Ј–≤–Є—В–Є—П –Т–Я–І –≤ —И–µ–є–Ї–µ –Љ–∞—В–Ї–Є –њ–Њ–Ї–∞–Ј–∞–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1 [15].
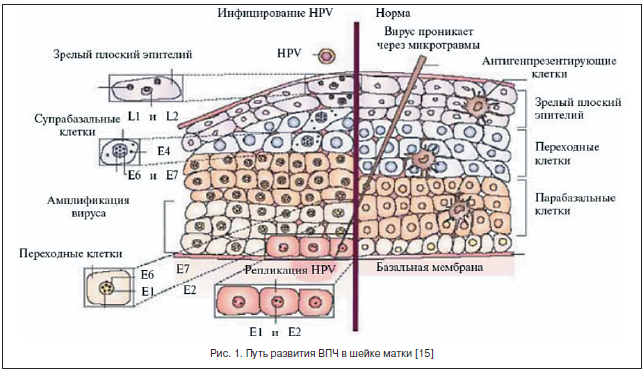
–Я–Њ–Ј–і–љ–Є–µ –≥–µ–љ—Л –Ї–Њ–і–Є—А—Г—О—В —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –±–µ–ї–Ї–Є –≤–Є—А–Є–Њ–љ–∞. –У–µ–љ—Л –Х-6 –Є –Х-7 –≤—Б–µ–≥–і–∞ –≤—Л—П–≤–ї—П—О—В—Б—П –≤ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Т–Я–І, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і—А—Г–≥–Є–µ —Д—А–∞–≥–Љ–µ–љ—В—Л –≤–Є—А—Г—Б–љ–Њ–≥–Њ –≥–µ–љ–Њ–Љ–∞ –Љ–Њ–≥—Г—В –±—Л—В—М —Г—В–µ—А—П–љ—Л –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –µ–≥–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ.
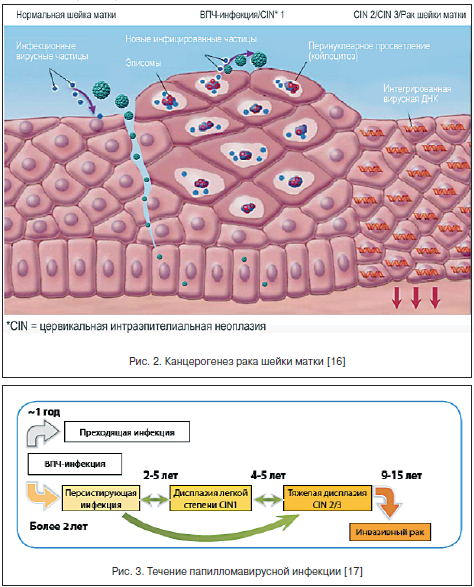
–Т–Я–І –Є–љ—Д–Є—Ж–Є—А—Г–µ—В –њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є–µ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П —Н–њ–Є—В–µ–ї–Є—П –Є –Њ—В–ї–Є—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —В—А–Њ–њ–Є–Ј–Љ–Њ–Љ –Є–Љ–µ–љ–љ–Њ –Ї —Н—В–Њ–Љ—Г —В–Є–њ—Г –Ї–ї–µ—В–Њ–Ї. –Ш–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –Љ–љ–Њ–≥–Њ—Б–ї–Њ–є–љ–Њ–≥–Њ –њ–ї–Њ—Б–Ї–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —З–µ—А–µ–Ј –Љ–Є–Ї—А–Њ–њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П (–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –Є –і—А.), –Ї–Њ–≥–і–∞ –≥–ї—Г–±–Є–љ–∞ –Є—Е –і–Њ—Б—В–Є–≥–∞–µ—В –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П, –≥–і–µ –Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Н–њ–Є—Б–Њ–Љ–∞–ї—М–љ—Л–є –≤–Є—А—Г—Б–љ—Л–є –≥–µ–љ–Њ–Љ (—А–Є—Б. 2). –Я—А–Є —Н—В–Њ–Љ —А–µ–њ–ї–Є–Ї–∞—Ж–Є—П –Ф–Э–Ъ –Т–Я–І –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —В–Њ–ї—М–Ї–Њ –≤ –Ї–ї–µ—В–Ї–∞—Е –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П, —Н—В–Є –Ї–ї–µ—В–Ї–Є —П–≤–ї—П—О—В—Б—П –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –∞ –≤ –Ї–ї–µ—В–Ї–∞—Е –і—А—Г–≥–Є—Е —Б–ї–Њ–µ–≤ –≤–Є—А—Г—Б–љ—Л–µ —З–∞—Б—В–Є—Ж—Л –ї–Є—И—М –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—В.
–Я–∞–њ–Є–ї–ї–Њ–Љ–∞—В–Њ–Ј–љ—Л–µ —А–∞–Ј—А–∞—Б—В–∞–љ–Є—П —Д–Њ—А–Љ–Є—А—Г—О—В—Б—П –≤ —А–Њ–≥–Њ–≤–Њ–Љ —Б–ї–Њ–µ –≤ –ї–Њ–Ї—Г—Б–∞—Е –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є —А–µ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤–Є—А—Г—Б–∞ (—А–Є—Б. 3). –Т –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –≤–Є—А—Г—Б–љ—Л–є –≥–µ–љ–Њ–Љ –Љ–Њ–ґ–µ—В —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞—В—М –≤ 2-—Е —Д–Њ—А–Љ–∞—Е: —Н–њ–Є—Б–Њ–Љ–∞–ї—М–љ–Њ–є (–≤–љ–µ —Е—А–Њ–Љ–Њ—Б–Њ–Љ) –Є –Є–љ—В–µ–≥—А–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤ –Ї–ї–µ—В–Њ—З–љ—Л–є –≥–µ–љ–Њ–Љ [16, 17].
–†–µ–њ–ї–Є–Ї–∞—Ж–Є—П –Ф–Э–Ъ –≤–Є—А—Г—Б–∞ –Є —Б–Є–љ—В–µ–Ј —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–µ–є –Ї–∞–њ—Б–Є–і–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є–Ј–Љ–µ–љ—П—О—В –Ї–ї–µ—В–Њ—З–љ—Л–є —Ж–Є–Ї–ї –Є –њ—А–Є–≤–Њ–і—П—В –Ї –Ї–ї–µ—В–Њ—З–љ–Њ–є –∞—В–Є–њ–Є–Є, —З—В–Њ –Ј–∞–љ–Є–Љ–∞–µ—В –Њ—В 1 –і–Њ 3-—Е –ї–µ—В.
–Я–Њ–Ї–∞ –≤–Є—А—Г—Б –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —Н–њ–Є—Б–Њ–Љ–∞–ї—М–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, –љ–∞–±–ї—О–і–∞—О—В—Б—П –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л. –Я–Њ—Б–ї–µ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П –Т–Я–І –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –љ–∞—А—Г—И–∞–µ—В—Б—П –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –Ї–ї–µ—В–Ї–∞—Е —И–Є–њ–Њ–≤–∞—В–Њ–≥–Њ —Б–ї–Њ—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ї–ї–Њ–љ–∞–ї—М–љ–∞—П —Н–Ї—Б–њ–∞–љ—Б–Є—П –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Т–Я–І-–Ї–ї–µ—В–Њ–Ї –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П, –њ—А–Њ—И–µ–і—И–Є—Е —В–Њ–ї—М–Ї–Њ –њ–µ—А–≤–Є—З–љ—Г—О —Б—В–∞–і–Є—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є. –≠—В–∞ –Ї–ї–Њ–љ–∞–ї—М–љ–∞—П —Н–Ї—Б–њ–∞–љ—Б–Є—П —Б–≤—П–Ј–∞–љ–∞ —Б –Є—Е —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–µ–є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Љ–∞–ї–Є–≥–љ–Є–Ј–∞—Ж–Є–µ–є. –Т —Б—В–∞–і–Є–Є —А–∞–Ј–≤–Є—В–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б–Є–љ—В–µ–Ј –≤–Є—А—Г—Б–љ–Њ–є –Ф–Э–Ъ –≤ –Ї–ї–µ—В–Ї–∞—Е —И–Є–њ–Њ–≤–∞—В–Њ–≥–Њ —Б–ї–Њ—П –њ—А–Є –њ–µ—А–µ—Е–Њ–і–µ –≤ –Ј–µ—А–љ–Є—Б—В—Л–є —Б–ї–Њ–є. –Я—А–Є—З–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –њ–Њ–Ј–і–љ–Є—Е –≥–µ–љ–Њ–≤ L1 –Є L2 –љ–∞ —Н—В–Њ–Љ —Н—В–∞–њ–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –Ю–љ–∞ –љ–∞—Б—В—Г–њ–∞–µ—В —В–Њ–ї—М–Ї–Њ –љ–∞ –Ї–Њ–љ–µ—З–љ–Њ–є —Б—В–∞–і–Є–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є, –≥–і–µ –Є –љ–∞–±–ї—О–і–∞—О—В—Б—П –∞–Ї—В–Є–≤–љ–∞—П —Б–±–Њ—А–Ї–∞ –Ј—А–µ–ї—Л—Е –≤–Є—А—Г—Б–љ—Л—Е —З–∞—Б—В–Є—Ж, –Є—Е –≤—Л–і–µ–ї–µ–љ–Є–µ –Є–Ј –Ї–ї–µ—В–Њ–Ї –Є –њ–Њ—З–Ї–Њ–≤–∞–љ–Є–µ –њ—А—П–Љ–Њ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –њ—А–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Ї–Њ–љ–і–Є–ї–Њ–Љ. –Ш–Љ–µ–љ–љ–Њ —Н—В–Є —Г—З–∞—Б—В–Ї–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ –Њ–њ–∞—Б–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–Њ–љ—В–∞–Ї—В–љ–Њ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П.
–Ю–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Є–µ –∞–≤—В–Њ—А—Л –њ—А–Є—Е–Њ–і—П—В –Ї –≤—Л–≤–Њ–і—Г, —З—В–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Т–Я–І вАУ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ, –љ–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ —Б–Њ–±—Л—В–Є–µ –і–ї—П —А–∞–Ї–Њ–≤–Њ–≥–Њ –њ–µ—А–µ—А–Њ–ґ–і–µ–љ–Є—П. –Ф–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ–є –љ–µ–Њ–њ–ї–∞–Ј–Є–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л:
вАУ –∞–Ї—В–Є–≤–љ–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –≥–µ–љ–Њ–≤ –Х-6 –Є –Х-7 –≤–Є—А—Г—Б–∞;
вАУ –Є–љ–і—Г–Ї—Ж–Є—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Ї–Њ–љ–≤–µ—А—Б–Є–Є —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤ 16,2-–≥–Є–і—А–Њ–Ї—Б–Є—Б—В–µ—А–Њ–љ (16,2-–Ю–Э);
вАУ –Є–љ–і—Г–Ї—Ж–Є—П –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є —Е—А–Њ–Љ–Њ—Б–Њ–Љ–љ–Њ–є –Ф–Э–Ъ –≤ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–ї–µ—В–Ї–µ, –Ї–Њ—В–Њ—А–∞—П –Ј–∞–≤–µ—А—И–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б –њ–µ—А–µ—А–Њ–ґ–і–µ–љ–Є—П.
–Ъ—А–∞–є–љ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–∞ —Б–Њ—З–µ—В–∞–љ–љ–∞—П –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є—П –Т–Я–І —Б –≤–Є—А—Г—Б–Њ–Љ –њ—А–Њ—Б—В–Њ–≥–Њ –≥–µ—А–њ–µ—Б–∞ 2-–≥–Њ —В–Є–њ–∞, —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б–Њ–Љ, –≤–Є—А—Г—Б–Њ–Љ –≠–њ—И—В–µ–є–љ–∞ вАУ –С–∞—А—А, –≤–Є—А—Г—Б–Њ–Љ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, —Е–ї–∞–Љ–Є–і–Є—П–Љ–Є –Є –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–∞–Љ–Є.
–†–∞–Ј–≤–Є—В–Є–µ –†–®–Ь вАУ –љ–µ –Љ–Њ–ї–љ–Є–µ–љ–Њ—Б–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –Њ–љ –Ј–∞–љ–Є–Љ–∞–µ—В 10вАУ15 –ї–µ—В. –Ш–Ј –≤—Б–µ—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –†–®–Ь –Њ–≥—А–Њ–Љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –≤–Њ–Ј—А–∞—Б—В —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–≥–Њ –і–µ–±—О—В–∞. –Я–Њ –і–∞–љ–љ—Л–Љ D.R. Brown et al. (2005) [18], —А–∞–љ–љ–µ–µ –љ–∞—З–∞–ї–Њ –њ–Њ–ї–Њ–≤–Њ–є –ґ–Є–Ј–љ–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Т–Я–І-–Є–љ—Д–µ–Ї—Ж–Є–µ–є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –†–®–Ь –≤ 22 —А–∞–Ј–∞. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є F.X. Bosh et al. (2006) [19], 13% –ґ–µ–љ—Й–Є–љ —Б –†–®–Ь –љ–∞—З–∞–ї–Є –њ–Њ–ї–Њ–≤—Г—О –ґ–Є–Ј–љ—М —А–∞–љ–µ–µ 14 –ї–µ—В –њ—А–Њ—В–Є–≤ 3,5% –ґ–µ–љ—Й–Є–љ —Б –†–®–Ь, –Є–Љ–µ–≤—И–Є—Е –Ї–Њ–Є—В–∞—А—Е–µ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 20 –ї–µ—В.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ —З—В–Њ –ї–Є—Ж–∞ 15вАУ19 –ї–µ—В —Б–Њ—Б—В–∞–≤–ї—П—О—В –ї–Є—И—М 25% —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П, –±–Њ–ї–µ–µ 50% —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ-—В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ —В. —З. –Т–Я–І, –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Є–Љ–µ–љ–љ–Њ –≤ —Н—В–Њ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ. –Т–Я–І-–Є–љ—Д–µ–Ї—Ж–Є—П —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б—А–µ–і–Є –ї–Є—Ж 15вАУ19 –ї–µ—В —Б –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є —З–∞—Б—В–Њ—В–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П 17% –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ –Є 35,7% вАУ –≤ —В–µ—З–µ–љ–Є–µ 3-—Е –ї–µ—В —Б –Љ–Њ–Љ–µ–љ—В–∞ –Ї–Њ–Є—В–∞—А—Е–µ.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–Ј—Г—З–µ–љ–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Т–Я–І-–Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є. –£ –ї–Є—Ж –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ—В 13 –і–Њ 21 –≥–Њ–і–∞ —З–∞—Б—В–Њ—В–∞ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П —А–∞–≤–љ–∞ 38,2%, –њ—А–Є—З–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–Є 13вАУ18 –ї–µ—В –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –≤ 2 —А–∞–Ј–∞ —З–∞—Й–µ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –Т–Я–І, —З–µ–Љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 19вАУ21 –≥–Њ–і–∞ [20].
–Я—Г—В–Є –њ–µ—А–µ–і–∞—З–Є –Є –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П –Т–Я–І
1. –Я–Њ–ї–Њ–≤–Њ–є –њ—Г—В—М. –Ш–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –Т–Я–І –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Є –≥–µ–љ–Є—В–∞–ї—М–љ–Њ- –≥–µ–љ–Є—В–∞–ї—М–љ–Њ–Љ –њ–Њ–ї–Њ–≤–Њ–Љ –∞–Ї—В–µ, –Љ–∞–љ—Г–∞–ї—М–љ–Њ-–≥–µ–љ–Є—В–∞–ї—М–љ–Њ–Љ –Є –Њ—А–∞–ї—М–љ–Њ-–≥–µ–љ–Є—В–∞–ї—М–љ–Њ–Љ –Ї–Њ–љ—В–∞–Ї—В–∞—Е.
2. –Т–µ—А—В–Є–Ї–∞–ї—М–љ—Л–є –њ—Г—В—М. –Ф–Њ–Ї–∞–Ј–∞–љ—Л –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н–њ–Є—В–µ–ї–Є—П —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –Ї –Т–Я–І –≤ –њ–µ—А–Є–Њ–і –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П –њ–ї–Њ–і–∞ –Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ.
3. –С—Л—В–Њ–≤–Њ–є –њ—Г—В—М. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ–µ—А–µ–і–∞—З–∞ –≤–Є—А—Г—Б–∞ —З–µ—А–µ–Ј –љ–Є–ґ–љ–µ–µ –±–µ–ї—М–µ, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –њ–µ—А—З–∞—В–Ї–Є, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞—А–Є–є –і–ї—П –±–Є–Њ–њ—Б–Є–Є –Є –і—А—Г–≥–Є–µ –њ—А–µ–і–Љ–µ—В—Л, –Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ—Л–µ –Т–Я–І. –Ь–µ–і–њ–µ—А—Б–Њ–љ–∞–ї –Љ–Њ–ґ–µ—В –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞—В—М—Б—П –Т–Я–І –≤–Њ –≤—А–µ–Љ—П –ї–∞–Ј–µ—А–љ–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е –±–Њ—А–Њ–і–∞–≤–Њ–Ї, –≤–і—Л—Е–∞—П –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –і—Л–Љ.
–Ш–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1вАУ6 –Љ–µ—Б., –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤–Є—А—Г—Б–∞ –≤ –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е —В–Ї–∞–љ—П—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –љ–∞ 6-–є –Љ–µ—Б.
–І–∞—Б—В–Њ—В–∞ –њ–µ—А–µ–і–∞—З–Є –Т–Я–І –Њ—В –Љ–∞—В–µ—А–Є –Ї –њ–ї–Њ–і—Г, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, —А–∞–Ј–ї–Є—З–∞–µ—В—Б—П –≤–µ—Б—М–Љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ вАУ –Њ—В 4 –і–Њ 87%. –Я—А–Є —Н—В–Њ–Љ –Т–Я–І –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В –Љ–Њ–ґ–µ—В –њ–µ—А—Б–Є—Б—В–Є—А–Њ–≤–∞—В—М –≤ –Ї–ї–µ—В–Ї–∞—Е —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —А—В–∞ —А–µ–±–µ–љ–Ї–∞ –Є —П–≤–ї—П—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є —Г—З–∞—Б—В–Є–≤—И–µ–≥–Њ—Б—П –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –њ–∞–њ–Є–ї–ї–Њ–Љ–∞—В–Њ–Ј–∞ –≥–Њ—А—В–∞–љ–Є.
–Ґ–µ—З–µ–љ–Є–µ –Я–Т–Ш
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–ї—Г—З–∞–µ–≤ –≤—Л—П–≤–ї–µ–љ–Є—П –Я–Т–Ш –Є —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –љ–∞–±–ї—О–і–∞–µ–Љ—Л–µ –њ—А–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –љ–µ—А–µ–і–Ї–Њ —А–∞–Ј—А–µ—И–∞—О—В—Б—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ (–њ—А–µ—Е–Њ–і—П—Й–∞—П, –Є–ї–Є –ї–∞—В–µ–љ—В–љ–∞—П, –Є–љ—Д–µ–Ї—Ж–Є—П), –љ–µ –Њ—Б—В–∞–≤–ї—П—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Є –њ—А–Є—Б—Г—В—Б—В–≤–Є—П –Я–Т–Ш [16, 21вАУ23].
–Я—А–Є –љ–∞–ї–Є—З–Є–Є –Т–Я–І –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –±–Њ–ї–µ–µ 2-—Е –ї–µ—В —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, –Ї–Њ—В–Њ—А–∞—П –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О CIN [24].
–Я–Њ –Љ–љ–µ–љ–Є—О L.G. Koss (1987), –њ–∞—В–Њ–ї–Њ–≥–Є—П —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –њ–Њ–і–Њ–±–љ–∞ –∞–є—Б–±–µ—А–≥—Г: –ї–Є—И—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –љ–∞—Е–Њ–і–Є—В—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–∞–Љ–µ—З–µ–љ–∞ –≥–ї–∞–Ј–Њ–Љ [25, 26]. –†—Г—В–Є–љ–љ—Л–є –Њ—Б–Љ–Њ—В—А —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –≤ –Ј–µ—А–Ї–∞–ї–∞—Е –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Я—А–Є–љ—Ж–Є–њ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –і–∞–≤–љ–Њ –Є–Ј—Г—З–µ–љ—Л –Є –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–ї–Њ–ґ–љ–Њ—Б—В–µ–є. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П—О—В—Б—П —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і (–†–Р–†-—В–µ—Б—В), —А–∞—Б—И–Є—А–µ–љ–љ–∞—П –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Т–Я–І-—В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П (–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ), –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Є–Њ–њ—В–∞—В–∞ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –Є –≤—Л—Б–Ї–∞–±–ї–Є–≤–∞–љ–Є–µ —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є. –Ю–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–∞ —Г—А–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Г—О –Є–љ—Д–µ–Ї—Ж–Є—О (–£–У–Ш): –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—П –Љ–∞–Ј–Ї–∞, –њ–Њ—Б–µ–≤ –љ–∞ —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ—Г—О —Д–ї–Њ—А—Г, –Я–¶–†-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ш–Я–Я–Я —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–µ–љ—Л –≤ –њ–µ—А–µ—З–µ–љ—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є.
–Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN
–Ґ–µ—А–∞–њ–Є—П –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є, –њ–Њ—Н—В–∞–њ–љ–Њ–є –Є –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —З–∞—Б—В—Л—Е –Є –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –њ–Њ —В–µ—З–µ–љ–Є—О —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Я–Т–Ш –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –£—Б—В–Њ–є—З–Є–≤—Л–є –Є —Г–њ–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Я–Т–Ш –Ј–∞—Б—В–∞–≤–ї—П–µ—В —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –њ–Њ–Є—Б–Ї–Є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —Б—Е–µ–Љ –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є —Б—А–µ–і—Б—В–≤ –ї–µ—З–µ–љ–Є—П.
–°–Є—Б—В–µ–Љ–љ–∞—П —В–µ—А–∞–њ–Є—П —Б–Њ—З–µ—В–∞–љ–љ—Л—Е —Д–Њ—А–Љ –Є–љ—Д–µ–Ї—Ж–Є–Є –і–Њ–ї–ґ–љ–∞ –≤–Ї–ї—О—З–∞—В—М –≤ —Б–µ–±—П –ї–µ—З–µ–љ–Є–µ –£–У–Ш –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ—А–Њ—В–Є–≤–Њ–Љ–Є–Ї—А–Њ–±–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –і–µ–є—Б—В–≤–Є—П, –і–Њ–њ–Њ–ї–љ—П—В—М—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Љ–µ—Б—В–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –і–ї—П —Б–∞–љ–∞—Ж–Є–Є –≤–ї–∞–≥–∞–ї–Є—Й–∞ –≤ –≤–Є–і–µ —Б–≤–µ—З–µ–є, –≥–µ–ї–µ–є –Є–ї–Є –Ї—А–µ–Љ–Њ–≤. –° —Ж–µ–ї—М—О —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П —Н—Г–±–Є–Њ—В–Є–Ї–Є –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –≤–ї–∞–≥–∞–ї–Є—Й–∞.
–° —Г—З–µ—В–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–є –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є –ґ–µ–љ—Й–Є–љ –њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ–Є –≤–Є—А—Г—Б–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–Ї–ї—О—З–∞—В—М –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ [27вАУ29].
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –≤–Є—А—Г—Б–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤ –њ—А–Є–Љ–µ–љ—П—О—В –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Л–µ –Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —П–≤–ї—П–µ—В—Б—П –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є [20, 30, 31].
–Ю–і–љ–Є–Љ –Є–Ј —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Є –љ–µ —В—А–µ–±—Г—О—Й–Є—Е –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –Њ–љ–Ї–Њ–ї–Њ–≥–∞–Љ–Є –њ—А–Є –≤–µ–і–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN 3 –Є –Љ–Є–Ї—А–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ –†–®–Ь —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Њ–≥ –Є–љ–Њ–Ј–Є–љ–∞ вАУ Inosine Pranobex (–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ).
Inosine Pranobex (–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ) –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–≤–Њ–є–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ вАУ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–µ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–µ, —Б–Њ—Б—В–Њ–Є—В –Є–Ј 2-—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤: –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ вАУ –Є–љ–Њ–Ј–Є–љ–∞, –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –њ—Г—А–Є–љ–∞ (1,9-–і–Є–≥–Є–і—А–Њ-9-–≤-D-—А–Є–±–Њ—Д—Г—А–∞–љ–Њ–Ј–Є–ї–Њ-6–Э-–њ—Г—А–Є–љ-6-OH) –Є –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞, –њ–Њ–≤—Л—И–∞—О—Й–µ–≥–Њ –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Є–љ–Њ–Ј–Є–љ–∞ –і–ї—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б–Њ–ї–Є 4-–∞—Ж–µ—В–∞–Љ–Є–і–Њ–±–µ–љ–Ј–Њ–є–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б N,NвАУ–і–Є–Љ–µ—В–Є–ї–∞–Љ–Є–љ–Њ-2-–њ—А–Њ–њ–∞–љ–Њ–ї–Њ–Љ). –Я—А–µ–њ–∞—А–∞—В –њ–Њ–і–∞–≤–ї—П–µ—В —А–µ–њ–ї–Є–Ї–∞—Ж–Є—О –Ф–Э–Ъ –Є –†–Э–Ъ –Т–Я–І –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б —А–Є–±–Њ—Б–Њ–Љ–Њ–є –Ї–ї–µ—В–Ї–Є –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –µ–µ —Б—В–µ—А–µ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–Њ–µ–љ–Є—П –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. Inosine Pranobex (–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ) –≤–Ї–ї—О—З–µ–љ –≤ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–µ —Б—В–∞–љ–і–∞—А—В—Л –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Я–Т–Ш –Є —Б—З–Є—В–∞–µ—В—Б—П –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–Љ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–≥–Њ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —В–Є–њ–∞ —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ —В–Є–Љ–Њ–Љ–Є–Љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –∞–Ї—В–Є–≤–Є—А—Г–µ—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Ґ-–ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –Ґ-—Е–µ–ї–њ–µ—А–Њ–≤, –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (NK)-–Ї–Є–ї–ї–µ—А–Њ–≤, —Г—А–∞–≤–љ–Њ–≤–µ—И–Є–≤–∞–µ—В –±–∞–ї–∞–љ—Б –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Є –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Ј–≤–µ–љ—М–µ–≤ –≤ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ [27, 29, 32].
–†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Ј—А–Њ—Б–ї—Л–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 50 –Љ–≥/–Ї–≥/—Б—Г—В, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л–µ –љ–∞ 3вАУ4 –њ—А–Є–µ–Љ–∞. –Я—А–Є –Я–Т–Ш –≤–Ј—А–Њ—Б–ї—Л–Љ –њ—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞—О—В –њ–Њ 2 —В–∞–±–ї–µ—В–Ї–Є 3 —А./—Б—Г—В –≤ 3вАУ4 –њ—А–Є–µ–Љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 14вАУ28 –і–љ–µ–є –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є. –Я—А–Є CIN, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Т–Я–І, –љ–∞–Ј–љ–∞—З–∞—О—В –њ–Њ 2 —В–∞–±–ї–µ—В–Ї–Є 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є, –і–∞–ї–µ–µ –њ—А–Њ–≤–Њ–і—П—В 2вАУ3 –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е –Ї—Г—А—Б–∞ —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 10вАУ14 –і–љ–µ–є [30, 33].
–†—П–і –∞–≤—В–Њ—А–Њ–≤ —Б–Њ–Њ–±—Й–∞—О—В –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Т–Я–І-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Э–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л–µ –њ–Њ –њ–Њ–≤–Њ–і—Г CIN –Є –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –ї–µ—З–µ–љ–Є—П (—Н–ї–µ–Ї—В—А–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є—П, –Ї—А–Є–Њ–і–µ—Б—В—А—Г–Ї—Ж–Є—П, –ї–∞–Ј–µ—А–Њ–≤–∞–њ–Њ—А–Є–Ј–∞—Ж–Є—П, —Н–ї–µ–Ї—В—А–Њ–Ї–Њ–љ–Є–Ј–∞—Ж–Є—П). –Э–∞ –≤—В–Њ—А–Њ–Љ —Н—В–∞–њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, —В. –Ї. –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є—П –≤–Є—А—Г—Б–∞ —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [28, 30]. –С—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ Inosine Pranobex (–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ) –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є (1000 –Љ–≥ 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤–Є—А—Г—Б–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –Т–Я–І 16-–≥–Њ –Є 18-–≥–Њ —В–Є–њ–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л—Е –њ—А–Є –Я–¶–†-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ [28, 33].
–Т 2008 –≥. –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –Є –≤–љ–µ–і—А–µ–љ–∞ –њ—А–Њ–≥—А–∞–Љ–Љ–∞ ¬Ђ–Р–°–Ґ–†–Р¬ї вАУ –Њ–±—Й–µ—А–Њ—Б—Б–Є–є—Б–Ї–∞—П –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–∞—П –њ—А–Њ–≥—А–∞–Љ–Љ–∞ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞, –Њ–±–Њ–±—Й–µ–љ–Є—П –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—В—З–µ—В–љ–Њ—Б—В–Є –Њ–± –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е –Є —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Т–Я–І, –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ–±—Л—З–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї –≤–Ї–ї—О—З–µ–љ 6191 –њ–∞—Ж–Є–µ–љ—В (5896 –ґ–µ–љ—Й–Є–љ –Є 295 –Љ—Г–ґ—З–Є–љ). –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ CIN I –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г 90% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ CIN II вАУ –≤ 82% —Б–ї—Г—З–∞–µ–≤, –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –Т–Я–І —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–Њ—Б—В–Є–≥–∞–ї–∞ 91% [34].
–Ф–ї—П –ї–µ—З–µ–љ–Є—П CIN –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Љ–µ—В–Њ–і—Л –∞–±–ї–∞—Ж–Є–Є –Є –Љ–µ—В–Њ–і—Л —Н–Ї—Б—Ж–Є–Ј–Є–Є. –Р–±–ї–∞—Ж–Є—П (—Б–Є–љ.: –і–µ—Б—В—А—Г–Ї—Ж–Є—П, –Ї–Њ–∞–≥—Г–ї—П—Ж–Є—П), –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є CIN —А–∞–Ј—А—Г—И–∞–µ—В—Б—П, –≤–Ї–ї—О—З–∞–µ—В —Н–ї–µ–Ї—В—А–Њ-, –ї–∞–Ј–µ—А–љ—Г—О –Є –Ї—А–Є–Њ–∞–±–ї–∞—Ж–Є—О. –Э–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –∞–±–ї–∞—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–Ї–∞–љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –њ–µ—А–µ–і –ї–µ—З–µ–љ–Є–µ–Љ —В—А–µ–±—Г—О—В—Б—П —В—Й–∞—В–µ–ї—М–љ–Њ–µ –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –±–Є–Њ–њ—Б–Є—П –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [5].
–≠–Ї—Б—Ж–Є–Ј–Є–Њ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Њ–±—А–∞–Ј–µ—Ж —В–Ї–∞–љ–Є –і–ї—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—О—В –Ї–Њ–љ–Є–Ј–∞—Ж–Є—О —Б–Ї–∞–ї—М–њ–µ–ї–µ–Љ, –ї–∞–Ј–µ—А–љ—Г—О –Ї–Њ–љ–Є–Ј–∞—Ж–Є—О –Є –њ–µ—В–ї–µ–≤—Г—О —Н–ї–µ–Ї—В—А–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї—Г—О —Н–Ї—Б—Ж–Є–Ј–Є–Њ–љ–љ—Г—О –њ—А–Њ—Ж–µ–і—Г—А—Г (LEEP –Є–ї–Є LLETZ).
–Э–∞–Є–±–Њ–ї–µ–µ –њ—А–Є–µ–Љ–ї–µ–Љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ, —Б –њ–Њ–Ј–Є—Ж–Є–Є –∞–Ї—Г—И–µ—А–Њ–≤-–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Њ–≤, —П–≤–ї—П–µ—В—Б—П —А–∞–і–Є–Њ–≤–Њ–ї–љ–Њ–≤–Њ–є –Љ–µ—В–Њ–і, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –≤–µ—Б—М —Г–і–∞–ї–µ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –і–Њ—Б—В—Г–њ–µ–љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О. –≠—В–Њ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –Њ—В–ї–Є—З–∞–µ—В –µ–≥–Њ –Њ—В –ї–∞–Ј–µ—А–љ–Њ–є –Є –Ї—А–Є–Њ–і–µ—Б—В—А—Г–Ї—Ж–Є–Є, –≥–і–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –љ–µ—В, –Є –Њ—В —Н–ї–µ–Ї—В—А–Њ–љ–Њ–ґ–µ–≤–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ–±—Г–≥–ї–Є–≤–∞–љ–Є–µ —В–Ї–∞–љ–µ–є. –£–і–∞–ї–µ–љ–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—З–∞—Б—В–Ї–Њ–≤ –≤—Г–ї—М–≤—Л, –≤–ї–∞–≥–∞–ї–Є—Й–∞ –Є —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ–Њ–і –Љ–µ—Б—В–љ—Л–Љ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є–µ–Љ —А–∞–і–Є–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ (Surgitron) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–∞–і–Є–Њ–њ–µ—В–ї–Є –≤ —А–µ–ґ–Є–Љ–µ ¬Ђ—А–∞–Ј—А–µ–Ј –Є –Ї–Њ–∞–≥—Г–ї—П—Ж–Є—П¬ї (–Љ–Њ—Й–љ–Њ—Б—В—М—О 2вАУ4 –µ–і.). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ—З–∞—Б—В–Њ—В–љ—Л—Е –≤–Њ–ї–љ (3,8 –Ь–У—Ж) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–µ—Б–Ї–Њ–љ—В–∞–Ї—В–љ—Л–є —А–∞–Ј—А–µ–Ј —В–Ї–∞–љ–Є –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –±–Є–Њ–њ—Б–Є—О, —Н–Ї—Б—Ж–Є–Ј–Є—О —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –±–µ—Б–Ї—А–Њ–≤–љ–Њ, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ, –±–µ–Ј —В—А–∞–≤–Љ–∞—В–Є–Ј–∞—Ж–Є–Є –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е —В–Ї–∞–љ–µ–є –Є –њ–Њ–ї—Г—З–Є—В—М –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –і–ї—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [5, 35].
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є —Н–Ї—Б—Ж–Є–Ј–Є–Є —Б–ї–µ–і—Г–µ—В —Г–і–∞–ї—П—В—М –Ј–Њ–љ—Г —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є (–Ч–Ґ) –µ–і–Є–љ—Л–Љ –±–ї–Њ–Ї–Њ–Љ, —В. –Ї. —Г–і–∞–ї–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є —Д—А–∞–≥–Љ–µ–љ—В–∞–Љ–Є –Љ–Њ–ґ–µ—В –Ј–∞—В—А—Г–і–љ–Є—В—М –µ–µ –≥–Є—Б—В–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Њ—Ж–µ–љ–Ї—Г, –∞ –≤ —Б–ї—Г—З–∞–µ –Љ–Є–Ї—А–Њ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П вАУ —Б–і–µ–ї–∞—В—М –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —В–Њ—З–љ–Њ–є –≥–ї—Г–±–Є–љ—Л –Є–љ–≤–∞–Ј–Є–Є –Є–ї–Є –њ–Њ–ї–љ–Њ—В—Л —Н–Ї—Б—Ж–Є–Ј–Є–Є –≤–Њ —Д—А–∞–≥–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н–Ї—Б—Ж–Є–Ј–Є–Њ–љ–љ—Л—Е –Њ–±—А–∞–Ј—Ж–∞—Е. –≠–Ї—Б—Ж–Є–Ј–Є—О —Б–ї–µ–і—Г–µ—В —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ—П—В—М —Г –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–∞–љ–љ—Л–µ –∞–љ–∞–ї–Є–Ј–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ —Н—В–∞ –њ—А–Њ—Ж–µ–і—Г—А–∞ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л—Е —А–Њ–і–Њ–≤.
–Т—Л–±–Њ—А –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –≤ –Ї–∞–ґ–і–Њ–Љ –Њ—В–і–µ–ї—М–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Љ–љ–Њ–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤: —В—П–ґ–µ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П, —В–Є–њ–∞ –Ч–Ґ, –≤–Њ–Ј—А–∞—Б—В–∞, –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –∞–љ–∞–Љ–љ–µ–Ј–∞, –Њ—Б–љ–∞—Й–µ–љ–љ–Њ—Б—В–Є –Ї–ї–Є–љ–Є–Ї–Є –Є –Њ–њ—Л—В–∞ –≤—А–∞—З–∞.
–∞
–Я—А–Є–љ—Ж–Є–њ—Л –ї–µ—З–µ–љ–Є—П CIN
–Ы–µ—З–Є—В—М –≤—Б—О –Ч–Ґ –љ–∞ –≥–ї—Г–±–Є–љ—Г –љ–µ –Љ–µ–љ–µ–µ 7 –Љ–Љ (–њ—А–Є —Н–Ї–Ј–Њ—Ж–µ—А–≤–Є–Ї–∞–ї—М–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е). –Я—А–Є –љ–∞–ї–Є—З–Є–Є –Ч–Ґ III —В–Є–њ–∞, –µ—Б–ї–Є –Ч–Ґ –њ–Њ–ї–љ–Њ—Б—В—М—О –љ–µ –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А—Г–µ—В—Б—П, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –њ—А–Є–Ј–љ–∞–Ї–Є –ґ–µ–ї–µ–Ј–Є—Б—В–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є–ї–Є –Є–љ–≤–∞–Ј–Є–Є, –Є–Љ–µ–µ—В—Б—П —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Ж–Є—В–Њ–ї–Њ–≥–Є–Є –Є –±–Є–Њ–њ—Б–Є–Є, –∞–±–ї–∞—Ж–Є—П –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–∞! –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –Ї–Њ–љ—Г—Б–Њ–≤–Є–і–љ–∞—П —Н–Ї—Б—Ж–Є–Ј–Є—П.
–Т –†–Њ—Б—Б–Є–Є –ї–µ—З–µ–љ–Є–µ CIN III –Є c–∞ncer in situ –≤—Е–Њ–і–Є—В –≤ —Д—Г–љ–Ї—Ж–Є–Є –Њ–љ–Ї–Њ–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–∞.
–Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –ґ–µ–љ—Й–Є–љ —Б CIN I –≤ –±–Є–Њ–њ—В–∞—В–µ
CIN I —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є —А–µ–≥—А–µ—Б—Б–Є–Є –Є –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є–Є —Н—В–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є. –Р–ї–≥–Њ—А–Є—В–Љ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN I —З–µ—В–Ї–Њ –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ. –Т–µ–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN I —В—А–µ–±—Г–µ—В –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є, –Њ–і–љ–∞–Ї–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Љ–Њ–ґ–љ–Њ –љ–µ –њ—А–Њ–≤–Њ–і–Є—В—М –≤ —В–µ—З–µ–љ–Є–µ 1,5вАУ2 –ї–µ—В –≤–≤–Є–і—Г –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є —А–µ–≥—А–µ—Б—Б–Є–Є —Г –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ [36].
–°—Г—Й–µ—Б—В–≤—Г—О—В –і–≤–∞ —В–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–∞, –≤—Л–±–Њ—А –Њ–і–љ–Њ–≥–Њ –Є–Ј –љ–Є—Е –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є—П—Е –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Є –≤—А–∞—З–∞:
1. –Э–∞–±–ї—О–і–µ–љ–Є–µ CIN I —Б —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ —З–µ—А–µ–Ј 6 –Є 12 –Љ–µ—Б. –Є–ї–Є –Т–Я–І-—В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ —З–µ—А–µ–Ј 12 –Љ–µ—Б. –Я–Њ—Б–ї–µ 2-—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–ї–Є –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –Т–Я–І-—В–µ—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –њ–Њ–і–ї–µ–ґ–Є—В —А—Г—В–Є–љ–љ–Њ–Љ—Г —Б–Ї—А–Є–љ–Є–љ–≥—Г, –≤ —Б–ї—Г—З–∞–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ >ASC-US, –Є–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Т–Я–І-—В–µ—Б—В–∞ вАУ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—О –љ–∞ –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—О.
–Я—А–Њ–≤–Њ–і—П—В—Б—П –ї–µ—З–µ–љ–Є–µ –£–У–Ш, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –≤–∞–≥–Є–љ–Њ–Ј–∞, –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –≤–ї–∞–≥–∞–ї–Є—Й–∞. –Э–∞–Ј–љ–∞—З–∞–µ—В—Б—П –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ –њ–Њ 2 —В–∞–±–ї–µ—В–Ї–Є 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є, –і–∞–ї–µ–µ –њ—А–Њ–≤–Њ–і—П—В 2вАУ3 –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е –Ї—Г—А—Б–∞ —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 10вАУ14 –і–љ–µ–є.
–Ы–µ—З–µ–љ–Є–µ CIN I –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–Њ–≤ –∞–±–ї–∞—Ж–Є–Є –Є–ї–Є —Н–Ї—Б—Ж–Є–Ј–Є–Є. –Ю–±–∞ –Љ–µ—В–Њ–і–∞ –њ—А–Є–µ–Љ–ї–µ–Љ—Л –њ—А–Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є (–Ч–Ґ I –Є–ї–Є II —В–Є–њ–∞).
2. –Т —Б–ї—Г—З–∞–µ –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є (–Ч–Ґ III —В–Є–њ–∞), –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤ —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–Љ –Њ–±—А–∞–Ј—Ж–µ –Є —Г –ґ–µ–љ—Й–Є–љ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ CIN —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Н–Ї—Б—Ж–Є–Ј–Є—П.
–Р–Ї—В–Є–≤–љ–Њ–µ –≤–µ–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN I —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–±–ї–∞—Ж–Є–Є –Є–ї–Є —Н–Ї—Б—Ж–Є–Ј–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є:
вАУ –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є;
вАУ –Њ–±—И–Є—А–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є;
вАУ –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є CIN I > 18 –Љ–µ—Б.;
вАУ –≤–Њ–Ј—А–∞—Б—В–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є > 35 –ї–µ—В;
вАУ –љ–µ–ґ–µ–ї–∞–љ–Є–Є –ґ–µ–љ—Й–Є–љ—Л –њ–Њ—Б–µ—Й–∞—В—М –≤—А–∞—З–∞ —А–µ–≥—Г–ї—П—А–љ–Њ.
–Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –ґ–µ–љ—Й–Є–љ —Б CIN IIвАУIII –≤ –±–Є–Њ–њ—В–∞—В–µ
–Я–Њ—А–∞–ґ–µ–љ–Є—П —Н–њ–Є—В–µ–ї–Є—П —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є (HSIL) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –†–®–Ь, –њ–Њ—Н—В–Њ–Љ—Г —В—А–µ–±—Г—О—В –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
CIN IIвАУIII —Б—З–Є—В–∞—О—В—Б—П –њ—А–µ–і—А–∞–Ї–Њ–≤—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є, –Њ–љ–Є —З–∞—Й–µ –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—В –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—В, —З–µ–Љ —А–µ–≥—А–µ—Б—Б–Є—А—Г—О—В, –Є –њ–Њ—Н—В–Њ–Љ—Г –і–Њ–ї–ґ–љ—Л –њ–Њ–і–≤–µ—А–≥–∞—В—М—Б—П –ї–µ—З–µ–љ–Є—О (–Є—Б–Ї–ї—О—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П—О—В CIN IIвАУIII —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є CIN II —Г —О–љ—Л—Е –ґ–µ–љ—Й–Є–љ).
–Я—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М —Н–Ї—Б—Ж–Є–Ј–Є–Њ–љ–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –ї–µ—З–µ–љ–Є—П (–њ–µ—В–ї–µ–≤–∞—П —Н–Ї—Б—Ж–Є–Ј–Є—П –Є–ї–Є –Ї–Њ–љ–Є–Ј–∞—Ж–Є—П), –∞ –љ–µ –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї–Њ–љ–Є–Ј–∞—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В, –Ї–∞–Ї —Г–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М, –њ–Њ–ї—Г—З–Є—В—М –±–Є–Њ–Љ–∞—В–µ—А–Є–∞–ї, –њ—А–Є–≥–Њ–і–љ—Л–є –і–ї—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З—В–Њ –≥–∞—А–∞–љ—В–Є—А—Г–µ—В –≤—А–∞—З—Г –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ —Б—В–∞–і–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [37].
–≠–Ї—Б—Ж–Є–Ј–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –њ—А–Є:
вАУ –±–Њ–ї—М—И–Њ–є –њ–ї–Њ—Й–∞–і–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П;
вАУ –љ–µ—Б–Њ–≤–њ–∞–і–µ–љ–Є–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–∞–Ї–ї—О—З–µ–љ–Є–є;
вАУ —А–µ—Ж–Є–і–Є–≤–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
вАУ –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є (–Ч–Ґ III —В–Є–њ–∞, –Ї–Њ–≥–і–∞ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –≤–љ—Г—В—А–Є —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞ –Є –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є); –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN III –њ—А–Њ–≤–Њ–і—П—В –Њ–љ–Ї–Њ–≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є.
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —В–∞–Ї—В–Є–Ї–Є –≤–µ–і–µ–љ–Є—П CIN —Г –і–µ–≤–Њ—З–µ–Ї-–њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ –Є —О–љ—Л—Е –ґ–µ–љ—Й–Є–љ
–£ —О–љ—Л—Е –ґ–µ–љ—Й–Є–љ —Б CIN I –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–∞ —В–∞–Ї—В–Є–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П, —В–Њ–ї—М–Ї–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є CIN III вАУ –ї–µ—З–µ–љ–Є–µ. –Ф–µ–≤–Њ—З–Ї–Є-–њ–Њ–і—А–Њ—Б—В–Ї–Є –Є —О–љ—Л–µ –ґ–µ–љ—Й–Є–љ—Л —Б CIN I –љ–∞–±–ї—О–і–∞—О—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –ї–µ—В —Б –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є —З–µ—А–µ–Ј 12 –Є 24 –Љ–µ—Б. –Ъ–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ, –µ—Б–ї–Є –≤ –Љ–∞–Ј–Ї–µ —З–µ—А–µ–Ј 12 –Љ–µ—Б. >HSIL –Є–ї–Є —З–µ—А–µ–Ј 24 –Љ–µ—Б. >ASC-US (–∞—В–Є–њ–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –њ–ї–Њ—Б–Ї–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –љ–µ—П—Б–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П).
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б CIN –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ
–Э–∞–Є–±–Њ–ї—М—И–Є–є —Г—А–Њ–≤–µ–љ—М –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –†–®–Ь –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –ґ–µ–љ—Й–Є–љ —Б—В–∞—А—И–µ 45 –ї–µ—В. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–∞—В—А—Г–і–љ–µ–љ–∞. –≠—Б—В—А–Њ–≥–µ–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –∞—В—А–Њ—Д–Є–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є —Ж–µ—А–≤–Є–Ї—Б–∞ –Є –≤—В—П–≥–Є–≤–∞–љ–Є—О –Ј–Њ–љ—Л —Б—В—Л–Ї–∞ —Н–њ–Є—В–µ–ї–Є—П –≤ —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї—Б. –Ф–Њ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л —В–Њ–ї—М–Ї–Њ 8% CIN –љ–∞—Е–Њ–і—П—В—Б—П —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ, –њ–Њ—Б–ї–µ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л 48% CIN —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—В—Б—П –≤ —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–Љ –Ї–∞–љ–∞–ї–µ. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–Є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Є–Є –Ч–Ґ III –Є –љ–∞–ї–Є—З–Є–Є –∞–љ–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞–Ј–Ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ї—О—А–µ—В–∞–ґ–∞ —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї—Б–∞ (—В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ –Т–Я–І) –Є –Ї–Њ–љ–Є–Ј–∞—Ж–Є–Є —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є. –Я—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є CIN I –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–∞–љ–∞—Ж–Є–Є –Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –і–Њ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я—А–Є –њ–Њ–ї—Г—З–µ–љ–Є–Є –∞–љ–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ –Љ–∞–Ј–Ї–∞ –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Њ–≤–Њ–і—П—В—Б—П —Б–∞–љ–∞—Ж–Є—П –Є –Ї—О—А–µ—В–∞–ґ —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї—Б–∞, –Ї–Њ–љ–Є–Ј–∞—Ж–Є—П. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –њ–Њ 2 —В–∞–±–ї–µ—В–Ї–Є 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є, –і–∞–ї–µ–µ –њ—А–Њ–≤–Њ–і—П—В 2вАУ3 –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е –Ї—Г—А—Б–∞ —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 10вАУ14 –і–љ–µ–є –Є–ї–Є –±–µ–Ј –њ–µ—А–µ—А—Л–≤–∞ –Ї—Г—А—Б–Њ–Љ 30 –і–љ–µ–є.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Н—Б—В—А–Њ–≥–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є вАУ –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Њ—Б—В–Њ–є —Б–њ–Њ—Б–Њ–± —Г–ї—Г—З—И–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є–Є. –≠—Б—В—А–Њ–≥–µ–љ—Л —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –≤—Л–≤–Њ—А–Њ—В—Г —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —А–∞—Б—И–Є—А–µ–љ–Є—О —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞ —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–ї–Є–Ј–Є, –Ї–Њ—В–Њ—А–∞—П –±–ї–∞–≥–Њ–і–∞—А—П —Б–≤–Њ–µ–є –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —Г–ї—Г—З—И–∞–µ—В –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї—Б–∞. –Ь–∞–ї–µ–љ—М–Ї–Є–µ –і–Њ–Ј—Л —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ—Л –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –∞—В—А–Њ—Д–Є–Є, –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –љ–µ–±–Њ–ї—М—И–Є—Е –∞—В–Є–њ–Є–є CIN IвАУII, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –∞—В—А–Њ—Д–Є–µ–є. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–∞—П —Б–∞–љ–∞—Ж–Є—П –≤–ї–∞–≥–∞–ї–Є—Й–∞ –Є –Љ–µ—Б—В–љ–∞—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 15 –і–љ–µ–є —Г–ї—Г—З—И–∞—О—В —Г—Б–ї–Њ–≤–Є—П –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Є –Њ–±–ї–µ–≥—З–∞—О—В –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—О –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–∞–Ј–Ї–Њ–≤ –Є –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Э–∞–±–ї—О–і–µ–љ–Є–µ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П CIN
–£—А–Њ–≤–µ–љ—М –Њ—Б—В–∞—В–Њ—З–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Є —А–µ—Ж–Є–і–Є–≤–Њ–≤ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П CIN —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5вАУ15%, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2-—Е –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –ї–µ—В.
–Т –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —В–µ –ґ–µ –Љ–µ—В–Њ–і—Л, —З—В–Њ –Є –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –њ–µ—А–µ–і –ї–µ—З–µ–љ–Є–µ–Љ: —Ж–Є—В–Њ–ї–Њ–≥–Є—О, –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—О –Є –Т–Я–І-—В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Т–Я–І-—В–µ—Б—В–∞ –≤ –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Њ—Б—В–∞—В–Њ—З–љ—Л—Е –Є–ї–Є —А–µ—Ж–Є–і–Є–≤–љ—Л—Е CIN IIвАУIII –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М –µ–≥–Њ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і—П—В –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Ю—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–є –Т–Я–І-—В–µ—Б—В —З–µ—А–µ–Ј 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П CIN IIвАУIII –Є–ї–Є 3 –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б 6-–Љ–µ—Б—П—З–љ—Л–Љ –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ, –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–µ—А–µ–≤–µ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Ї—Г –љ–∞ –µ–ґ–µ–≥–Њ–і–љ–Њ–µ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Я—А–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –Т–Я–І-—В–µ—Б—В–µ –Є–ї–Є —Ж–Є—В–Њ–ї–Њ–≥–Є–Є >ASC-US –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Ї–Њ–ї—М–њ–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–Х—Б–ї–Є CIN IIвАУIII –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ –Ї—А–∞—П—Е –Є—Б—Б–µ—З–µ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—Г—Б–∞ –Є–ї–Є –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ, –њ–Њ–ї—Г—З–µ–љ–љ–Њ–Љ –Є–Ј –Њ—Б—В–∞–≤—И–µ–є—Б—П —З–∞—Б—В–Є –Ї–∞–љ–∞–ї–∞ —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ —Н–Ї—Б—Ж–Є–Ј–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –њ–Њ–ї—Г—З–µ–љ–Є–µ–Љ —Н–љ–і–Њ—Ж–µ—А–≤–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Њ–±—А–∞–Ј—Ж–∞ —З–µ—А–µ–Ј 4вАУ6 –Љ–µ—Б., –і–ї—П –ґ–µ–љ—Й–Є–љ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–∞ –њ–Њ–≤—В–Њ—А–љ–∞—П –њ—А–Њ—Ж–µ–і—Г—А–∞ —Н–Ї—Б—Ж–Є–Ј–Є–Є. –£ –ґ–µ–љ—Й–Є–љ —Б –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Є–ї–Є —А–µ—Ж–Є–і–Є–≤–љ–Њ–є CIN IIвАУIII –і–Њ–њ—Г—Б—В–Є–Љ—Л –њ–Њ–≤—В–Њ—А–љ–∞—П –њ—А–Њ—Ж–µ–і—Г—А–∞ —Н–Ї—Б—Ж–Є–Ј–Є–Є –Є–ї–Є –≥–Є—Б—В–µ—А—Н–Ї—В–Њ–Љ–Є—П.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ вАУ –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є—П
–Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—П –њ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ –≤ –Њ–±–ї–∞—Б—В–Є —А–∞–Ї–∞ (IARC) –Њ–њ—А–µ–і–µ–ї–Є–ї–∞, —З—В–Њ –Я–Т–Ш вАУ –≤–∞–Ї—Ж–Є–љ–Њ—Г–њ—А–∞–≤–ї—П–µ–Љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, –∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ –Ј–∞—А–∞–ґ–µ–љ–Є—П –Є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є –Т–Я–І –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –†–®–Ь [6, 18, 20, 37, 38].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –Љ–Є—А–µ –Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –†–Њ—Б—Б–Є–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 2 –≤–∞–Ї—Ж–Є–љ—Л –њ—А–Њ—В–Є–≤ –Т–Я–І: –±–Є–≤–∞–ї–µ–љ—В–љ–∞—П –Є –Ї–≤–∞–і—А–Є–≤–∞–ї–µ–љ—В–љ–∞—П.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П –≤–∞–Ї—Ж–Є–љ–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ 117 —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞. –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –њ—А–Њ–≥—А–∞–Љ–Љ—Л –Т–Я–І-–≤–∞–Ї—Ж–Є–љ–∞—Ж–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л –≤ 60 —Б—В—А–∞–љ–∞—Е, –њ—А–Є—З–µ–Љ –≤ 6 —Б—В—А–∞–љ–∞—Е —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є—П –Љ–∞–ї—М—З–Є–Ї–Њ–≤.
–Ю–±–µ –≤–∞–Ї—Ж–Є–љ—Л –≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –Ь–Є–љ–Є—Б—В–µ—А—Б—В–≤–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–§, –≤ 2007 –≥. –≤ –†–Њ—Б—Б–Є–Є –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є—П –њ—А–Њ—В–Є–≤ –†–®–Ь –Њ–і–Њ–±—А–µ–љ–∞ –њ—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–Њ–Љ —Б—В—А–∞–љ—Л. –Т–Ю–Ч —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–∞—Б—Б–Њ–≤–Њ–є –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є–Є –Њ—В –Т–Я–І –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Я–І- –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–∞–Ї–Њ–≤.












