Введение
Артериальные и венозные тромбозы, тромбоэмболии, кровотечения, шоки и шокоподобные состояния являются наиболее опасными для жизни осложнениями различных заболеваний. Именно с этими причинами во многом связаны тяжелейшие акушерские осложнения, материнская и перинатальная смертность, поэтому изучение механизмов развития данных патологических состояний, их своевременная диагностика чрезвычайно важны для профилактики и эффективной терапии осложнений беременности.Помимо врожденных и приобретенных расстройств гемостаза большое значение в практике врача акушера-гинеколога имеют так называемые сосудистые тромбогеморрагические нарушения [10]. Этот термин включает в себя различные группы наследственных, приобретенных и ятрогенных заболеваний с различной этиологией и патогенезом, требующих различных методов терапии, общим для которых является патология сосудистой стенки. К ним относятся врожденные заболевания соединительной ткани (синдромы Марфана, Элерса-Данло, Рендю-Ослера, несовершенный остеогенез, гигантская кавернозная гемангиома), гипергомоцистеинемия, диффузные заболевания соединительной ткани, в том числе болезни, связанные с циркуляцией иммунных комплексов (системная красная волчанка, системная склеродермия, дерматомиозит, ревматоидный артрит, полиартериит, синдром Бехчета, сочетанные формы заболеваний соединительной ткани), сахарный диабет, синдром Кушинга, пурпура аллергического и инфекционного генеза, злокачественные парапротеиновые заболевания (злокачественная миелома, макроглобулинемия Вальденстрема), доброкачественные парапротеиновые заболевания (амилоидоз, криоглобулинемия), лекарственные васкулиты.
Подобное объединение, на первый взгляд, совершенно различных патологических состояний вполне приемлемо для практики с точки зрения сходных акушерско-гинекологических осложнений, которые они вызывают. Тромбогеморрагические осложнения при всех перечисленных заболеваниях могут быть связаны с различными патогенетическими механизмами, включающими в себя активацию системы комплемента, кининовой системы, миграцию лейкоцитов, активацию системы гемостаза или фибринолиза, аллергические реакции или сочетание этих механизмов.
Патология сосудов может встречаться как изолированно, так и являться триггером для запуска других тромбогеморрагических механизмов.
Подозревать патологию сосудов следует при наличии таких симптомов, как бледность, цианоз или мраморность кожных покровов, ретикулярное ливедо, спонтанные кровотечения из слизистых оболочек, включая билатеральные носовые кровотечения, кровотечения из желудочно-кишечного тракта (часто скрытые), легочные и генитальные кровотечения. Такие пациенты часто жалуются на спонтанное образование синяков, десновые кровотечения при чистке зубов. Одним из важнейших клинических симптомов, указывающих на наличие сосудистого дефекта, является наличие петехий или пурпуры на конечностях при отсутствии подобных изменений на остальных участках тела. Данные изменения характерны именно для сосудистых расстройств, в отличие от тромбоцитарных нарушений, при которых петехиальные высыпания и пурпура симметрично расположены как на конечностях, так и на туловище [10].
Диагноз сосудистой патологии во многом является диагнозом исключения, так как в первую очередь необходимо исключить нарушения гемостаза. R. Bick [10] предлагает следующий алгоритм диагностики в подобных случаях:
1. Исключить дефекты основных коагуляционных белков, используя такие показатели, как протромбиновое время и активированное частичное тромбопластиновое время.
2. Исключить тромбоцитопению.
3. Исключить нарушения функции тромбоцитов, используя метод агрегации тромбоцитов, или оценить функцию тромбоцитов на аппаратах PFA-100 или тромбостат-400 [11, 31].
После исключения вышеперечисленных нарушений следует с большой вероятностью подозревать сосудистую патологию.
Большую группу больных с высоким риском тромбогеморрагических нарушений, связанных с патологией сосудистой стенки, составляют больные с врожденными заболеваниями соединительной ткани (синдромами Марфана, Элерса-Данло, Рендю-Ослера). Для всех перечисленных заболеваний характерен врожденный дефект соединительной ткани, проявляющийся нарушением строения и функции различных органов и систем: скелетными аномалиями, изменениями со стороны органа зрения, кожи и подкожной клетчатки и многих других систем. Однако наибольшую опасность у беременных с врожденными заболеваниями соединительной ткани представляет собой нарушение структуры соединительнотканного компонента стенок сосудов различного калибра, так как именно с этим связаны тяжелые тромбогеморрагические осложнения при данных заболеваниях. Чрезвычайная важность проблемы состоит в том, что заболевания часто протекают субклинически и своевременно не диагностируются. Риск возможных осложнений во время беременности, родов и послеродового периода у данной категории больных нередко недооценивается, что может приводить к летальным исходам. Единственным способом предотвращения тяжелых осложнений у беременных с врожденными заболеваниями соединительной ткани является своевременная диагностика заболевания и ведение беременности и родов с учетом специфики того или иного синдрома.
Синдром Марфана
Синдром Марфана представляет собой аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией в гене фибриллина — одного из основных эластических компонентов соединительной ткани [5,7,14]. При этом нарушается синтез микрофибриллярных волокон в стенках сосудов, клапанах сердца, связках, суставах, твердой мозговой оболочке, костях и других органах. Распространенность синдрома Марфана, по данным различных источников, составляет 1 на 5-10 тыс. населения [5,14,18,20]. Наиболее частыми клиническими признаками заболевания являются прогрессирующая дилатация аорты, пролапс и недостаточность митрального и аортального клапанов, гипермобильность суставов, высокий рост, длинные конечности, арахнодактилия, деформация грудной клетки, сколиоз, эктопия хрусталика, миопия [5,8,18]. Особое значение имеют проявления со стороны сердечно-сосудистой системы, так как именно с ними связана высокая летальность при этом заболевании [18]. Молекулярная диагностика синдрома Марфана проводится редко, в связи с чем в настоящее время согласно международным рекомендациям используется клиническая диагностика в соответствии с диагностическими критериями Ghent, предложенными в 1996 году взамен ранее существовавших Берлинских критериев 1988 года (табл. 1).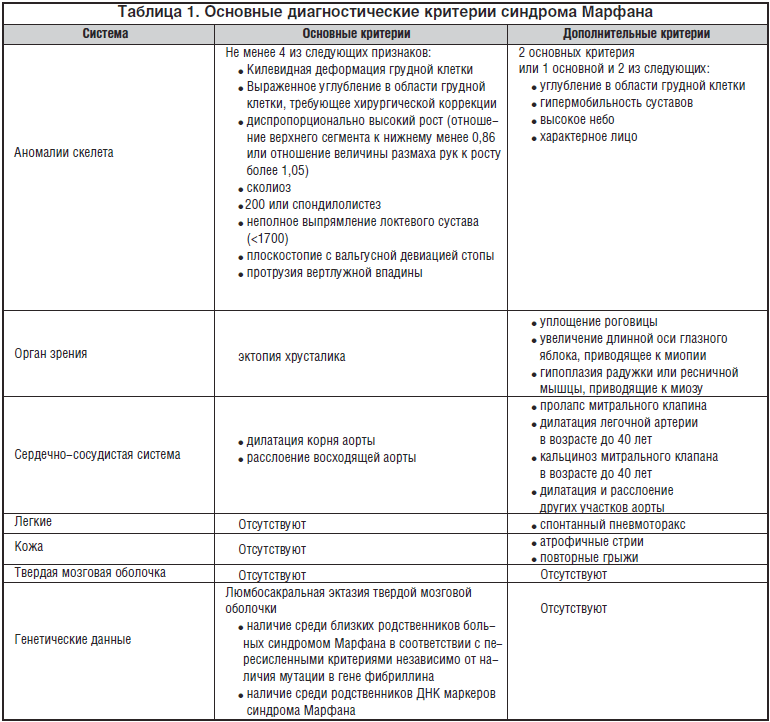
Для постановки диагноза необходимо по 1 основному критерию со стороны 2 различных систем органов (4 признака со стороны скелета составляют 1 основной критерий) и 1 дополнительный критерий.
При ведении беременных с синдромом Марфана следует учитывать два основных обстоятельства:
1. Беременные с синдромом Марфана имеют высокий риск развития летальных осложнений со стороны сердечно-сосудистой системы (разрыва аорты и расслоения аневризмы аорты).
2. Заболевание наследуется у детей в 50% случаев.
Больным с синдромом Марфана показано тщательное обследование в период планирования беременности, обязательно включающее трансторакальное или трансэзофагеальное ультразвуковое исследование аорты. При диаметре аорты более 4 см беременность противопоказана. Все необходимые хирургические вмешательства на клапанах и аорте больным с синдромом Марфана должны быть произведены до беременности. Женщины должны быть предупреждены о возможных летальных осложнениях во время беременности и о риске наследования заболевания ребенком. Кроме того, необходимо информировать пациентку и ее родственников о снижении продолжительности жизни в связи с беременностью и ухудшении течения заболевания. Риск наследования синдрома Марфана плодом можно определить уже в конце 1 триместра при генетическом исследовании.
Большинство осложнений со стороны сердечно-сосудистой системы развивается во втором или третьем триместрах беременности, хотя описаны случаи расслоения аорты на ранних сроках беременности, в родах и на протяжении 8 дней послеродового периода. Причинами высокого риска расслоения аневризмы аорты во время беременности у пациенток синдромом Марфана являются физиологическое увеличение объема циркулирующей крови и сердечного выброса на фоне врожденной аномалии коллагена. Определенную роль также имеют гормональные изменения. Гестационная гипертензия и гестозы резко увеличивают риск дилатации, расслоения и разрыва аорты. Своевременная диагностика и терапия внезапного расслоения аневризмы аорты жизненно необходимы, так как около 50% пациентов погибает в течение 48 часов после возникновения осложнения. При беременности этот процент значительно выше. Основными симптомами являются боль в груди, иррадиирующая в спину, плечи и живот. Другие симптомы связаны с осложнениями данного состояния. Наиболее опасными осложнениями являются кровотечения в перикард, плевральную полость, средостение, забрюшинное пространство, стенку легочной артерии, полости сердца. Кроме того, нередко наблюдаются симптомы, связанные с частичной или полной окклюзией различных артерий гематомой средней оболочки аорты. Окклюзия коронарных артерий может привести к внезапной смерти или инфаркту миокарда, общей сонной — к синкопальным состояниям, инсульту или коме, подключичной артерии—ишемии верхних конечностей и парезам, межреберных или поясничных артерий — ишемии спинного мозга. Вследствие дилатации или расслоении аорты на уровне аортального клапана может развиться выраженная аортальная недостаточность и отек легких. Обструкция аорты или легочной артерии нередко приводит к циркуляторному коллапсу.
При физическом обследовании часто выявляются дефицит пульса, диастолический шум на аорте, неврологические проявления (цереброваскулярные нарушения, потеря сознания, парапарезы или параплегии). При рентгенографии грудной клетки обнаруживается расширение средостения. Иногда имеются признаки гемоторакса (в основном левостороннего при расслоении дистального участка аорты). Однако данные рентгенографии неспецифичны и отсутствие патологических изменений на рентгенограммах не позволяет исключить диагноз. Золотым стандартом диагностики расслоения аорты является аортография. Однако во время беременности методами выбора являются контрастная высокоразрешающая компьютерная томография, магнитно-резонансное исследование, трансэзофагеальная эхокардиография и ультразвуковое исследование, что связано с их неинвазивностью и отсутствием отрицательного влияния на плод.
Дифференциальный диагноз расслоения аневризмы аорты у беременных с синдромом Марфана проводится с такими острыми состояниями, как эмболия околоплодными водами, инфаркт миокарда и аортальная регургитация, вызванные другими причинами, а также пневмотораксом, инсультом, разрывом матки, отслойкой плаценты, тромбозом мезентериальных сосудов. В большинстве случаев диагноз расслоения аневризмы аорты устанавливается post mortem.
Для предотвращения и своевременной коррекции угрожающих жизни осложнений на протяжении всей беременности больные с синдром Марфана должны находиться под тщательным наблюдением акушеров и сосудистых хирургов. Всем беременным с синдромом Марфана (даже не ранее не имевшим признаков поражения сердечно-сосудистой системы) показано трансторакальное ультразвуковое исследование или МРТ в динамике. Во многих работах доказана эффективность b-адреноблокаторов для предотвращения прогрессирующей дилатации аорты, аортальной регургитации, расслоения аневризмы аорты, развития застойной сердечной недостаточности [8,14]. При терапии b-адреноблокаторами следует учитывать их возможные побочные эффекты, включающие задержку развития плода, брадикардию, гипогликемию, гипербилирубинемию, повышение тонуса матки, апноэ у новорожденных. В связи с секрецией b-адреноблокаторов в грудное молоко кормление следует проводить только через 3-4 часа после приема препарата, когда его концентрация в плазме начинает снижаться. Четких рекомендаций о показаниях к профилактическому назначению b-адреноблокаторов во время беременности больным синдромом Марфана на данный момент не существует. При расслоении аневризмы дистального отдела аорты используется внутривенное введение b-адреноблокаторов до достижения снижения ЧСС на 20%, снижения АД и сократимости левого желудочка. В последующем переходят на поддерживающую дозу оральных b-адреноблокаторов. Необходимо снижение систолического АД до 100—120 мм рт.ст. или до минимального уровня, необходимого для кровоснабжения жизненноважных органов. Основным средством для снижения АД вне беременности является нитропруссид натрия, обладающий рядом преимуществ по сравнению с другими препаратами (быстрое начало воздействия, короткий период полувыведения и легкость в подборе необходимой дозы). Однако в связи с возможным токсическим действием на плод его применение у беременных ограничено. Поэтому средством выбора для снижения АД у беременных с синдромом Марфана является гидралазин в комбинации с b-адреноблокаторами. Хирургическое вмешательство при расслоении дистального отдела аорты показано при неэффективности медикаментозной терапии, разрыве или угрозе разрыва аорты, прогрессирующем расслоении аневризмы аорты. При расслоении аневризмы проксимального отдела аорты необходимо срочное оперативное вмешательство, так как только эта мера способна предотвратить летальный исход. Срочное хирургическое вмешательство показано также беременным с синдромом Марфана при увеличении диаметра аорты свыше 45 мм: на ранних сроках рекомендуется прерывание беременности, на поздних—кесарево сечение с последующей реконструктивной операцией на аорте. Другим частым показанием к неотложному оперативному вмешательству во время беременности у больных с синдромом Марфана является прогрессирующая аортальная недостаточность. Успех оперативных вмешательств у беременных с синдромом Марфана зависит от тяжести осложнения, срока беременности, своевременности вмешательства. В большинстве случаев хирургическое лечение приводит к прерыванию беременности, поэтому при жизнеспособном плоде до или одновременно с операцией на сердце и сосудах проводится кесарево сечение.
Оптимальным методом родоразрешения беременных с синдромом Марфана является кесарево сечение, что позволяет минимизировать гемодинамические изменения, связанные с вагинальным родоразрешением. Лишь в немногих случаях при диаметре аорты менее 40 мм, отсутствии сопутствующих проявлений заболевания, адекватном обезболивании и хорошем контроле артериального давления возможны роды через естественные родовые пути. В определенных случаях для укорочения второго периода родов показаны акушерские щипцы. Некоторые авторы [8,18] рекомендуют одновременно с кесаревым сечением производить гистерэктомию, так как в послеродовом периоде у родильниц с синдромом Марфана часто отмечаются массивные маточные кровотечения. Причиной таких кровотечений является нарушение сократительной способности спиральных артерий, что имеет место и при других заболеваниях соединительной ткани (например, при синдроме Элерса-Данло).
Синдром Элерса-Данло
Синдром Элерса-Данло представляет собой гетерогенную группу заболеваний соединительной ткани, характеризующихся гиперэластичностью кожи, гипермобильностью суставов и некоторыми другими симптомами. Распространенность этого синдрома варьирует от 1:560 000 до 1:5 000 [11,15].Наибольшее значение в практике акушера-гинеколога имеет сосудистый тип синдрома Элерса-Данло, так как именно он сопровождается различными акушерскими и общемедицинскими проблемами, часто угрожающими жизни. При этом заболевании имеется дефект III типа коллагена, являющегося важнейшим компонентом сосудистой стенки и стенок ЖКТ. Повреждения артерий включают в себя разрывы, расслоения, артерио-венозные фистулы. Склонность к кровотечениям и гематомам объясняется нарушением структуры сосудистой стенки, а не какими-либо дефектами в системе свертывания крови, так как, по данным многих исследователей [11,15], основные показатели гемостаза у таких пациентов чаще всего в норме. Около 50% всех сосудистых повреждений составляют артерии груди и живота. Как правило, вовлекаются артерии среднего калибра. Разрывы артерий часто возникают без какой-то определенной причины. Наиболее опасные осложнения связаны с угрожающими кровотечениями, а также перфорацией кишечника. Часто кровотечения требуют неотложного хирургического вмешательства. Однако трудность заключается в том, что само хирургическое вмешательство может привести к массивным летальным кровотечениям из других артерий. Шансы на успех значительно увеличиваются при своевременной диагностике заболевания, принятии необходимых превентивных мер и использовании наименее травматичной техники хирургического вмешательства.
Одним из наиболее частых проявлений со стороны сосудов головного мозга у больных синдромом Элерса-Данло являются каротидно-кавернозные фистулы.
Частота внутричерепных кровоизлияний у больных с синдромом Элерса-Данло составляет около 4% . В половине случаев происходит разрыв ранее существовавших аневризм. Как можно более раннее установление диагноза у таких пациентов имеет первостепенную важность для выбора тактики дальнейшего обследования и хирургического вмешательства. Стандартная ангиография противопоказана в связи с высоким риском массивных гематом и расслоения стенки артерий. Методами выбора являются допплеровское исследование и МРТ.
Другим частым осложнением у пациентов с синдромом Элерса-Данло является расслоение интра- или экстракраниального сегментов позвоночной и сонной артерий.
Поскольку коллаген III типа является одним из основных компонентов стенок ЖКТ, у пациентов с синдромом Элерса-Данло часто встречается перфорация кишечника. В большинстве случаев в процесс вовлекается сигмовидная кишка, однако описаны также перфорации тонкой кишки и желудка [11].
При планировании беременности у больных с синдромом Элерса-Данло следует учитывать подтип синдрома и присущие ему осложнения, а также риск передачи заболевания плоду (тип наследования). В связи с аутосомно-доминантным типом наследования риск передачи сосудистого типа синдрома Элерса-Данло плоду при наличии заболевания у одного из родителей составляет 50%, поэтому на этапе планирования беременности необходимо генетическое консультирование.
Основным методом диагностики синдрома Элерса-Данло является молекулярный анализ—определение мутации в гене, кодирующем III тип коллагена (COL3A1), расположенном в длинном плече 2 хромосомы (2q24.3-q31).
Особую опасность представляет беременность у женщин с сосудистым вариантом синдрома в связи с высокой вероятностью фатальных кровотечений, инсультов, разрыва матки. При наличии этого варианта синдрома необходимо тщательное обследование, обязательное МРТ головного мозга. Большинству таких женщин беременность противопоказана.
В связи с гемодинамическими и гормональными изменениями у беременных с сосудистым вариантом синдрома Элерса-Данло значительно увеличивается риск разрыва артерий различного калибра, а следовательно, массивных кровотечений, кровоизлияний и инсультов. Наиболее опасным в плане сосудистых осложнений является последний триместр беременности. Большую проблему представляет также внезапный разрыв матки. Материнская летальность при синдроме Элерса-Данло составляет, по данным разных авторов, от 10 до 25% [11,15]. Риск осложнений также чрезвычайно высок во время родов и в раннем послеродовом периоде. У таких женщин часто наблюдаются массивные ранние послеродовые кровотечения, в основе которых лежит нарушение структуры спиральных артерий матки. Единственным способом остановки подобных кровотечений является гистерэктомия.
Некоторые авторы [11] рекомендуют дородовую госпитализацию беременных с синдромом Элерса-Данло со срока 32 недели беременности для пристального наблюдения и немедленных мер в случае осложнений.
Терапия геморрагических осложнений зависит от калибра сосуда и тяжести кровотечения. Как уже упоминалось, инвазивные методы диагностики и лечения таким беременным не показаны, так как часто приводят лишь к усугублению ситуации. В некоторых случаях показано использование 1-деамино-8-D-аргинин вазопрессина (DDAVP).
Для выявления передачи заболевания плоду используется генетический анализ мутации. Теоретически пренатальная диагностика возможна, однако в связи с высоким риском проведения самой процедуры для матери ее применение ограничено.
Вопрос о родоразрешении беременных с синдромом Элерса-Данло является дискутабельным. С одной стороны, плановое кесарево сечение позволяет уменьшить риск осложнений, связанных с физической нагрузкой в родах (разрывы сосудов, инсульты) и маточными сокращениями (разрыв матки), а также обеспечить лучший контроль гемостаза. С другой—любое хирургическое вмешательство у таких больных сопряжено с высоким риском повреждения сосудов и массивного кровотечения, а также осложнениями послеоперационного периода в связи с плохой заживляемостью ран и формированием неполноценного рубца. Все же, по данным литературы, большинство авторов отдают предпочтение кесареву сечению. Длительность послеоперационного наблюдения в этом случае должна быть увеличена в связи с возможными осложнениями.
Синдром Рендю-Ослера
Синдром Рендю-Ослера (врожденная геморрагическая телеангиоэктазия) представляет собой группу аутосомно-доминантных заболеваний. Распространенность заболевания, по различным данным, составляет от 5 до 8 на 1000 населения [6,17]. Клинические проявления наследственной геморрагической телеангиоэктазии связаны с нарушением структуры стенки сосудов (рис. 1).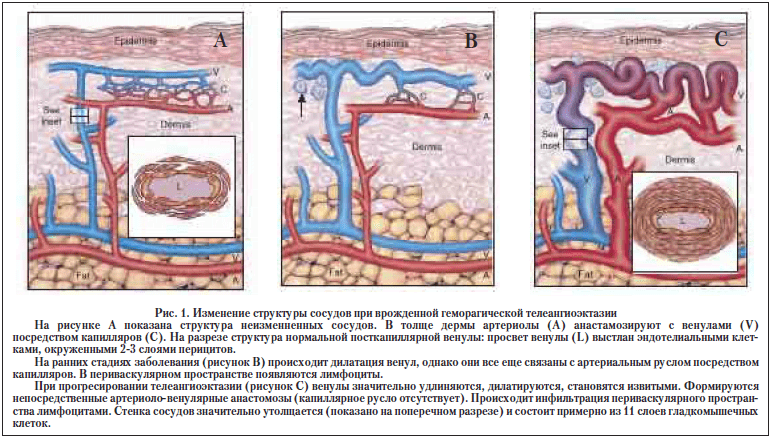
Наиболее частым клиническим проявлением синдрома Рендю-Ослера являются спонтанные рецидивирующие носовые кровотечения (имеются в 78-96% случаев). Другим частым симптомом являются телеангиоэктазии на коже и слизистых, которые появляются в более позднем возрасте, чем носовые кровотечения и имеют тенденцию увеличиваться в размерах и количестве с возрастом. Телеангиоэктазии располагаются на губах, языке, мягком небе, слизистой полости рта, лице, конъюнктивах, ногтевых ложах, пальцах. Более редким проявлением заболевания являются артерио-венозные мальформации, расположенные в различных органах: легких, ЖКТ, печени, головном и спинном мозге. Большую опасность представляют легочные артерио-венозные мальформации. Это прямые анастомозы между легочным артериальным и венозным руслом, минуя капилляры. Симптомы легочных артерио-венозных мальформаций включают в себя одышку, цианоз, кашель, боль в области грудной клетки и др. Наличие легочных артерио-венозных мальформаций может привести к ряду серьезных осложнений, которые можно предотвратить своевременной диагностикой и лечением. Наиболее частыми являются неврологические осложнения, которые включают в себя инсульты, транзиторные ишемические атаки, абсцессы мозга, мигрени. Более редкими, но крайне опасными осложнениями являются гемоторакс и легочное кровотечение.
Основными методами диагностики легочных артерио-венозных мальформаций являются рентгенологическое исследование грудной клетки, методика со 100% кислородом, контрастная эхокардиография, сцинтиграфия, компьютерная томография. Основным методом лечения является чрескожная эмболотерапия.
Иногда у пациентов с врожденной геморрагической телангиэктазией имеются нарушения в системе гемостаза. У многих из них выявляются дефекты функции тромбоцитов и системы фибринолиза. Примерно у 50% больных имеется нерезковыраженный ДВС-синдром, редко переходящий в фульминантную форму.
Таким образом, больные с синдромом Рендю-Ослера имеют высокий риск развития угрожающих жизни осложнений, для предотвращения которой чрезвычайно важна своевременная диагностика заболевания. Для стандартизации подходов к диагностике и для предотвращения случаев гипердиагностики на последнем международном конгрессе в 2000 году были выработаны следующие диагностические критерии заболевания (табл. 2).

Все потомство больных наследственной геморрагической телеангиоэктазией имеет потенциальный риск манифестации заболевания в более позднем возрасте. При постановке диагноза следует исключить дефекты гемостаза. При наличии висцеральных проявлений заболевания у детей следует тщательно проверить остальных членов семьи. В будущем, вероятнее всего, клинический диагноз в соответствии с вышеперечисленными критериями будет заменен молекулярными тестами, которые станут общедоступными.
Беременность у женщин с болезнью Рендю-Ослера связана с чрезвычайно высоким риском осложнений. Вопрос о беременности должен решаться индивидуально в каждом конкретном случае, однако благоприятный исход беременности следует ожидать лишь при правильном ее ведении, включающем своевременную диагностику и терапию осложнений заболевания. Большую опасность представляют осложнения, связанные с наличием легочных артерио-венозных мальформаций, в частности, массивные легочные кровотечения. Изменение гемодинамики и гормонального статуса беременных приводит к ухудшению состояния ранее существовавших мальформаций и росту новых. Во время беременности объем циркулирующей крови увеличивается на 40%, сердечный выброс — на 30-50%, что способствует значительному повышению кровотока в легких и, как следствие, дилатации или разрыву тонкостенных сосудов артерио-венозных мальформаций. Чаще подобные осложнения имеют место во 2-3 триместрах беременности, когда увеличение объема циркулирующей крови и сердечного выброса достигают максимума. Кроме того, высокий уровень прогестерона во время беременности способствует ослаблению стенок венозных сосудов, что также приводит к росту артерио-венозных мальформаций.
На данный момент не существует четких рекомендаций о наиболее целесообразном методе родоразрешения женщин с наследственной геморрагической телеангиоэктазией. Отсутствуют исследования о сравнительной безопасности консервативного и оперативного родоразрешения. В большинстве наблюдений различных авторов [6,17] беременность у женщин с наследственной геморрагической телеангиоэктазией завершилась плановым или экстренным кесаревым сечением. Случаи экстренного оперативного родоразрешения были связаны в основном с несвоевременной диагностикой и коррекцией угрожающих жизни осложнений, (в частности, легочных кровотечений и гемоторакса) [17], причем исход для плода в подобных случаях был не всегда благоприятным и зависел в основном от срока родоразрешения. Плановое оперативное родоразрешение, по-видимому, показано беременным с имеющимися легочными или церебральными мальформациями (или подозрением на их наличие) для уменьшения риска разрыва мальформаций и кровотечений во время родов через естественные родовые пути.
Консервативное родоразрешение беременных с наследственной геморрагической телеангиоэктазией следует рекомендовать при отсутствии церебральных и легочных мальформаций или при их полноценной коррекции до беременности.
В связи с возможными артерио-венозными мальформациями спинного мозга таким беременным не рекомендуется проведение эпидуральной анестезии. Для исключения мальформаций спинного мозга показано магнитно-резонансное исследование.
Таким образом, наиболее безопасной стратегией для женщин с наследственной геморрагической телеангиоэктазией является планирование беременности с тщательным обследованием до беременности, в частности, на предмет наличия артерио-венозных мальформаций в легких и головном мозге (ангиография, МРТ, КТ) и при необходимости их хирургической коррекции. Кроме того, следует учитывать, что риск подобной патологии у детей составляет 50%.
Мы имеем опыт ведения беременности и родов у больных с врожденными заболеваниями соединительной ткани. За последние 10 лет в родильном доме при 67 ГКБ г. Москвы мы наблюдали 27 беременных с врожденными заболеваниями соединительной ткани (12 с синдромом Марфана, 9 с синдромом Элерса-Данло и 6 с синдромом Рендю-Ослера).
Большинство беременных с врожденными заболеваниями соединительной ткани имели различные осложнения во время беременности, родов и послеродового периода, включая дилатацию восходящей аорты, развитие аортальной недостаточности, тромбоз левого предсердия, увеличение выраженности телеангиоэктазий, прогрессирование носовых, десновых или желудочно-кишечных кровотечений, появление артерио-венозных мальформаций в легких, тяжелые послеродовые кровотечения, развитие гематом послеоперационного шва. У 22 беременных с врожденными заболеваниями соединительной ткани выявлены различные дефекты в системе гемостаза, включая нарушение функции тромбоцитов, дефекты в системе фибринолиза и признаки ДВС-синдрома. 24 из 27 беременных с врожденными заболеваниями соединительной ткани были родоразрешены путем операции кесарево сечение, причем основным показанием к операции во всех случаях явилась соматическая патология. Во время операции у большинства таких больных отмечалась повышенная кровоточивость из сосудов мелкого и среднего калибра. С целью профилактики и коррекции тромбогеморрагических осложнений использовались свежезамороженная плазма, транексамовая кислота.












