Иммунотропные препараты. Классификации
Иммунотропные препараты относятся к лекарственным средствам, оказывающим влияние на различные звенья иммунной системы или выработку цитокинов. Классификации иммунотропных препаратов предлагали разные авторы: Р.М. Хаитов, Б.В. Пинегин (1996), Р.И. Сепиашвили (2000), И.В. Нестерова и соавт. (2002), Т.П. Маркова (2003, 2014) [1–4].
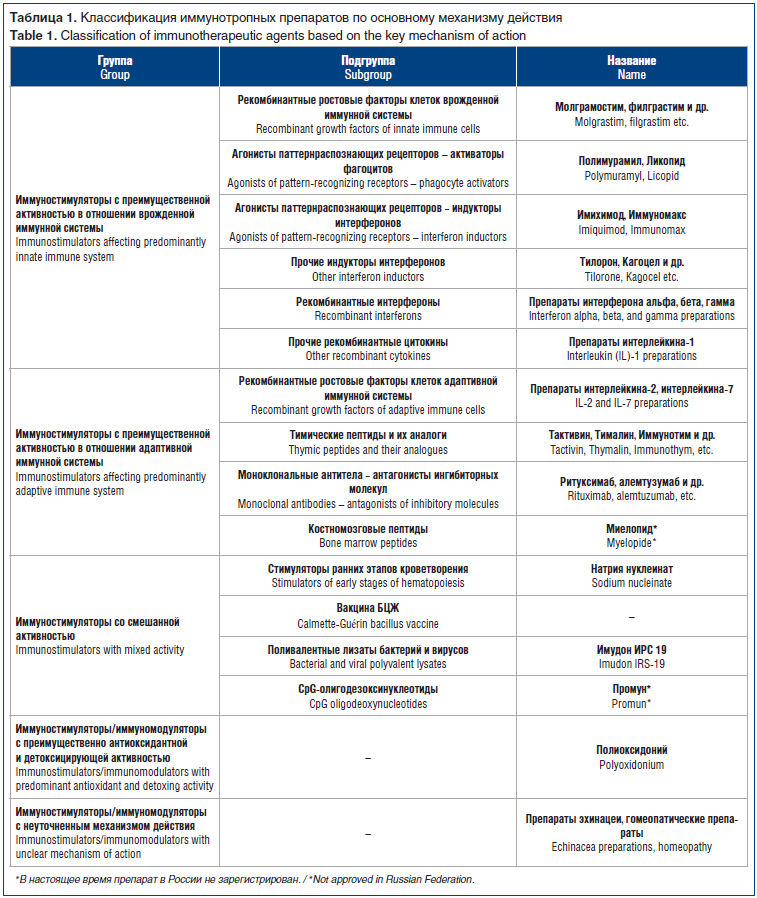
В таблице 1 приведена классификация Р.М. Хаитова иммунотропных препаратов с учетом их происхождения [5] и указаны наиболее известные из них.
Одним из первых официнальных иммунотропных препаратов можно считать левамизол. Механизм действия и возможности его применения в медицине интенсивно изучались в 1960–1970-х гг. Тимические пептиды и их аналоги были созданы и исследованы в 1970–1980-х гг. Ряд препаратов имеют историческое значение, например миелопид, нуклеинат натрия [1–4]. Современные исследования уделяют большое внимание врожденному и мукозальному иммунитету и разработке новых иммунотропных препаратов.
Местный иммунитет и патогены
Углубленное изучение иммунотропных препаратов открывает новые аспекты механизма их действия и влияния на патогенез иммунозависимых заболеваний. Особенности мукозального и врожденного иммунитета, включая сигнальные рецепторы врожденного иммунитета (паттернраспознающие, pattern-recognition receptors — PRR) и их взаимодействие с патогенами, лекарствами (антибиотиками, иммунотропными препаратами), имеют значение для поддержания защитной функции слизистых. Проникновение патогенов в организм человека чаще происходит через слизистые (респираторного и желудочно-кишечного тракта (ЖКТ), мочеполовой системы), поврежденную или воспаленную кожу. Борьба с патогенами осуществляется с участием лимфоидной ткани, ассоциированной со слизистыми и кожей — MALT (mucosal-associated lymphoid tissue). В зависимости от того, где анатомически размещается та или иная барьерная ткань, различают: TALT — носоглотка, евстахиева труба, ухо; NALT — носовая полость, ротоглотка, конъюнктива; BALT — трахея, бронхи, легкие, молочные железы; GALT — пищевод, желудок, тонкий кишечник и проксимальные отделы урогенитального тракта, дистальные отделы урогенитального тракта; SALT — кожа (дерма). MALT — наибольшая по площади (400 м2) часть структур местного иммунитета, где вырабатывается в 200–300 раз больше специфических антител и сконцентрировано 50% иммунокомпетентных клеток. Для защитной функции слизистых также важен качественный состав слизи, в которую входят микробиота, кератин, дефенсины — противомикробные пептиды, секреторный иммуноглобулин А (sIgA). В слизи происходит уничтожение патогенов, что препятствует их проникновению через слизистые, так называемая «неиммунная элиминация» [6, 7].
Взаимодействие бактериальных антигенов с TLR-рецепторами на поверхности дендритных клеток приводит к созреванию, активации дендритных клеток и их миграции в лимфатические узлы. Презентация антигенов дендритными клетками Т- и В-клеткам сопровождается синтезом цитокинов, пролиферацией Т-хелперов и В-лимфоцитов, затем происходит синтез специфических иммуноглобулинов, особенно IgA и sIgA, защищающих слизистые. Уничтожение патогенов может осуществляться фагоцитами и клетками — естественными киллерами (ЕК-клетками) [8, 9].
Антитела обеспечивают процесс опсонизации поступающих в организм патогенных микроорганизмов, что облегчает поглощение и уничтожение патогенов фагоцитами, позволяет снизить частоту, продолжительность и тяжесть инфекционных заболеваний. Фагоциты имеют специфические рецепторы для IgG и IgA, что облегчает фагоцитоз патогенов, покрытых антителами, и уничтожение их с помощью ферментов фагосом. Патогены и специфические IgM, синтезируемые на раннем этапе иммунного ответа, активируют компоненты комплемента С3b и C4b, усиливающие опсонизацию. Фагоциты имеют рецепторы для этих компонентов комплемента, а также компонента С5, который способен активировать и усиливать фагоцитоз, приводящий к уничтожению патогена [8, 9].
За счет циркуляции цитокинов, IgA и sIgA, действия закона «хоминга» для иммунокомпетентных клеток происходит активация местного и системного иммунитета, поддерживается гомеостаз и осуществляется защита организма [6–9].
Иммунотропные препараты. Влияние на врожденный иммунитет
Изучение механизмов развития врожденного иммунитета было ознаменовано присуждением Нобелевской премии в 2011 г. и привело к открытию сигнальных рецепторов sPRR (signal pattern recognizing receptors), взаимодействие которых с патогенами активирует сначала врожденный, а затем адаптивный иммунитет, обеспечивая полноценную противоинфекционную защиту. Среди sPRR-рецепторов в настоящее время различают TOLL-подобные (TLR, NLR, NOD1 и NOD2) и RIG-подобные (RLR, RIG-1 и MDA-5). NLR взаимодействуют с бактериальными, RLR — с вирусными возбудителями внутриклеточно [10, 11]. У млекопитающих описаны и изучены 15 TLR-рецепторов, расположенных на мембране, в цитоплазме, в эндосомах нейтрофильных лейкоцитов, макрофагов, дендритных, эпителиальных и эндотелиальных клеток [6, 12, 13]. У большинства микроорганизмов есть структуры, называемые патоген-ассоциированными молекулярными образами (pathogen-associated molecular pattern, PAMP), к ним можно отнести липополисахариды (ЛПС), липотейхоевые кислоты, маннаны, бактериальную ДНК, двухспиральную РНК вирусов, глюканы грибов. PAMP распознаются сигнальными рецепторами sPRR и индуцируют развитие Т-хелперов 1 или 2 типа (Th1 или Th2). Действие Th1 связано с клеточным ответом цитотоксических Т-клеток, макрофагов против внутриклеточных патогенов (вирусы, микоплазмы, хламидии), паразитов, клеток опухоли и сопровождается синтезом интерферона-γ (ИФНγ), интерлейкина ИЛ-12. При иммунном ответе с участием Th2 происходит преобразование В-лимфоцитов в плазматические клетки, синтез специфических иммуноглобулинов и цитокинов ИЛ-4, ИЛ-6, ИЛ-10, ИЛ-13. У здоровых людей синтезируются IgM, IgG, IgA, а при аллергических заболеваниях — IgE [14].
Отмечается интерес к проведению исследований по разработке препаратов, активирующих врожденный иммунитет, переключение синтеза IgE на синтез Ig других классов, действия Th2 на действие Th1 при иммунном ответе. Известен препарат глюкозаминилмурамилдипептид (ГМДП) — агонист паттернраспознающих рецепторов, активатор фагоцитов, специфический лиганд NOD2-рецептора, активатор фактора транскрипции NF-κB и регулятор синтеза цитокинов (повышает уровень ИФНγ, снижает уровень ИЛ-4) [15, 16]. Показана эффективность ГМДП при воспалительных, опухолевых, аллергических заболеваниях [16]. За рубежом получен синтетический аналог пептидогликана — ромуртид (препарат не зарегистрирован в России) [17].
Выделение фрагментов пептидогликана клеточной стенки грамотрицательных бактерий Salmonella typhi привело к созданию нового препарата Полимурамил в ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Полимурамил активирует цитоплазматические рецепторы врожденного иммунитета NOD1 и NOD2. Мурамилпептиды у здоровых людей как продукты распада клеточной стенки резидентных и транзиторных бактерий в ЖКТ попадают в кровь, органы и ткани и обеспечивают биологический и физиологический тренинг иммунной системы [18].
Химические свойства Полимурамила связаны с наличием в его составе альдегидной, карбоксильной и аминовой групп, он устойчив при рН от 3 до 11 в течение длительного времени. Препарат выпускается в жидком виде, расфасован в ампулы по 0,5 мл (200 мкг активного вещества), представляет собой прозрачную бесцветную жидкость. Полимурамил не обладает митогенным эффектом, не влияет на пролиферативную активность мононуклеаров, стимулированных фитогемагглютинином. На функциональную активность ЕК-клеток препарат оказывает стимулирующий эффект в дозах 1 мкг/мл, 100 нг/мл и 10 нг/мл. При применении больших доз, 100 мкг/мл и 10 мкг/мл эффекта не наблюдалось. В концентрациях 1, 10 и 100 мкг/мл индуцировалась продукция цитокинов ИЛ-12p70 (активатор Т-клеток), фактора некроза опухоли α (ФНО-α) и ИЛ-6 in vitro макрофагами и дендритными клетками [19, 20].
Возможно, под влиянием мурамилпептидов происходит эпигенетическое репрограммирование клеток врожденного иммунитета или поддержание «тренированного иммунитета» для борьбы с патогенами в организме [19, 20].
Показано, что под влиянием Полимурамила (аналогично действию ЛПС) дендритные клетки синтезируют провоспалительные цитокины ФНО-α, ИЛ-6. Незрелые дендритные клетки вырабатывают небольшое количество ФНО-α, ИЛ-6, а Полимурамил способствует созреванию клеток и дополнительно стимулирует синтeз ИЛ-8, CCL5, MIP-1β (macrophage inflammatory protein 1β — макрофагальный белок воспаления 1β). Снижение у дендритных клеток способности синтезировать ИЛ-1β приводит к снижению синтеза ФНО-α, что возможно при различных заболеваниях [18, 19]. Показана неэффективная трансляция мРНК ФНО-α под действием мурамилдипептида (агонист рецептора NOD2) на моноцитарно-макрофагальную линию клеток MAC6. Экспрессия ФНО-α регулируется на стадии транскрипции фактором NF-κB и на стадии трансляции — серин-треониновой киназой МК-2, которая активируется киназой р38. TLR4 рецептор ЛПС может активировать оба пути активации ФНО-α. Мурамилдипептид может взаимодействовать с рецептором NLRP3, что приводит к сборке инфламмасомы и активации каспазы-1, фермент превращает про-ИЛ-1β в активный ИЛ-1β, который активирует киназу МК-2 и р38. Киназа МК-2 усиливает трансляцию цитокинов, включая ФНО-α, ИЛ-6, ИЛ-8. Блокада синтеза ИЛ-1β соответственно подавляет синтез других цитокинов, что важно для понимания патогенеза воспаления при заболеваниях. Рекомбинантный ИЛ-1β связывается с рецепторами с меньшей аффинностью, чем естественный цитокин [18, 19, 21].
Результаты клинического применения Полимурамила
По данным Н.П. Ермошиной, Е.Е. Жильцовой (2013), при добавлении Полимурамила к лечению джозамицином у 14 из 15 больных с хронической пиодермией отмечен полный регресс воспаления, а у 8 из них наблюдалась полная эпителизация. В группе сравнения, получавшей только джозамицин, состояние клинической ремиссии было достигнуто у 2 из 13 пациентов, тогда как полная эпителизация не была достигнута ни у одного из них. В общем анализе крови произошли следующие изменения: нормализация количества лейкоцитов — у 2 пациентов, значительная тенденция к их снижению — у 5, повышение по сравнению с исходными данными — у 2, нормализация количества эозинофилов — у 1, повышение с 5 до 7% эозинофилов — у 1, нормализация палочкоядерных лейкоцитов — у 2, нормализация сегментоядерных (с/я) лейкоцитов — у 1 (у остальных пациентов наблюдалась тенденция к снижению с/я лейкоцитов от 62 до 53%), нормализация количества лимфоцитов — у 3 пациентов с лимфопенией и тенденция к повышению — у 3 пациентов с лимфоцитозом, нормализация показателей — у 6 пациентов с моноцитозом в исходе, моноцитоз — у 4 пациентов с нормальными показателями до лечения, нормализация СОЭ — у 7. В группе сравнения, не получавшей Полимурамил, изменения были следующими: сохранявшийся лейкоцитоз — у 1 пациента, повышение с/я лейкоцитов — у 8, лимфоцитоз — у 5, моноцитоз — у 6. Динамика иммунологических показателей не была достоверной, в целом отмечалась нормализация или повышение количества CD3+, CD4+, CD8+, HLA-DR+, ЕК-клеток, бактерицидности нейтрофильных лейкоцитов, уровня IgG, IgM, снижение индуцированной хемилюминесценции, фагоцитарного индекса по процентному содержанию нейтрофилов и моноцитов. В результате комплексного лечения с Полимурамилом клинический эффект отмечен у 86,7%, а в группе сравнения — у 60% пациентов. Переносимость Полимурамила была хорошей, лишь у 1 больного отмечена болезненность в месте инъекций [22].
М.В. Пащенков и соавт. провели открытое плацебо-контролируемое исследование на больных в возрасте 18–75 лет с гнойно-хирургическими инфекциями (абсцесс, карбункул, фурункул, флегмона). Группа из 30 больных получала Полимурамил по 200 мкг внутримышечно в течение 5 дней в комплексе со стандартной терапией (хирургическое лечение, антибиотики, перевязки с антисептическими растворами и мазью диоксометилтетрагидропиримидин + хлорамфеникол). Группа сравнения (30 больных) получала стандартную терапию. У всех до начала лечения была повышена функциональная активность фагоцитов, после лечения снижались показатели внутриклеточной бактерицидной активности, фагоцитарный индекс, зимозан-индуцированная хемилюминесценция, индекс стимуляции. Внутриклеточная бактерицидность, фагоцитарный индекс нейтрофилов, зимозан-индуцированная хемилюминесценция, уровень сывороточного IgM у больных, получавших Полимурамил, были достоверно выше, чем в группе сравнения. У получавших Полимурамил на 2 дня быстрее нормализовалась температура (p<0,05), но сроки нахождения в стационаре и получения антибиотика в группах были сходными. После окончания курса Полимурамила у 30 пациентов отмечен регресс воспаления, а в группе сравнения улучшение наступило только у 21 из 30 пациентов (p<0,05). Получавшие Полимурамил пациенты субъективно отметили улучшение сна, снижение дискомфорта. Повышение уровня сывороточного IgM важно, т. к. он обладает активностью при уничтожении внеклеточной инфекции. Хорошая эффективность лечения (исчезновение клинических проявлений, регрессия очагов поражения на 75% и более) отмечены у 83,3% получавших препарат и у 56,7% пациентов группы сравнения (разница достоверна). Таким образом, назначение Полимурамила в комплексном лечении больных с гнойно-хирургическими инфекциями ускоряет уменьшение симптомов воспаления, процессы эпителизации в очаге поражения, нормализацию температуры [23].
Хронический парапроктит — заболевание, при котором в 15–30% случаев отмечено формирование параректальных свищей, при этом оперативное лечение в 7–30% не дает положительных результатов. Из 48 больных с хроническим парапроктитом, госпитализированных в колопроктологическое отделение, 28 больных после хирургического вмешательства получали противовоспалительную терапию, анальгетики, перевязки. Дополнительно 20 больным вводили Полимурамил по 200 мкг внутримышечно в течение 5 дней. У получавших Полимурамил отмечена коррекция дисбаланса CD3+CD19- и CD3+СD16+СD56+-клеток. Сохранялся дисбаланс ЕК и CD3+HLA-DR+-клеток. Клинически у этих пациентов наблюдались ускоренные очищение раневой поверхности, формирование грануляций, эпителизация, уменьшалось воспаление, сокращались сроки госпитализации. На 10-е сут воспалительные изменения в ране (гиперемия, отек) в группе, получавшей препарат, наблюдались у 6,5%, а в группе сравнения — у 18,7% пациентов, формирование грануляций в ране наблюдалось у 92,3% и 77,8% больных соответственно [24].
В другом исследовании 30 больных 18–65 лет с гнойно-воспалительными заболеваниями мягких тканей (абсцессы, флегмоны кожи и подкожной клетчатки) без сопутствующей патологии были разделены на 2 группы, сопоставимые по полу, возрасту и клинико-лабораторным проявлениям патологии. Доминирующим инфекционным агентом, высеваемым из раневого экссудата, являлся Staphylococcus aureus. У всех больных были измерены линейные размеры раны (длина, ширина, глубина) и рассчитана площадь до и после лечения. Стандартное лечение включало хирургическое вмешательство, противовоспалительную и антибактериальную терапию, перевязки (группа сравнения). Основная группа дополнительно получала Полимурамил по 200 мкг внутримышечно в течение 5 дней. У этих больных отмечено более выраженное повышение числа моноцитов через 5 дней, чем в группе сравнения (p<0,05). Количество тромбоцитов достоверно повышалось в обеих группах. Количество CD3+СD16+СD56+ ТЕК-клеток достоверно повышалось через 5 дней у пациентов, получавших Полимурамил. Количество CD3-СD16+СD56+ ЕК-клеток повышалось через 5 дней у пациентов, не получавших препарат (p<0,05). У больных, получавших Полимурамил, количество CD3-СD16+СD56+ ЕК-клеток изначально было в пределах нормы и через 5 дней достоверно не менялось. Можно отметить повышение бактерицидной активности лейкоцитов в обеих группах после лечения (p>0,05). Повышение поглотительной активности нейтрофилов через 5 дней было достоверным у получавших Полимурамил. Повышение количества тромбоцитов расценивается положительно в связи с синтезом ранозаживляющего фактора роста. Площадь раны и ее глубина через 5 дней наблюдения были достоверно меньше у пациентов, получавших Полимурамил [25].
В исследовании О.И. Летяевой и соавт. (2018) изучена динамика уровня цитокинов у больных с хронической пиодермией, получавших Полимурамил. Группа из 35 мужчин в возрасте 23–55 лет с хронической пиодермией (остиофолликулит, фолликулит, сикоз, фурункулез) и 2–3 рецидивами в год были рандомизированно разделены на 2 группы: 1-я группа (17 человек) получала стандартное лечение, 2-я группа (18 человек) дополнительно к стандартному лечению получала Полимурамил по 200 мкг внутримышечно в течение 5 дней. Длительность наблюдения составила 6 мес. У пациентов, получавших Полимурамил, наблюдали ускорение регрессии клинических проявлений и индукцию стойкой ремиссии. Через 6 мес. не отмечалось пустул/фурункулов у 9 пациентов из получавших Полимурамил, и только
у 3 пациентов из группы сравнения (p<0,05). Уровень ИФНγ и ИЛ-4 начинал снижаться с 14-го дня наблюдения, через 6 мес. снижение ИФНγ, ИЛ-4, ИЛ-8 и ИЛ-10 оставалось достоверным у пациентов, получавших Полимурамил, при этом в группе сравнения динамика показателей не была достоверной. Через 6 мес. в обеих группах сохранялось достоверное снижение уровня ФНО-α. Снижение уровня цитокинов связано с уменьшением воспаления и выраженности клинических проявлений [26].
Интересные результаты получены при назначении Полимурамила по 200 мкг внутримышечно через день № 5 в комплексном лечении больных с Х-сцепленной агаммаглобулинемией и гипогаммаглобулинемией (общая вариабельная иммунная недостаточность), получавших заместительную терапию иммуноглобулинами (ВВИГ) внутривенно в дозе 0,4 г/кг веса. Полимурамил вводили пациентам, если заместительная терапия ВВИГ была недостаточной и полностью не купировала клинические проявления хронических заболеваний и респираторных инфекций (отиты, синуситы, бронхиты, пиелонефриты, патология ЖКТ). Через 3 мес. после введения Полимурамила у больных отмечено повышение количества активированных CD3+HLA-DR+-клеток с 7,01±1,07% до 19±4,06% и CD8+HLA-DR+-клеток с 6,3±1,17% до 18,9±4,04%. Отмечено повышение экспрессии TLR-рецепторов на моноцитах и TLR4+-клеток с 21,2±2,3% до 43,7±3,81%. Не отмечалось повышения показателя спонтанного теста восстановления нитросинего тетразолия [27, 28]. Применение заместительной терапии ВВИГ и Полимурамила курсами каждые 3 мес. в течение года обеспечило существенный клинический эффект в виде трехкратного снижения частоты обострений очагов хронических инфекций и сокращения потребности в применении антибиотиков на 70% [29].
Заключение
Развитие клинической иммунологии и новые технологии позволили создать инновационные иммунотропные препараты, оказывающие преимущественное воздействие на местный и врожденный иммунитет. Одним из таких препаратов является Полимурамил — агонист паттернраспознающих рецепторов, активатор фагоцитов, ЕК и ЕКТ-клеток, TLR4+-клеток, синтеза регуляторных цитокинов, специфический лиганд NOD1- и NOD2-рецепторов. Полимурамил в комплексном лечении демонстрирует возможности усиления противоинфекционной защиты, включая как местный, так и врожденный иммунитет при хронических инфекционно-воспалительных заболеваниях (абсцессы, флегмоны, парапроктит) у больных с вторичной иммунной недостаточностью и при генетически детерминированных иммунодефицитах (аиммуноглобулинемия и гипоиммуноглобулинемия). Полимурамил является новым достижением в создании иммунотропных препаратов и понимании иммунопатогенеза противоинфекционной защиты.
Благодарность
Публикация осуществлена при поддержке компании ООО «Корус Фарм» в соответствии с внутренней политикой и действующим законодательством РФ. ООО «Корус Фарм», его работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также не несут ответственности за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение ООО «Корус Фарм» может отличаться от мнения авторов и редакции.
Acknowledgement
The publication is supported by LLC «Corus Pharm» according to the internal policy and existing legislation. LLC «Corus Pharm», its employees or representatives did not participate in the writing of this paper and are not responsible for either content or any financial or other agreements with third parties regarding this paper. LLC «Corus Pharm» view can be different from that of the authors and Editorial Board.
Сведения об авторах:
Маркова Татьяна Петровна — д.м.н., профессор, заведующая кафедрой иммунопатологии и иммунодиагностики, ORCID iD 0000-0002-1330-1035;
Чувиров Денис Геннадьевич — к.м.н., доцент кафедры клинической иммунологии и аллергологии, ORCID iD 0000-0002-6109-1669;
Ярилина Лариса Геннадьевна — к.м.н., доцент кафедры иммунопатологии и иммунодиагностики, ORCID iD 0000-0002-0531-2682;
Кожинова Елена Вадимовна — старший преподаватель кафедры клинической иммунологии и аллергологии, ORCID iD 0000-0001-8106-5831.
Академия постдипломного образования ФГБУ ФНКЦ ФМБА России. 125371, Россия, г. Москва, Волоколамское шоссе, д. 91.
Контактная информация: Маркова Татьяна Петровна, e-mail: logot12@list.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 16.02.2020.
About the authors:
Tat’yna P. Markova — MD, PhD, Professor, Head of the Department of Immunopathology and Immunodiagnostics, ORCID iD 0000-0002-1330-1035;
Denis G. Chuvirov — MD, PhD, Associate Professor of the Department of Immunopathology and Immunodiagnostics, ORCID iD 0000-0002-6109-1669;
Larisa G. Yarilina — MD, PhD, Associate Professor of the Department of Immunopathology and Immunodiagnostics, ORCID iD 0000-0002-0531-2682;
Elena V. Kozhinova — MD, Senior Teacher of the Department of Clinical Immunology and Allergy, ORCID iD 0000-0001-8106-5831.
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical Biological Agency of Russian Federation. 91, Volokolamskoe road, Moscow, 125371, Russian Federation.
Contact information: Tat’yna P. Markova, e-mail: logot12@list.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 16.02.2020.












