Введение
Острые респираторные вирусные инфекции (ОРВИ) вызываются разнообразными возбудителями, среди которых вирусы парагриппа, аденовирусы, риновирусы, реовирусы и др. — всего более 300 вирусов. Это самая распространенная группа среди инфекционных заболеваний, характеризующаяся обычно непродолжительной лихорадкой, поражением респираторного тракта и интоксикационным синдромом. Показатели заболеваемости гриппом и ОРВИ ежегодно в России высокие — от 27,3 млн до 41,2 млн человек, заболеваемость гриппом в мире — до 1 млрд случаев, из которых от 3 млн до 5 млн — тяжелые формы. Случаи летальности от гриппа и его осложнений в мире составляют от 250 тыс. до 500 тыс. человек, при этом в последние десятилетия не было отмечено снижения показателей смертности от гриппозной пневмонии [1].Профилактика инфекций дыхательных путей предусматривает использование специфических и неспецифических медицинских средств. Специфическая вакцинопрофилактика существует только для гриппа. Однако с учетом того, что удельный вес гриппа в структуре заболеваемости ОРВИ составляет не более 1%, применение только противогриппозных вакцин не позволяет решить проблему. Широкое распространение получил отечественный препарат умифеновир, который рекомендуется для лечения и профилактики гриппа и ОРВИ у взрослых и детей. Многочисленные экспериментальные и клинические исследования показали, что эффективность умифеновира обусловлена непосредственно вирус-специфическим действием. По механизму противовирусного действия он относится к ингибиторам слияния (фузии), взаимодействует с гемагглютинином вируса и препятствует слиянию липидной оболочки вируса и клеточных мембран. Оказывает умеренное иммуномодулирующее действие. Обладает интерферон-индуцирующей активностью, стимулирует гуморальные и клеточные реакции иммунитета, фагоцитарную функцию макрофагов, повышает устойчивость организма к вирусным инфекциям [2].
Значительные успехи в области иммунологии в последние десятилетия открыли перспективы для пересмотра прежних представлений о возможностях первичной профилактики ОРВИ и создания соответствующих лекарственных средств. Основными требованиями к разрабатываемым препаратам являлись губительное воздействие на большинство респираторных вирусов в сочетании с нормализацией состояния иммунной системы и повышением неспецифической резистентности организма к респираторной вирусной инфекции при отсутствии побочных эффектов.
Иммунитет слизистых реализуется через единую структурированную систему, получившую название «мукоза-ассоциированная лимфоидная ткань» (МАЛТ, mucosa-associated lymphoid tissue). МАЛТ — это самая большая часть иммунной системы, где на общей площади 400 м2 располагаются около 50% иммунокомпетентных клеток (клетки врожденного и приобретенного иммунитета) [3]. МАЛТ обеспечивает многоуровневую защиту организма от проникновения патогенов и чужеродных веществ: от «пассивной» гуморальной защиты через активный антиген-неспецифический врожденный иммунитет к высокоспецифическому адаптивному иммунитету, с возможностью перехода с местного уровня на системный.
Помимо единой структурной организации существует еще одна особенность — активация адаптивного иммунитета в какой-либо части МАЛТ приводит к формированию пула антиген-специфических клеток, часть которого остается в месте начала иммунного ответа, а другая выходит в системный кровоток и расселяется (хоминг) в другие компартменты МАЛТ. За счет этого механизма формируется глобальная защита всех барьерных тканей [3, 4].
Учитывая все возможные опосредованные механизмы воздействия на иммунную систему, представляется оптимальным использование при ОРВИ препаратов интерферона (ИФН). Интерфероны физиологичны, являются естественными медиаторами детально исследованных эффекторных и регуляторных сигналов иммунной системы. Топические формы ИФН вводятся непосредственно в первичные места проникновения вирусов в верхних отделах дыхательных путей и действуют на соответствующие рецепторы эпителиальных и других клеток этого биотопа, а для ректальных форм ИФН конечной мишенью являются нижние отделы респираторного тракта, куда они могут попасть через прямокишечные вены. Доказано, что топические и ректальные формы ИФН приемлемы для укрепления противоинфекционной защиты в разных отделах респираторного тракта [5, 6].
Многие годы интерфероны успешно используются для лечения ОРВИ и гриппа, в частности, препарат Виферон® (ООО «Ферон», Россия). Имеющиеся научные данные характеризуют Виферон® как иммуномодулирующий препарат с выраженным противовирусным эффектом [1, 6, 7],
он выпускается в виде ректальных свечей (регистрационный номер 000017/01), содержащих ИФН альфа-2b (ИФН α-2b) и высокоактивные антиоксиданты — витамины Е и С в 4 различных дозировках: 150 тыс. МЕ, 500 тыс. МЕ, 1 млн и 3 млн МЕ. Мы в своей работе использовали Виферон® в дозе 1 млн МЕ, альфа-токоферола ацетат (0,055 г) и аскорбиновую кислоту (0,0081 г). Также препарат выпускается в виде мази и геля для наружного и местного применения (регистрационный номер геля 001142/02, регистрационный номер мази 001142/01). Лекарственная форма в виде геля использовалась нами интраназально, что обеспечивает простой, безопасный и безболезненный способ применения препарата. Гель Виферон® — комплексный отечественный препарат [8], содержащий ИФН α-2b
(36 000 МЕ / 1 г), альфа-токоферола ацетат (0,055 г), бензойную кислоту (0,00128 г) и лимонной кислоты моногидрат (0,001 г). Природный антиоксидант витамин Е и его синергисты — лимонная и бензойная кислоты, метионин способствуют стабилизации клеточных мембран. Гелевая основа обеспечивает пролонгированное действие препарата, образует защитную пленку, предохраняющую от вторичного инфицирования.
Цель работы: оценка клинико-иммунологической эффективности комбинации ректальной и топической форм ИФН α-2b (Виферон®) в лечении ОРВИ у взрослых.
Материал и методы
В 2016–2018 гг. под наблюдением в условиях поликлиники № 180, НККДЦ ЦНИИ Эпидемиологии и ИГБ № 2 находились 89 пациентов (из них 48 мужчин и 41 женщина в возрасте от 18 до 45 лет, средний возраст — 28,3±1,9 года) с неосложненными формами ОРВИ на момент обращения. Все пациенты были включены в исследование не позднее 48 ч от момента появления первых симптомов заболевания.
Критерии исключения из исследования: пациенты, принимавшие противовирусные и иммуномодулирующие препараты в течение 1 мес. до заболевания,
а также имеющие в анамнезе хронические заболевания органов дыхания, сердечно-сосудистой и эндокринной систем; больные ОРВИ с осложнениями в момент скрининга; выявление респираторных инфекций Chlamydia pneumoniae и Mycoplasma pneumoniae; проявившаяся в ходе исследования аллергическая реакция на лекарственные препараты; несоблюдение кратности и схемы приема препарата; отказ пациента от продолжения участия в исследовании.
Также была обследована группа из 30 условно здоровых лиц (контрольная группа), сопоставимых по возрасту и полу с основной группой, не болевших респираторными инфекциями и не принимавших антибактериальные и противовирусные препараты в течение последних 6 мес.
Всем пациентам после подписанного информированного согласия на участие в исследовании проведено комплексное обследование, включавшее в себя клинический анализ крови, общий анализ мочи; верификацию возбудителей респираторной инфекции методом полимеразной цепной реакции (ПЦР) — исследование мазков из носа и ротоглотки на респираторные инфекции в лаборатории ЦНИИЭ. Исследования концентрации секреторного иммуноглобулина А (sIgA) в назальных пробах (экстракция мазка из носа в 1 мл физиологического раствора методом иммуноферментного анализа (ИФА) (тест-системы
АО «Вектор-БЕСТ», Россия) и уровней сывороточного ИФН, спонтанной и индуцированной концентрации цитокинов ИФН-α, ИФН-γ в сыворотке крови проводили на базе лаборатории онтогенеза и коррекции системы интерферона ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Концентрацию ИФН-α и ИФН-γ в плазме крови и супернатантах культур клеток крови определяли методом твердофазного «сэндвич»-варианта иммуноферментного анализа (ИФА) с помощью наборов АО «Вектор-Бест» на микропланшетном ридере Anthos 2020 (Австрия).
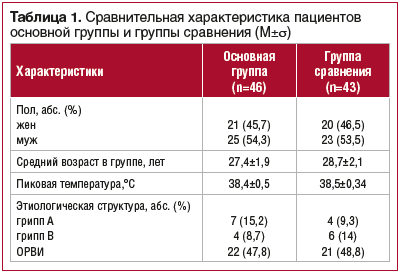
Больные были рандомизированы в 2 сопоставимые группы. В 1-й (основной) группе (n=46) пациенты в течение
5 дней в составе комплексного лечения получали 2 р./сут ректальные свечи Виферон®, содержащие 1 млн МЕ ИФН α-2b, и интраназально Виферон® гель для наружного и местного применения, содержащий 36 000 МЕ / 1 г ИФН α-2b, 3 р./сут в течение 5 дней. Во 2-й группе (сравнения) (n=43) больным назначали умифеновир по 200 мг 4 р./сут в течение 5 дней.
Помимо противовирусной терапии пациенты получали симптоматическое лечение (ирригационные процедуры, деконгестанты, парацетамол/ибупрофен при температуре выше 38,5 °C). Характеристика групп наблюдения представлена в таблице 1.
Все исследования проводились в динамике: в 1-й день включения и на следующий день после окончания терапии; по необходимости проводились пульсоксиметрия, рентгенография органов грудной клетки, электрокардиография.
В процессе лечения ежедневно регистрировались субъективные жалобы пациентов в дневнике самоконтроля состояния, проводилась термометрия 2 р./сут, осуществлялись осмотр и контроль ведения дневника пациентом в 1-й и 6-й дни терапии. Проводилась оценка эффективности противовирусной терапии по клинико-лабораторным данным в группах сравнения в динамике.
Математическую обработку данных осуществляли с помощью программы Statistica 8 (StatSoftInc). Сравнение независимых выборок по количественным характеристикам проводили с помощью критерия Манна — Уитни. Результаты сравнений считались статистически значимыми при р<0,05.
Результаты исследования
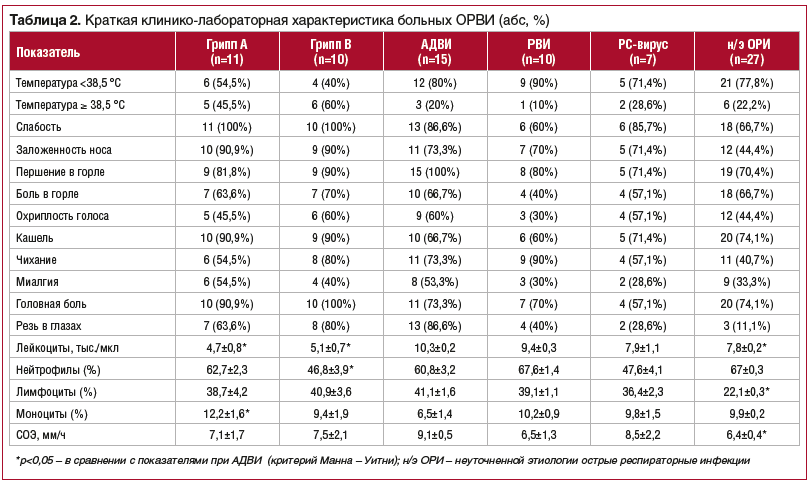
Клиническая картина заболевания была типичной, заболевание начиналось остро: с лихорадки, интоксикации, катарально-респираторного синдрома разной степени выраженности. Основными жалобами были повышение температуры, преимущественно сухой кашель, боль и першение в горле, насморк и/или заложенность носа, слабость, головная боль, ломота в теле. Методом ПЦР у пациентов были выявлены грипп типа А и В у 11 (12,4%) и 10 (11,2%) больных соответственно, риновирус (РВИ) — у 11 (12,4%), аденовирус (АДВИ) — у 15 (16,9%), РС-вирус — у 7 (7,9%), парагрипп — у 3 (3,4%), микст-инфекции (сочетание различных респираторных инфекций) — у 5 (5,6%). В 30,3% (n=27) случаев не удалось обнаружить возбудителей респираторных инфекций.Клинические и лабораторные показатели во всех случаях свидетельствовали о легком или среднетяжелом течении заболевания. Клинико-лабораторная характеристика больных ОРВИ в зависимости от этиологии представлена в таблице 2. Грипп характеризуется выраженной интоксикацией, лейкопенией и длительно сохраняющейся астенизацией. АДВИ характеризуется лейкоцитозом, выраженным катаральным синдромом на фоне умеренно выраженной интоксикации и лимфоаденопатией в 68% случаев.
Анализ основных клинических симптомов в сравниваемых группах не выявил значимых различий в их частоте до начала терапии, что позволило объективно оценить клиническую эффективность различных схем терапии. Сравнительный анализ эффективности терапии оценивался по следующим критериям: сроки нормализации температуры, сроки исчезновения основных клинических симптомов, элиминация вируса после терапии. Сравнительный анализ продолжительности основных клинических синдромов в группах наблюдения представлен в таблице 3.

В проведенном сравнительном исследовании клинической эффективности противовирусной терапии ОРВИ в обеих группах получены сопоставимые результаты, однако прослеживается выраженная тенденция к сокращению продолжительности лихорадочного периода, интоксикационного синдрома и астенизации в основной группе. На 3-й день (по дневнику контроля) значительное улучшение наблюдалось в обеих группах, но в основной группе улучшение отмечалось в 76,7% случаев, тогда как в группе сравнения — в 65,7% случаев. На 5-й день терапии в основной группе у 1 больного (2,2%) не было улучшения
(с 3-го дня), выявлен острый бронхит, назначена соответствующая терапия. В группе сравнения у 3 больных (7%) отсутствовало улучшение с 3-го дня, 2 пациентам назначена антибактериальная терапия (синусит, тонзиллит). Отмечается меньшая динамика в элиминации АДВИ на 6-й день лечения: 49% — в основной группе и 41% — в группе сравнения при клинической стабилизации и на фоне выраженной положительной динамики в 97% случаев в основной группе и в 93% случаев в группе сравнения.
При оценке интерферонового статуса выявлены низкая концентрация ИФН-α в сыворотке крови и отсутствие спонтанной продукции в 74% случаев. Индуцированная выработка ИФН-α клетками крови у больных ОРВИ снижена, и сравнительный анализ не выявил межгрупповых отличий по этому показателю до лечения. Наблюдалось более значимое повышение уровня ИФН-α в основной группе при снижении уровня индуцированной продукции ИФН-α в сыворотке крови больных в группе сравнения после терапии. У больных оказались исходно статистически значимо ниже показатели индуцированной продукции ИФН-γ, чем у здоровых лиц (p<0,05). Выявлено повышение индуцированной продукции ИФН-γ в группе сравнения, в то время как применение комбинации ректальной и топической формы Виферона не оказывало значимого влияния на продукцию ИФН-γ (рис. 1).

Оценка продукции секреторного иммуноглобулина А (sIgA) в назальных пробах не выявила значимых отклонений между группами наблюдения. После лечения (рис. 2) выявлены достоверное повышение продукции sIgA (1,32±0,12 мг/л) в основной группе и выраженное снижение его продукции в группе сравнения — до 0,84±0,11 мг/л. Такой эффект ИФН объясняется усилением секреции sIgA эпителиоцитами и значительным влиянием на гуморальный иммунитет, что обеспечивает выраженный протективный эффект при проведении профилактики инфицирования патогенами.

В период наблюдения не отмечено никаких нежелательных явлений при применении препаратов умифеновир и Виферон® в ректальной и интраназальной формах. Лекарственные средства хорошо переносились, не вызывали аллергических реакций и побочных эффектов.
Заключение
Результаты исследования свидетельствуют, что совместное применение ректальных и топических форм ИФН α-2b (Виферон® свечи + Виферон® гель) позволяет получать положительные результаты, которые можно видеть при оценке клинической эффективности лечения: сокращается продолжительность лихорадочного периода, интоксикационного синдрома и астенизации, снижается число бактериальных осложнений, ускоряется достижение клинической ремиссии. Положительные клинические эффекты, как правило, сопровождаются позитивной динамикой со стороны показателей иммунной системы. Комбинация ректальной и топической форм ИФН α-2b (Виферон® свечи + Виферон® гель) обеспечивает положительную клиническую динамику к 3-му дню от начала лечения, является эффективной и безопасной терапией для больных ОРВИ и гриппом (97%). Кроме того, по эффективности эта комбинация сопоставима с терапией умифеновиром (93%) и даже превосходит его по иммуномодулирующему и протективному эффекту.Исходя из полученных данных доказано, что совместное применение препарата Виферон® в форме суппозиториев и геля в комплексной терапии ОРВИ и гриппа решает вопрос выбора эффективного и безопасного средства.












