–Т–≤–µ–і–µ–љ–Є–µ
–Ю—Б—В—А—Л–µ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–Ю–†–Ч) –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—Б—В–∞—О—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –Є —Б–Њ—Б—В–∞–≤–ї—П—О—В –і–Њ 90% –≤—Б–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —Г –і–µ—В–µ–є.. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–Њ–±—А–µ—В–∞—О—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є (–Ю–†–Т–Ш) —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (75вАУ80%) –Є –Њ–њ–њ–Њ—А—В—Г–љ–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, —В—А–µ–±—Г—О—Й–Є–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Р–С–Ґ) —Б–Њ–≥–ї–∞—Б–љ–Њ –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –њ–Њ –Њ–Ї–∞–Ј–∞–љ–Є—О –њ–Њ–Љ–Њ—Й–Є –і–µ—В—П–Љ —Б –Ю–†–Т–Ш [1]. –Ю–і–љ–∞–Ї–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ј–і–Њ—А–Њ–≤—М—П –і–µ—В–µ–є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –∞–Ї—В–Є–≤–љ–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –њ—А–Њ–±–ї–µ–Љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –і–µ—В–µ–є —Б –Љ–Є–Ї—А–Њ—Н–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ —З–∞—Й–µ —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П –њ–Њ–≤—В–Њ—А–љ—Л–µ –Ю–†–Ч [2вАУ4]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Є–Ј—Г—З–µ–љ–Є–µ –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є –њ–Њ–Є—Б–Ї —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ–Њ–і—Е–Њ–і–Њ–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –і–µ—В–µ–є —Б –Ю–†–Ч –љ–∞ —Д–Њ–љ–µ –Р–С–Ґ —П–≤–ї—П—О—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ–Є.
–Ю—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ—А–Є–≤–ї–µ–Ї–∞–µ—В –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ю–†–Т–Ш, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –Є–Љ–Љ—Г–љ–Њ—В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ).
–І–∞—Б—В–Њ—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ю–†–Т–Ш –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –≤ –†–§ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 30% –і–Њ 80%, –і–Њ—Б—В–Є–≥–∞—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞—Е 98% [5]. –Ґ–∞ –ґ–µ —В–µ–љ–і–µ–љ—Ж–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –Є –і–ї—П –і—А—Г–≥–Є—Е —Б—В—А–∞–љ. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –њ—А–Є–≤–Њ–і—П—В—Б—П –і–∞–љ–љ—Л–µ –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є –Ю–†–Т–Ш —Г –і–µ—В–µ–є –≤ 14вАУ80% —Б–ї—Г—З–∞–µ–≤ [4].
–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б—В—А–∞–љ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —З–∞—Б—В–Њ—В–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —В–∞–Ї–Є—Е –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–∞–Ї –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ —Б –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є, –љ–Њ–≤—Л–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л, –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б—В–∞—А—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –і–µ–є—Б—В–≤–Є—П (–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –Є —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤) [4, 5]. –Ю–і–љ–∞–Ї–Њ –њ—А–Є —Б—В—А–µ–Љ–ї–µ–љ–Є–Є –і–Њ–±–Є—В—М—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤–µ–ї–Є–Ї —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є.
–Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В–Є–≤–љ—Л–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –∞–љ–∞—Н—А–Њ–±–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л –≤—Л–Ј—Л–≤–∞—В—М –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј –Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Г—О –і–Є–∞—А–µ—О (–Р–Р–Ф), —А–Є—Б–Ї –Ї–Њ—В–Њ—А—Л—Е –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤, —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ II –Є III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П.. –Я–Њ –і–∞–љ–љ—Л–Љ L. McFarland [6], —Н—В–Є –љ–∞—А—Г—И–µ–љ–Є—П –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ 5вАУ10% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ–∞, –≤ 10вАУ25% вАФ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ –Є —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ IIвАУIII –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Є –ї–Є—И—М –≤ 2вАУ5% —Б–ї—Г—З–∞–µ–≤ вАФ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і—А—Г–≥–Є—Е –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ, –Љ–∞–Ї—А–Њ–ї–Є–і—Л (—Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ), –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ, –Ї–Њ-—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї, —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л, –∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–Њ–Ј–Є–і—Л (–Ї–∞–љ–∞–Љ–Є—Ж–Є–љ, –≥–µ–љ—В–∞–Љ–Є—Ж–Є–љ) [7].
–Э–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Р–Р–Ф –љ–µ –≤–ї–Є—П–µ—В –њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞. –°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞—О—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Р–Р–Ф —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Р–С–Ґ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –µ–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—Г—А—Б–Њ–≤, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –≤—Л–≤–Њ–і—П—Й–Є—Е—Б—П —Б –ґ–µ–ї—З—М—О [8].
–Я–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –Њ–±–ї–Є–≥–∞—В–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –њ—А–Є–≤–Њ–і–Є—В –Ї –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ—Г –Љ–Є–Ї—А–Њ–±–љ–Њ–Љ—Г —А–Њ—Б—В—Г –Є –љ–∞—А—Г—И–µ–љ–Є—О –≥–Є–і—А–Њ–ї–Є–Ј–∞ —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –∞ –≤–Љ–µ—Б—В–µ —Б —Н—В–Є–Љ –Є –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Ї–Њ—А–Њ—В–Ї–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–Ъ–¶–Ц–Ъ), –Ї–Њ—В–Њ—А—Л–µ (–Њ—Б–Њ–±–µ–љ–љ–Њ –Љ–∞—Б–ї—П–љ–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Є –∞—Ж–µ—В–∞—В) —Б–ї—Г–ґ–∞—В –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Н–љ–µ—А–≥–Є–Є –і–ї—П —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–Њ–≤ –Ї–Є—И–µ—З–љ–Є–Ї–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –∞ —В–∞–Ї–ґ–µ —Г—З–∞—Б—В–≤—Г—О—В –≤ —Б–µ–Ї—А–µ—Ж–Є–Є —Б–ї–Є–Ј–Є, —А–µ–≥—Г–ї—П—Ж–Є–Є –Є–Њ–љ–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –≤ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–µ, —Г–≥–љ–µ—В–∞—О—В —А–Њ—Б—В –њ–∞—В–Њ–≥–µ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л [9, 10]. –†–Њ–ї—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –і–Є–∞—А–µ–є–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –љ–∞–Є–±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ–∞ –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Њ–љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–∞ 1вАУ3-–є –і–µ–љ—М –Њ—В –љ–∞—З–∞–ї–∞ –Р–С–Ґ [11].
–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є –Р–Р–Ф –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є—Б—В–Њ—Й–µ–љ–Є–µ –±—Г—В–Є—А–∞—В-–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –∞–љ–∞—Н—А–Њ–±–Њ–≤ (Bacteroides, Cloctridium, Eubacterium, Lachnospira, Fusobacterium –Є –і—А.), –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П вАФ –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ–ї–љ–Њ–є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є.. –≠—В–Њ, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–Љ–µ–љ–љ–Њ –±—Г—В–Є—А–∞—В–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –і—А—Г–≥–Є—Е –Ъ–¶–Ц–Ъ (–∞—Ж–µ—В–∞—В, –ї–∞–Ї—В–∞—В) —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П [12]. C–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –±—Г—В–Є—А–∞—В–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –і–µ—Д–Є—Ж–Є—В—Г —Н–љ–µ—А–≥–Њ–Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Є –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –њ–Њ–Ї—А–Њ–≤–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П, –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ї–Є—И–µ—З–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ –њ–Є—Й–µ–≤–Њ–≥–Њ –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –љ–∞—А—Г—И–µ–љ–Є—О –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –≤–Њ–і—Л –Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤..
–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є —А–∞–Ј–≤–Є—В–Є–µ –љ–∞ –Є—Е —Д–Њ–љ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ вАФ –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ—А–Њ–±–ї–µ–Љ—Л —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є Clostridium difficile. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б—З–Є—В–∞—О—В –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –∞–≥–µ–љ—В–Њ–Љ –Р–Р–Ф C. difficile, —Б –Ї–Њ—В–Њ—А–Њ–є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ 10вАУ25% –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Р–Р–Ф –Є –і–Њ 90вАУ100% —Б–ї—Г—З–∞–µ–≤ –њ—Б–µ–≤–і–Њ–Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–ї–Є—В–∞ [13, 14]. –Т –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —А–∞–±–Њ—В–∞—Е —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –∞–≤—В–Њ—А–Њ–≤ –њ–Њ–ї—Г—З–µ–љ—Л —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –і–∞–љ–љ—Л–µ вАФ 14,7% Cl. difficile-–і–Є–∞—А–µ–є –Њ—В –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–ї–Є—В–Њ–≤ [15].
–Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–Є—И–µ—З–љ—Л—Е –±–Є—Д–Є–і–Њ–±–∞–Ї—В–µ—А–Є–є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—М–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –Ј–∞ —Б—З–µ—В –≤—Л—А–∞–±–Њ—В–Ї–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ –њ–∞—В–Њ–≥–µ–љ—Л, —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –∞–Љ–Љ–Є–∞–Ї–∞ –≤ –Ї—А–Њ–≤–Є –Є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤.
–Т —Б–≤—П–Ј–Є —Б –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ—Л–Љ –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Ј–∞–і–∞—З–µ–є —П–≤–ї—П–µ—В—Б—П –њ–Њ–Є—Б–Ї –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е —Б—В—А–∞—В–µ–≥–Є–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є –≤ –≤–Є–і–µ –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Є –Ю–†–Ч –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤.
–Т —А–µ—И–µ–љ–Є–Є —Н—В–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–і–∞–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ –Є–Ј –≥—А—Г–њ–њ—Л —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤ –Є –њ–Њ–ї–Є–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л—Е –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±–љ—Л –Њ–Ї–∞–Ј—Л–≤–∞—В—М —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Љ–Є–Ї—А–Њ—Н–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П —Г —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –і–µ—В–µ–є, —З—В–Њ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [16вАУ19].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–Љ –њ—А–Є –і–Є–∞—А–µ–є–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ, —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В –љ–∞ –Њ—Б–љ–Њ–≤–µ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ вАФ —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П, –њ–Њ–Ї–∞–Ј–∞–≤—И–Є–є –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [20вАУ22].
–Ц–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В –і–Њ—Б—В–Є–≥–∞–µ—В –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї—Г—О –Ј–∞—Й–Є—В—Г —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Њ—В –Љ–∞—Б—Б–Њ–≤–Њ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –≤–Є—А—Г—Б–Њ–≤/–±–∞–Ї—В–µ—А–Є–є, –Є—Е —В–Њ–Ї—Б–Є–љ–Њ–≤ –Є –Ї–Є—Б–ї–Њ—В, –≤—Л–і–µ–ї—П–µ–Љ—Л—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –±—А–Њ–ґ–µ–љ–Є—П, –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Њ–є —Б—В–µ–љ–Ї–Є, –Њ–±—А–∞–Ј—Г—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ —В–Њ–љ–Ї—Г—О –Ј–∞—Й–Є—В–љ—Г—О –њ–ї–µ–љ–Ї—Г вАФ ¬Ђ–±–Є–Њ–±–∞—А—М–µ—А¬ї, –Ї–Њ—В–Њ—А—Л–є –Ј–∞–Ї—А—Л–≤–∞–µ—В —А–∞–Ј—А—Г—И–µ–љ–љ—Л–µ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Н–њ–Є—В–µ–ї–Є—П.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В –љ–µ —В–Њ–ї—М–Ї–Њ –Ј–∞—Й–Є—Й–∞–µ—В —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –Ц–Ъ–Ґ, –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В –∞–і–≥–µ–Ј–Є—О –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –љ–∞ —Н–љ—В–µ—А–Њ—Ж–Є—В–∞—Е –Є —Г–Љ–µ–љ—М—И–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О, –њ–Њ–і–Њ–±–љ–Њ —Н–љ—В–µ—А–Њ—Б–Њ—А–±–µ–љ—В–∞–Љ, –љ–Њ –Є –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В –±–∞–ї–∞–љ—Б –Љ–µ–ґ–і—Г —Б–µ–Ї—А–µ—Ж–Є–µ–є –Є –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ–Љ –≤–Њ–і—Л –Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, —В–∞–Ї –Ї–∞–Ї –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–µ–є—Б—В–≤–Є–µ, —Б–≤–Њ–є—Б—В–≤–µ–љ–љ–Њ–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–∞–Љ..
–Т –Њ—Б–љ–Њ–≤–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –ї–µ–ґ–Є—В –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –Њ—В–Њ–±—А–∞–љ–љ—Л—Е –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ Lactobacillus rhamnosus GG (LGG) –Є Bifidobacterium BB-12 (BB-12), –Ї–Њ—В–Њ—А—Л–µ –і–Њ–њ–Њ–ї–љ—П—О—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і—А—Г–≥ –і—А—Г–≥–∞, –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –Ї–Є—И–µ—З–љ—Г—О –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Г, —Б–љ–Є–ґ–∞—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М —Б—В–µ–љ–Њ–Ї –Ї–Є—И–µ—З–љ–Є–Ї–∞, –Є —Г–і–∞–ї—П—О—В —В–Њ–Ї—Б–Є–љ—Л, –њ–Њ–Љ–Њ–≥–∞—П —Г—Б—В—А–∞–љ—П—В—М —Б–Є–Љ–њ—В–Њ–Љ—Л –Ї–Є—И–µ—З–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤.
LGG –Є BB-12 –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є –Њ–±–ї–∞–і–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Б–Є–љ–µ—А–≥–Є–Ј–Љ–Њ–Љ, —Б–Њ–Ј–і–∞–≤–∞—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Г—О –і–ї—П –њ–∞—В–Њ–≥–µ–љ–Њ–≤ —Б—А–µ–і—Г, –≤ –Ї–Њ—В–Њ—А–Њ–є –Њ–љ–Є –±—Л—Б—В—А–Њ –њ–Њ–≥–Є–±–∞—О—В. –Ю–±–∞ —И—В–∞–Љ–Љ–∞ —Г–Ї–∞–Ј–∞–љ—Л –≤ –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –ї–µ—З–µ–љ–Є—О –≤–љ—Г—В—А–Є–±–Њ–ї—М–љ–Є—З–љ–Њ–є –і–Є–∞—А–µ–Є (Grade of recommendation for prevention nosocomial diarrhea, 2016) –Є –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –ї–µ—З–µ–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–Є–∞—А–µ–Є (Grade of recommendation for treatment of antibiotic-associated diarrhea, 2016) [23, 24].
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤–Њ –Љ–љ–Њ–≥–Є—Е —А–∞–±–Њ—В–∞—Е –і–Њ–Ї–∞–Ј–∞–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Љ—Г–ї—М—В–Є–њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е LGG –Є BB-12, –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –±–Є–Њ—В–Њ–њ–Њ–≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –Ї–∞–Ї –њ—А–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ, —В–∞–Ї –Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ю–†–Ч [25вАУ27]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е LGG, –љ–∞ 27вАУ31% —Г–Љ–µ–љ—М—И–∞–µ—В —З–∞—Б—В–Њ—В—Г –≤—Б–µ—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Ю–†–Ч.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАФ —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Љ–µ—В–Њ–і –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –Р–С–Ґ —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –Њ—Ж–µ–љ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤..
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т 2019вАУ2020 –≥–≥. –љ–∞ –±–∞–Ј–µ –У–С–£–Ч ¬Ђ–Ф–У–Ъ–С вДЦ 9 –Є–Љ. –У.–Э. –°–њ–µ—А–∞–љ—Б–Ї–Њ–≥–Њ –Ф–Ч–Ь¬ї –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –љ–∞—Е–Њ–і–Є–ї–Њ—Б—М 90 –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 12 –і–Њ 60 –Љ–µ—Б.. (–Љ–µ–і–Є–∞–љ–∞ вАФ 36 –Љ–µ—Б.; –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е (–Ь–Ъ–†) вАФ 25вАУ43 –Љ–µ—Б.), —Б –Ї–ї–Є–љ–Є–Ї–Њ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Ю–†–Ч, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Р–С–Ґ. –Ф–µ—В–µ–є —А–∞–Ј–і–µ–ї–Є–ї–Є –љ–∞ 3 –≥—А—Г–њ–њ—Л –Љ–µ—В–Њ–і–Њ–Љ —Б–ї—Г—З–∞–є–љ–Њ–є –≤—Л–±–Њ—А–Ї–Є.. –Т 1-—О –≥—А—Г–њ–њ—Г –≤–Ї–ї—О—З–Є–ї–Є 30 –і–µ—В–µ–є (–Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ вАФ 31,5 –Љ–µ—Б.; –Ь–Ъ–† вАФ 24вАУ42,75 –Љ–µ—Б.), –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Р–С–Ґ (—Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ—Л –Є–ї–Є –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е) –Є –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б LGG¬Ѓ –Є BB-12¬Ѓ –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 109 –Ъ–Ю–Х (–Р–і–Є–∞—А–Є–љ¬Ѓ –Я—А–Њ–±–Є–Њ, 6 –Ї–∞–њ–µ–ї—М 1 —А/—Б—Г—В). –Т–Њ 2-—О –≥—А—Г–њ–њ—Г –≤–Ї–ї—О—З–Є–ї–Є 30 –і–µ—В–µ–є (–Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ вАФ 36 –Љ–µ—Б., –Ь–Ъ–† вАФ 26,5вАУ44,75 –Љ–µ—Б.), –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–С–Ґ (—Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ—Л, –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л –Є –Љ–∞–Ї—А–Њ–ї–Є–і—Л –≤ –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е) –Є —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В (–Р–і–Є–∞—А–Є–љ¬Ѓ, 250 –Љ–≥ 3вАУ4 —А/—Б—Г—В). –Т 3-—О –≥—А—Г–њ–њ—Г –≤–Њ—И–ї–Є 30 –і–µ—В–µ–є (–Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ вАФ 39 –Љ–µ—Б., –Ь–Ъ–† вАФ 28,75вАУ44,25 –Љ–µ—Б.), –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ –Р–С–Ґ (–≥—А—Г–њ–њ—Л —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤, –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е).
–Ґ–∞–Ї–ґ–µ –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –і–µ—В–Є –њ–Њ–ї—Г—З–∞–ї–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О (–ґ–∞—А–Њ–њ–Њ–љ–Є–ґ–∞—О—Й–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Є, –Љ—Г–Ї–Њ–ї–Є—В–Є–Ї–Є –Є –і—А.).
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П: –≤–Њ–Ј—А–∞—Б—В вАФ –Њ—В 12 –і–Њ 60 –Љ–µ—Б.; –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Р–С–Ґ –њ–Њ –њ–Њ–≤–Њ–і—Г –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Є –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є; –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ —Г–Ї–∞–Ј–∞–љ–Є–є –љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б., –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–≤—И–Є—Е —А–∞–Ј–≤–Є—В–Є—О –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –±–∞–Ї—В–µ—А–Є–Њ—Д–∞–≥–Њ–≤ –Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л; –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ —А–Њ–і–Є—В–µ–ї–µ–є –Є–ї–Є –і—А—Г–≥–Є—Е –Ј–∞–Ї–Њ–љ–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –±–Њ–ї—М–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞ –љ–∞ –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–Ъ—А–Є—В–µ—А–Є–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П: –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –Є–ї–Є –і—А—Г–≥–Є–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–Њ–Љ –Є–ї–Є —И—В–∞–Љ–Љ–∞–Љ–Є LGG –Є BB-12, –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ; –≤–Њ–Ј—А–∞—Б—В –Љ–ї–∞–і—И–µ 12 –Љ–µ—Б..; –Њ—В–Ї–∞–Ј —А–Њ–і–Є—В–µ–ї–µ–є –Є–ї–Є –і—А—Г–≥–Є—Е –Ј–∞–Ї–Њ–љ–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –±–Њ–ї—М–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞ –Њ—В —Г—З–∞—Б—В–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є; —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Є; —Б—В–Њ–є–Ї–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Ц–Ъ–Ґ (—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–њ–Њ—А—Л, —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б –Ј–∞–њ–Њ—А–∞–Љ–Є).
–Ъ—А–Є—В–µ—А–Є–Є –і–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –≤—Л–±—Л—В–Є—П: –њ–Њ—П–≤–ї–µ–љ–Є–µ –∞–ї–ї–µ—А–≥–Є—З–µ¬≠—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є –Є–ї–Є –і—А—Г–≥–Є—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ), —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, —З—В–Њ —П–≤–ї—П–ї–Њ—Б—М –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –Є—Е –Њ—В–Љ–µ–љ–µ; –і—А—Г–≥–Є–µ –Э–ѓ, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—Й–Є–µ —Г—З–∞—Б—В–Є—О –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є; –Њ—В–Ї–∞–Ј —А–Њ–і–Є—В–µ–ї–µ–є –Њ—В –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —Г—З–∞—Б—В–Є—П. –£—З–∞—Б—В–љ–Є–Ї–Є, –і–Њ—Б—А–Њ—З–љ–Њ –≤—Л–±—Л–≤—И–Є–µ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –љ–µ –Ј–∞–Љ–µ–љ—П–ї–Є—Б—М –њ—Г—В–µ–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –љ–Њ–≤—Л—Е —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤. –Ю—В—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ –і–∞–љ–љ—Л–µ –љ–µ –Ј–∞–Љ–µ—Й–∞–ї–Є—Б—М..
–Т —Е–Њ–і–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є:
–Ї—А–∞—В–љ–Њ—Б—В—М —Н–њ–Є–Ј–Њ–і–Њ–≤ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Р–Р–Ф, –µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤ —В–Њ—З–Ї–∞—Е –Є–Ј–Љ–µ—А–µ–љ–Є—П;
–і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Њ—З–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Р–Р–Ф: –±–Њ–ї–Є –≤ –ґ–Є–≤–Њ—В–µ, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ, —Б–љ–Є–ґ–µ–љ–Є–µ –∞–њ–њ–µ—В–Є—В–∞, —В–Њ—И–љ–Њ—В—Г;
–і–Њ–ї—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є (–∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П), —А–∞–Ј–≤–Є–≤—И–Є–Љ–Є—Б—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Є –њ—А.;
–Њ–±—Й—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є.
–Т—Б–µ –і–µ—В–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ—Л –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ–Њ—А—П–і–Ї–Њ–Љ –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –і–µ—В—П–Љ —Б –Ю–†–Ч (–њ—А–Є–Ї–∞–Ј –Ь–Ч –†–§ вДЦ 798–љ –Њ—В 09.11.2012): –њ—А–Њ–≤–µ–і–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—З–Є (–Ю–Р–Ь), –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ–Њ—Б–µ–≤ –Ї–∞–ї–∞ –љ–∞ –Ї–Є—И–µ—З–љ—Г—О –≥—А—Г–њ–њ—Г –Є —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ—Г—О —Д–ї–Њ—А—Г, –∞–љ–∞–ї–Є–Ј –Ї–∞–ї–∞, –∞–љ–∞–ї–Є–Ј –Ї–∞–ї–∞ –љ–∞ —В–Њ–Ї—Б–Є–љ—Л –Р –Є –Т Cl. difficile –Љ–µ—В–Њ–і–Њ–Љ –Ш–§–Р, –∞–љ–∞–ї–Є–Ј –Ї–∞–ї–∞ –љ–∞ –Ї–∞–ї—М–њ—А–Њ—В–µ–Ї—В–Є–љ (–њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ), –£–Ч–Ш —Б—В–µ–љ–Њ–Ї —В–Њ–ї—Б—В–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ), —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є (–њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ). –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–∞—Б—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –њ–Њ —Г—А–Њ–≤–љ—О –Ъ–Ц–¶–Ъ –Љ–µ—В–Њ–і–Њ–Љ –≥–∞–Ј–Њ–ґ–Є–і–Ї–Њ—Б—В–љ–Њ–є —Е—А–Њ–Љ–∞—В–Њ–≥—А–∞—Д–Є–Є (–У–Ц–•) –Є—Б—Е–Њ–і–љ–Њ –Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ (–ї–∞–±–Њ—А–∞—В–Њ—А–Є—П ¬Ђ–£–љ–Є–Ь–µ–і¬ї). –Ф–ї—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –±—Л–ї —А–∞—Б—Б—З–Є—В–∞–љ –∞–љ–∞—Н—А–Њ–±–љ—Л–є –Є–љ–і–µ–Ї—Б (–Р–Ш), –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є –Њ—В–љ–Њ—И–µ–љ–Є–µ —Б—Г–Љ–Љ—Л –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є (–°) –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л—Е –Ї–Є—Б–ї–Њ—В –Ї –Љ–µ–љ–µ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ:
–Р–Ш = (–° –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–∞—П + –° –Љ–∞—Б–ї—П–љ–∞—П)
–° —Г–Ї—Б—Г—Б–љ–∞—П .
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–∞–Ї–µ—В–∞ R 3.6.1, —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–∞–Ї–µ—В–∞ Microsoft Excel –і–ї—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є 95%. –Ю–њ–Є—Б–∞—В–µ–ї—М–љ—Л–µ —Б—В–∞—В–Є—Б—В–Є–Ї–Є —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –њ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–Љ –Љ–µ—В–Њ–і–Є–Ї–∞–Љ.. –Ф–ї—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –µ—Б–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ—А–Є–Ј–љ–∞–≤–∞–ї–Њ—Б—М –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ, —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М —Б—А–µ–і–љ–µ–µ (M), —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ (SD) –Є 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї (95% –Ф–Ш) –і–ї—П —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П. –Х—Б–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –Љ–µ–і–Є–∞–љ–∞ (Me) –Є 1-–є –Є 3-–є –Ї–≤–∞—А—В–Є–ї–Є. –Ф–ї—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М —З–∞—Б—В–Њ—В—Л –Є –і–Њ–ї–Є –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Ј–љ–∞—З–µ–љ–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –∞ —В–∞–Ї–ґ–µ 95% –Ф–Ш –і–ї—П –і–Њ–ї–µ–є.. –Ф–ї—П –њ—А–Њ—В—П–ґ–µ–љ–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є —Б—А–µ–і–љ–Є–µ –≤–µ–ї–Є—З–Є–љ—Л, –Є—Е —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –Є –Њ—И–Є–±–Ї–Є (–Ь¬±m –і–ї—П —А<0,05). –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —Б—А–µ–і–љ–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л—Е –µ–і–Є–љ–Є—Ж –Љ–µ–ґ–і—Г –Є–Ј—Г—З–∞–µ–Љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Є—Е –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –ї–Є–љ–µ–є–љ—Л–є —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б –≤—Л—З–Є—Б–ї–µ–љ–Є–µ–Љ –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л—Е –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ —Г–≥–ї–∞ –љ–∞–Ї–ї–Њ–љ–∞ (–∞) –Є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ —З–ї–µ–љ–∞ (b) –≤ —Г—А–∞–≤–љ–µ–љ–Є—П—Е —А–µ–≥—А–µ—Б—Б–Є–Є. –Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Е–∞—А–∞–Ї—В–µ—А–∞ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –і–µ—В–µ—А–Љ–Є–љ–∞—Ж–Є–Є R2.
–Ю—Ж–µ–љ–Ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–Є–є —Б—А–µ–і–љ–Є—Е –∞–±—Б–Њ–ї—О—В–љ—Л—Е –≤–µ–ї–Є—З–Є–љ –і–ї—П –≤—Л–±–Њ—А–Њ–Ї —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –њ–Њ t-–Ї—А–Є—В–µ—А–Є—О –°—В—М—О–і–µ–љ—В–∞, –∞ –і–ї—П —А—П–і–Њ–≤ —Б –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ—Л–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ вАФ –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є, –§–Є—И–µ—А–∞, –Ъ—А–∞—Б–Ї–∞–ї–∞ вАФ –£–Њ–ї–ї–Є—Б–∞. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є —Б—З–Є—В–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≤—Л–±–Њ—А–Ї–∞–Љ–Є –њ—А–Є –≤–µ–ї–Є—З–Є–љ–µ p<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–µ–≤–∞–ї–Є—А–Њ–≤–∞–ї–Є –і–µ—В–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –і–Њ 4 –ї–µ—В: 57%, 67% –Є 60% –≤ 1-–є, 2-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –У—А—Г–њ–њ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г –Є –њ–Њ–ї—Г (—А=1,0). –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ—В–µ–є –±—Л–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А –≤ –њ–Њ–Ј–і–љ–Є–µ —Б—А–Њ–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–љ–∞ 3-–Є вАУ 5-–µ —Б—Г—В–Ї–Є), –Є –ї–Є—И—М 16% –і–µ—В–µ–є –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е –Є 27% –і–µ—В–µ–є –≤ 3-–є –≥—А—Г–њ–њ–µ –њ–Њ—Б—В—Г–њ–Є–ї–Є —А–∞–љ–µ–µ 3 —Б—Г—В–Њ–Ї –±–Њ–ї–µ–Ј–љ–Є. –У—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ —Б—А–Њ–Ї–∞–Љ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є (—А=0,218). –Я—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –і–µ—В–Є —Б–Њ —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є
–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Т—Б–µ –≥—А—Г–њ–њ—Л –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –њ–Њ –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Д–Њ—А–Љ–∞–Љ (p>0,05): –Ю–†–Ч, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Є –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (–±—А–Њ–љ—Е–Є—В—Л, –њ–љ–µ–≤–Љ–Њ–љ–Є–Є) –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л —Г 47% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ 1-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е, —Г 37% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 2-–є –≥—А—Г–њ–њ—Л, —З—В–Њ —Б–Њ—Б—В–∞–≤–Є–ї–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Њ—Ж–µ–љ—В –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –і–µ–є—Б—В–≤–Є—П.. –Ю–†–Т–Ш, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–µ –Ы–Ю–†-–њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л —Г 23,3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л, —Г 40% вАФ 2-–є –≥—А—Г–њ–њ—Л –Є —Г 30% вАФ 3-–є –≥—А—Г–њ–њ—Л.
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О –Р–С–Ґ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–ї—Г—З–∞–ї–Є –і–µ—В–Є —Б –њ–љ–µ–≤–Љ–Њ–љ–Є—П–Љ–Є –Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –Љ–Њ—З–µ–≤—Л–і–µ–ї–Є—В–µ–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (3,3% –Њ—В –≤—Б–µ—Е –і–µ—В–µ–є, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є). –Я–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ–Є III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П 72,2% –і–µ—В–µ–є, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –њ–Њ 67% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ 1-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е –Є 83% –і–µ—В–µ–є –≤–Њ 2-–є –≥—А—Г–њ–њ–µ. –Ч–∞—Й–Є—Й–µ–љ–љ—Л–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л –њ–Њ–ї—Г—З–∞–ї–Є 24% –і–µ—В–µ–є –Є–Ј –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤: 33% вАФ –≤ 1-–є –≥—А—Г–њ–њ–µ, 13% вАФ –≤–Њ 2-–є –Є 26% вАФ –≤ 3-–є –≥—А—Г–њ–њ–∞—Е.
–Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є –њ–Њ–ї—Г—З–∞–ї–Є 3% –і–µ—В–µ–є. –У—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ш–Ј—Г—З–µ–љ–Є–µ –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Р–С–Ґ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –≤—Б–µ—Е –ґ–∞–ї–Њ–± —Г –і–µ—В–µ–є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –≥—А—Г–њ–њ—Л —Б–≤—П–Ј–∞–љ—Л —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ц–Ъ–Ґ –Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –≤ —В–µ—З–µ–љ–Є–µ 2вАУ4 —Б—Г—В–Њ–Ї –Њ—В –љ–∞—З–∞–ї–∞ –Р–С–Ґ –≤ –≤–Є–і–µ –Р–Р–Ф, –і–Є—Б–њ–µ–њ—Б–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є (—В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ). –Т 3-–є –≥—А—Г–њ–њ–µ –і–Є–∞—А–µ–є–љ—Л–є —Б–Є–љ–і—А–Њ–Љ –Њ—В–Љ–µ—З–µ–љ –≤ 14 (46,7%) —Б–ї—Г—З–∞—П—Е, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤–Њ 2-–є –≥—А—Г–њ–њ–µ вАФ –≤ 5 (16,7%),
–∞ –≤ 1-–є –≥—А—Г–њ–њ–µ вАФ –≤ 7 (23,3%) (—А=0,03).
–£ –і–µ—В–µ–є 1-–є –Є 2-–є –≥—А—Г–њ–њ –і–Є–∞—А–µ–є–љ—Л–є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–≤–Є–≤–∞–ї—Б—П —А–µ–ґ–µ –Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞ 3вАУ4-–µ —Б—Г—В–Ї–Є –ї–µ—З–µ–љ–Є—П, —Г –і–µ—В–µ–є 3-–є –≥—А—Г–њ–њ—Л вАФ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Є —А–∞–љ—М—И–µ вАФ –љ–∞ 1вАУ3-–Є —Б—Г—В–Ї–Є —В–µ—А–∞–њ–Є–Є (—А–Є—Б. 1, 2 ). –Э–∞ —А–Є—Б—Г–љ–Ї–µ 2 –Њ—В—А–∞–ґ–µ–љ—Л –і–∞–љ–љ—Л–µ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ —З–µ—А–µ–Ј 24 —З, —З–µ—А–µ–Ј 48 —З –Є —З–µ—А–µ–Ј 72 —З, —Б —Г—З–µ—В–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Њ—Б—В–∞–≤—И–Є—Е—Б—П –њ–∞—Ж–Є–µ–љ—В–Њ

 –≤, –≤—Л–њ–Є—Б–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–≤–Є–ї–∞—Б—М –і–Є–∞—А–µ—П, —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –і–Є–∞—А–µ—П.
–≤, –≤—Л–њ–Є—Б–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–≤–Є–ї–∞—Б—М –і–Є–∞—А–µ—П, —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –і–Є–∞—А–µ—П.
–Э–∞ 3-–Є —Б—Г—В–Ї–Є –ї–µ—З–µ–љ–Є—П –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е —Б—В—Г–ї –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–≤ 97% –Є 100% —Б–ї—Г—З–∞–µ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ 3-–є –≥—А—Г–њ–њ–µ —Г 25% –і–µ—В–µ–є —Б—В—Г–ї –Њ—Б—В–∞–≤–∞–ї—Б—П –ґ–Є–і–Ї–Є–Љ. –Я—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б—В—Г–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Б–Њ–≤–Љ–µ—Б—В–љ—Л–є –њ—А–Є–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –Є –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞.. –°—А–µ–і–Є –і–Є—Б–њ–µ–њ—Б–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є—Б—М: —В–Њ—И–љ–Њ—В–∞ (–і–Њ 20% —Б–ї—Г—З–∞–µ–≤), –±–Њ–ї–Є –≤ –ґ–Є–≤–Њ—В–µ (–≤ 13,3% —Б–ї—Г—З–∞–µ–≤), –Љ–µ—В–µ–Њ—А–Є–Ј–Љ (–≤ 10% —Б–ї—Г—З–∞–µ–≤), —А–≤–Њ—В–∞ (–і–Њ 3,3% —Б–ї—Г—З–∞–µ–≤). –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ—Л —Н—В–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –±—Л–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 3-–є –≥—А—Г–њ–њ—Л, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ –Р–С–Ґ. –Т 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е –і–∞–љ–љ—Л–µ –ґ–∞–ї–Њ–±—Л –Њ—В–Љ–µ—З–µ–љ—Л —Г 2% –і–µ—В–µ–є. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Р–С–Ґ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–Љ –Є–ї–Є —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–Љ.. –†–≤–Њ—В–∞, –≤–Њ–Ј–љ–Є–Ї–∞–≤—И–∞—П –≤ —Н—В–Є—Е –≥—А—Г–њ–њ–∞—Е —Г –µ–і–Є–љ–Є—З–љ—Л—Е –±–Њ–ї—М–љ—Л—Е, –±—Л–ї–∞ —Б–≤—П–Ј–∞–љ–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —Б –њ–µ—А¬≠–Њ—А–∞–ї—М–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М–њ—А–Њ—В–µ–Ї—В–Є–љ–∞ –≤ –Ї–∞–ї–µ.. –Ю–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ —Г 66,6% –і–µ—В–µ–є, –Є–Ј –љ–Є—Е —Г 2,2% (2 –њ–∞—Ж–Є–µ–љ—В–∞ 3-–є –≥—А—Г–њ–њ—Л) –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –±–Њ–ї–µ–µ 50 –Љ–Ї–≥/–≥.. –Ф–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ (—А=0,00028 –Є —А=0,00036) (—А–Є—Б. 3).

–Р–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –≤ –≤–Є–і–µ –Ї–Њ–ґ–љ—Л—Е –≤—Л—Б—Л–њ–∞–љ–Є–є –±—Л–ї–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –≤ 4,4% —Б–ї—Г—З–∞–µ–≤ (4 –њ–∞—Ж–Є–µ–љ—В–∞) —Б—А–µ–і–Є –≤—Б–µ—Е —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –њ—А–Є–µ–Љ–Њ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (–∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ —Б—Г–ї—М–±–∞–Ї—В–∞–Љ, —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ), —З—В–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ —Б–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –і—А—Г–≥–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л. –Я—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ —Б –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–Њ–Љ (–Р–і–Є–∞—А–Є–љ¬Ѓ) –Є–ї–Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–Љ (–Р–і–Є–∞—А–Є–љ¬Ѓ –Я—А–Њ–±–Є–Њ) –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ.
–Ґ–∞–Ї–ґ–µ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤–Њ 2-–є –≥—А—Г–њ–њ–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–µ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –љ–Є –Њ–і–љ–Њ–≥–Њ —Б–ї—Г—З–∞—П —А–∞–Ј–≤–Є—В–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ј–∞–њ–Њ—А–Њ–≤, —Е–Њ—В—П –њ–Њ–і–Њ–±–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Љ–Њ–≥—Г—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М –њ—А–Є–µ–Љ —Н–љ—В–µ—А–Њ—Б–Њ—А–±–µ–љ—В–Њ–≤. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л 1-–є –≥—А—Г–њ–њ—Л –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–ї–Є –њ—А–Є–µ–Љ –Р–і–Є–∞—А–Є–љ–∞¬Ѓ –Я—А–Њ–±–Є–Њ, –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є (–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Ю–Р–Ь, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Ї–Њ–њ—А–Њ–≥—А–∞–Љ–Љ–∞) –љ–µ –Є–Љ–µ–ї–Є –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –љ–Є—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ъ–Њ–љ—В—А–Њ–ї—М–љ—Л–µ –∞–љ–∞–ї–Є–Ј—Л —В–∞–Ї–ґ–µ –љ–Є–Ї–∞–Ї–Є—Е —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–µ –≤—Л—П–≤–Є–ї–Є.
–£–Ч–Ш –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Њ 73,3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л, 76,6% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 2-–є –≥—А—Г–њ–њ—Л –Є 70% –і–µ—В–µ–є 3-–є –≥—А—Г–њ–њ—Л. –Т–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —З–∞—Б—В–Њ –≤—Л—П–≤–ї–µ–љ—Л —Н—Е–Њ-–њ—А–Є–Ј–љ–∞–Ї–Є –Љ–µ–Ј–∞–і–µ–љ–Є—В–∞..
–Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ 26 –і–µ—В—П–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–≤–Є–ї—Б—П –і–Є–∞—А–µ–є–љ—Л–є —Б–Є–љ–і—А–Њ–Љ –љ–∞ —Д–Њ–љ–µ –Р–С–Ґ, –њ—А–Њ–≤–Њ–і–Є–ї–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б —Ж–µ–ї—М—О –Є—Б–Ї–ї—О—З–µ–љ–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Ї–Є—И–µ—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є: –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї–∞–ї–∞, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–∞–ї–∞ –љ–∞ –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –Љ–µ—В–Њ–і–Њ–Љ –Ш–§–Р. –°–ї—Г—З–∞–µ–≤ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Є –≤–Є—А—Г—Б–љ—Л—Е –Ї–Є—И–µ—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –љ–µ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ. –Т—Б–µ–Љ –і–µ—В—П–Љ —Б–і–µ–ї–∞–љ–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–∞–ї–∞ —Б —Ж–µ–ї—М—О –≤—Л—П–≤–ї–µ–љ–Є—П —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є —Д–ї–Њ—А—Л (–£–Я–§). –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 4.
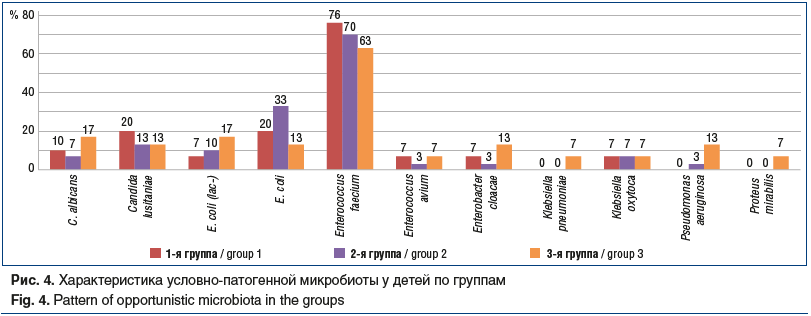
–Ш–Ј—Г—З–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ–µ–є–Ј–∞–ґ–∞ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ —Д–∞–Ї—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Б –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –£–Я–§ –Є–Љ–µ–љ–љ–Њ –≤ 3-–є –≥—А—Г–њ–њ–µ –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –Р–С–Ґ: Candida albicans –Є E. coli (lac-) –≤—Л—П–≤–ї–µ–љ—Л —Г 17% –і–µ—В–µ–є, Enterobacter cloacae, Candida lustianiae –Є Pseudomonas aeruginosa вАФ —Г 13%, –≤—Л—Б–µ–≤ Proteus mirabilis –Є Klebsiella oxytoca –њ–Њ–ї—Г—З–µ–љ —Г 7% –і–µ—В–µ–є –≤ –Ї–∞–ґ–і–Њ–Љ —Б–ї—Г—З–∞–µ. –Т —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ LGG¬Ѓ –Є BB-12¬Ѓ –і–∞–љ–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –≤—Л—Б–µ–≤–∞–ї–Є—Б—М —А–µ–ґ–µ: C. albicans вАФ —Г 10% –і–µ—В–µ–є, E. coli (lac-), Klebsiella pneumoniae, Enterobacter cloacae, Enterococcus avium вАФ —Г 7% –і–µ—В–µ–є. –Э–∞–Є–±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–∞—П –Ї–∞—А—В–Є–љ–∞ –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ–µ–є–Ј–∞–ґ–∞ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤–Њ 2-–є –≥—А—Г–њ–њ–µ –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≤–Љ–µ—Б—В–µ —Б –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–Љ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В, –Љ–Є–Ї—А–Њ–±–љ—Л–є –њ–µ–є–Ј–∞–ґ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±—Л–ї –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ Enterococcus faecium –Є E. coli. –£ 3 –і–µ—В–µ–є (–њ–Њ 1 —А–µ–±–µ–љ–Ї—Г –≤ –Ї–∞–ґ–і–Њ–є –≥—А—Г–њ–њ–µ) –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ Cl. difficile-–Є–љ—Д–µ–Ї—Ж–Є—П. –Т –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Н—В–Є –і–µ—В–Є –њ–Њ–ї—Г—З–∞–ї–Є —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ—Л III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П. –Ґ–∞–Ї–ґ–µ —Г –љ–Є—Е –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–µ –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ–µ–є —В–Њ–Ї—Б–Є–љ–Њ–≤ –Р/–Т –і–Њ 1,65 –љ–∞ —Д–Њ–љ–µ –Р–С–Ґ. –Ю–і–љ–∞–Ї–Њ —Г –і–µ—В–µ–є –Є–Ј 1-–є –Є 2-–є –≥—А—Г–њ–њ Cl. difficile-–Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ –њ—А–Є–≤–µ–ї–Њ –Ї —А–∞–Ј–≤–Є—В–Є—О –і–Є–∞—А–µ–Є –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –∞ —Г —А–µ–±–µ–љ–Ї–∞ –Є–Ј 3-–є –≥—А—Г–њ–њ—Л —А–∞–Ј–≤–Є–ї—Б—П Cl.difficile-—Н–љ—В–µ—А–Њ–Ї–Њ–ї–Є—В –≤ –ї–µ–≥–Ї–Њ–є —Д–Њ—А–Љ–µ.
–Я–Њ–Љ–Є–Љ–Њ –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –±—Л–ї–Њ —В–∞–Ї–ґ–µ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–Њ –≤–ї–Є—П–љ–Є–µ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ –Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–∞ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ—Г—В–µ–Љ –Є–Ј—Г—З–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ъ–¶–Ц–Ъ –Љ–µ—В–Њ–і–Њ–Љ –У–Ц–• –≤ –Ї–∞–ї–µ —Г –і–µ—В–µ–є.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е —Г–Ї—Б—Г—Б–љ–Њ–є (–°2), –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–Њ–є (–°3), –Є–Ј–Њ–Љ–∞—Б–ї—П–љ–Њ–є (–Є–Ј–Њ-–°4), –Љ–∞—Б–ї—П–љ–Њ–є (–°4), –Є–Ј–Њ–≤–∞–ї–µ—А–Є–∞–љ–Њ–≤–Њ–є (–Є–Ј–Њ-–°5), –≤–∞–ї–µ—А–Є–∞–љ–Њ–≤–Њ–є (–°5), –Є–Ј–Њ–Ї–∞–њ—А–Њ–љ–Њ–≤–Њ–є (–Є–Ј–Њ-–°6) –Є –Ї–∞–њ—А–Њ–љ–Њ–≤–Њ–є (–°6) –Ї–Є—Б–ї–Њ—В –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
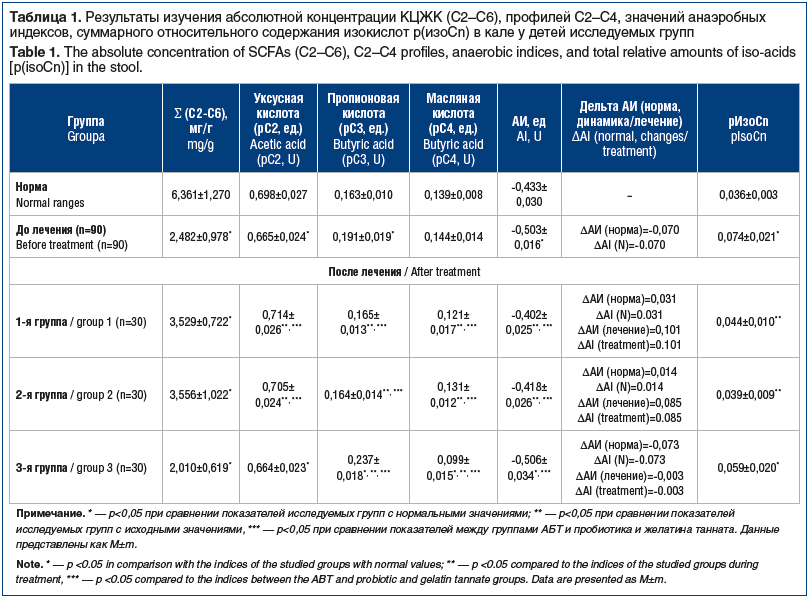
–Ш—Б—Е–Њ–і–љ–Њ (–і–Њ –ї–µ—З–µ–љ–Є—П) –∞–±—Б–Њ–ї—О—В–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ъ–¶–Ц–Ъ –≤ –Ї–∞–ї–µ —Г –≤—Б–µ—Е –і–µ—В–µ–є –±—Л–ї–∞ —Б–љ–Є–ґ–µ–љ–∞ –≤ 2,5 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–Њ—А–Љ–Њ–є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л.. –Т –њ—А–Њ—Д–Є–ї–µ –°2вАУ–°4 –Ї–Є—Б–ї–Њ—В ((—АCn= ќ£√Ч(C2+C3+C4)/Cn) —Г –і–µ—В–µ–є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞—Е–Њ–і–Є–ї–Њ—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ—А–Њ–і—Г—Ж–µ–љ—В–∞–Љ–Є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л —П–≤–ї—П—О—В—Б—П –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –Љ–Њ–ї–Њ—З–љ–Њ–Ї–Є—Б–ї–Њ–є —Д–ї–Њ—А—Л, –њ–Њ—Н—В–Њ–Љ—Г –µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –і–Є—Б–±–∞–ї–∞–љ—Б–∞ —Н–Ї–Њ—Б–Є—Б—В–µ–Љ—Л вАФ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Є—Д–Є–і–Њ- –Є –ї–∞–Ї—В–Њ–±–∞–Ї—В–µ—А–Є–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–µ—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–љ–∞—Н—А–Њ–±–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –њ—А–Њ–њ–Є–Њ–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г (–±–∞–Ї—В–µ—А–Њ–Є–і—Л, –њ—А–Њ–њ–Є–Њ–љ–Є–±–∞–Ї—В–µ—А–Є–Є –Є –і—А.) [27].
–Ч–љ–∞—З–µ–љ–Є—П –Р–Ш —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б—Е–Њ–і–љ–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ—Л –≤ –Њ–±–ї–∞—Б—В—М —А–µ–Ј–Ї–Њ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (ќФ–Р–Ш (N)=-0,070 –µ–і..) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–Њ—А–Љ–Њ–є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± ¬Ђ–∞–љ–∞—Н—А–Њ–±–Є–Ј–∞—Ж–Є–Є¬ї —Б—А–µ–і—Л, –њ—А–Є–≤–Њ–і—П—Й–µ–є –Ї –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –∞–љ–∞—Н—А–Њ–±–љ—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є–є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Ш—Б—Е–Њ–і–љ–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є–Ј–Њ–Ї–Є—Б–ї–Њ—В, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–µ–≥–Њ –Њ–± —Г—Б–Є–ї–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ–Њ–є –Є –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л.
–Т 3-–є –≥—А—Г–њ–њ–µ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ –і–Є—Б–±–∞–ї–∞–љ—Б–∞ –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л: —Б–љ–Є–ґ–∞–ї–Њ—Б—М —Б—Г–Љ–Љ–∞—А–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ъ–¶–Ц–Ъ, –њ–Њ–≤—Л—И–∞–ї–Њ—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Р–Ш –Њ—В–Ї–ї–Њ–љ—П–ї—Б—П –≤ –Њ–±–ї–∞—Б—В—М –±–Њ–ї–µ–µ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (ќФ–Р–Ш (–љ–Њ—А–Љ–∞)=-0,073 –µ–і., ќФ–Р–Ш (–ї–µ—З–µ–љ–Є–µ)=-0,003 –µ–і.), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤ –њ–Њ–ї—М–Ј—Г –љ–∞—А–∞—Б—В–∞–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ–∞—Н—А–Њ–±–љ–Њ–є —Д–ї–Њ—А—Л. –Я—А–Є —Н—В–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ ¬Ђ–≥–Є–±–µ–ї–Є¬ї –±—Г—В–Є—А–∞—В-–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ (—Д—Г–Ј–Њ–±–∞–Ї—В–µ—А–Є–є, —Н—Г–±–∞–Ї—В–µ—А–Є–є, –љ–µ–њ–∞—В–Њ–≥–µ–љ–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –Ї–ї–Њ—Б—В—А–Є–і–Є–є –Є –і—А.), —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–њ–Є—В–µ–ї–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ —Н–љ–µ—А–≥–Њ–Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –љ–∞ —Д–Њ–љ–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–£ –і–µ—В–µ–є 1-–є –Є 2-–є –≥—А—Г–њ–њ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–і–Є–∞—А–Є–љ¬Ѓ –Я—А–Њ–±–Є–Њ –Є –Р–і–Є–∞—А–Є–љ¬Ѓ (–ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В), –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ъ–¶–Ц–Ъ, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –њ—А–Њ—Д–Є–ї–µ –°2-–°4 –Ї–Є—Б–ї–Њ—В. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є..
–Ф–∞–љ–љ—Л–є —Д–∞–Ї—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Г –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ –Є —И—В–∞–Љ–Љ–Њ–≤ LGG¬Ѓ –Є –Т–Т-12¬Ѓ, –Ј–∞–Ї–ї—О—З–∞—О—Й–µ–Љ—Б—П –≤ –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –Є–љ–і–Є–≥–µ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –±–∞–ї–∞–љ—Б–∞ –∞—Н—А–Њ–±–љ–Њ–є –Є –∞–љ–∞—Н—А–Њ–±–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Є –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –±—Г—В–Є—А–∞—В-–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й—Г—О –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Г. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ–Љ –ї–Є–љ–µ–є–љ–Њ–≥–Њ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –Т 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е –Ј–љ–∞—З–µ–љ–Є—П –Р–Ш —Б–Љ–µ—Й–∞—О—В—Б—П –≤ –Њ–±–ї–∞—Б—В—М –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (1-—П –≥—А—Г–њ–њ–∞: ќФ–Р–Ш (N) вАФ 0,031 –µ–і., ќФ–Р–Ш –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ 0,101 –µ–і.; 2-—П –≥—А—Г–њ–њ–∞: ќФ–Р–Ш (N) вАФ 0,014 –µ–і., ќФ–Р–Ш –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ 0,085 –µ–і.), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –≤–љ—Г—В—А–Є–Ї–Є—И–µ—З–љ–Њ–є —Б—А–µ–і—Л. –Э–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є–Ј–Њ–Ї–Є—Б–ї–Њ—В —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ–Њ–є –Є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є—О –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л. –Я—А–Є —Н—В–Њ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –і–Є–љ–∞–Љ–Є–Ї—Г –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ъ–¶–Ц–Ъ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ.
–Т—Л–≤–Њ–і—Л
–Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–і–Є–∞—А–Є–љ¬Ѓ –Я—А–Њ–±–Є–Њ –Є –Р–і–Є–∞—А–Є–љ¬Ѓ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –Њ—Б–ї–Њ–ґ–љ—П–ї–∞—Б—М —А–∞–Ј–≤–Є—В–Є–µ–Љ –і–Є–∞—А–µ–є–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–С–Ґ (–≤ 23% –Є 17% —Б–ї—Г—З–∞–µ–≤ –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –њ—А–Њ—В–Є–≤ 47% –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є —В–Њ–ї—М–Ї–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є) –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б—В—Г–ї–∞ —Г–ґ–µ –љ–∞ 3-–Є —Б—Г—В–Ї–Є –ї–µ—З–µ–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Њ–±–ї–∞–і–∞–ї —Б–Њ–≤–Љ–µ—Б—В–љ—Л–є –њ—А–Є–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –Є –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞..
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ —Ж–Є—В–Њ–Љ—Г–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞ –ґ–µ–ї–∞—В–Є–љ–∞ —В–∞–љ–љ–∞—В–∞ –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ LGG¬Ѓ –Є BB-12¬Ѓ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Є–Ї—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ъ–¶–Ц–Ъ –≤ –Ї–∞–ї–µ —Г –і–µ—В–µ–є –≤ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Б—В–µ–њ–µ–љ–Є. –Т–Ї–ї—О—З–µ–љ–Є–µ –і–∞–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –ї–µ—З–µ–љ–Є—П –і–µ—В–µ–є —Б –Ю–†–Ч —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ј–∞ —Б—З–µ—В —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –њ—Г–ї–∞ –Є–љ–і–Є–≥–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±—Г—В–Є—А–∞—В—Л..
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–і–Є–∞—А–Є–љ¬Ѓ –Я—А–Њ–±–Є–Њ –Є –Р–і–Є–∞—А–Є–љ¬Ѓ –њ—А–Є –Р–С–Ґ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—О –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–Є–∞—А–µ–є–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є—О –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Є—Е —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –≤ –ї–µ—З–µ–љ–Є–Є –і–µ—В–µ–є —Б –Ю–†–Ч.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Ь–∞–Ј–∞–љ–Ї–Њ–≤–∞ –Ы—О–і–Љ–Є–ї–∞ –Э–Є–Ї–Њ–ї–∞–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Ї–∞—Д–µ–і—А–Њ–є –і–µ—В—Б–Ї–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–∞–Ї—Г–ї—М—В–µ—В–∞ –§–У–С–Ю–£ –Ф–Я–Ю –†–Ь–Р–Э–Я–Ю –Ь–Є–љ¬≠–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 123242, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –С–∞—А—А–Є–Ї–∞–і–љ–∞—П, –і. 2/1, —Б—В—А. 1; ORCID iD 0000-0002-0895-6707.
–Я–µ—А–ї–Њ–≤—Б–Ї–∞—П –°–≤–µ—В–ї–∞–љ–∞ –У–µ–љ–љ–∞–і—М–µ–≤–љ–∞ вАФ –≤—А–∞—З-–њ–µ–і–Є–∞—В—А –У–С–£–Ч ¬Ђ–Ф–У–Ъ–С вДЦ 9 –Є–Љ. –У.–Э. –°–њ–µ—А–∞–љ—Б–Ї–Њ–≥–Њ –Ф–Ч–Ь¬ї; 123317, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –®–Љ–Є—В–Њ–≤—Б–Ї–Є–є –њ—А-–і, –і. 29; ORCID iD 0000-0001-7014-5393.
–Р—А–і–∞—В—Б–Ї–∞—П –Ь–∞—А–Є—П –Ф–Љ–Є—В—А–Є–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і¬≠—А—Л —В–µ—А–∞–њ–Є–Є –Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –§–У–С–£ –Ф–Я–Ю ¬Ђ–¶–У–Ь–Р¬ї; 121359, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ь–∞—А—И–∞–ї–∞ –Ґ–Є–Љ–Њ—И–µ–љ–Ї–Њ, –і. 19, —Б—В—А. 1–Р; ORCID iD 0000-0001-8150-307X.
–Ъ–Њ—А—Б—Г–љ—Б–Ї–Є–є –Р–љ–∞—В–Њ–ї–Є–є –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–Є—З вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Ї–∞—Д–µ–і—А–Њ–є –њ–µ–і–Є–∞—В—А–Є–Є –Є –і–µ—В—Б–Ї–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–∞–Ї—Г–ї—М—В–µ—В–∞ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8, —Б—В—А. 1; –≥–ї–∞–≤–љ—Л–є –≤—А–∞—З –У–С–£–Ч ¬Ђ–Ф–У–Ъ–С вДЦ 9 –Є–Љ. –У.–Э. –°–њ–µ—А–∞–љ—Б–Ї–Њ–≥–Њ –Ф–Ч–Ь¬ї; 123317, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –®–Љ–Є—В–Њ–≤—Б–Ї–Є–є –њ—А-–і, –і. 29; ORCID iD 0000-0002-9087-1656.
–®–µ—Б—В–∞–Ї–Њ–≤–∞ –Ш–Ј–∞–±–µ–ї–ї–∞ –Т–∞—Б–Є–ї—М–µ–≤–љ–∞ вАФ –≤—А–∞—З –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–С–£–Ч ¬Ђ–Ф–У–Ъ–С вДЦ 9 –Є–Љ. –У.–Э.. –°–њ–µ—А–∞–љ—Б–Ї–Њ–≥–Њ –Ф–Ч–Ь¬ї; 123317, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –®–Љ–Є—В–Њ–≤—Б–Ї–Є–є –њ—А-–і, –і. 29; ORCID iD 0000-0003-2428-1612.
–°–∞–Љ–∞—А–Є–љ–∞ –Ю–ї—М–≥–∞ –Ѓ—А—М–µ–≤–љ–∞ вАФ –≤—А–∞—З-–±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥ –У–С–£–Ч ¬Ђ–Ф–У–Ъ–С вДЦ 9 –Є–Љ. –У.–Э. –°–њ–µ—А–∞–љ—Б–Ї–Њ–≥–Њ –Ф–Ч–Ь¬ї; 123317, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –®–Љ–Є—В–Њ–≤—Б–Ї–Є–є –њ—А-–і, –і. 29; ORCID iD 0000-0000-000-0000.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Я–µ—А–ї–Њ–≤—Б–Ї–∞—П –°–≤–µ—В–ї–∞–љ–∞ –У–µ–љ–љ–∞–і—М–µ–≤–љ–∞, e-mail: grow-up@mail.ru.
–Ш—Б—В–Њ—З–љ–Є–Ї —Д–Є–љ–∞–љ—Б–Є—А–Њ–≤–∞–љ–Є—П: –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –њ—А–Є –њ–Њ–і–і–µ—А–ґ–Ї–µ –Ю–Ю–Ю ¬Ђ–ѓ–Ф–†–Р–Э¬ї.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В..
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 13.09.2021.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 06.10.2021.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 29.10.2021.
About the authors:
Lyudmila N. Mazankova вАФ Dr. Sc. (Med.), Professor, Head of the Department of ChildrenвАЩs Infectious Diseases of the Pediatric Faculty, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-0895-6707.
Svetlana G. Perlovskaya вАФ pediatrician, G.N. Speranskiy ChildrenвАЩs City Clinical Hospital No. 9; 29, Shmitovskiy pass., Moscow, 123317, Russian Federation; ORCID iD 0000-0001-7014-5393.
Mariya D. Ardatskaya вАФ Dr. Sc. (Med.), professor of the Department of Therapy and Gastroenterology, Central State Medical Academy; 19 build. 1A, Marshal Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0001-8150-307X.
Anatoliy A. Kosunskiy вАФ Dr. Sc. (Med.), Professor, Head of the Department of Pediatrics and ChildrenвАЩs Infectious Diseases of the Pediatric Faculty, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; Head Doctor, G.N. Speranskiy ChildrenвАЩs City Clinical Hospital No. 9; 29, Shmitovskiy pass., Moscow, 123317, Russian Federation; ORCID iD 0000-0002-9087-1656.
Izabella V. Shestakova вАФ doctor of Clinical Laboratory Diagnostics, G.N. Speranskiy ChildrenвАЩs City Clinical Hospital No. 9; 29, Shmitovskiy pass., Moscow, 123317, Russian Federation; ORCID iD 0000-0003-2428-1612.
Olga Yu. Samarina вАФ bacteriologist, G.N. Speranskiy ChildrenвАЩs City Clinical Hospital No. 9; 29, Shmitovskiy pass., Moscow, 123317, Russian Federation; ORCID iD 0000-0000-000-0000.
Contact information: Svetlana G. Perlovskaya, e-mail: grow-up@mail.ru.
The study is supported by LLC "YADRAN".
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 13.09.2021
Revised 06.10.2021
Accepted 29.10.2021.












