Научная информация о лихорадке Эбола долгое время была уделом узких специалистов вследствие высокого уровня биологической опасности и труднодоступности известных природных очагов в Центральной Африке. Все это способствовало подмене научных данных многочисленными мифами, которые часто принимают форму откровенных «информационных фейков», сильно затрудняющих формирование адекватного общественного мнения и проведение противоэпидемических мероприятий.
В данной работе в процессе разбора пяти наиболее часто встречающихся мифов о лихорадке Эбола излагаются научные данные о таксономическом статусе возбудителя, истории его открытия, этимологии терминов, причинах возникновения и ранних событиях современной эпидемии в Западной Африке, научно-практической помощи Гвинейской Республике со стороны Российской Федерации.
Миф 1. Этиологическим агентом лихорадки Э’бола является вирус Э’бола, названный в честь реки, берега которой были эпицентром эпидемии в Конго в сентябре-октябре 1976 г.
Выражение «вирус Эбола» в настоящее время является устаревшим и таксономически несостоятельным. Международный комитет по таксономии вирусов четко определяет название этиологического агента современной эпидемии лихорадки Эбола в Западной Африке – эболавирус Заир (ZEBOV – Zaire ebolavirus) [1–3]. Именно этот научный термин и следует применять вместо «вируса Эбола», который, в лучшем случае, можно признать научным сленгом – допустимым в неформальном общении, но совершенно недопустимым в официальных сообщениях.
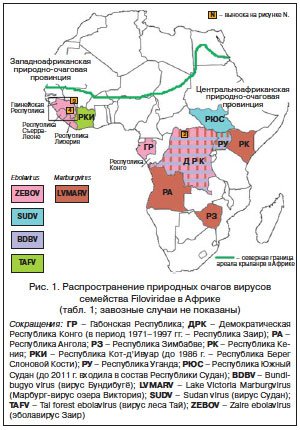
ZEBOV входит в состав рода Ebolavirus, который включает 5 вирусов: четыре из них – за исключением вируса Рестон (RESTV – Reston virus) – являются возбудителями тяжелых геморрагических лихорадок у людей с высоким уровнем летальности (табл. 1, рис. 1) [4–7]. Род Ebolavirus – наряду с родами Marburgvirus и Cuevavirus – формирует семейство Filoviridae отряда Mononegavirales [4, 5]. Род Marburgvirus представлен единственным марбург-вирусом озера Виктория (LVMARV – Lake Victoria marburgvirus), в отношении которого тоже часто используется устаревшее название «вирус Марбург» [8, 9]. Род Cuevavirus – это новый член семейства Filoviridae, сформированный после изоляции непатогенного для человека вируса Лловиу (LLOV – Lloviu virus) [10].
Усложнение таксономической структуры филовирусов должно повлечь за собой в обозримом будущем и изменения в названиях соответствующих нозологий – например, «лихорадка леса Тай», «лихорадка Бундибугё» и т. д. Однако в отсутствие статистически достоверных сравнительных клинических исследований дифференцировать нозологии было бы преждевременно. Поэтому исторически сложившийся термин «лихорадка Эбола» имеет право на существование наряду с более корректным «филовирусная лихорадка». Подобные ситуации, когда название инфекционного заболевания не вполне совпадает с названием его этиологического агента, или когда одна и та же нозология связана с несколькими разными патогенами, в современной вирусологии не редкость. Первым примером может служить вирус Крымской-Конго геморрагической лихорадки (Bunyaviridae, Nairovirus), вызывающий заболевание, которое допустимо называть не только «Крымской-Конго геморрагической лихорадкой», но и исторически сложившимся термином «Крымская геморрагическая лихорадка» [11, 12]. Вторым примером является геморрагическая лихорадка с почечным синдромом, которая в различных частях своего ареала связана с различными вирусами из рода Hantavirus (Bunyaviridae): Добрава-Белград, Сааремаа, Тула, Топографов, река Лена, Хабаровск, Пуумала, Юньань, Сеул, Хантаан [12, 13]. Другой известный пример такого же рода – грипп, этиологически связанный с вирусами трех различных родов семейства Orthomyxoviridae: гриппа А (Influenzavirus A), В (Influenzavirus B) и С (Influenzavirus C) [14, 15].
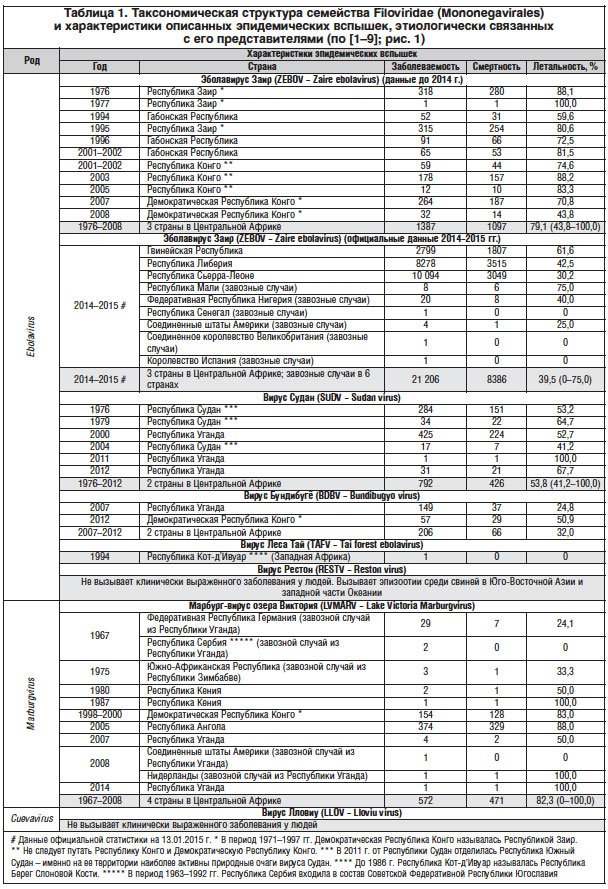
Начало эпидемии лихорадки Эбола 1976 г. в Демократической Республике Конго (ДРК) официально принято отсчитывать от 28.09.1976 г., когда в штаб-квартиру ВОЗ в Женеве поступила срочная телеграмма о вспышке заболевания неясной этиологии «… тифа или желтой лихорадки … в районе Бумба, община Ямбуку». Однако начало эпидемии было положено 26.08.1976 г., когда заболел 44-летний учитель местной школы. Через 4 сут больной был госпитализирован в больницу местного католического прихода, в которой имелось всего пять шприцев, их стерилизация кипячением производилась нерегулярно [16–19] – последовала внутрибольничная вспышка, быстро распространившаяся в соседние населенные пункты.
Деревня Ямбуку (Yambuku) (2° 49′ 23″ с.ш., 22° 18′ 28″ в.д.), ставшая эпицентром эпидемии лихорадки Эбола в 1976 г. [16–19], находится не на берегах реки Эбола, а примерно в сотне километров южнее (рис. 1, 2). Этот населенный пункт входит с состав префектуры Монгала Экваториальной провинции ДРК. При этом, следует иметь в виду два факта:
1. В период 1971–1997 гг. ДРК называлась Республикой Заир.
2. Республика Конго и ДРК – это два различных государства (поэтому говорить просто «в Конго» некорректно).
После изоляции этиологического агента эпидемии (1976 г.) в ДРК и установления [16–19] его таксономической близости, но не идентичности ранее открытому (в 1967 г.) вирусу марбург (ныне – LVMARV) [8] перед сотрудниками специальной миссии ВОЗ встала задача присвоения имени новому вирусу. В принципе, простор для творчества был достаточно широкий, поскольку эпидемия вышла далеко за пределы основного эпидемического очага с эпицентром в Ямбуку – спорадические случаи были зарегистрированы также в городах Бумба, Абумомбази, Киншаса – так что имя новому вирусу можно было бы дать по названию любого из них. Однако, как вспоминает один из первооткрывателей ZEBOV P. Piot [20], возникли серьезные опасения, что ассоциация опасного заболевания с конкретным населенным пунктом может повлечь за собой нежелательные социально-экономические последствия.
Наиболее известный пример подобного рода – описанная ранее, в 1969 г., социальная стигматизация жителей нигерийского г. Ласса [21] в связи с идентификацией одноименного вируса Ласса (Arenaviridae, Arenavirus). Авторитарный президент Республики Заир Мобуту Сесо Секо применял чрезвычайно жесткие меры по локализации эпидемических очагов с привлечением армии, имевшей приказ открывать огонь на поражение в случае необходимости. Поэтому было решено назвать новый вирус в честь какой-либо периферической реки. Напрашивающееся «Конго» (рис. 1) не подходило в связи с тем, что вирус Конго уже был известен (позднее – вирус Крымской-Конго геморрагической лихорадки) [11, 12]. А поскольку несколько образцов биологического материала для изоляции вируса были собраны в г. Абумомбази, расположенном в пойме реки Эбола, именно этот географический объект, удаленный от центра эпидемии, и удостоился сомнительной чести дать свое имя опасному патогену.
Наконец, следует проанализировать постановку корректного ударения в слове «Эбола». На берегах этой реки проживает народ бангала, говорящий на языке лингала1 [22], который принадлежит бантоидной ветви бенуэ-конголезской группы конго-кордофанской языковой семьи [23]. Название «Эбола» впервые появилось на бельгийских картах в колониальный период в конце XIX в. как неточная калька одного из местных названий, из которых наиболее вероятными являются ebale [eh-ba'-leh] (река) и ebolo [eh-bo'-lo] (часть целого)2 [23, 24]. Оба слова начинаются с именного префикса седьмого класса e-; ударение должно падать на первый слог основы [23] – следовательно, в обоих случаях ударение приходится на предпоследний слог – Эбóла.
Бытует мнение, что нет большой разницы, где ставить ударение в слове «Эбола». В предметном отношении разница действительно невелика, т. к. вряд ли вызовет разночтение даже у неспециалистов. Однако неправильная постановка ударения не только нарушает требование терминологической однозначности, но и имеет соответствующую культурологическую нагрузку [25]: традиции отечественной топонимики включают подчеркнуто уважительное отношение к местной специфике, поскольку веками складывались в единой многонациональной и многоконфессиональной стране, не имевшей опыта строительства собственной колониальной системы, традиционно пренебрегающей туземными обычаями.
Миф 2. Современная эпидемия лихорадки Эбола в Западной Африке началась весной 2014 г.
Действительно, 23.03.2014 г. Африканское региональное бюро ВОЗ объявило об эпидемии лихорадки Эбола в Гвинейской Республике (в пределах лесистой части Северо-Гвинейской возвышенности); 29.03.2014 г. последовало подтверждение первого случая лихорадки Эбола в Республике Либерия, 25.05.2014 г. – в Республике Сьерра-Леоне. Однако это – официальные датировки. Результаты ретроспективного эпидемиологического расследования показывают, что современная эпидемия лихорадки Эбола в Западной Африке началась еще в декабре 2013 г. [1, 2].
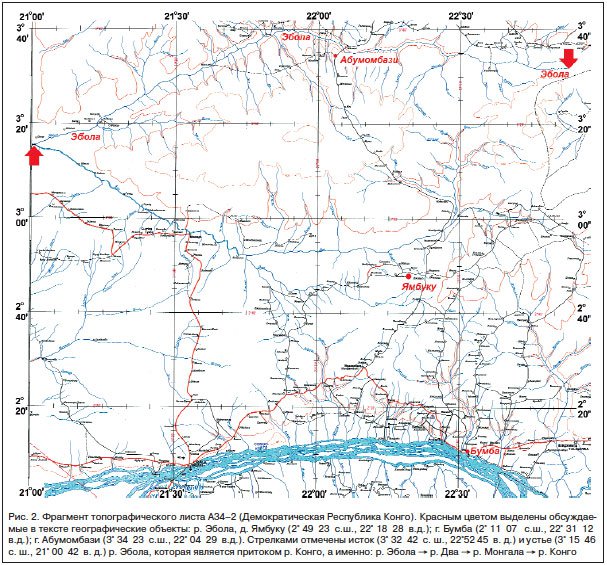
Первым пациентом (П1) стал 2-летний Эмиль Уамунó (Emile Ouamouno), который остро заболел 24.12.2013 г. с симптомами лихорадки, рвоты, кровавого стула и умер 28.12.2013 г. Он жил со своей семьей на окраине небольшой (31 хижина) деревни Мельяндỳ (Meliando) (8° 37′ 21.36″ с.ш., 10° 3′ 51.12″ з.д.) в префектуре Гекедỳ (Gueckedou) провинции Нзерекорé (Nzerekore) (рис. 3).
В научной литературе приводятся различные даты смерти Эмиля Уамунó (06.12.2013 г. [1] vs. 28.12.2013 г. [2]) и первых 4-х пациентов (П1-4). Несмотря на то, что публикация S. Baize и соавт. [1] появилась раньше и именно ее данные широко цитируются средствами массовой информации, сведения A. Marí Saéz и соавт. [2] вызывают большее доверие, т. к. его авторы работали непосредственно в Мельянду, беседовали с очевидцами и проводили сверку с медицинскими записями в местном медицинском пункте. Кроме того, данные A. Marí Saéz и соавт. [2] по П1-4 лучше согласуются по срокам с последующими эпидемическими событиями.
На первом этапе (до начала марта 2014 г.) эпидемия развивалась по классическому сельскому типу (см. подробности у М.Ю. Щелканова и соавт. [3]): источником инфекции стали, по-видимому, выделения крыланов (Chiroptera, Megachiroptera), которые являются природным резервуаром эболавирусов [26–28], будучи способны переносить инфекцию бессимптомно. В лесном массиве, окружающем Мельяндỳ, были обнаружены несколько видов крыланов и летучих мышей. Возможно, источником инфекции стали заразившиеся от крыланов больные и ослабленные летучие мыши (Chiroptera, Microchiroptera), жившие в дуплистом дереве близ деревни, вокруг которого любили играть дети (см. Приложения в [2]).
Второй жертвой лихорадки Эбóла в Мельяндỳ стала 3–летняя сестра Эмиля Филомэ (П2), умершая 05.01.2014 г. Мать погибших детей Сиá (П3) плохо почувствовала себя уже на похоронах дочери и умерла 11.01.2014 г., вслед за ней (13.01.2014 г.) – и ее мать Кумбá (П4). Принимавшая участие в похоронном обряде сестра Кумбы заболела (П5) 20.01.2014 г. и умерла 26.01.2014 г., став источником эпидемической вспышки в д. Давá в феврале 2014 г. Женщины в африканских деревнях рожать начинают рано, а Кумбá находилась в фертильном возрасте, и когда у нее началось маточное кровотечение, ее осматривали местная акушерка (П6) и медсестра (П7), которые тоже заболели 25.01.2014 и 29.01.2014 г. соответственно, и обе умерли 02.02.2014 г. П6 была госпитализирована в г. Гекедỳ, где от нее заразился медицинский работник (П8), который заболел 05.02.2014 г., самостоятельно отправился в госпиталь г. Масентá (Macenta) и умер 10.02.2014 г. Родственники П8-П9 и П10 – завезли инфекцию в г. Баладỳ (Baladou) и г. Фаракó (Farako), где эпидемические вспышки были зарегистрированы в конце февраля – начале марта 2014 г. Доктор (П11), лечивший П8 в Масентá, заболел 19.02.2014 г. и умер 24.02.2014 г. Два брата П11 (П13-14) заболели 24.02.2014 г. и умерли с интервалом в сутки 07.03.2014 и 08.03.2014 г. в Киссидугу (Kissidougou). Другой член семьи П11 после его похорон стал источником (П15) эпидемической вспышки в Нзерекоре (заболел 26.02.2014 г., умер 28.02.2014 г.).
Таким образом, к концу февраля 2014 г. вирус проник в крупные населенные пункты, и следующая стадия эпидемии начала развиваться по городскому типу [3], когда высокая плотность населения способствует быстрому распространению вируса контактным путем. В Западной Африке контактный путь распространения инфекционных заболеваний во многом связан с наличием специфических погребальных обрядов и невероятной скученностью в транспортных средствах. К 26.03.2014 г., когда ВОЗ объявила об идентификации этиологического агента эпидемии (EBOVZ), эпидемия городского типа уже вырвалась на вольный простор. В тот момент ее еще можно было остановить с помощью масштабных и слаженных противоэпидемических мероприятий, но осуществить их в сложнейших социально-экономических условиях современной Западной Африки оказалось невозможно. 27.03.2014 г. эпидемия достигла столицы Гвинейской Республики г. Конакри, и число заболевших стало нарастать лавинообразно.
Миф 3. Современная эпидемия лихорадки Эбола в Западной Африке – это результат применения биологического оружия: целенаправленно спланированного либо непреднамеренного (вышедших из-под контроля полевых испытаний)
Всякий раз, когда ВОЗ объявляет очередную пандемию гриппа А (последний пример – А (H1N1) pdm09 [14]), ученые открывают новый вирус человека (например, вирус иммунодефицита человека [29], вирус тяжелого острого респираторного синдрома [30], вирус ближневосточного респираторного синдрома [30]), вспыхивает крупная эпидемия (лихорадки Эбола в Западной Африке 2014 г. [1–3]) или эпизоотия с высоким пандемическим потенциалом (оспа обезьян [31], высоковирулентный грипп А птиц [14, 32]), в средствах массовой информации происходит всплеск интереса к конспирологическим версиям, среди которых можно выделить два лейтмотива:
1. получение сверхприбылей от производства лекарственных средств и вакцин;
2. применение биологического оружия.
Уместна аналогия: когда идет дождь, продавцы зонтиков получают прибыль, но все же не в состоянии вызывать дождь.
В принципе, любой патоген при грамотном его использовании и достаточной квалификации тех, кто его использует, может стать биологическим оружием. И филовирусы здесь не исключение. Однако, во-первых, сегодня продолжает действовать «Конвенция о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их уничтожении» (1972 г.); во-вторых, сравнимые научные потенциалы наиболее развитых стран не позволяют надеяться на незаметное применение биологического оружия. Технологический паритет в области микробиологии является одной из лучших гарантий неприменения биологического оружия. Одним из важнейших его элементов считается система планового мониторинга природных очагов инфекционных заболеваний. В СССР и современной России такая система успешно функционирует [32–36], представляя собой, по сути, перманентные маневры с целью профилактики применения биологического оружия.
Более того, СССР на безвозмездной основе проводил мониторинговые исследования в интересах обеспечения эпидемиологического благополучия стран, вставших на путь социалистического развития. Так, на базе Гвинейского института им. Л. Пастера (г. Киндия) в период 1978–1991 гг. успешно работала Российско-гвинейская вирусологическая и микробиологическая лаборатория [37]. В публикациях этой лаборатории [38, 39] была описана эпидемическая вспышка геморрагической лихорадки с летальностью свыше 30% в марте-августе 1982 г. среди населения юго-восточной части плато Фута-Джаллон, в супрефектуре Мадина-Улá (Madina-Oula) провинции Киндия, на границе Гвинейской Республики и Республики Сьерра-Леоне, проходящей по р. Коленте’ (рис. 3, 4). Этиологический агент заболевания в то время идентифицировать не удалось, а «… особенности клинического течения болезни в наибольшей степени напоминают описанную симптоматику вирусных геморрагических лихорадок Марбург и Эбола» (цит. по [38, С. 69]). В 1987 г. было показано, что среди населения Гвинейской Республики имеются специфические антитела против эболавирусов [39]. По-видимому, это было первое указание на существование природных очагов представителей рода Ebolavirus на территории Северо-Гвинейской возвышенности. Если бы из-за так называемой «перестройки» не оборвались научно-практические связи между российскими и гвинейскими специалистами, то к 2013 г. уже имелись бы статистически обоснованные данные циркуляции EBOVZ в Западной Африке. А это существенно ускорило бы идентификацию возбудителя и, возможно, позволило оперативно взять под контроль эпидемический процесс.
Таким образом, эпидемия лихорадки Эбола в Западной Африке вспыхнула в декабре 2013 г. отнюдь не в результате преднамеренного или непреднамеренного использования биологического оружия, а в результате повышения активности циркуляции EBOVZ в его природных очагах на территории Северо-Гвинейской возвышенности. С учетом данных 2014 г. (табл. 1, рис. 1), необходимо внести изменения в классификацию природных очагов филовирусов: Африканская природно-очаговая область теперь подразделяется на две природно-очаговые провинции – Центральноафриканскую (ядро очага – Североконголезский природно-очаговый округ) и Западно-африканскую (ядро очага – Северогвинейский3 природно-очаговый округ) (рис. 1). Природным резервуаром являются крыланы (Chiroptera, Megachiroptera). Сравнительная характеристика циркуляции филовирусов в выделенных природно-очаговых провинциях должна стать предметом детальных исследований уже в ближайшем будущем. Молекулярно-генетический анализ полноразмерных генетических последовательностей штаммов EBOVZ, изолированных в 2014 г. в Западной Африке, не выявил у них принципиальных отличий от ранее известных вариантов этого вируса. Генетическая дистанция от штаммов, изолированных в 2008 г. в ДРК, составляет около 3% [1], что достаточно для выделения нового генотипа EBOVZ и полностью согласуется с концепцией наличия в Африке двух природно-очаговых провинций.
Миф 4. Население Западной Африки охвачено паникой, в т. ч. будучи напуганным искусственно завышенными показателями летальности
Население Западной Африки, к огромному сожалению, давно привыкло жить (и при этом – не паниковать) в условиях хронического эпидемического неблагополучия. Достаточно сказать, что детская смертность в странах Западной Африки превышает 60, в иные годы поднимаясь выше 100 (например, в 2008 г. в Республике Сьерра-Леоне и Республике Либерия). Средняя продолжительность жизни – 56 лет в Гвинейской Республике, 54 – в Республике Либерия, 45 – в Республике Сьерра-Леоне. В регионе отсутствуют или недостаточно масштабированы системы мониторинга социально-значимых инфекций: гриппа, вирусных гепатитов, заболеваний, передающихся половым путем. Территория Западной Африки включает сложнейшие в структурно-функциональном отношении сочетанные природные очаги инфекционных заболеваний, среди которых – помимо EBOVZ и TAFV (Filoviridae, Ebolavirus) (табл. 1, рис. 1) – следует отметить особо опасные вирусы Ласса (Arenaviridae, Arenavirus); Дугбе и Крымской-Конго геморрагической лихорадки (Bunyaviridae, Nairovirus); Бвамба, Буньямвера, Мпоко, Симбу, Татагине, Тягиня, Шамонда и Шуни (Bunyaviridae, Orthobunyavirus); Бханджа и лихорадки долины Рифт (Bunyaviridae, Phlebovirus); Вессельсброн, денге, желтой лихорадки, Западного Нила и Сабойя (Flaviviridae, Flavivirus); Кваранфил и озера Чад (Orthomyxoviridae, Quaranjavirus); Тогото (Orthomyxoviridae, Thogotovirus); Абадина, Киндия и синего языка овец (Reoviridae, Orbivirus); Синдбис и Чикунгунья (Togaviridae, Alphavirus); бактерии: Yersinia pestis, Salmonella enterica, S. bongori, S. subterranea (Enterobacteriaceae); Rickettsia spр., Coxiella spр., Rochalimaea spр. (Rickettsiae); Borrelia duttonii (Spirochaetaceae); Vibrio cholerae (Vibrionaceae); протозои: Entamoeba histolytica (Entamoebidae); Listeria monocytogenes (Listeriaceae); Plasmodium falciparum, P. malariae, P. ovale и P. vivax (Plasmodiidae); Leishmania donovani (Trypanosomatidae).
Однако перечень природно-очаговых патогенных микроорганизмов, распространенных в Западной Африке, далеко не исчерпывается приведенным перечнем. Ситуация серьезно осложняется отсутствием современных научных данных о таксономическом статусе, экологии и патогенности подавляющего большинства микроорганизмов, уже известных для данного региона, и которые могут быть открыты при развертывании соответствующих мониторинговых программ.
Основной причиной недостаточной развитости системы здравоохранения в Западной Африке является комплекс социально-экономических проблем, уходящих своими корнями в колониальное прошлое этого региона [22, 40]. Непродолжительный по историческим меркам период строительства социализма в Гвинейской Республике позволил при помощи СССР4 заложить основы современного здравоохранения и сформировать местные медицинские кадры. Распад СССР в начале 1990-х гг. существенно сократил масштабы этого сотрудничества.
В августе 2014 г. активные рабочие контакты между российскими и гвинейскими медицинскими специалистами были возобновлены: в Гвинейскую Республику прибыла экспертно-рекогносцировочная группа Роспотребнадзора и Минздрава России (рис. 4) [3]. В задачи группы входили обеспечение биологической безопасности посольства и российских граждан; научно-методическая поддержка местных специалистов; сбор аналитической информации непосредственно в очаге эпидемии; ознакомление с опытом гвинейских коллег по диагностике и лечению лихорадки Эбола, установление контактов с представителями ВОЗ и других международных организаций, осуществляющих деятельность по предотвращению распространения эпидемии, возобновление контактов со специалистами Гвинейского института им. Л. Пастера (г. Киндия), проведение переговоров с Министерством здравоохранения Гвинейской Республики с целью определения масштабов помощи со стороны Российской Федерации, а также получения приглашения на работу российских специализированных противоэпидемических бригад (СПЭБов).
По распоряжению Главного государственного санитарного врача Российской Федерации д.м.н. А.Ю. Поповой от 21.08.2014 г. в г. Конакри, в Национальный госпиталь «Донка» Министерства здравоохранения Гвинейской Республики (рис. 5) были направлены мобильные лабораторные модули, на которых немедленно приступили к работе специалисты ФКУЗ «РосНИПЧИ “Микроб”» (г. Саратов) и ФБУН «ГНЦ ВБ “Вектор”» (п. Кольцово, Новосибирская обл.) Роспотребнадзора. Получение приглашения российских СПЭБов имело большую научно-практическую ценность, в первую очередь для Гвинейской Республики, которая, как и другие страны региона, охваченные эпидемией, остро нуждалась в средствах современной молекулярной диагностики, а во-вторых, и для Российской Федерации, т. к. ПЦР-тест-системы российского производства имели возможность пройти «проверку боем» в условиях реальной эпидемии.
Внедрение методов молекулярной диагностики лихорадки Эбола привело к закономерному снижению статистики летальности. И причина кроется совсем не в том, что прежде летальность сознательно завышалась. Благодаря молекулярной диагностике статистика стала учитывать все, а не только наиболее тяжелые случаи заболевания, что и привело к снижению летальности: 30.06.2014 г. – 73,4% (303/413); 30.07.2014 г. – 57,4% (826/1440); 26.08.2014 г. – 50,6% (1552/3069); 29.10.2014 г. – 35,9% (4910/13676); 26.11.2014 г. – 35,7% (5674/15901); 13.01.2015 г. – 39,5% (8386/21206). Снижение летальности после внедрения методов молекулярной диагностики было описано и при других вирусных инфекциях [11–14].
По поручению Президента Российской Федерации от 14.12.2014 г. российские военно-медицинские специалисты доставили в Гвинейскую Республику мобильный госпиталь, способный одновременно разместить на лечение 200 пациентов, в составе которого уже к 18.12.2014 г. были развернуты в г. Киндия (рис. 3), протестированы и штатно функционировали приемно-диагностическое отделение, диагностические лаборатории, три инфекционных отделения, отделение интенсивной терапии, стерилизационная, а также системы контроля за соблюдением санитарного режима. Российские медики организовали для гвинейских коллег курсы повышения квалификации по инфекционным болезням, организовали лечебный процесс, медицинскую логистику, разработали схемы действий при чрезвычайных ситуациях, санитарно-эпидемиологический мониторинг. 17.01.2014 г. на территории Гвинейского института им. Л. Пастера (г. Киндия) был открыт Российско-гвинейский центр микробиологических исследований, имеющий собственное клиническое отделение: инфекционный госпиталь, провизорный госпиталь, отделение переливания крови. В г. Киндия была перебазирована часть группировки мобильных лабораторий Роспотребнадзора. На открытии Центра присутствовал Президент Гвинейской Республики Альфа Конде (рис. 6). Предпринятые меры позволят не только улучшить ситуацию с диагностикой и лечением лихорадки Эбола, но и проводить плановый комплексный мониторинг природных очагов инфекционных заболеваний на территории Западной Африки.
Миф 5. Мир стоит перед лицом ужасной пандемии лихорадки Эбола, представляющей угрозу существованию человечества
Беспрецедентные масштабы современной эпидемии лихорадки Эбола в Западной Африке, впервые вышедшей на региональный уровень, могут быть объяснены 4 основными причинами: 1. наличие природных очагов EBOVZ на территории Западной Африки; 2. отсутствие научной информации о функционировании природных очагов EBOVZ в данном регионе (затруднило своевременную идентификацию возбудителя заболевания); 3. наличие своеобразных местных обрядов (в частности – обряда погребения, включающего многолюдные похороны и массовые омовения покойного), которые существенно способствуют распространению инфекционных агентов – включая EBOVZ – контактным путем; 4. сложнейшая социально-экономическая обстановка.
В Европе, Северной Евразии (включая Российскую Федерацию), Южной и Северной Америке отсутствуют природные очаги эболавируса Заир, поскольку ареал природного резервуара – крыланов (Chiroptera, Megachiroptera) – ограничивается субтропическими зонами Восточного полушария (рис. 1; [3]).
С высокой вероятностью, эпидемия лихорадки Эбола не выйдет за границы Западной Африки и закончится, хотя бы уже вследствие формирования достаточной иммунной прослойки среди местного населения этого региона. В остальных странах возможны завозные спорадические случаи заболевания, вероятность разрастания которых до эпидемических вспышек и эпидемий городского типа [3] определяется уровнем развития системы биологической безопасности конкретной страны.
Следует подчеркнуть, что проблема интродукции патогенных микроорганизмов появилась отнюдь не в связи с лихорадкой Эбола – острота этой проблемы неуклонно возрастает, начиная примерно с середины прошлого века, в связи с интенсификацией пассажирских потоков во всем мире. При этом, медицинский контроль в транспортных пунктах пропуска является необходимой, но недостаточной мерой, поскольку инфекционный больной в инкубационном периоде способен преодолеть самый строгий контроль и заболевает уже на новой территории. В частности, в Российской Федерации ежегодно регистрируют несколько сотен случаев завозных экзотических инфекционных заболеваний [41–43]. Все эти случаи быстро выявляются, грамотно идентифицируются, в результате проводимых оперативных мероприятий купируются возможные пути передачи возбудителя, и эпидемических вспышек удается избежать. Эффективность этих мероприятий и высокая степень настороженности системы биологической безопасности развитых стран мира (в т. ч. Российской Федерации) являются надежным барьером на пути распространения лихорадки Эбола.
1 Строго говоря, лингала не связан ни с одним из местных этносов, представляя собой региональный лингва-франка [23].
2 Нередко в средствах массовой информации приходится встречать «романтические» версии переводов «Эбола» с лингала как
«белая вода» или «черная вода». «Белый» переводится на лингала как mpembe [mpe'-mbe'], черный – moyindo [moh-yee'-ndoh], во-
да – mai [ma'-ee] [24]. Очевидно, что здесь нет никаких фонетических соответствий слову «Эбо'ла».
3 Название происходит от названия Северо-Гвинейской возвышенности, в свою очередь, названной по своему местоположению –
на севере Гвинейского залива.
4 СССР стал первой страной, признавшей независимость Гвинейской Республики уже 05.10.1958 г., через 2 дня после объявления
независимости. Попытки Франции проводить изоляционистскую политику в отношении своей бывшей колонии вынудили перво-
го Президента Гвинейской Республики Секу Туре ориентироваться на СССР и КНР [40].



Литература
1. Baize S. et al. Emergence of Zaire Ebola virus disease in Guinea // N. Engl. J. Med. 2014. Vol. 371. № 15. P. 1418–1425.
2. Mari’ Sae’z A. et al. Investigating the zoonotic origin of the West African Ebola epidemic // EMBO Mol Med. 2014. Vol. 7. № 1. P. 17–23.
3. Щелканов М.Ю., Magassouba N’F., Boiro M.Y., Малеев В.В. Причины развития эпидемии лихорадки Эбола в Западной Африке // Лечащий врач. 2014. № 11. С. 30–37.
4. Львов Д.К., Щелканов М.Ю. Филовирусы (Filoviridae) // Медицинская вирусология / Под ред. Д.К. Львова. М.: МИА, 2008. С. 224–228.
5. Львов Д.К., Щелканов М.Ю. Филовирусы (Filoviridae) // Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных / Под ред. Д.К. Львова. М.: МИА, 2013. С. 202–205.
6. Miranda M.E., Miranda N.L. Reston ebolavirus in humans and animals in the Philippines: a review // J. Infect. Dis. 2011. Vol. 204 (Suppl. 3). P. S757–760.
7. Pan Y. et al. Reston virus in domestic pigs in China // Arch Virol. 2014. Vol. 159. № 5. P. 1129–1132.
8. Bonin O. The Cercopithecus monkey disease in Marburg and Frankfurt (Main), 1967 // Acta Zool. Pathol. Antverp. 1969. Vol. 48. P. 319–331.
9. Pavlin B.I. Calculation of incubation period and serial interval from multiple outbreaks of Marburg virus disease // BMC Research Notes. 2014. № 7. P. 906–911.
10. Negredo A. et al.Discovery of an ebolavirus-like filovirus in Europe // PLoS Pathog. 2011. Vol. 7. № 10. P. e1002304.
11. Аристова В.А., Колобухина Л.В., Щелканов М.Ю., Львов Д.К. Экология вируса Крымской-Конго геморрагической лихорадки и особенности клиники на территории России и сопредельных стран // Вопросы вирусологии. 2001. № 4. С. 7–15.
12. Львов Д.К., Альховский С.В., Щетинин А.М., Щелканов М.Ю. Буньявирусы (Bunyaviridae) // Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных / Под ред. Д.К. Львова. М.: МИА, 2013. С. 279–298.
13. Ткаченко Е.А. и др. Актуальные проблемы геморрагической лихорадки с почечным синдромом // ЖМЭИ. 2013. № 1. С. 51–58.
14. Щелканов М.Ю., Колобухина Л.В., Львов Д.К. Грипп: история, клиника, патогенез // Лечащий врач. 2011. № 10. С. 33–38.
15. Щелканов М.Ю. и др. Таксономическая структура Orthomyxoviridae: современное состояние и ближайшие перспективы // Вестник РАМН. 2011. № 5. С. 12–19.
16. Pattyn S. et al. Isolation of Marburg-like virus from a case of haemorrhagic fever in Zaire // Lancet. 1977. V. 1. P. 573–574.
17. After Marburg, Ebola // Lancet. 1977. № 1. P. 581–582.
18. Emond R.T., Evans B., Bowen E.T., Lloyd G. A case of Ebola virus infection // Br. Med. J. 1977. Vol. 2. P. 541–544.
19. Ebola haemorrhagic fever in Zaire, 1976. Report of an International Commission // Bulletin of the World Health Organization. 1978. Vol. 56. № 2. P. 271–293.
20. Piot P. Part one: A virologist's tale of Africa's first encounter with Ebola // With permission of the publisher, W.W. Norton & Company Inc. (11 August 2014). http://news.sciencemag.org/africa/2014/08/part-one-virologists-tale-africas-first-encounter-ebola.
21. Richmond J.K., Baglole D.J. Lassa fever: epidemiology, clinical features, and social consequences // Brit. Med. J. 2003. Vol. 327. P. 1271–1275.
22. Собченко А.И. Языки народов Бельгийского Конго // Современный Восток. 1959. № 2. С. 47–49.
23. Топорова И.Н. Грамматика языка лингала. М.: Институт языкознания РАН, 1994. 260 с.
24. Akowuah T.A. Lingala-English, English-Lingala: Dictionary and Phrasebook. NY: Hippocrene Books, 1996. 120 p.
25. Веселовский С.Б. Топонимика на службе у истории // Исторические записки. 1945. № 17. С. 24–52.
26. Leroy E.M. et al. Fruit bats as reservoirs of Ebola virus // Nature. 2005. Vol. 438. P. 575–576.
27. Pourrut X. et al. Large serological survey showing cocirculation of Ebola and Marburg viruses in Gabonese bat populations, and a high seroprevalence of both viruses in Rousettus aegyptiacus // BMC Infectious Diseases. 2009. Vol. 9. P. e159.
28. Pigott D.M., et al.Mapping the zoonotic niche of Ebola virus disease in Africa // Elife. 2014. Vol. 3. P. e04395.
29. Barre-Sinoussi F., Chermann J.C., Rey F., Monagnier L. Isolation of T-lymphotropic retrovirus from a patient at risk for aquired immune deficiency syndrome (AIDS) // Science. 1983. Vol. 20. P. 868–871.
30. Щелканов М.Ю., Колобухина Л.В., Львов Д.К. Коронавирусы человека (Nidovirales, Coronaviridae): возросший уровень эпидемической опасности // Лечащий врач. 2013. № 10. С. 49–54.
31. Kugelman J.R. et al. Genomic variability of monkeypox virus among humans, Democratic Republic of the Congo // Emerg. Infect. Dis. 2014. Vol. 20. № 2. P. 232–239.
32. Щелканов М.Ю. Эволюция высоковирулентного вируса гриппа А (H5N1) в экосистемах Северной Евразии (2005–2009 гг.). Дис. … д.б.н. (03.02.02 – Вирусология). М.: НИИ вирусологии им. Д.И. Ивановского РАМН, 2010. 488 с.
33. Организация эколого-эпидемиологического мониторинга территории Российской Федерации с целью противоэпидемической защиты населения и войск (методические рекомендации) / Под ред. Д.К. Львова. М.: МЗ РФ, Федеральное Управление медико-биологических и экстремальных проблем при МЗ РФ, НИИ вирусологии им. Д.И. Ивановского РАМН, 1993. 128 с.
34. Атлас распространения возбудителей природно-очаговых вирусных инфекций на территории Российской Федерации / Львов Д.К. и др. М.: Изд-во НПЦ МЗ РФ, 2001. 192 с.
35. Щелканов М.Ю., Громашевский В.Л., Львов Д.К. Роль эколого-вирусологического районирования в прогнозировании влияния климатических изменений на ареалы арбовирусов // Вестник РАМН. 2006. № 2. С. 22–25.
36. Применение современных молекулярно-генетических технологий для обеспечения биологической безопасности / Львов Д.К. и др. // Вестник Российской военно-медицинской академии. 2014. № 3. С. 115–127.
37. Бутенко А.М. Изучение циркуляции арбовирусов в Гвинейской Республике // Медицинская паразитология и паразитарные болезни. 1996. № 2. С. 40–44.
38. Сочинский В.А. и др. Клинико-эпидемиологическое изучение острого заболевания, протекающего с геморрагическим синдромом, в округе Мадина Ула области Киндия (1982) // Арбовирусы, паразитозы и бактериальные инфекции в Гвинейской Народной Революционной Республике. Конакри, 1983. С. 65–69.
39. Boiro I. et al. Clinico-epidemiologic and laboratory research on hemorrhagic fevers in Guinea // Bull. Soc. Pathol. Exot. Filiales. 1987. Vol. 80. № 4. P. 607–612.
40. Фирсов А.А. Экономические проблемы Гвинейской Республики. М., 1965. 192 с.
41. Ларичев В.Ф. и др. Завозные случаи арбовирусных инфекций в Российской Федерации // Эпидемиология и инфекционные болезни. 2012. № 1. С. 35–38.
42. Ларичев В.Ф. и др. Случаи завоза арбовирусных инфекций в Россию // Новые и возвращающиеся инфекции в системе биобезопасности Российской Федерации. Учебно-методическое пособие. М.: Изд-во Первого МГМУ им. И.М. Сеченова, 2014. С. 72–78.
43. Щелканов М.Ю. и др. Изоляция вируса Чикунгунья в Москве от приезжего из Индонезии (сентябрь 2013 г.) // Вопросы вирусологии. 2014. Т. 59. № 3. С. 28–34.












