Безусловно, ключевым событием в решении проблемы снижения летальности от ВТЭ следует считать 1960 год, когда были опубликованы результаты первого и единственного исследования Barritt D.W., Jordan S.C. (1960), сравнивавших эффективность антикоагулянтной терапии нефракционированной гепарии (НФГ) в/в + ОАК с плацебо у больных ВТЭ. В группе получавших НФГ в/в + оральные антикоагулянты (ОАК) у всех больных было достигнуто выраженное клиническое улучшение без развития летальных исходов, в группе плацебо – скончались 5 больных. Снижение летальности составило 25%. Именно с этого момента терапия НФГ в/в ± ОАК была признана наиболее эффективным методом лечения ВТЭ, позволяющим снизить летальность от ТЭЛА в 3–6 раз [Buller H.R., Agnelli G. et al., 2004].
Дальнейшие усилия были направлены на поиски оптимальных схем терапии НФГ и ОАК. В результате проведения большого количества работ к началу 1990–х годов были определены оптимальные дозы НФГ и ОАК (значение АЧТВ в 1,5–2,5 раза превышающее нормальные значения для гепарина и МНО от 2 до 3 для ОАК), необходимые для обеспечения их оптимального терапевтического эффекта при минимальном риске кровотечений [Hull R. et al., 1979; Hull R., 1982; Hull R., Hirsh J. et al., 1982]. Внедрение этих схем антикоагулянтной терапии в клиническую практику позволило снизить частоту объективно подтвержденных рецидивов ВТЭ у пациентов с проксимальными тромбозами (подколенным, бедренным или подвздошным) в течение 3 месяцев с 47 до 2% [Goldhaber et al.,1999].
Принципиальным этапом явилось определение эффективности тромболитической терапии (ТЛТ) у больных с ТЭЛА и показаний к ее проведению. Уже первые работы в начале 70–х годов XX века подтвердили возможность достижения выраженного клинического эффекта, максимально быстрого восстановления кровотока в окклюзированной легочной артерии, уменьшения легочной гипертензии и постнагрузки на правый желудочек в первые часы проведения ТЛТ [Miller G.A. et al., 1971; Tibbutt D.A. et al.,1974]. Однако этот положительный эффект не приводил к снижению летальности у больных с ТЭЛА по сравнению с пациентами, получавшими НФГ, и сопровождался увеличением количества серьезных кровотечений [Goldhaber S.Z. et al., 1999; Meyer G. et al., 1998; Kanter D.S. et al., 1997; Boumanameaux H. et al.,1985; Konstantinides S. et al., 1997; Goldhaber S.Z. et al., 198; Goldhaber S.Z. et al., 1988; Dalla–Volta S., Palla A. et al., 1992; Meyer G. et al., 1992; Goldhaber S.Z. et al.,1993; Goldhaber S.Z. et al., 1992]. Только в 2004 году были опубликованы результаты мета–анализа Wan S. et al., (2004) данных 11 рандомизированных исследований с участием 748 больных (табл. 1), показавшего возможность снижения летальности у больных с массивными ТЭЛА (с нарушениями гемодинамики), получавших ТЛТ. У больных с немассивными ТЭЛА (со стабильной гемодинамикой), каких–либо различий в количестве смертей и рецидивов ТЭЛА между группами больных, получавших ТЛТ или гепаринотерапию, отмечено не было [Wan S. et al., 2004]. С учетом результатов данного мета–анализа и были определены показания к проведению ТЛТ у больных с массивными ТЭЛА. Степень доказанности этих показаний пока оставляет желать лучшего – 2В [Buller H.R. et al., 2004].
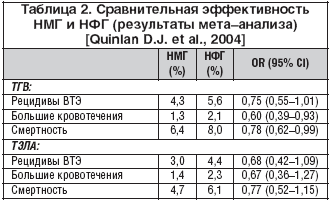
НМГ впервые использованы в профилактике тромбоза глубоких вен (ТГВ) у хирургических больных в 1982 году в исследовании под руководством доктора V.V. Каккаr. В последующие годы было проведено очень большое количество исследований с целью выявления преимущества НМГ перед НФГ [Van den Belt A.G. et al., 2000; Leizorovicz A., 1996]. Но только после опубликования результатов крупного мета–анализа 14 рандомизированных исследований больных с ТГВ и 12 рандомизированных исследований больных с ТЭЛА удалось показать возможность снижения смертности от ВТЭ при применении НМГ по сравнению с НФГ [Quinlan D.J. et al., 2004]. Результаты этого мета–анализа представлены в таблице 2.
Следует подчеркнуть, что снижение летальности при лечении НМГ обеспечивается прежде всего за счет большей комплаентности пациентов и удобства использования для медицинского персонала, а также возможности пролонгации лечения в амбулаторных условиях [Levine M.N. et al.,1996].
Большие надежды были связаны с внедрением в клиническую практику в конце 1960–х годов кава–фильтров. Однако с накоплением опыта применения этого метода лечения, клиницисты стали отмечать значительное количество осложнений, включая тромбирование самого кава–фильтра и превращение его в источник эмболии, дислокацию кава–фильтра, увеличение числа рецидивов ТГВ ниже места его постановки [Streiff M.B., 2000; Crochet D.P. et al.,1993; Greenfield L.J., Michna B.A., 1988]. Окончательное значение этого метода лечения и показания к его применению были определены после опубликования результатов исследования Decousus H. с соавт. в 1998 году [Decousus H. et al., 1998]. В исследовании участвовало 400 пациентов с ТГВ±ТЭЛА. 200 больным проводилась стандартная антикоагулянтная терапия (АКТ), другим 200 больным дополнительно к стандартной АКТ был поставлен постоянный кава–фильтр. Через 2 года наблюдения разницы в смертности между двумя группам выявлено не было. Результаты исследования позволили сформулировать современные показания к постановке кава–фильтров: неэффективность проводимой АКТ или противопоказания к ее проведению [Buller H.R. et al., 2004].
В настоящее время активно изучаются возможности постановки временных кава–фильтров. Уже накоплен достаточно большой опыт в применении этого метода лечения. Но пока доказательств, позволяющих говорить о возможности снижения летальности от ВТЭ с помощью постановки временных кава–фильтров, не получено. Показания к постановке временных кава–фильтров на сегодняшний день такие же, как и к постановке постоянных кава–фильтров.
Начали применяться в клинической практике или проходят различные фазы испытания все новые антикоагулянтные средства. Наиболее перспективными препаратами являются прямые селективные ингибиторы фактора Ха: фондапаринукс, индрапаринукс, ривароксабан, апиксабан, дабигатран. Проведенные исследования показали определенные преимущества этой группы препаратов, связанные с возможностью меньшей кратности введения (индрапаринукс – 1 раз в неделю), меньшим количеством кровотечений по сравнению с НМГ (фондапаринукс), возможностью приема оральных форм (ривароксабан). Однако рассматривать эти препараты как средства, способные обеспечить дальнейшее снижение летальности от ТЭЛА, пока нет оснований [Agnelli G. et al., 2003; Cohen A.T. et al., 2003; Eriksson B.I. et al., 2006; Mahaffey K.W. and Becker R.C., 2006].
Таким образом, после внедрения в клиническую практику НФГ ± ОАК, позволившим принципиально снизить летальность от ТЭЛА, дальнейшее внедрение все новых методов лечения ВТЭ (НМГ, ТЛТ, имплантации постоянных или временных кава–фильтров, новых антикоагулянтых препаратов) не привело к существенному улучшению прогноза заболевания. По данным международного кооперативного (52 госпиталя в 7 странах) регистра ICOPER, в который было включено 2454 больных ТЭЛА, 3–месячная летальность от ТЭЛА составляет 17,5%, причем в 40% случаев причиной смерти явилась непосредственно ТЭЛА [Goldhaber S.Z. et al., 1999].
Не меньше сомнений вызывают надежды на снижение летальности, связанные с внедрением в клиническую практику современных алгоритмов диагностики ТЭЛА с использованием высокочувствительных и специфичных инструментальных методов. Эти алгоритмы основаны на двухэтапном обследовании больных.
В первый этап включается определение клинической вероятности наличия у больного ТЭЛА и уровня D–димера крови, проведение ЭКГ, рентгенографии грудной клетки, ЭхоКГ.
Для оценки вероятности развития ТЭЛА по клиническим данным, как правило, используется количественный (балльный) анализ различных симптомов, предложенный Rodger M. и Wells P.S. (2001). Однако такой подход имеет два существенных недостатка. Во–первых, чтобы воспользоваться таким подходом, клиницист должен предположить возможность наличия у больного ТЭЛА, а именно этот момент в диагностике и является самым «слабым звеном», приводящим в дальнейшем к неправильным диагнозам и летальным исходам. Во–вторых, этот анализ имеет существенное значение, прежде всего для проведения научных исследований и практически не применяется в рутинной клинической практике. Примерно теми же недостатками обладают другие методы стратификации вероятности ТЭЛА по факторам риска и клиническим синдромам [Thomas M.H., 1999].
Определение уровня D–димера крови проводится с целью исключения диагноза ТЭЛА. Метод имеет несомненное клиническое значение. Нормальные показания D–димера позволяют исключить диагноз ТЭЛА с вероятностью близкой к 100%. Однако низкая специфичность метода не позволяет использовать его в целях подтверждения диагноза ТЭЛА [Verhaeghe R. et al., 2004].
ЭКГ, рентгенографии грудной клетки, ЭхоКГ проводятся прежде всего с целью исключения заболеваний, сходных по своим клиническим проявлениям с ТЭЛА.
В зависимости от результатов первого этапа обследования все больные стратифицируются на три группы: высокой, средней и низкой вероятности развития ТЭЛА.
Вторым этапом проводятся инструментальные обследования, позволяющие окончательно подтвердить или исключить диагноз ТЭЛА: вентиляционно–перфузионное сканирование легких (ВПСЛ), спиральная компьютерная томография (сКТ) с ангиографией, ангиопульмонография. Все перечисленные методы обладают высокой чувствительностью и специфичностью (табл. 3) и позволяют поставить диагноз ТЭЛА с высокой степенью достоверности [International consensus statement, 1997; Pulmonary Embolism – New Paradigms in Diagnosis and Therapy, 2001; The PIOPED Investigators, 1990; The PISAPED Investigators, 1996; Musset D. et al., 1986; Pond G.D. et al., 1983; Musset D. et al., 2002; Van Erkel A.R. et al., 1996].
На рисунках 1 и 2 представлены наиболее часто применяемые алгоритмы диагностики ТЭЛА с использованием ВПСЛ и сКТ легких с контрастированием.
Однако используемые алгоритмы, несмотря на свою высокую чувствительность и специфичность, не могут решить проблемы снижения летальности от ТЭЛА по трем объективным причинами:
1. Каждый пятый из умерших от ТЭЛА больных погибает в течение первого часа от начала заболевания, не дождавшись какой–либо медицинской помощи [Heit J.A., 2002].
2. Среди больных, умерших от ТЭЛА, при жизни предположительный диагноз ТЭЛА устанавливается только в 30–45% случаев [Goldhaber S.Z. et al., 1982; Rubinstein I. et al.,1988; Morgenthaler T., Ryu J., 1995; Lilibeth A. et al., 2001; Heit J.A., 2002]. Остальные больные умирают, не получив адекватной антикоагулянтной терапии.
3. Внедрение в клиническую практику высокочувствительных и специфичных инструментальных методов диагностики ТЭЛА (ВПСЛ, сКТ с ангиографией легких, ангиопульмонография) не решает проблемы ранней (хотя бы предположительной) диагностики заболевания, которая возможна только на основе анализа клинических данных.
Очевидно, что наиболее эффективным путем снижения летальности от ТЭЛА является разработка подхода к ранней диагностике ТЭЛА по клиническим данным, позволяющего практикующим врачам начать эпмирическую антикоагулянтную терапию на этапе предположительного диагноза. Однако именно на этом этапе клиницисты сталкиваются с самыми большими трудностями, обусловленными полиморфизмом клинических проявлений заболевания, отсутствием патогномоничных симптомов. В таблице 4 представлена чувствительность и специфичность наиболее часто встречаемых симптомов у больных с подозрением на ТЭЛА [Stein P.D. et al., 1991; Stein P.D. et al., 1993].
Действительно, любой из приведенных выше симптомов может быть проявлением очень большого количества различных заболеваний, прежде всего сердца и легких, многие из которых встречаются значительно чаще, чем ТЭЛА. В результате в процессе прижизненной диагностики ТЭЛА правильный диагноз устанавливается только в 70% случаев, а гипердиагностика имеет место в 65% случаев [Guidelines on diagnosis and management of acute pulmonary embolism, 2000].
С учетом принципиального значения существующей проблемы нами была предпринята попытка выделения синдромокомплексов, обладающих высокой чувствительностью, специфичностью и позволяющих свести к минимуму процент недиагностируемых ТЭЛА и гипердиагностики.
Во многих исследованиях показано, что примерно в 90% случаев симптоматические ТЭЛА манифестируют с диспноэ, боли в груди или синкопе [Stein P.D. et al., 1991; Stein P.D. et al., 1991; The PIOPED Investigators, 1990; Meignan M. et al., 2000; Ryu J.H. et al., 1998]. Безусловно, у всех больных с такой манифестацией заболевания опытный клиницист должен проводить дифференциальный диагноз с ТЭЛА. Однако все три симптома (диспноэ, боли в груди, синкопе) имеют низкую специфичность, что и ведет к большому количеству диагностических ошибок.
Ситуация кардинально меняется при выявлении у больных с клиническим подозрением на ТЭЛА (диспноэ, боли в груди или синкопе) выпота в плевральной полости и/или легочной гипертензии.
Выпот в плевральную полость диагностируется у 30–50% больных с ТЭЛА. Около 80% выпотов – экссудаты, как правило, имеющие геморрагический характер, остальные 20% выпотов – транссудаты. Количество выпота в плевральных полостях обычно бывает незначительным и часто не получает должной оценки клиницистов. Хотя именно выявление выпота в плевральной полости и определение его характера может быть «ключевым» синдромом в постановке диагноза ТЭЛА.
Принципиальной особенностью плевральных выпотов у больных с ТЭЛА является отсутствие в большинстве случаев очаговых и инфильтративных изменений при проведении рентгенографии легких или сКТ легких. Инфарктные пневмонии и, следовательно, инфильтративные изменения при Rh–графии легких развиваются только у 10% больных с ТЭЛА.
В случае диагностики плеврального выпота у больных с подозрением на ТЭЛА, с нашей точки зрения, обязательным является проведение диагностической плевральной пункции. Определение характера выпота (транссудат/экссудат, характер экссудата) является важнейшей дополнительной информацией, необходимой для проведения дифференциального диагноза с заболеваниями, сходными по своей клинической картине с ТЭЛА. Возможно выявление следующих вариантов синдромокомплексов, позволяющих с высокой степенью вероятности диагностировать ТЭЛА:
1. Подозрение на ТЭЛА по клиническим данным (диспноэ, боли в груди или синкопе) + отсутствие очаговых и инфильтративных изменений при проведении рентгенографии легких + выявление транссудата в плевральной полости.
2. Подозрение на ТЭЛА по клиническим данным (диспноэ, боли в груди или синкопе) + отсутствие очаговых и инфильтративных изменений при проведении рентгенографии легких + выявление геморрагического экссудата в плевральной полости.
По нашим данным, вероятность диагноза ТЭЛА при выявлении транссудата в плевральной полости и отсутствии очаговых и инфильтративных изменений при проведении рентгенографии составляет 90,9%. Частота встречаемости этого синдромокомплекса среди пациентов с ТЭЛА – 8,8%. Дифференциальный диагноз следует проводить с сердечной недостаточностью, гипоальбуминемией и циррозом печени, что в большинстве случаев не представляет сложностей.
При выявлении геморрагического экссудата в плевральной полости и отсутствии очаговых и инфильтративных изменений при проведении рентгенографии вероятность диагноза ТЭЛА составляет 94,4%. Частота встречаемости этого синдромокомплекса среди больных с ТЭЛА – 30,1%. Дифференциальный диагноз проводится с раком легких, коллагенозами, хронической почечной недостаточностью, травмой, синдромом Дресслера, асбестозом.
Выявление негеморрагического экссудата в плевральной полости при отсутствии очаговых и инфильтративных изменений легких по данным рентгенографии имеет гораздо меньшее диагностическое значение. Вероятность наличия ТЭЛА составляет 40%. Синдромокомплекс встречается в 2% случаев ТЭЛА. Для уточнения диагноза необходимо проведение традиционных инструментальных методов диагностики ТЭЛА: ВПСЛ, сКТ с ангиографией, ангиопульмонографии. Дифференциальный диагноз необходимо проводить со злокачественными заболеваниями, включая метастатическое поражение легких и плевры, инфекционными заболевания, воспалительными заболеваниями брюшной полости, заболеваниями соединительной ткани, эндокринными заболеваниями и поражениями лимфатической системы.
Оптимальный алгоритм дифференциальной диагностики больных с клиническим подозрением на ТЭЛА при отсутствии очаговых и инфильтративных изменений в легких по данным рентгенографии и наличии выпота в плевральной полости представлен на рисунке 3.
Таким образом, выявление у пациентов с подозрением на ТЭЛА по клиническим данным синдромокомплекса «отсутствия очаговых и инфильтративных изменений при рентгенографии легких и наличия выпота в плевральную полость» позволяет диагностировать ТЭЛА у 38,9% больных уже на самом раннем этапе постановки диагноза. Вероятность правильного диагноза сопоставима с результатами основных инструментальных методов исследования: ВПСЛ, сКТ с контрастированием, ангиопульмонографией (табл. 5).
Легочная гипертензия развивается в острой стадии симптоматических ТЭЛА примерно в 80% случаев. Чаще всего она спонтанно регрессирует параллельно с реканализацией сосудистого русла легких.
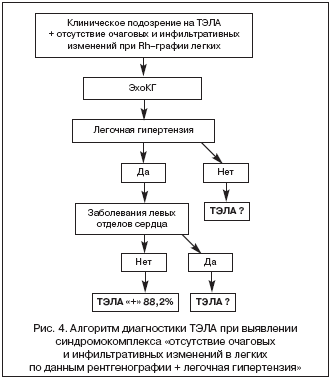
В связи с большим количеством различных патологических состояний, сопровождающихся развитием легочной гипертензии, установление ее генеза часто оказывается сложной клинической задачей. Однако выявление у больных с подозрением на ТЭЛА по клиническим данным синдромокомплекса «отсутствия очаговых и инфильтративных изменений в легких по данным рентгенографии легких + легочная гипертензия» резко сужает диагностический поиск и позволяет построить рациональный алгоритм дифференциальной диагностики ТЭЛА. После проведения Эхо–КГ и исключения заболеваний левых отделов сердца, которые могут являться причиной развития легочной гипертензии, вероятность диагноза ТЭЛА составляет 88,2%. Частота встречаемости этого синдромокомплекса среди больных с ТЭЛА – 54%.
Дифференциальный диагноз в этом случае следует проводить с ХОБЛ, интерстициальными заболеваниями легких, нарушениями дыхания во время сна, альвеолярной гиповентиляцией, длительным пребыванием на большой высоте, нарушением развития. Реже возникает необходимость проведения дифференциального диагноза с миелопролиферативными заболеваниями, сдавлением легочных сосудов, заболеваниями соединительной ткани, портальной гипертензией, нетромботическими легочными эмболиями.
Оптимальный алгоритм дифференциальной диагностики больных с клиническим подозрением на ТЭЛА, отсутствием очаговых и инфильтративных изменений в легких по данным рентгенографии и выявленной легочной гипертензии представлен на рисунке 4.
Таким образом, сочетание типичной клинической манифестации ТЭЛА (диспноэ, боли в груди, синкопе) с отсутствием очаговых и инфильтративных изменений в легких по данным рентгенографии и легочной гипертензии при отсутствии заболеваний левых отделов сердца по данным Эхо–КГ позволяет диагностировать ТЭЛА с высокой вероятностью, сопоставимой с результатами применения ВПСЛ, сКТ с ангиографией и ангиопульмонографией (табл. 6).
Использование вышеописанных алгоритмов обследования больных с клиническим подозрением на ТЭЛА позволяет, во–первых, обратить внимание практикующих врачей на особенности клинического течения ТЭЛА и, следовательно, уменьшить количество недиагностированных ТЭЛА и, во–вторых, избежать необходимости применения инвазивных, малодоступных дорогостоящих методов инструментальной диагностики ТЭЛА.
Собственный опыт применения описанных синдромокомплексов позволил нам сформулировать «золотые» правила в диагностике ТЭЛА:
– при выявлении у больного диспноэ, боли в груди или синкопе неясной этиологии в обязательном порядке проведение дифференциальной диагностики с ТЭЛА;
– при выявлении у больного диспноэ, боли в груди или синкопе в обязательном порядке исследовать плевральные полости на предмет наличия в них выпота;
– при обнаружении выпота в плевральных полостях обязательно проводить диагностическую плевральную пункцию с целью определения характера выпота;
– при выявлении диспноэ, боли в груди или синкопе неясной этиологии обязательно исследовать степень легочной гипертензии.
Не следует забывать, что описанные синдромокомплексы не являются основанием к отказу от проведения таких принципиальных для диагностики ТЭЛА исследований, как определение D–димера и исследование вен нижних конечностей (цветное дупликсное сканирование/флебография), которые дают важную дополнительную информацию, определяющую тактику ведения больных с ВТЭ.





Литература
1. Agnelli G., Bergqvist D., Cohen A. et al. Randomized doubleblind study to compare the efficacy and safety of postoperative fondaparinux (Arixtra) and preoperative dalteparin in the prevention of venous thromboembolism after high–risk abdominal surgery: the PEGASUS Study [abstract] // Blood. – 2003. – Vol. 102. – P. 15a.
2. Barritt DW, Jordan SC. Anticoagulant drugs in the treatment of pulmonary embolism. A controlled trial. Lancet 1960; 1: 1309–12.
3. Boumanameaux H., Vermylen J., Collen D. Thrombolytic treatment with recombinant tissue–type plasminogen activator in patient with pulmonary embolism. Ann Intern Med 1985;103:64–6.
4. Buller HR, Agnelli G, Hull RD, Hyers TM, Prins MH, Raskob GE. Antithrombotic therapy for venous thromboembolic desease: the 7–th АССР Conference on Antithrombotic and Thrombolitic Therapy. CHEST 2004:126: 401S–428S.
5. Cohen A.T., Davidson B.L., Gallus A.S. et al. Fondaparinux for the prevention of VTE in acutely ill medical patients [abstract] // Blood. – 2003. – Vol. 102. – P. 15a.
6. Crochet DP, Stora O, Ferry D et al. Vena Tech–LGM filter: long term results of a prospective study. Radiology 1993; 188:857–60.
7. Dalla–Volta S, Palla A, Santolicandro A, et al. PAIMS 2: alteplase combined with heparin versus heparin in the treatment of acute pulmonary embolism: Plasminogen Activator Italian Multicenter Study 2. J Am Coll Cardiol 1992;20:520–526.[ISI][Medline].
8. Decousus H. et al, A Clinical Trial of Vena Caval Filters in the Prevention of Pulmonary Embolism in Patients with Proximal Deep–Vein Thrombosis. N Engl J Med . Volume 338:409–416.February 12, 1998 Number 7.
9. Eriksson BI, Borris LC, Dahl OE, et al. A once–daily, oral, direct factor Xa inhibitor, rivaroxaban (BAY 59–7939), for thromboprophylaxis after total hip replacement. Circulation 2006; 114:2374–2381.
10. Greenfield LJ, Michna BA. Twelve–year clinical experience with the Greenfield vena cava filter. Surgery 1988;104:706–712.[Medline]
11. Goldhaber, SZ, Hennekens, CH, Evans, DA, et al. Factors associated with correct antemortem diagnosis of major pulmonary embolism. Am J Med 1982; 73,822–826[Medline.]
12. Goldhaber SZ, Vaughan DE, Markis JE, et al. Acute pulmonary embolism treated with tissue plasminogen activator. Lancet 1986;2:886–889.[ISI][Medline].
13. Goldhaber SZ, Kessler CM, Heit J, et al. Randomised controlled trial of recombinant tissue plasminogen activator versus urokinase in the treatment of acute pulmonary embolism. Lancet 1988;2:293–298.[ISI][Medline].
14. Goldhaber SZ, Haire WD, Feldstein ML, et al. Alteplase versus heparin in acute pulmonary embolism: randomised trial assessing right–ventricular function and pulmonary perfusion. Lancet 1993;341:507–511.[ISI][Medline].
15. Goldhaber SZ, Kessler CM, Heit JA, et al. Recombinant tissue–type plasminogen activator versus a novel dosing regimen of urokinase in acute pulmonary embolism: a randomized controlled multicenter trial. J Am Coll Cardiol 1992;20:24–30.[ISI][Medline]).
16. Goldhaber, SZ, Visani L, De Rosa M, for ICOPER. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353:1386–9.
17. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force Report. European Society of Cardiology // Europ. Heart J. – 2000. – Vol. 21. – P. 1301–1336.
18. Stein, P. D., H. A. Saltzman, and J. G. Weg. 1991. Clinical characteristics of patients with acute pulmonary embolism. Am. J. Cardiol. 68: 1723–1724.
19. Heit JA. Venous thromboembolism epidemiology: implications for prevention and management. Semin Thromb Hemost. 2002; 28 (suppl 2): 3–13.
20. Hull, R, Delmore, T, Genton, E, et al. Warfarin sodium versus low–dose heparin in the long–term treatment of venous thrombosis. N Engl J Med 1979; 301:855.
21. Hull R., Delmore T., Carter C. et al. Adjusted subcutaneous heparin versus warfarin sodium in the long–term treatment of venous thrombosis // New Engl. J. Med. – 1982. – Vol. 306. – P. 189–94.
22. Hull R, Hirsh J, Jay R, Carter C, England C, Gent M, Turpie AG, McLoughlin D, Dodd P, Thomas M, Raskob G, Ockelford P. Different intensities of oral anticoagulant therapy in the treatment of proximal–vein thrombosis. N Engl J Med 1982; 307: 1676–81.
23. International consensus statement. (Guidelines According to Scientific Evidencee). Prevention of venous tromboembolism.// Int. Angiol. – 1997. – Vol. 16. – P.3–28.
24. Kanter DS, Mikkola KM, Patel SR, Parker JA, Goldhaber SZ. Thrombolytic therapy for pulmonary embolism. Frequency of intracranial hemorrhage and associated risk factors.Chest 1997;111:1241–5.
25. Konstantinides S, Geibel A, Olschewski M, et al. Association between thrombolytic treatment and the prognosis of hemodynamically stable patients with major pulmonary embolism: results of a multicenter registry. Circulation 1997;96:882–888.[Abstract/Full Text].
26. Leizorovicz A. Comparison of the efficacy and safety of low molecular weight heparins and unfractionated heparin in the initial treatment of deep venous thrombosis: an updated meta–analysis. Drugs 1996;52:Suppl 7:30–37.
27. Levine MN, Gent M, Hirsh J, Leclerc J, Anderson D, Weitz J, Ginsberg J, Turpie AG, Demers C, Kovacs M. A comparison of low–molecular–weight heparin administered primarily at home with unfractionated heparin administered in the hospital for proximal deep–vein thrombosis. N Engl J Med 1996; 334: 677–81.
28. Lilibeth A. Pineda, MD; Vasanthakumar S. Hathwar, MD and Brydon J. B. Grant, MD, FCCP Clinical Suspicion of Fatal Pulmonary Embolism. Chest. 2001;120:791–795.
29. Mahaffey KW and Becker RC. The scientific community’s quest to identify optimal targets for anticoagulant pharmacotherapy. Circulation 2006; 114:2313–2316.
30. Meignan M, Rosso J, Gauthier H, et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med 2000;160:159–164.[Medline].
31. Meyer G, Sors H, Charbonnier B, et al. Effects of intravenous urokinase versus alteplase on total pulmonary resistance in acute massive pulmonary embolism: a European multicenter double–blind trial. J Am Coll Cardiol 1992;19:239–245.[ISI][Medline].
32. Meyer G, Gisselbrecht M, Diehl JL, Journois D, Sors H. Incidence and predictors of major hemorrhagic complcations from thrombolityc therapy in patients with massive pulmonary embolism. Am J Med 1998;105:472–7.
33. Miller GA, Sutton GC, Kerr IH, Gibson RV, Honey M. Comparison of streptokinase and heparin in treatment of isolated acute massive pulmonary embolism. Br Heart J 1971;33:616–616.
34. Morgenthaler, T, Ryu, J (1995) Clinical characteristics of fatal pulmonary embolism in a referral hospital. Mayo Clin Proc 70,417–424[Medline].
35. Musset D, Rosso J, Petiptrets P et al. Acute pulmonary embolism: diagnostic value of digital subtraction angiography. Radiology 1986; 166: 455–9.
36. Musset D, Parent F, Meyer G, Maitre S. et al. For the Evaluation du Scanner Spirale dans I Embolie Pulmonaire study group // Lancet. – 2002. – Vol. 360. – P. 1914–1920.
37. Pond GD, Ovitt TW, Capp MP. Comparison of convention pulmonary angiography for pulmonary embolic disease. Radiology 1983; 147: 345–50.
38. Pulmonary Embolism – New Paradigms in Diagnosis and Therapy // Chest. – 2001. – Vol. 120. – P. 1556–1561.
39. Quinlan DJ, McQuillan A, Eikelboom JW. Low–molecular weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism: meta–analysis of randomized, controlled trials. Ann Intern Med 2004; 140:175–83.
40. Rodger M., Wells P. S. Diagnosis of Pulmonary Embolism // Thrombos. Res. – 2001. – Vol. 103. – P. 225–238.
41. Rubinstein, I, Murray, D, Hoffstein, V (1988) Fatal pulmonary emboli in hospitalized patients. Arch Intern Med 148,1425–1426[Medline.]
42. Ryu JH, Olson EJ, Pellikka PA. Clinical recognition of pulmonary embolism: problem of unrecognized and asymptomatic cases. Mayo Clin Proc 1998;73:873–879.[Medline].
43. Stein PD, Terrin ML, Hales CA et al. Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no pre–existing cardiac or pulmonary disease. Chest 1991; 100: 598–603.
44. Stein, P. D., H. A. Saltzman, and J. G. Weg. Clinical characteristics of patients with acute pulmonary embolism. Am. J. Cardiol. 1991;68: 1723–1724.
45. Stein PD, Hull RD, Saltzman HA, Pineo G. Strategy for diagnosis of patients with suspected acute pulmonary embolism. Chest 1993; 103: 1553–9
46. Streiff MB. Vena caval filters: a comprehensive review. Blood. 2000;95:3669–3677.
47. The PIOPED Investigators. A Collaborative Study. Value of the ventilationperfusion scan in acute pulmonary embolismresults of the prospective investigation of pulmonary embolism diagnosis (PIOPED). J.A.M.A. 1990;263: 2753–2759.
48. The PISAPED Investigators. Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the prospective study of acute pulmonary embolism diagnosis // Amer. J. respir. Crit. Care Med. – 1996. – Vol. 154. – P. 1387–1393.
49. Thomas M.Hyers. Venous Thromboembolism Am. J. Respir. Crit. Care Med., Volume 159, Number 1, January 1999, 1–14.
50. Tibbutt DA, Davies JA, Anderson JA et al. Comperison by controlled clinical trial of streptokinase and heparin in treatment of life–threatening pulmonary embolism. Br Med J 1974;1:343–7.
51. Wan S, Quinlan DJ, Agnelli G, Eikelboom JW. Thromolysis compared with heparin for the initial treatment of pulmonary embplism: a meta–analysis of the randomized controlled trials. Circulation 2004; 110: 744–9.
52. Van Erkel A.R., Van Rossum A.B., Bloem J.L., et al. Spiral CT angiography for suspected pulmonary embolism: cost–effectiveness analysis // Radiology. – 1996. – Vol. 201. – P. 29–36
53. Van den Belt AG, Prins MH, Lensing AW, Castro AA, Clark OA, Atallah AN, Burihan E. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev 2000 CD001 100. 4.
54. Verhaeghe R., Agnelli G., Becattini C. et al. Therapeutic aspects of pulmonary embolism. In: Pulmonary Vascular Pathology: A Clinical Update / Edited by Demedts M., Delcroix M., Verhaeghe R., Verleden G. M. // J. Europ. Respiratory Soc. – 2004. – Vol. 9. – Monogr. 27. – Chapter 3. – P. 25–32.












