–≠–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М –і–Є–µ—В—Л
–Ш–Ј–±—Л—В–Њ—З–љ–∞—П –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В—М –њ–Є—В–∞–љ–Є—П –Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –і–Є—Б–±–∞–ї–∞–љ—Б –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, —П–≤–ї—П—П—Б—М –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ —Б—В–µ–њ–µ–љ—М —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ –•–°, –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —Г—А–Њ–≤–љ—П –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є –ї–Є–њ–Є–і–Њ–≤ –Ї—А–Њ–≤–Є – –Њ–±—Й–µ–≥–Њ –•–°, –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –љ–Є–Ј–Ї–Њ–є –Є –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Э–Я, –Ы–Я–Ю–Э–Я), –Ґ–У. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н–љ–і–Њ–≥–µ–љ–љ–Њ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –•–° —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –љ–∞ 20 –Љ–≥ –љ–∞ –Ї–∞–ґ–і—Л–є –Ї–Є–ї–Њ–≥—А–∞–Љ–Љ –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Э–∞ —Д–Њ–љ–µ –Є–Ј–±—Л—В–Њ—З–љ–Њ –Ї–∞–ї–Њ—А–Є–є–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –њ–Њ–≤—Л—И–∞–µ—В—Б—П –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М –ґ–Є–≤–Њ—В–љ—Л—Е –ґ–Є—А–Њ–≤ –Є —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤.
–Р–љ–∞–ї–Є–Ј –≤–Ј–∞–Є–Љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б—В–µ–њ–µ–љ–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞, –∞ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤–Њ–Њ—З–µ—А–µ–і–љ–Њ–є –Ј–∞–і–∞—З–µ–є –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –њ—А–Є –Ь–° [1, 3]. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –љ–∞ 10 –Ї–≥ —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–° –љ–∞ 10%, –•–° –Ы–Я–Э–Я –љ–∞ 15%, –Ґ–У –љ–∞ 30% –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –•–° –Ы–Я–Т–Я –љ–∞ 8%.
–Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –њ–Њ–і—Е–Њ–і–Њ–Љ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Љ–∞—Б—Б—Л —В–µ–ї–∞ —П–≤–ї—П–µ—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –і–Є–µ—В—Л, —Б—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П –Ї–Њ—В–Њ—А–Њ–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –Є –Ј–∞–≤–Є—Б–Є—В –Ї–∞–Ї –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Њ–ґ–Є—А–µ–љ–Є—П, –љ–∞–ї–Є—З–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Њ–Ј—А–∞—Б—В–∞ –±–Њ–ї—М–љ—Л—Е, —В–∞–Ї –Є –Њ—В –Є—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ш–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В–Є –і–Є–µ—В—Л –і–ї—П –ї–Є—Ж —Б —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П –љ–∞—А—Г—И–µ–љ–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –±–∞–Ј–Є—А—Г—О—В—Б—П –љ–∞ –Њ—Ж–µ–љ–Ї–µ –±–∞–Ј–∞–ї—М–љ–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ —Н–љ–µ—А–≥–Є–Є (–С–Я–≠) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Г—А–∞–≤–љ–µ–љ–Є—П –•–∞—А—А–Є—Б–∞––С–µ–љ–µ–і–Є–Ї—В–∞ [3]:
–Ь—Г–ґ—З–Є–љ—Л
–С–Я–≠ (–Ї–Ї–∞–ї) = 66,47 + (13,75 x W) + (5,0 x H) – (6,77 x A)
–С–Я–≠ (–Ї–Ф–ґ) = 278 + (57,5 x W) + (20,92 x H) – (28,37 x A)
–Ц–µ–љ—Й–Є–љ—Л
–С–Я–≠ (–Ї–Ї–∞–ї) = 65,51 + (9,56 x W) + (1,85 x H) – (4,67 x A)
–С–Я–≠ (–Ї–Ф–ґ) = 274,1 + (40,0 x W) + (7,74 x H) – (19,68 x A)
–≥–і–µ W – —Д–∞–Ї—В–Є—З–µ—Б–Ї–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ (–Ї–≥); H – —А–Њ—Б—В (—Б–Љ); A – –≤–Њ–Ј—А–∞—Б—В (–≥–Њ–і—Л)
1 –Ї–Ї–∞–ї = 4,184 –Ї–Ф–ґ; –Ї–Ф–ґ = 0,239 –Ї–Ї–∞–ї
–Я—А–Є —А–∞—Б—З–µ—В–µ —Д–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—Е–Њ–і–∞ —Н–љ–µ—А–≥–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Д–∞–Ї—В–Њ—А –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Я—А–Є –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –С–Я–≠ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –љ–∞ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В 1,2; –њ—А–Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є – –љ–∞ 1,4; –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є – –љ–∞ 1,6.
–£ –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ 25–29,9 –Ї–≥/–Љ2) –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ 30 –Ї–≥/–Љ2 –Є –±–Њ–ї–µ–µ) —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –і–Є–µ—В—Л, –љ–µ –њ—А–µ–≤—Л—И–∞—О—Й–µ–µ 30–40% –Њ—В —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ —Н–љ–µ—А–≥–Є–Є, –≤ —Б—А–µ–і–љ–µ–Љ –і–Њ 1500 –Ї–Ї–∞–ї/—Б—Г—В., —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 0,5–1 –Ї–≥/–љ–µ–і–µ–ї—О. –Т —Ж–µ–ї—П—Е –њ–Њ–≤—Л—И–µ–љ–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–Є—Б–±–∞–ї–∞–љ—Б–∞ –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ–Њ—В–µ—А–Є –≤–µ—Б–∞ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–∞–Ј–≥—А—Г–Ј–Њ—З–љ—Л—Е –і–љ–µ–є 1–3 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О, —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 800 –і–Њ 1200 –Ї–Ї–∞–ї. –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є (1000 –Ї–Ї–∞–ї/–і–µ–љ—М) –љ–µ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–µ—А–µ–і —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –Ї–∞–ї–Њ—А–Є—З–µ—Б–Ї–Њ–є —А–µ–і—Г–Ї—Ж–Є–Є (1500 –Ї–Ї–∞–ї/–і–µ–љ—М). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–Є–µ—В —Б –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В—М—О (400–800 –Ї–Ї–∞–ї/—Б—Г—В.) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є (—Б–ї–∞–±–Њ—Б—В—М, –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –Ј–∞–њ–Њ—А—Л, —В–Њ—И–љ–Њ—В–∞, —Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї —Е–Њ–ї–Њ–і—Г), –∞ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞, —А–∞–Ј–≤–Є—В–Є—О –њ–Њ–і–∞–≥—А—Л, –ґ–µ–ї—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –њ–Њ—В–µ—А–µ —В–Њ—Й–µ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞.
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є –Ь–°, –Є–Љ–µ—О—Й–Є—Е –љ–Њ—А–Љ–∞–ї—М–љ—Г—О –Љ–∞—Б—Б—Г —В–µ–ї–∞, –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В—М —А–∞—Ж–Є–Њ–љ–∞ –і–Њ–ї–ґ–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞—В—М —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—В—А–µ–±–љ–Њ—Б—В—П–Љ —Б —Г—З–µ—В–Њ–Љ —Н–љ–µ—А–≥–Њ—В—А–∞—В –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —З—В–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ 2000–2500 –Ї–Ї–∞–ї/—Б—Г—В.
–Ь–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –ґ–Є—А–Њ–≤–Њ–≥–Њ
—Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л
–Ь–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –ґ–Є—А–Њ–≤–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л –Є–≥—А–∞–µ—В –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –Є —Б–љ–Є–ґ–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ—А–Є –Ь–°, –Њ–Ї–∞–Ј—Л–≤–∞—П –Ј–∞–Љ–µ—В–љ–Њ –±–Њ–ї—М—И–Є–є –ї–µ—З–µ–±–љ—Л–є —Н—Д—Д–µ–Ї—В –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –і–Є–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Ж–Є–Њ–љ–∞. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є —Б–Њ—Б—В–∞–≤ –ґ–Є—А–∞ –≤ —А–∞—Ж–Є–Њ–љ–µ, –∞ —В–∞–Ї–ґ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–Є—А–Њ–њ–Њ–і–Њ–±–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ (—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤, —Б—В–µ—А–Є–љ–Њ–≤) –Њ–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –ґ–Є—А–∞ (40% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞), —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–Э–Ц–Ъ) –Є –•–°, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —Д–Њ–љ–µ –і–µ—Д–Є—Ж–Є—В–∞ –њ–Њ–ї–Є–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–Я–Э–Ц–Ъ), –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [4–6]. –Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ —Б –њ–Є—Й–µ–є –Э–Ц–Ъ –Є —В—А–∞–љ—Б–Є–Ј–Њ–Љ–µ—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–°, –Ґ–У, –•–° –Ы–Я–Э–Я –Є –Ы–Я–Ю–Э–Я, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –•–° –Ы–Я–Т–Я –≤ –Ї—А–Њ–≤–Є, –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –Є —Б–Є–љ—В–µ–Ј –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [5]. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Э–Ц–Ъ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Ы–Я–Э–Я –љ–∞ 5–10% [3]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –±–Њ–ї—М—И–∞—П —З–∞—Б—В—М –•–° —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –•–° –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 100 –Љ–≥ –љ–∞ 1000 –Ї–Ї–∞–ї/—Б—Г—В. —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –•–° –Ї—А–Њ–≤–Є –љ–∞ 12%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –•–° –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞ 1% —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Њ—В –Ш–С–° –љ–∞ 2–5%.
–Ь–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –ґ–Є—А–Њ–≤–Њ–є —З–∞—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞ –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–µ–є –Є –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –•–° –Ы–Я–Т–Я –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є—А–∞ –і–Њ 25–30% –Њ—В —Б—Г—В–Њ—З–љ–Њ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є, —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –і–Њ 10% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –і–Њ 300 –Љ–≥/—Б—Г—В., –Њ–±–Њ–≥–∞—Й–µ–љ–Є–µ –і–Є–µ—В—Л –Љ–Њ–љ–Њ–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ–Є –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є (–Ь–Э–Ц–Ъ), –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ –Њ–Љ–µ–≥–∞–3, —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є –Є —Д–Є—В–Њ—Б—В–µ—А–Є–љ–∞–Љ–Є, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —В—А–∞–љ—Б–Є–Ј–Њ–Љ–µ—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В [3–5]. –Т –і–Є–µ—В–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Љ–µ–ґ–і—Г –Э–Ц–Ъ, –Ь–Э–Ц–Ъ, –Я–Э–Ц–Ъ, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–µ 1:1:1, —Е–Њ—В—П –Њ–љ–Њ –Љ–Њ–ґ–µ—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є. –Т–∞–ґ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ы–Я–Э–Я —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Э–Ц–Ъ –≤ –і–Є–µ—В–µ –і–Њ 7% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞ –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –і–Њ 200 –Љ–≥/—Б—Г—В. [3,7].
–Ь–Э–Ц–Ъ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–Є—Б—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –ґ–Є—А–Њ–≤—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ —А–∞—Ж–Є–Њ–љ–∞, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –ї–Є–њ–Є–і–Њ–≤ –Ї—А–Њ–≤–Є [8]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤ —А–∞–±–Њ—В–∞—Е –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ј–∞–Љ–µ–љ–∞ —З–∞—Б—В–Є –Э–Ц–Ъ –Љ–Њ–љ–Њ–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ–Є –Є–ї–Є –Њ–±–Њ–≥–∞—Й–µ–љ–Є–µ –і–Є–µ—В—Л –Ь–Э–Ц–Ъ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б—В–Њ–ї—М –ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ–±—Й–µ–≥–Њ –•–° –Є –•–° –Ы–Я–Э–Я, –Ї–∞–Ї –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–ґ–Є—А–Њ–≤–Њ–є –і–Є–µ—В—Л –Є–ї–Є –і–Є–µ—В—Л, –Њ–±–Њ–≥–∞—Й–µ–љ–љ–Њ–є –Я–Э–Ц–Ъ [9,10]. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –•–° –Ы–Я–Т–Я –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –≤ –і–Є–µ—В–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ь–Э–Ц–Ъ –і–Њ 20% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ш–С–° –≤ —Б—В—А–∞–љ–∞—Е –°—А–µ–і–Є–Ј–µ–Љ–љ–Њ–Љ–Њ—А—Б–Ї–Њ–≥–Њ —А–µ–≥–Є–Њ–љ–∞, –љ–∞—Б–µ–ї–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –њ–Њ—В—А–µ–±–ї—П–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ–ї–Є–≤–Ї–Њ–≤–Њ–µ –Љ–∞—Б–ї–Њ (–Њ—Б–љ–Њ–≤–љ–Њ–є –Є—Б—В–Њ—З–љ–Є–Ї –Ь–Э–Ц–Ъ), —П–≤–ї—П–µ—В—Б—П –љ–Є–Ј–Ї–Є–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є—А–∞ –≤ –Є—Е –њ–Є—Й–µ–≤–Њ–Љ —А–∞—Ж–Є–Њ–љ–µ. –Э–∞ –і–Њ–ї—О –Ь–Э–Ц–Ъ –≤ –і–Є–µ—В–µ –±–Њ–ї—М–љ—Л—Е —Б –Ь–° –і–Њ–ї–ґ–љ–Њ –њ—А–Є—Е–Њ–і–Є—В—М—Б—П 10–15% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –і–Є–µ—В—Л.
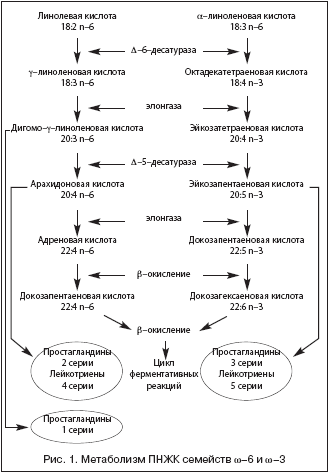
–Я–Э–Ц–Ъ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ –њ–Є—В–∞–љ–Є—П, —В–∞–Ї –Ї–∞–Ї –Њ–љ–Є –љ–µ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Ф–µ—Д–Є—Ж–Є—В –Я–Э–Ц–Ъ –≤—Л–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Є —Д—Г–љ–Ї—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ, –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ, –±–Є–Њ—Б–Є–љ—В–µ–Ј–µ —Н–є–Ї–Њ–Ј–∞–љ–Њ–Є–і–Њ–≤ (–њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤, —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ–Њ–≤). –Я–Њ —Б–≤–Њ–µ–Љ—Г —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Б—В—А–Њ–µ–љ–Є—О –Њ–љ–Є –і–µ–ї—П—В—Б—П –љ–∞ –і–≤–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–∞—Б—Б–∞: –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤ w–6 –Є w–3, —А–∞–Ј–ї–Є—З–∞—О—Й–Є–µ—Б—П —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ–Љ –њ–µ—А–≤–Њ–є –і–≤–Њ–є–љ–Њ–є —Б–≤—П–Ј–Є —Г 6 –Є–ї–Є 3 –∞—В–Њ–Љ–∞ —Г–≥–ї–µ—А–Њ–і–∞. –Ъ —З–Є—Б–ї—Г –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w–6 –Њ—В–љ–Њ—Б—П—В—Б—П –ї–Є–љ–Њ–ї–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (18:2 n–6), —Б–Њ–і–µ—А–ґ–∞—Й–∞—П—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б–ї–∞—Е (–њ–Њ–і—Б–Њ–ї–љ–µ—З–љ–Њ–µ, –Ї—Г–Ї—Г—А—Г–Ј–љ–Њ–µ, —Е–ї–Њ–њ–Ї–Њ–≤–Њ–µ), –Є –≤–∞–ґ–љ–µ–є—И–Є–є –њ—А–Њ–і—Г–Ї—В –µ–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ – –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (20:4 n–6). –У–ї–∞–≤–љ—Л–Љ–Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ–Є –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w–3 —П–≤–ї—П—О—В—Б—П a––ї–Є–љ–Њ–ї–µ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (18:3 n–3), —Б–Њ–і–µ—А–ґ–∞—Й–∞—П—Б—П –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б–ї–∞—Е (–ї—М–љ—П–љ–Њ–µ, —Б–Њ–µ–≤–Њ–µ, —А–∞–њ—Б–Њ–≤–Њ–µ, –≥–Њ—А—З–Є—З–љ–Њ–µ –Є –і—А.), –Њ—А–µ—Е–∞—Е, –Ј–µ–ї–µ–љ—Л—Е –Њ–≤–Њ—Й–∞—Е, –Є –µ–µ –і–ї–Є–љ–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л–µ –љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –∞–љ–∞–ї–Њ–≥–Є – —Н–є–Ї–Њ–Ј–∞–њ–µ–љ—В–∞–µ–љ–Њ–≤–∞—П –Є –і–Њ–Ї–Њ–Ј–∞–≥–µ–Ї—Б–∞–µ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В—Л (–≠–Я–Ъ –Є –Ф–У–Ъ), –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –ґ–Є—А–µ –Љ–Њ—А—Б–Ї–Є—Е —А—Л–±, –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е, –Љ–Њ–ї–ї—О—Б–Ї–∞—Е, –Љ–Њ—А—Б–Ї–Є—Е —А–∞—Б—В–µ–љ–Є—П—Е, —Д–Є—В–Њ–њ–ї–∞–љ–Ї—В–Њ–љ–µ [11–13]. –Ь–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Я–Э–Ц–Ъ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –Ш–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–є —Б—Е–µ–Љ—Л –≤–Є–і–љ–Њ, —З—В–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤ w–6 –Є w–3 —Б–ї—Г–ґ–∞—В –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є —В–∞–Ї–Є—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Ї–∞–Ї –њ—А–Њ—Б—В–∞–љ–Њ–Є–і—Л –Є –ї–µ–є–Ї–Њ—В—А–Є–µ–љ—Л.
–Я–Э–Ц–Ъ –Њ–±–ї–∞–і–∞—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —З—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–°, –•–° –Ы–Я–Э–Я –Є –Ґ–У –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–љ–Є–ґ–µ–љ–Є–Є —Б–Є–љ—В–µ–Ј–∞ –Ы–Я–Э–Я –≤ –њ–µ—З–µ–љ–Є, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–∞—О—В –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Я–Э–Ц–Ъ –≤ –і–Є–µ—В–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –і–Њ 7–9% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Я–Э–Ц–Ъ –≤ —А–∞—Ж–Є–Њ–љ–µ —Б–≤—Л—И–µ 10% –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ, —Г—З–Є—В—Л–≤–∞—П –≤—Л—Б–Њ–Ї—Г—О —Б—В–µ–њ–µ–љ—М –Є—Е –љ–µ–љ–∞—Б—Л—Й–µ–љ–љ–Њ—Б—В–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [4]. –Ф–Є–µ—В–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –Я–Э–Ц–Ъ (—Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Я–Э–Ц–Ъ/–Э–Ц–Ъ 2:1 –Є –±–Њ–ї–µ–µ) –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є III –Є IV —В–Є–њ–∞, —В–∞–Ї –Ї–∞–Ї –≤—Л–Ј—Л–≤–∞–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Г—А–Њ–≤–љ—П –•–° –Є –∞–њ–Њ–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–∞ –Т. –Ю–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —Б—З–Є—В–∞–µ—В—Б—П –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –ї–Є–љ–Њ–ї–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 6–8% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–Њ—Б –Є–љ—В–µ—А–µ—Б –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч, –Њ–±–ї–∞–і–∞—О—Й–Є—Е —А—П–і–Њ–Љ –≤–∞–ґ–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [12,13]. –Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–Љ–Є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–є –Є—Е –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ, —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ, –Є–Љ–Љ—Г–љ–Њ–Ї–Њ—А—А–Є–≥–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ [12–16]. –Т –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч –≤ –і–Є–µ—В–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –Љ–Њ—А—Б–Ї–∞—П —А—Л–±–∞ (—Б–Ї—Г–Љ–±—А–Є—П, —Б–∞—А–і–Є–љ–∞, —Б–µ–ї—М–і—М –Є–≤–∞—Б–Є, –њ–∞–ї—В—Г—Б –Є –і—А.), —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–∞—Б–ї–∞ (—Б–Њ–µ–≤–Њ–µ, —А–∞–њ—Б–Њ–≤–Њ–µ, –≥–Њ—А—З–Є—З–љ–Њ–µ, –Ї—Г–љ–ґ—Г—В–љ–Њ–µ, –Њ—А–µ—Е–Њ–≤–Њ–µ –Є –і—А.), –±–Њ–≥–∞—В—Л–µ a––ї–Є–љ–Њ–ї–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є (18:3 n–3), –∞ —В–∞–Ї–ґ–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–µ –і–Њ–±–∞–≤–Ї–Є –Ї –њ–Є—Й–µ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –≤—Л—Б–Њ–Ї–Њ–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –і–ї–Є–љ–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л–µ –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч – –≠–Я–Ъ –Є –Ф–У–Ъ. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 1–2 –≥/—Б—Г—В. –і–Њ 1–2% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞ [4,17].
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ, —З—В–Њ —Б–Њ—З–µ—В–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч –Є —Б—В–∞—В–Є–љ–Њ–≤ – –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —Д–µ—А–Љ–µ–љ—В–∞ –≥–Є–і—А–Њ–Ї—Б–Є–ї–Љ–µ—В–Є–ї–≥–ї—О—В–∞—А–Є–ї–Ї–Њ—Н–љ–Ј–Є–Љ––Р —А–µ–і—Г–Ї—В–∞–Ј—Л, —Б–љ–Є–ґ–∞—О—Й–Є—Е –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–є —Б–Є–љ—В–µ–Ј —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –•–° –Ы–Я–Э–Я, –љ–Њ –Є –Ґ–У, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П –њ–Њ–≤—Л—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є [18,19].
–° –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–∞—А—Г—И–µ–љ–Є–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П, –љ–∞—А—П–і—Г —Б –Э–Ц–Ъ, –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ —В—А–∞–љ—Б–Є–Ј–Њ–Љ–µ—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—А–∞–Ј—Г—О—В—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –≥–Є–і—А–Њ–≥–µ–љ–Є–Ј–∞—Ж–Є–Є –Я–Э–Ц–Ъ –њ—А–Є –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ –Љ–∞—А–≥–∞—А–Є–љ–Њ–≤. –Т –љ–∞—В—Г—А–∞–ї—М–љ–Њ–Љ —Б–ї–Є–≤–Њ—З–љ–Њ–Љ –Љ–∞—Б–ї–µ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –Њ—В 0,6 –і–Њ 4,2% —В—А–∞–љ—Б–Є–Ј–Њ–Љ–µ—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Љ–∞—А–≥–∞—А–Є–љ–∞—Е – —Б–≤—Л—И–µ 10%. –°—З–Є—В–∞—О—В, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –ґ–Є—А–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ —А–∞—Ж–Є–Њ–љ–∞ —Б –Ј–∞–Љ–µ–љ–Њ–є –љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –Є —В—А–∞–љ—Б—Д–Њ—А–Љ–ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –љ–∞ –Ь–Э–Ц–Ъ –Є —Ж–Є—Б–—Д–Њ—А–Љ—Л –Я–Э–Ц–Ъ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–° –Є –•–° –Ы–Я–Э–Я –љ–∞ 5–10% [4]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞—Е–Њ–і–Є—В —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Љ–∞—А–≥–∞—А–Є–љ–Њ–≤ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ–µ—А–µ—Н—В–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —В—А–∞–љ—Б–Є–Ј–Њ–Љ–µ—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В.
–Ч–љ–∞—З–µ–љ–Є–µ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Є —Д–Є—В–Њ—Б—В–µ—А–Є–љ–Њ–≤ –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Е –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Г –Є —Д—Г–љ–Ї—Ж–Є—О –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ–Љ–±—А–∞–љ, –ї–Є–њ–Њ—В—А–Њ–њ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –•–° –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ [3,20]. –Я–Њ –і–∞–љ–љ—Л–Љ —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤ [21,22], –Њ–±–Њ–≥–∞—Й–µ–љ–Є–µ –і–Є–µ—В—Л —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ–Є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є. –Р–і–µ–Ї–≤–∞—В–љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П—О—В—Б—П —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–∞—Б–ї–∞, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 7 –≥/—Б—Г—В. [23]. –Ю–і–љ–∞–Ї–Њ –њ—А–Є —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–Є–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б–µ–ї –±–Њ–ї—М—И–∞—П —З–∞—Б—В—М —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ —В–µ—А—П–µ—В—Б—П, –њ–Њ—Н—В–Њ–Љ—Г –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Е –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Ї–∞–Ї –љ–µ—А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–∞—Б–ї–∞, –Њ–±–Њ–≥–∞—Й–µ–љ–љ—Л–µ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–∞–Љ–Є, —В–∞–Ї –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–µ –і–Њ–±–∞–≤–Ї–Є –Ї –њ–Є—Й–µ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Л.
–Ю–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—П –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ
—Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л
–Ю–њ—В–Є–Љ–∞–ї—М–љ–∞—П —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –ї–Є–њ–Є–і–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Є –Ь–°. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Б–Њ–і–µ—А–ґ–∞—Й–Є–є—Б—П –≤ –њ–Є—Й–µ –±–µ–ї–Њ–Ї, –Ї–∞–Ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ, —В–∞–Ї –Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –µ–≥–Њ —Б–Њ—Б—В–∞–≤, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –љ–∞ —Г—А–Њ–≤–µ–љ—М –•–° –≤ –Ї—А–Њ–≤–Є. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –≤ –њ–Є—Й–µ –і–Њ–ї–Є –Љ—П—Б–љ–Њ–≥–Њ, —П–Є—З–љ–Њ–≥–Њ, –Љ–Њ–ї–Њ—З–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–∞—А–∞—Б—В–∞–љ–Є—О –•–° –≤ –Ї—А–Њ–≤–Є, –∞ —Б–Њ–µ–≤–Њ–≥–Њ –±–µ–ї–Ї–∞ – –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О. –Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –±–µ–ї–Ї–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ–Љ –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є –Є –Ј–∞–Љ–µ—В–љ–Њ–є –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–µ–є –Ї—А–Њ–≤–Є –њ—А–Є –і–µ–њ—А–µ—Б—Б–Є–Є —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞. –Ф–µ—Д–Є—Ж–Є—В –±–µ–ї–Ї–∞ –≤ —А–∞—Ж–Є–Њ–љ–µ –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П –љ–∞—А—Г—И–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л—Е —Д–Њ—А–Љ –ї–Є–њ–Є–і–Њ–≤ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –∞–Њ—А—В–µ. –І–∞—Б—В–Є—З–љ–∞—П –Ј–∞–Љ–µ–љ–∞ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –≤ —А–∞—Ж–Є–Њ–љ–µ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ (—Б–Њ–µ–≤—Л–Љ) –±–µ–ї–Ї–Њ–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—Й–µ–≥–Њ –•–° –Є –Ґ–У –≤ –Ї—А–Њ–≤–Є [24]. –Ю–і–љ–∞–Ї–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –≥–Є–њ–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –≤ —А–∞—Ж–Є–Њ–љ–µ –±–µ–ї–Ї–Њ–≤ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Є —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —В–Њ–ї—М–Ї–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ [4].
–Ю–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —Б—З–Є—В–∞–µ—В—Б—П —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –±–µ–ї–Ї–∞ –≤ –і–Є–µ—В–µ, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–µ 80–90 –≥/—Б—Г—В. –Є–ї–Є 12–14% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞. –Ю–±–µ—Б–њ–µ—З–µ–љ–Є–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –±–µ–ї–Ї–∞ (—Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –Є –Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В) –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ –і–Є–µ—В—Г –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ (–љ–µ–ґ–Є—А–љ—Л–µ —Б–Њ—А—В–∞ –Љ—П—Б–∞, —А—Л–±—Л, –њ—В–Є—Ж—Л, –Љ–Њ–ї–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л –њ–Њ–љ–Є–ґ–µ–љ–љ–Њ–є –ґ–Є—А–љ–Њ—Б—В–Є, —П–Є—З–љ—Л–є –±–µ–ї–Њ–Ї) –Є —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ (–Ї—А—Г–њ—Л, –Ј–µ—А–љ–Њ–≤—Л–µ, –±–Њ–±–Њ–≤—Л–µ) –±–µ–ї–Ї–∞. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Є —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –њ—А–Є —Н—В–Њ–Љ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М —А–∞–≤–љ—Л–Љ.
–Ю–і–љ–Є–Љ –Є–Ј –њ—Г—В–µ–є –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –њ—А–Є –Ь–° —П–≤–ї—П–µ—В—Б—П –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –і–Є–µ—В—Г –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–µ—А–µ—А–∞–±–Њ—В–Ї–Є —Б–Њ–µ–≤—Л—Е –±–Њ–±–Њ–≤, —П–≤–ї—П—О—Й–Є—Е—Б—П —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Б–Њ–µ–≤—Л–є –±–µ–ї–Њ–Ї, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О, —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М—О –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Є —Е–Њ—А–Њ—И–µ–є —Г—Б–≤–Њ—П–µ–Љ–Њ—Б—В—М—О, –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–є –Љ–Њ–ї–Њ—З–љ—Л–Љ –Є –Љ—П—Б–љ—Л–Љ –±–µ–ї–Ї–∞–Љ [25]. –Т –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–ї—Г—З–µ–љ—Л —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –≥–Є–њ–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є —Б–Њ–µ–≤–Њ–≥–Њ –±–µ–ї–Ї–∞ [24]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –Ј–∞–Љ–µ—В–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –•–° –Є –Ґ–У –Ї–∞–Ї —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, —В–∞–Ї –Є —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –њ—А–Є –Ј–∞–Љ–µ–љ–µ –≤ –і–Є–µ—В–µ —З–∞—Б—В–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ —Б–Њ–µ–≤—Л–Љ [24,26]. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ, —З—В–Њ –≥–Є–њ–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В —Б–Њ–µ–≤—Л—Е –±–Њ–±–Њ–≤ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ —Б–Њ–µ–≤–Њ–≥–Њ –±–µ–ї–Ї–∞, –љ–Њ –Є –љ–∞–ї–Є—З–Є–µ–Љ –≤ –љ–Є—Е —А—П–і–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ (–Я–Э–Ц–Ъ, –њ–Є—Й–µ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞, —Д–µ–љ–Њ–ї—М–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, —Б–∞–њ–Њ–љ–Є–љ—Л, –Є–Ј–Њ—Д–ї–∞–≤–Њ–љ–Њ–Є–і—Л), –Њ–±–ї–∞–і–∞—О—Й–Є—Е –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ, —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Э–∞–ї–Є—З–Є–µ –≤ —Б–Њ–µ–≤—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–∞—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –∞–Ї—В–Є–≤–љ–Њ –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М –Є/–Є–ї–Є –Ї–Њ—А—А–Є–≥–Є—А–Њ–≤–∞—В—М –Є—Е –љ–∞—А—Г—И–µ–љ–Є—П, –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Є—Е –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –Ь–°.
–Ь–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П
—Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л
–Э–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є –љ–µ–Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –≤ –і–Є–µ—В–µ –љ–µ —В–Њ–ї—М–Ї–Њ —Г—Б—Г–≥—Г–±–ї—П–µ—В –љ–∞—А—Г—И–µ–љ–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –њ—А–Є –Ь–°, –љ–Њ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Я–Њ–≤—Л—И–µ–љ–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ —Г–≥–ї–µ–≤–Њ–і–Њ–≤ (–±–Њ–ї–µ–µ 65% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞), –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ —Г–≥–ї–µ–≤–Њ–і–Њ–≤ —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–Њ–љ–Њ– –Є –і–Є—Б–∞—Е–∞—А–Є–і–Њ–≤ – –≥–ї—О–Ї–Њ–Ј—Л, —Д—А—Г–Ї—В–Њ–Ј—Л, —Б–∞—Е–∞—А–Њ–Ј—Л – —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ–µ–є –Ы–Я–Ю–Э–Я –Є –Ґ–У –≤ –Ї—А–Њ–≤–Є [27]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞ –њ–Њ–ї—Г—З–µ–љ—Л –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є–µ —А–∞–Ј–≤–Є—В–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Є–≥—А–∞—О—Й–µ–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Г—О —А–Њ–ї—М –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є, –њ—А–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є —Б–∞—Е–∞—А–Њ–Ј—Л –Є —Д—А—Г–Ї—В–Њ–Ј—Л (–±–Њ–ї–µ–µ 60% –Є 35% –Њ—В —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) [28,29]. –Ш—Б–Ї–ї—О—З–µ–љ–Є–µ –Є–Ј —А–∞—Ж–Є–Њ–љ–∞ —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ы–Я–Ю–Э–Я –Є –Ґ–У, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–µ–Ї–Њ—В–Њ—А–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—Й–µ–≥–Њ –•–° –Ї—А–Њ–≤–Є.
–Т –і–Є–µ—В–µ –±–Њ–ї—М–љ—Л—Е —Б –Ь–° –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Г–≥–ї–µ–≤–Њ–і–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–µ 50–55% –Њ—В –Њ–±—Й–µ–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —А–∞—Ж–Є–Њ–љ–∞, —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —Б–ї–Њ–ґ–љ—Л—Е –Љ–µ–і–ї–µ–љ–љ–Њ –≤—Б–∞—Б—Л–≤–∞—О—Й–Є—Е—Б—П —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ –Є–ї–Є –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –±—Л—Б—В—А–Њ–≤—Б–∞—Б—Л–≤–∞–µ–Љ—Л—Е —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–∞—Е–∞—А–Њ–≤. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –≤ –і–Є–µ—В–µ —П–≤–ї—П—О—В—Б—П —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л – –Ј–µ—А–љ–Њ–≤—Л–µ, –Ї—А—Г–њ—Л, –Њ–≤–Њ—Й–Є –Є —Д—А—Г–Ї—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –Є –љ–µ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –њ–Є—Й–µ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ (–Я–Т).
–Я–Т – –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–∞—П –≥—А—Г–њ–њ–∞ –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –±–Є–Њ–њ–Њ–ї–Є–Љ–µ—А–Њ–≤ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П —Б —А–∞–Ј–љ–Њ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–Њ–є –Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–Є–Ј–Є–Ї–Њ–—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ–µ—А–µ–≤–∞—А–Є–≤–∞—О—В—Б—П –Є –љ–µ –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ —З–µ–ї–Њ–≤–µ–Ї–∞. –С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Я–Т –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –Ј–∞–≤–Є—Б—П—В –Њ—В –Є—Е –≤–ї–∞–≥–Њ—Г–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є, —Б–Њ—А–±—Ж–Є–Њ–љ–љ–Њ–є, –Є–Њ–љ–Њ–Њ–±–Љ–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –У–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –Я–Т, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ–µ–Ї—В–Є–љ, —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –≥–µ–Љ–Є—Ж–µ–ї–ї—О–ї–Њ–Ј—Л, –Ї–∞–Љ–µ–і–Є. –Т–Ї–ї—О—З–µ–љ–Є–µ 15 –≥ —А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –Я–Т –≤ –і–Є–µ—В—Г –љ–∞ 15–21% —Б–љ–Є–ґ–∞–µ—В —Г—А–Њ–≤–µ–љ—М –•–° –≤ –Ї—А–Њ–≤–Є [4]. –®–Є—А–Њ–Ї–Њ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –і–Є–µ—В—Г –Њ–≤–Њ—Й–µ–є, —Д—А—Г–Ї—В–Њ–≤, –Ј–µ—А–љ–Њ–≤—Л—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–ї–љ–Њ—Б—В—М—О —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В—М –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –Я–Т, –Ї–Њ—В–Њ—А–∞—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 25–30 –≥ –≤ —Б—Г—В. –Я—А–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П—Е –Љ–Њ–ґ–љ–Њ —Г–≤–µ–ї–Є—З–Є—В—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Я–Т –і–Њ 40 –≥/—Б—Г—В. –Ј–∞ —Б—З–µ—В –Є—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ – –Њ–≤—Б—П–љ—Л—Е, —А–ґ–∞–љ—Л—Е, —П—З–Љ–µ–љ–љ—Л—Е –Њ—В—А—Г–±–µ–є, —Е–Є–Љ–Є—З–µ—Б–Ї–Є —З–Є—Б—В–Њ–≥–Њ –њ–µ–Ї—В–Є–љ–∞, –Љ–µ—В–Є–ї—Ж–µ–ї–ї—О–ї–Њ–Ј—Л –Є –і—А. –Ю–і–љ–∞–Ї–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Я–Т –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –±–Њ–ї–µ–µ 60 –≥ –≤ —Б—Г—В–Ї–Є –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ – –Ї–∞–ї—М—Ж–Є—П, –Љ–∞–≥–љ–Є—П, –ґ–µ–ї–µ–Ј–∞, –Љ–µ–і–Є, —Ж–Є–љ–Ї–∞ –Є —А—П–і–∞ –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤.
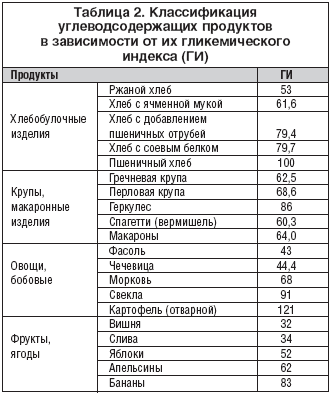
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞—О—В –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –і–Є–µ—В—Л —Б –љ–Є–Ј–Ї–Є–Љ –Є –≤—Л—Б–Њ–Ї–Є–Љ –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ–і–µ–Ї—Б–Њ–Љ (–У–Ш) –љ–∞ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–Є–µ—В—Л —Б –≤—Л—Б–Њ–Ї–Є–Љ –У–Ш –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≥–ї–Є–Ї–µ–Љ–Є–Є –Є —Г—Б–Є–ї–µ–љ–Є–µ–Љ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –љ–Њ –Є —Б –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ —В–∞–Ї–Є–µ –Љ–∞—А–Ї–µ—А—Л –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –Ї–∞–Ї –Ґ–У, –•–° –Ы–Я–Т–Я –Є –°–—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї [30,31]. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –і–Є–µ—В–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є –±–ї—О–і —Б –љ–Є–Ј–Ї–Є–Љ –У–Ш –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П –ї—Г—З—И–µ–є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П —Г–≥–ї–µ–≤–Њ–і—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –Є—Е –У–Ш –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 2.
–°–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–љ–Њ–≥–Њ, –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л. –Ь–Є–љ–Њ—А–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ–Є—Й–Є
–Ю–±–µ—Б–њ–µ—З–µ–љ–Є–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–љ–Њ–≥–Њ, –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –і–Є–µ—В—Л –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–∞—А—Г—И–µ–љ–Є—П—Е –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –њ—А–Є –Ь–°. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –≤–Є—В–∞–Љ–Є–љ—Л –Є –Љ–Є–љ–µ—А–∞–ї—М–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞ —П–≤–ї—П—О—В—Б—П —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –њ–Є—В–∞–љ–Є—П, –Є –і–µ—Д–Є—Ж–Є—В –Є—Е –≤ –њ–Є—Й–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –≤ —Б–≤—П–Ј–Є —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –њ–Є—В–∞–љ–Є—П —А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б–Њ–Ј–і–∞—О—В—Б—П –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –і–µ—Д–Є—Ж–Є—В–∞ –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤ —Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —З–∞—Б—В–Є –љ–∞—Б–µ–ї–µ–љ–Є—П. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ—А–Є –Љ–љ–Њ–≥–Є—Е –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ––Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е —Б—Г—В–Њ—З–љ–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –≤–Є—В–∞–Љ–Є–љ–∞—Е, –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–∞—Е –њ–Њ–≤—Л—И–∞–µ—В—Б—П.
–Ф–ї—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –≤ –і–Є–µ—В–Є—З–µ—Б–Ї–Є–є —А–∞—Ж–Є–Њ–љ –≤–Ї–ї—О—З–∞—О—В—Б—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –љ–∞—В—Г—А–∞–ї—М–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л, —П–≤–ї—П—О—Й–Є–µ—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤, –Є –і–Є–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ–і—Г–Ї—В—Л, –Њ–±–Њ–≥–∞—Й–µ–љ–љ—Л–µ –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–∞–Љ–Є – –Р, –Х, –° –Є b––Ї–∞—А–Њ—В–Є–љ–Њ–Љ. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —П–≤–ї—П—О—В—Б—П —Д—А—Г–Ї—В—Л, —П–≥–Њ–і—Л, —И–Є–њ–Њ–≤–љ–Є–Ї, –Њ–≤–Њ—Й–Є; –≤–Є—В–∞–Љ–Є–љ–∞ –Х – —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–∞—Б–ї–∞ (—Б–Њ–µ–≤–Њ–µ, –Ї—Г–Ї—Г—А—Г–Ј–љ–Њ–µ, –њ–Њ–і—Б–Њ–ї–љ–µ—З–љ–Њ–µ), –Њ—А–µ—Е–Є, —Б–µ–Љ–µ—З–Ї–Є, –±–Њ–±–Њ–≤—Л–µ. –†–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–Є–µ –Є —В–µ—А–Љ–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ —Г–Љ–µ–љ—М—И–∞—О—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ –Х –≤ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б–ї–∞—Е. –Я—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –≤ —А–∞—Ж–Є–Њ–љ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Я–Э–Ц–Ъ, –Њ—Б–Њ–±–µ–љ–љ–Њ –і–ї–Є–љ–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е, –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≤–Є—В–∞–Љ–Є–љ–∞—Е––∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–∞—Е —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Ґ–∞–Ї, –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –≤ –і–Є–µ—В—Г 1 –≥ –Я–Э–Ц–Ъ —Б–µ–Љ–µ–є—Б—В–≤–∞ w––Ч —В—А–µ–±—Г–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П 5 –Љ–≥ –≤–Є—В–∞–Љ–Є–љ–∞ –Х [4]. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –≤–Є—В–∞–Љ–Є–љ–∞ –Р —П–≤–ї—П—О—В—Б—П –Љ–Њ–ї–Њ—З–љ—Л–є –ґ–Є—А, —Б—Л—А, —П–Є—З–љ—Л–є –ґ–µ–ї—В–Њ–Ї – –њ—А–Њ–і—Г–Ї—В—Л, –Ї–Њ—В–Њ—А—Л–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В—Б—П –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–∞—Е –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є. –Я–Њ—Н—В–Њ–Љ—Г –≤ —А–∞—Ж–Є–Њ–љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —И–Є—А–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Њ–і—Г–Ї—В—Л, –±–Њ–≥–∞—В—Л–µ b––Ї–∞—А–Њ—В–Є–љ–Њ–Љ – –Љ–Њ—А–Ї–Њ–≤—М, —Б–ї–∞–і–Ї–Є–є –њ–µ—А–µ—Ж, –Ј–µ–ї–µ–љ—Л–є –ї—Г–Ї, –њ–µ—В—А—Г—И–Ї–∞, —П–±–ї–Њ–Ї–Є, —Ж–Є—В—А—Г—Б–Њ–≤—Л–µ. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –і–Є–µ—В–Є—З–µ—Б–Ї–Є–є —А–∞—Ж–Є–Њ–љ –Њ–±–Њ–≥–∞—Й–∞–µ—В—Б—П –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –≥—А—Г–њ–њ—Л –Т, –†–†, —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є. –Ъ–Њ—А—А–µ–Ї—Ж–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Ь–°, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–Є–њ–Њ–Ї–∞–ї–Њ—А–Є–є–љ—Л—Е —А–∞—Ж–Є–Њ–љ–Њ–≤, –љ–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –≤–Є—В–∞–Љ–Є–љ–Њ–≤, –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —А–µ–≥—Г–ї—П—А–љ—Л–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ–Њ–ї–Є–≤–Є—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Т –і–Є–µ—В–µ –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Ь–° –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї–∞–Ї –Љ–∞–Ї—А–Њ– (–љ–∞—В—А–Є–є, –Ї–∞–ї–Є–є, –Љ–∞–≥–љ–Є–є, –Ї–∞–ї—М—Ж–Є–є –Є –і—А.), —В–∞–Ї –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ (–Љ–µ–і—М, —Е—А–Њ–Љ, —Ж–Є–љ–Ї, –Љ–∞—А–≥–∞–љ–µ—Ж, –є–Њ–і –Є –і—А.), —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Є –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Ґ–∞–Ї, –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Е—А–Њ–Љ–∞ —Б–≤—П–Ј–∞–љ–Њ —Б –µ–≥–Њ —Г—З–∞—Б—В–Є–µ–Љ –≤ –ї–Є–њ–Є–і–љ–Њ–Љ –Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–Љ –Њ–±–Љ–µ–љ–µ. –Ф–µ—Д–Є—Ж–Є—В —Е—А–Њ–Љ–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–° –Є –Ґ–У –≤ –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —А–Њ—Б—В–Њ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –Ш–С–° [32]. –Т–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ —Е—А–Њ–Љ–∞, –љ–∞—А—П–і—Г —Б —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–є –Ї –Є–љ—Б—Г–ї–Є–љ—Г, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ–±—Й–µ–≥–Њ –•–°, –•–° –Ы–Я–Э–Я –Є –Ґ–У –≤ –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–µ–љ–Є—О –•–° –Ы–Я–Т–Я —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ [32,33]. –Я–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —Е—А–Њ–Љ–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 200 –Љ–Ї–≥/—Б—Г—В. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є —Е—А–Њ–Љ–∞ —П–≤–ї—П—О—В—Б—П –њ–µ–Ї–∞—А—Б–Ї–Є–µ –і—А–Њ–ґ–ґ–Є, —А–ґ–∞–љ–∞—П –Є –њ—И–µ–љ–Є—З–љ–∞—П –Љ—Г–Ї–∞ –≥—А—Г–±–Њ–≥–Њ –њ–Њ–Љ–Њ–ї–∞, –±–Њ–±–Њ–≤—Л–µ, –њ–µ—А–ї–Њ–≤–∞—П –Ї—А—Г–њ–∞. –£—З–Є—В—Л–≤–∞—П –≤–∞–ґ–љ—Г—О —А–Њ–ї—М —Ж–Є–љ–Ї–∞ –≤ –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е, –∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–µ–љ–љ—Л–є –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–є —Н—Д—Д–µ–Ї—В –і–Њ–±–∞–≤–Њ–Ї —Ж–Є–љ–Ї–∞ [34,35], –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –Ь–° –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–±–µ—Б–њ–µ—З–Є—В—М –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Ж–Є–љ–Ї–∞, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–µ 12–15 –Љ–≥/—Б—Г—В. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є —Ж–Є–љ–Ї–∞ —П–≤–ї—П—О—В—Б—П –Љ—П—Б–Њ, –њ—В–Є—Ж–∞, –±–Њ–±–Њ–≤—Л–µ, –Њ—А–µ—Е–Є. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –є–Њ–і–∞ (–і–Њ 0,5 –Љ–≥/—Б—Г—В.) –≤ –і–Є–µ—В–µ –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –µ–≥–Њ —Г—З–∞—Б—В–Є–µ–Љ –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞. –Э–∞–Є–±–Њ–ї–µ–µ –±–Њ–≥–∞—В—Л –є–Њ–і–Њ–Љ –Љ–Њ—А—Б–Ї–∞—П —А—Л–±–∞ –Є –і—А—Г–≥–Є–µ –њ—А–Њ–і—Г–Ї—В—Л –Љ–Њ—А—П (–Љ–Њ—А—Б–Ї–∞—П –Ї–∞–њ—Г—Б—В–∞, –Ї—А–µ–≤–µ—В–Ї–Є, –Љ–Є–і–Є–Є –Є –і—А.). –Т —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Є–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е —Г–ї—Г—З—И–µ–љ–Є—О –Њ–±–µ—Б–њ–µ—З–µ–љ–љ–Њ—Б—В–Є –є–Њ–і–Њ–Љ, –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ–Є—Й–µ–≤—Л–µ –њ—А–Њ–і—Г–Ї—В—Л —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –є–Њ–і–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –є–Њ–і–Є—А–Њ–≤–∞–љ–љ–∞—П –њ–Є—Й–µ–≤–∞—П —Б–Њ–ї—М –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –і–Њ 3–5 –≥ (1 —З–∞–є–љ–∞—П –ї–Њ–ґ–Ї–∞) –≤ —Б—Г—В–Ї–Є.
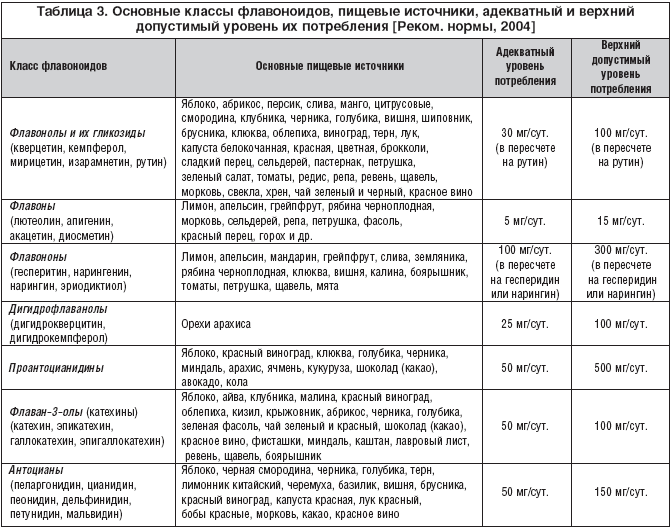
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ –і–Є–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –њ—А–Є –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞—Е–Њ–і—П—В —Д–ї–∞–≤–Њ–љ–Њ–Є–і–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П, –Њ—В–ї–Є—З–∞—О—Й–Є–µ—Б—П –њ–Њ —Б–≤–Њ–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Д–ї–∞–≤–Њ–љ–Њ–Є–і—Л –Њ–±–ї–∞–і–∞—О—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В –Њ–Ї–Є—Б–ї–µ–љ–Є—О –Ы–Я–Э–Я, –њ–Њ–і–∞–≤–ї—П—О—В –њ—А–Њ—Ж–µ—Б—Б—Л –≤–љ—Г—В—А–Є–њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤, –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—О—В –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л—Е –Ї–Є—Б–ї–Њ—В, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В —А–∞–Ј–≤–Є—В–Є—О –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є –Њ–Ї–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –Є–ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ—Б—В–Є —В—А–µ—Е—Г–≥–ї–µ—А–Њ–і–љ–Њ–≥–Њ —Д—А–∞–≥–Љ–µ–љ—В–∞ —Д–ї–∞–≤–Њ–љ–Њ–Є–і—Л –њ–Њ–і—А–∞–Ј–і–µ–ї—П—О—В—Б—П –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–ї–∞—Б—Б–Њ–≤: —Д–ї–∞–≤–Њ–љ–Њ–ї—Л, —Д–ї–∞–≤–Њ–љ—Л, —Д–ї–∞–≤–Њ–љ–Њ–љ—Л, –і–Є–≥–Є–і—А–Њ—Д–ї–∞–≤–∞–љ–Њ–ї—Л, –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ—Л, –Ї–∞—В–µ—Е–Є–љ—Л, –∞–љ—В–Њ—Ж–Є–∞–љ—Л. –Ш—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П —Д–ї–∞–≤–Њ–љ–Њ–Є–і–Њ–≤ —Б –њ–Є—Й–µ–є —П–≤–ї—П—О—В—Б—П –Њ–≤–Њ—Й–Є, —Д—А—Г–Ї—В—Л, –љ–∞–њ–Є—В–Ї–Є –Є –і—А—Г–≥–Є–µ –њ—А–Њ–і—Г–Ї—В—Л —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П. –Ю—Б–љ–Њ–≤–љ—Л–µ –Ї–ї–∞—Б—Б—Л —Д–ї–∞–≤–Њ–љ–Њ–Є–і–Њ–≤, –њ–Є—Й–µ–≤—Л–µ –Є—Б—В–Њ—З–љ–Є–Ї–Є, –∞–і–µ–Ї–≤–∞—В–љ—Л–є –Є –≤–µ—А—Е–љ–Є–є –і–Њ–њ—Г—Б—В–Є–Љ—Л–є —Г—А–Њ–≤–µ–љ—М –Є—Е –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –±–ї—О–і.
–†–µ–ґ–Є–Љ –њ–Є—В–∞–љ–Є—П –±–Њ–ї—М–љ—Л—Е
–Ґ–µ—Е–љ–Њ–ї–Њ–≥–Є—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –і–Є–µ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—О–і –Є —А–µ–ґ–Є–Љ –њ–Є—В–∞–љ–Є—П –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–∞–Љ–µ—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б—В–∞—В—Г—Б –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є –±–ї—О–і —П–≤–ї—П—О—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Є–ї–Є –њ–Њ–ї–љ–Њ–µ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –њ–Є—Й–Є –њ–Њ–≤–∞—А–µ–љ–љ–Њ–є —Б–Њ–ї–Є, —Г–і–∞–ї–µ–љ–Є–µ –Є–Ј –Љ—П—Б–љ—Л—Е –Є —А—Л–±–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є –±–ї—О–і —Н–Ї—Б—В—А–∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Є–і–Њ–≤ —В–µ–њ–ї–Њ–≤–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –Њ—В–≤–∞—А–Є–≤–∞–љ–Є—П, –Ј–∞–њ–µ–Ї–∞–љ–Є—П –Є —В—Г—И–µ–љ–Є—П. –Т—Б–µ –±–ї—О–і–∞, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є, –≥–Њ—В–Њ–≤—П—В—Б—П —Б –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ –њ–Њ–≤–∞—А–µ–љ–љ–Њ–є —Б–Њ–ї–Є (–і–Њ 5 –≥/—Б—Г—В.). –° —Н—В–Њ–є —Ж–µ–ї—М—О –≤–Љ–µ—Б—В–Њ –Њ–±—Л—З–љ–Њ–є –њ–Њ–≤–∞—А–µ–љ–љ–Њ–є —Б–Њ–ї–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Ј–∞–Љ–µ–љ–Є—В–µ–ї–Є —Б–Њ–ї–Є –Є–ї–Є —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Њ–±—А–∞–Ј—Ж—Л —Б–Њ–ї–Є —Б –њ–Њ–љ–Є–ґ–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –љ–∞—В—А–Є—П. –Ф–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –≤–Ї—Г—Б–Њ–≤—Л—Е –Ї–∞—З–µ—Б—В–≤ –і–Є–µ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—О–і —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —И–Є—А–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ј–µ–ї–µ–љ—М (–њ–µ—В—А—Г—И–Ї–∞, —Г–Ї—А–Њ–њ, –Ї–Є–љ–Ј–∞ –Є –і—А.), –∞ —В–∞–Ї–ґ–µ —З–µ—Б–љ–Њ–Ї, –ї—Г–Ї, —Е—А–µ–љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Њ—А–≥–∞–љ–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–Њ–≥–∞—Й–∞—О—В –і–Є–µ—В—Г –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –Є –Љ–Є–љ–µ—А–∞–ї—М–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є.
–£–і–∞–ї–µ–љ–Є–µ —Н–Ї—Б—В—А–∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є–Ј –Љ—П—Б–љ—Л—Е –Є —А—Л–±–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–Љ –Њ—В–≤–∞—А–Є–≤–∞–љ–Є–µ–Љ —Н—В–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤. –Я—А–Є –Њ—В–≤–∞—А–Є–≤–∞–љ–Є–Є –Љ—П—Б–∞, —А—Л–±—Л –Є –њ—В–Є—Ж—Л 40–50% —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ—Б—П –≤ –љ–Є—Е –ґ–Є—А–∞ –њ–µ—А–µ—Е–Њ–і–Є—В –≤ –±—Г–ї—М–Њ–љ, —З—В–Њ —П–≤–ї—П–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є—А–∞ –≤ –і–Є–µ—В–µ. –Ь—П—Б–љ—Л–µ –Є —А—Л–±–љ—Л–µ –±—Г–ї—М–Њ–љ—Л –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В—Б—П –Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –њ–µ—А–≤—Л—Е –±–ї—О–і 1–2 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О.
–Т–∞–ґ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є —П–≤–ї—П–µ—В—Б—П —Б–Њ–±–ї—О–і–µ–љ–Є–µ –і—А–Њ–±–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –њ–Є—В–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–µ–≥–Њ 4–6 —А–∞–Ј–Њ–≤—Л–є –њ—А–Є–µ–Љ –њ–Є—Й–Є —Б —А–∞–≤–љ–Њ–Љ–µ—А–љ—Л–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –≤—Б–µ—Е –њ–Є—Й–µ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ –і–љ—П, —Б –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –Є–ї–Є –љ–Њ—З–љ–Њ–µ –≤—А–µ–Љ—П.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Deen D. Metabolic syndrome: Time for action // Am.Fam.Physician. – 2004. – Vol.69. – P.2875–2882.
2. –Ь–∞–Љ–µ–і–Њ–≤ –Ь.–Э. –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ – –±–Њ–ї—М—И–µ, —З–µ–Љ —Б–Њ—З–µ—В–∞–љ–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞: –њ—А–Є–љ—Ж–Є–њ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П. – –Ь., 2006. – 48 —Б.
3. Denke M.A. Dietary prescriptions to control dyslipidemias // Circulation. – 2002. – Vol.105. – P.132.
4. –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т. –Ю—Б–љ–Њ–≤—Л —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –і–Є–µ—В–Њ–ї–Њ–≥–Є—П. – 2004. – –Ґ.1, вДЦ2. – –°.17–29.
5. Hu F.B., Manson J.E., Willett W.C. Types of dietary fat and risk of coronary heart disease: A critical review // J.Am.Coll.Nutr. – 2001. – Vol.20. – P.5–19.
6. Kromhout D., Menotti A., Bloemberg B. et al.: Dietary saturated and trans fatty acids and cholesterol and 25–year mortality from coronary heart disease: the Seven Countries Study // Prev.Med. – 1995. – Vol.24. – P.308–315.
7. Carson J.A. Nutrition therapy for dyslipidemia // Curr.Diab.Rep. – 2003. – Vol.3. – P.397–403.
8. Fats and oils in human nutrition. Report of a joint expert consultation. FAO food and nutrition paper 57. – Rome, 1994.
9. –®–∞—А–∞—Д–µ—В–і–Є–љ–Њ–≤ –•.–•., –Я–ї–Њ—В–љ–Є–Ї–Њ–≤–∞ –Ю.–Р., –Ъ—Г–ї–∞–Ї–Њ–≤–∞ –°.–Э. –Є –і—А. –Т–ї–Є—П–љ–Є–µ –і–Є–µ—В—Л, –Њ–±–Њ–≥–∞—Й–µ–љ–љ–Њ–є –Љ–Њ–љ–Њ–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ–Є –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є, –љ–∞ –Ї–ї–Є–љ–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2003. – –Ґ.72, вДЦ4. – –°.20–23.
10. Ros E. Dietary cis–monounsaturated fatty acids and metabolic control in type 2 diabetes // Am.J.Clin.Nutr. – 2003. – Vol.78. – P.617S–625S.
11. –Ь–∞—А–Є –†., –У—А–µ–љ–µ –Ф., –Ь–µ–є–µ—Б –Я., –†–Њ–і—Г—Н–ї–ї –Т. –С–Є–Њ—Е–Є–Љ–Є—П —З–µ–ї–Њ–≤–µ–Ї–∞. –Т 2–—Е —В. –Ґ.1: –Я–µ—А. —Б –∞–љ–≥–ї. – –Ь.: –Ь–Є—А, 2004. – 381 —Б.
12. –Я–µ—А–Њ–≤–∞ –Э.–Т. –Ю–Љ–µ–≥–∞–3 –њ–Њ–ї–Є–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л –≤ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є // –Ъ–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —В–µ—А–∞–њ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞. – 2005. – вДЦ4. – –°.101–107.
13. MacLean C.H., Mojica W.A., Morton S.C. et al.. Effects of omega–3 fatty acids on lipids and glycemic control in type II diabetes and the metabolic syndrome and on inflammatory bowel disease, rheumatoid arthritis, renal disease, systemic lupus erythematosus, and osteoporosis // Evid.Rep.Technol.Assess. (Summ). – 2004. – вДЦ89. – P.1–4.
14. –Ь–µ—Й–µ—А—П–Ї–Њ–≤–∞ –Т.–Р., –Я–ї–Њ—В–љ–Є–Ї–Њ–≤–∞ –Ю.–Р., –®–∞—А–∞—Д–µ—В–і–Є–љ–Њ–≤ –•. –•. –Є –і—А. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –≤–ї–Є—П–љ–Є—П –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ —Н–є–Ї–Њ–љ–Њ–ї–∞ –Є–ї–Є –ї—М–љ—П–љ–Њ–≥–Њ –Љ–∞—Б–ї–∞ –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2001. – –Ґ.70, вДЦ2. – –°.28–30.
15. –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –Ъ–Њ–љ–і–∞–Ї–Њ–≤–∞ –Э.–Ь., –С–∞–є–Ї–Њ–≤ –Т.–У. –Ш–Ј—Г—З–µ–љ–Є–µ –ґ–Є—А–љ–Њ––Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б–Њ–µ–≤–Њ–≥–Њ –Љ–∞—Б–ї–∞ –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2000. – –Ґ.69, вДЦ5. – –°.39–42.
16. Hartweg J., Farmer A.J., Holman R.R., Neil H.A. Meta–analysis of the of n–3 polyunsaturated fatty acids on haematological and thrombogenic factors in type 2 diabetes // Diabetologia. – 2007. – Vol.50. – P.250–258.
17. Nettleton J.A., Katz R. n–3 long polyunsaturated fatty acids in type 2 diabetes: a review // J.Am.Diet.Assoc. – 2005. – Vol.105. – P.428–440.
18. Nambi V. Combination therapy with statins and omega–3 fatty acids // Am.J.Cardiol. – 2006. – Vol.98. – P.34i–38i.
19. Nordoy A. Statins and omega–3 fatty acids in the treatment of dyslipidemia and coronary heart disease // Minerva.Med. – 2002. – Vol.93. – P.357–363.
20. –°–њ—А–∞–≤–Њ—З–љ–Є–Ї –њ–Њ –і–Є–µ—В–Њ–ї–Њ–≥–Є–Є / –Я–Њ–і —А–µ–і–∞–Ї—Ж–Є–µ–є –Т.–Р.–Ґ—Г—В–µ–ї—М—П–љ–∞, –Ь.–Р.–°–∞–Љ—Б–Њ–љ–Њ–≤–∞ – –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 2002. – 3––µ –Є–Ј–і., –њ–µ—А–µ—А–∞–±. –Є –і–Њ–њ. – 544 —Б.
21. –≠—И–≥–Є–љ–Є–∞ –°., –У–∞–њ–њ–∞—А–Њ–≤ –Ь.–Ь. –Т–ї–Є—П–љ–Є–µ –њ–Є—Й–µ–≤—Л—Е —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–Њ–≤ –љ–∞ –Њ–±–Љ–µ–љ –ї–Є–њ–Є–і–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2006. – вДЦ2. – –°.37–39.
22. –≠—И–≥–Є–љ–Є–∞ –°., –У–∞–њ–њ–∞—А–Њ–≤ –Ь.–Ь., –°–Њ—В–Њ –•. –Т–ї–Є—П–љ–Є–µ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±–Љ–µ–љ–∞ –ї–Є–њ–Є–і–Њ–≤ –њ—А–Є –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2005. – вДЦ5. – –°.28–31.
23. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–µ —Г—А–Њ–≤–љ–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –њ–Є—Й–µ–≤—Л—Е –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤. – –Ь.: –У–°–≠–Э –†–§, 2004. – 42 —Б.
24. –Ґ—Г—В–µ–ї—М—П–љ –Т.–Р., –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –Т—Л—Б–Њ—Ж–Ї–Є–є –Т.–У. –Р–љ–∞–ї–Є–Ј —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Ї–Њ–љ—Ж–µ–њ—Ж–Є–є –Њ —А–Њ–ї–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–µ—А–µ—А–∞–±–Њ—В–Ї–Є —Б–Њ–µ–≤—Л—Е –±–Њ–±–Њ–≤ –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2000. – –Ґ.69, вДЦ5. – –°.43–51.
25. –Т—Л—Б–Њ—Ж–Ї–Є–є –Т.–У., –Ч–Є–ї–Њ–≤–∞ –Ш.–°. –†–Њ–ї—М —Б–Њ–µ–≤—Л—Е –±–µ–ї–Ї–Њ–≤ –≤ –њ–Є—В–∞–љ–Є–Є —З–µ–ї–Њ–≤–µ–Ї–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 1995. – вДЦ5. – –°.20–27.
26. –Ь–µ—Й–µ—А—П–Ї–Њ–≤–∞ –Т.–Р., –Я–ї–Њ—В–љ–Є–Ї–Њ–≤–∞ –Ю.–Р., –®–∞—А–∞—Д–µ—В–і–Є–љ–Њ–≤ –•.–•., –ѓ—Ж—Л—И–Є–љ–∞ –Ґ.–Р. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ —Б–Њ–µ–≤–Њ–≥–Њ –±–µ–ї–Ї–∞ –≤ –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2002. – –Ґ.71, вДЦ5. – –°.19–24.
27. Fried S.K., Rao S.P. Sugars, hypertriglyceridemia, and cardiovascular disease // Am.J.Clin.Nutr. – 2003. – Vol.78. – P.873S–880S.
28. Daly M. Sugars, insulin sensitivity, and the postprandial state // Amer.J.Clin.Nutr. – 2003. – Vol.78. – P. 865S–872S.
29. Elliott S.S., Keim N.L., Stern J.S. et al. Fructose, weight gain, and the insulin resistance syndrome // Am.J.Clin.Nutr. – 2002. – Vol.76. – P.911–922.
30. Dickinson S., Brand–Miller J. Glycemic index, posprandial glycemia and cardiovascular disease // Curr.Opin.Lipidol. – 2005. – Vol.16. – –†.69–75.
31. Kendall C.W., Augustin L.S., Emam A. et al. The glycemic index: methodology and use // Nestle Nutr.Workshop Ser.Clin.Perform. Programme. – 2006. – Vol.11. – P.43–56.
32. Cefalu W.T., Frank B. Hu F.B.. Role of Chromium in Human Health and in Diabetes // Diabetes Care. – 2004. – Vol.27. – P.2741–2751.
33. –®–∞—А–∞—Д–µ—В–і–Є–љ–Њ–≤ –•.–•., –Ь–µ—Й–µ—А—П–Ї–Њ–≤–∞ –Т.–Р., –Я–ї–Њ—В–љ–Є–Ї–Њ–≤–∞ –Ю.–Р. –Є –і—А. –Т–ї–Є—П–љ–Є–µ –С–Р–Ф, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є —Е—А–Њ–Љ, –љ–∞ –Ї–ї–Є–љ–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2004. – –Ґ.73, вДЦ5. – –°.17–20.
34. –®–∞—А–∞—Д–µ—В–і–Є–љ–Њ–≤ –•.–•., –Ь–µ—Й–µ—А—П–Ї–Њ–≤–∞ –Т.–Р., –Я–ї–Њ—В–љ–Є–Ї–Њ–≤–∞ –Ю.–Р. –Є –і—А. –Т–ї–Є—П–љ–Є–µ –С–Р–Ф, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є —Ж–Є–љ–Ї, –љ–∞ –Ї–ї–Є–љ–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. – 2004. – –Ґ.73, вДЦ4. – –°.17–20.
35. Anderson R.A., Roussel A.–M., Zouari N. et al. Potential antioxidant effects of zinc and chromium supplementation in people with type 2 diabetes mellitus // J.Am.Coll.Nutr. – 2001. – Vol.20 – P.212–218.












