Артериальная гипиертензия (АГ) – неинфекционная пандемия, определяющая структуру инвалидизации и летальности при сердечно–сосудистых заболеваниях в социально–значимой группе населения. Развитие первичной АГ детерминировано множеством взаимодействующих факторов: от генетической предрасположенности до социальных условий окружающей среды. АГ, начинающаяся как функциональное расстройство, в большинстве случаев, последовательно, через различные патофизиологические механизмы приводит к специфическим поражениям органов – «мишеней» (ЦНС, сердце, почки), трансформируясь из фактора риска в заболевание.
По данным различных авторов, АГ в 80% и более случаев сочетается с различными видами метаболических нарушений, вошедших в мировую клиническую практику под термином «метаболический синдром», включающий дислипидемию, нарушение углеводного обмена и инсулинорезистентность (ИР), абдоминальное ожирение [1,3,5,15].
С позиций современного представления о механизмах формирования высоких цифр АД назначаемые антигипертензивные препараты должны обладать следующими свойствами:
1. Эффективно снижать АД (достижение целевого уровня АД);
2. Предупреждать (уменьшать) поражение органов «мишеней»;
3. Не вызывать метаболические нарушения;
4. Быть безопасными в применении и не оказывать побочных эффектов;
5. Обладать пролонгированным гипотензивным действием (уменьшение кратности приема) [9].
Согласно современным рекомендациям ВОЗ (1999) на первом этапе лечения АГ рекомендовано применение диуретиков, b-блокаторов и ингибиторов ангиотензин–превращающих ферментов (иАПФ) с метаболически – нейтральными свойствами [4,9,10].
Тиазидные и тиазидоподобные диуретики можно условно разделить на два поколения: первое поколение – производные бензотиадиазина (гидрохлортиазид и др.) и бензолсульфонамида (хлорталидон и др.); второе поколение – производные хлорбензамида (индапамид, ксипамид и др.), содержащие метилиндолиновую группу.
Гемодинамический эффект индапамидоподобных диуретиков обусловлен их фармакологическим действием: ингибирование реабсорбции Na+, Cl–, H+ и в меньшей степени К+ и Mg2+ в проксимальных и дистальных канальцах короткого сегмента нефрона. Одновременно обсуждаемые диуретики устраняют избыточное содержание ионов Na+ в сосудистой стенке (вследствие их высокой липофильности), повышают синтез простагландинов Е2 и простациклина I2, угнетают приток ионов Са2+ в гладкомышечные клетки сосудистой стенки, что вызывает дилатацию сосудов и снижает их чувствительность к прессорным агентам (катехоламины, тромбоксаны). Суммарный гемодинамический эффект индапамидов проявляется в виде:
1. Вазодилатация;
2. Уменьшение общего периферического сосудистого сопротивления (ОПСС);
3. Снижение АД;
4. Изменение вязкостных свойств крови за счет ингибирования агрегационной активности тромбоцитов.
Применение индапамидов в суточной дозе 2,5 мг оказывает гипотензивный эффект без существенного влияния на диурез.
По своей гипотензивной активности индапамид превосходит в 30 раз действие спиронолактонов, в 100 раз – фуросемида и в 300 раз – хлорталидона при применении в сопоставимых дозах.
Терапевтическая эффективность индапамидовых диуретиков продемонстрирована в ряде крупных рандомизированных исследованиях [6,11,14]. Отмечена их способность профилактировать развитие ИБС за счет снижение массы миокарда при АГ. Это свойство, нетипичное для других классов диуретиков, делает индапамид уникальным препаратом с кардиопротективным действием, выраженность которого не уступает b-блокаторам и ингибиторам АПФ.
Особое внимание привлекает тот факт, что индапамидоподобные диуретики не обладают синдромом «отмены», не вызывают побочных метаболических нарушений: не оказывают отрицательного влияния на обмен глюкозы и уровень атерогенных липидов крови. В исследованиях последних лет, показано, что индапамид способствует нормализации уровня глюкозы у диабетиков II типа, профилактируя дабетическую нефропатию [10,15]. Индапамид, улучшая микроциркуляцию в почке, устраняет микроальбуминурию, являющуюся маркером генерализованного поражения сосудов и предиктором сердечно–сосудистых осложнений. Аналогичная закономерность отмечена при исследовании обмена холестерина (Х) и триглицеридов (ТГ) у пациентов с дислипопротеинемией. Индапамид снижает уровень атерогенного холестерина низкой плотности (ХЛПНП) и ТГ, одновременно увеличивая концентрацию липопротеидов высокой плотности (ХЛПВП).
Таким образом, индапамид, сочетая в себе все положительные фармакодинамические, фармакокинетические и экономические достоинства, при отсутствии побочных эффектов других диуретиков, является препаратом первой линии в плане лечения больных АГ и хронической сердечной недостаточности.
В настоящее время иАПФ, несмотря на их большое количество, согласно химической структуре ответственной за связывание системного и тканевого АПФ, составляют три группы:
1. Содержащие сульфгидрильную группу (каптоприл);
2. Содержащие карбоксильную группу – карбоксиалкилдипептиды (Эналаприл, квинаприл, лизиноприл , рамиприл, периндоприл, целазаприл, беназаприл);
3. Содержащие фосфильную группу (фозиноприл).
Каптоприл действует как активный препарат, выделяется почками, что ограничивает его применение при нарушении функции почек, требует минимум двукратного применения в сутки.
Эналаприл метаболизируется в организме и действует за счет своих активных метаболитов, превосходит по длительности и силе действия каптоприл, что позволяет его однократное суточное применение и в меньших дозах по сравнению с каптоприлом, выделяется через почки.
Фозиноприл действует через метаболиты, применяется однократно в сутки и имеет два пути выведения – почки и желудочно–кишечный тракт.
Все иАПФ обладают кардио–, вазо–, нефро–протекторными и метаболическими эффектами:
1. Кардиопртективные эффекты: восстановление баланса между потребностью и обеспечением миокарда О2, снижение пред– и постнагрузки на ЛЖ, уменьшение объема и массы ЛЖ, замедление ремоделирования ЛЖ, уменьшение симпатической стимуляции, антиаритмический эффект;
2. Вазопротекторные эффекты: прямой антиатерогенный эффект, антипрофилиративный и антимиграционный эффект на гладкомышечные клетки, нейтрофилы и моноциты; улучшение и восстановление функции эндотелия; антитромбоцитарный эффект, усиление эндогенного фибринолиза, улучшение податливости артерий и снижение их тонуса;
3. Нефропротекторные эффекты: снижение внутриклубочковой гипертензии, увеличение скорости клубочковой фильтрации, увеличение Na+ –уреза и уменьшение К+–уреза, уменьшение протеинурии, увеличение диуреза;
4. Метаболические эффекты: усиление распада липопротеидов очень низкой плотности и снижение синтеза ТГ, усиление синтеза ХЛПВП, повышение чувствительности клеточных рецепторов к инсулину и усиление потребления глюкозы.
Резюмируя выше изложенное, можно утверждать, что на сегодняшний день иАПФ являются перспективной группой препаратов в лечение АГ, многопрофильность действия позволили назвать их «золотым стандартом в терапии сердечно–сосудистых заболеваний».
Целью данной работы является изучение эффективности и переносимости тиазидного диуретика – индапамида и ингибитора АПФ – эналаприла у больных АГ.
Материалы и методы исследования
Нами был обследован 51 пациент с АГ 1–2 ст. по классификации ВОЗ [4]: 10 мужчин и 41 женщина в возрасте 60–78 лет (средний возраст 66,1±3,7 года). Критерии включения в исследование больных АГ: систолическое АД от 140 до 180 мм рт.ст., диастолическое АД – от 90 до 110 мм рт.ст. Средняя длительность АГ по всей группе больных составила 12,3±4,5 лет.
Всем больным до лечения и через 24 недели после лечения проводилось суточное мониторирование АД (СМАД) на комплексе АВРМ – 04 (Венгрия), регистрация стандартной ЭКГ на шестиканальном электрокардиографе «Kenz» (Япония), ЭхоКГ исследование в М и В режимах на аппарате «Тоshiba – 104A» (Япония) с расчетом массы миокарда ЛЖ (ММЛЖ) по формуле предложенной Devereux R. и Reichek N. [8] и индекса ММЛЖ: ИММЛЖ = ММЛЖ/площадь поверхности тела. Одновременно проводилось исследование электролитов в сыворотке (Na, K, Ca) и биохимических показателей крови: содержание глюкозы и толерантность к глюкозе по стандартной методике путем забора крови через 120 мин после 75 г нагрузкой глюкозой; уровень липидов (общий холестерин – ОХ, ТГ, ЛПВП).
В зависимости от программы лечения больные АГ случайной выборкой были распределены на две группы: А – 26 пациентов получали индапамид в дозировке от 1,5 до 3 мг/сутки; группа Б – 25 пациентов, у которых базовой гипотензивной терапией был Эналаприл от 10 до 40 мг/сутки.
В начале исследования больным АГ в качестве монотерапии назначали один из 2 изучаемых препаратов в минимальной дозе один раз в сутки утром. После первого приема препаратов больные находились под наблюдением врача в течение 2–4 часов для своевременного распознавания «гипотонии первой дозы». Контрольное исследование проводили через 4 недели. Если по данным СМАД АД достигало нормальных величин (среднедневное АД 140/90 мм рт.ст. и менее, и средненочное АД 125/80 мм рт.ст. и менее), доза препарата оставалась неизменной до конца исследования, т.е. до 24 недель. В том случае, если через 4 недели по результатам СМАД АД оставалось повышенным (среднедневное АД > 140/90 мм рт.ст. и/или средненочное АД > 125/80 мм рт.ст.) дозу препатата увеличивали. При этом при среднедневном АД, равном или более 140/90 мм рт.ст., а средненочном 125/80 мм рт.ст. и менее увеличивали утреннюю дозу. При средненочном АД 125/80 и более, независимо от уровня среднедневного АД, добавляли второй (вечерний) прием препарата. В том случае, если при СМАД не было отмечено нормализации АД как в дневное, так и в ночное время, дозу препарата вновь увеличивали. Окончательной считали ту максимальную дозу препарата, при приеме которой у больного не возникали побочные эффекты, либо дозу препарата, на которой была достигнута норма АД (среднедневное АД 140/90 мм рт.ст. и менее, и средненочное АД 125/80 мм рт.ст. и менее). После достижения окончательной дозы препарата она оставалась неизменной до конца исследования, т.е. до 24–й недели лечения. На 24–й неделе исследования во время последнего визита пациента повторно проводили СМАД, лабораторные исследования.
Статистическую обработку полученных данных выполняли с применением программного пакета электронных таблиц Microsoft Excel. Для установления взаимосвязи признаков применяли многофакторный корреляционный анализ с использованием критериев Пирсона и Спирмана. При обработке результатов и выявления корреляционных связей применялась значимость (вероятность) отклонений р<0,05 и менее.
Результаты лечения
Критерии оценки гипотензивной эффективности расценивали по следующим параметрам: хорошая – при нормализации среднего уровня АД: снижение САД ниже 140 мм рт.ст. днем и 125 мм рт.ст. ночью, ДАД ниже 90 мм.рт.ст. днем и 75 мм рт.ст. ночью; удовлетворительная – при снижении среднего АД больше чем на 10 мм рт.ст. от исходного уровня без его нормализации; неудовлетворительная – при снижении среднего АД менее чем на 10 мм.рт.ст. без его нормализации. Регистрацию побочных эффектов производили на всех этапах исследования. Переносимость лечения оценивали по следующим критериям: отсутствие побочных эффектов – «отличная», слабо выраженные побочные эффекты, не требующие коррекции дозы – «хорошая», побочные эффекты, проходящие после коррекции дозы – «удовлетворительная» и тяжелые побочные эффекты, требующие отмены препарата – «неудовлетворительная» .
На рисунке 1 представлены результаты гипотензивной эффективности к концу программы исследования у больных АГ в зависимости от программы лечения.
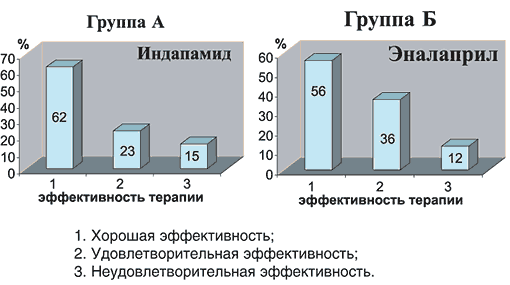
Рис. 1. Диаграммы эффективности лечения больных АГ
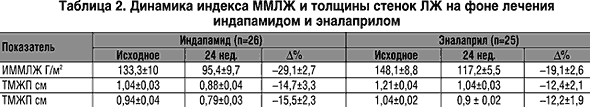
В группе А хорошая эффективность назначенной терапии была у 16 пациентов (61,5%), удовлетворительная – у 6 пациентов (23%), неудовлетворительная – у 4 пациентов (15%); в группе Б хорошая эффективность лечения зарегистрирована у 14 пациентов (56%), удовлетворительная – у 9 пациентов (36%), неудовлетворительная – у 3 пациентов (12%).В таблице 1 представлена динамика профиля АД, характеризющий циркадный ритм, нарушения которого чаще всего встречаются у больных с сахарным диабетом II типа, с толерантностью к углеводам, с симптоматической АГ (феохромацитома, гипертония почечного генеза, ХПН), у лиц пожилого возраста.
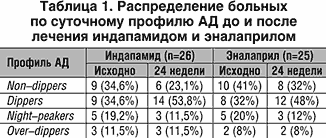
При анализе результатов ЭхоКГ (табл. 2) через 24 недели лечения эналаприлом установлено достоверное снижение индекса ММЛЖ (в среднем на 19%), уменьшение толщины стенок левого желудочка (в среднем на 12,3%). Изучая показатели Эхо–КГ через 24 недели лечения индапамидом, установлено достоверное снижение индекса ММЛЖ (в среднем на 29%), уменьшение толщины стенок левого желудочка (в среднем на 15%). Различия по сравнению с исходными данными достоверны по второму порогу вероятности безошибочных прогнозов (р<0,01).
При анализе ЭКГ достоверных изменений интервала PQ, QRS через 24 недели лечения на фоне индапамида и эналаприла не выявлено.
По данным биохимических показателей крови (табл. 3) на фоне лечения индапамидом и эналаприлом отмечено статистически недостоверное умеренное повышение глюкозы в плазме крови в среднем на 2,3% (р>0,05). По данным различных авторов, нетиазидные диуретики и ингибиторы АПФ не повышают вероятность развития сахарного диабета (СД) II типа [2,12,15].

Уровень мочевой кислоты (МК) повысился на фоне лечения индапамидом на 2,51% (с 234,00±29,09 мкмоль/л до 239,88±35,95 мкмоль/л) и уменьшился на 0,89% (с 224,30±35,93 мкмоль/л до 222,30±25,07 мкмоль/л) при лечении эналаприлом. Однако, эти изменения были недостоверными. В некоторых исследованиях [6] уровень МК повышался достоверно при приеме индапамида, однако, P. Weidmann [18] выявил увеличение МК при коротко длящейся терапии, а при пролонгированном приеме количество МК в крови уменьшается до исходных значений. По данным ряда авторов [7] эналаприл может увеличивать содержание МК в крови, однако имеются сообщения о нейтральном действии препарата [12,13]. Кроме того, индапамид уменьшал уровень мочевины на 3,83%, тогда как эналаприл увеличивал на 3,04%, однако эти изменения были недостоверны (р>0,05).
На фоне 24–х недельного цикла терапии обоими препаратами (индапамид и эналаприл) наряду со снижением АД все пациенты отмечали заметное улучшение общего состояния, проявляющееся уменьшением или исчезновением головной боли, шума в ушах, головокружения. У большинства пациентов повысилась трудоспособность и переносимость повседневных физических нагрузок. Из 26 пациентов группы индапамид полный курс лечения завершили все пациенты. Среди больных этой группы у 22% пациентов побочных эффектов не зарегистрировано – отличная переносимость. Хорошая переносимость выявлена более чем у половины пациентов (59%). Тяжелые побочные эффекты, требующие отмены препарата (неудовлетворительная переносимость), не выявлены. Самыми распространенными были сухость в полости рта – у 8 человек (30,8%), ортостатическая гипотония и головокружение – у 4 человек (15,4%), головные боли и запоры – у 2 пациентов (7,7%), зуд и парастезии – у 2 человек (7,7%), тошнота, кожная сыпь, нарушение координации отмечены в единичных случаях (3,8%).
В группе эналаприла примерно у четверти больных (21%) побочных эффектов не зарегистрировано – отличная переносимость. Хорошая переносимость установлена более чем у половины пациентов (52%). Тяжелые побочные эффекты (выраженный сухой кашель), требующие отмены препарата (неудовлетворительная переносимость), зарегистрированы у 4 человек (16%), миалгии, головокружение, кожная сыпь отмечены в единичных случаях (4%).
Обсуждение результатов
Как известно, уровень АД в организме определяется двумя физиологическими параметрами: МО (минутный объем) и общим периферическим сосудистым сопротивлением (ОПСС). Данную зависимость можно представить в виде следующей формулы:
АД = МО x ОПСС
При внезапном повышении МО (повышение активности симпатичеческой нервной системы), организм через функционирование барорефлекторного компенсаторного механизма уменьшает ОПСС, «гасит» эффект возросшего МО и способствует удержанию величины АД в пределах нормы.
Однако у некоторых индивидуумов отмечается неадекватность барорефлекторного контроля, что будет затруднять адекватную реакцию организма на колебания АД и способствовать «стабилизации» высоких цифр АД.
Таким образом, основная патофизиологическая сущность АГ определяется дисбалансом вазодилатирующих и вазоконстрикторных систем, которая усугубляется нарушением метаболизма глюкозы и липопротеидов, ответственных за атерогенез.
На рисунке 2 представлена схема основных вазоконстрикторных систем и их взаимосвязь с поверхностью гладкомышечной клетки сосудистого русла и нервного симпатического окончания.
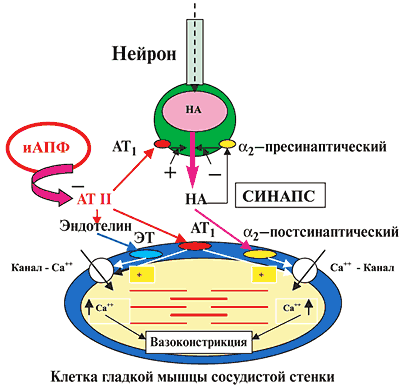
Рис. 2. Схема основных вазоконстрикторных систем и место действия иАПФ
Высвобождаемый из терминальных окончаний нейрона норадреналин (НА) через постсинаптические a2–адренорецепторы, расположенные на поверхности мышечной клетки, вызывает вазоконстрикцию, путем воздействия на кальциевые каналы и увеличения концентрации ионизированного Са2+ на сократительных внутриклеточных структурах (актин–миозин) гладкой мышцы. Одновременно высвобождаемый НА ограничивает свое выделение через стимуляцию пресинаптического a2–адренорецептора, лимитируя пролонгирование вазоконстрикторного эффекта.Ангиотензин–II (АТ II), который образуется в результате деятельности циркулирующей и локальной (тканевой) РААС, свое вазоконстрикторное влияние осуществляет через несколько механизмов:
– прямое воздействие на АТ1–рецепторы, расположенные на поверхности мышечной клетки (постсинаптические рецепторы);
– усиление выделения НА из нейрона через стимуляцию АТ1–рецепторов (пресинаптических), расположенных на нервных окончаниях;
– усиление выделения эндотелиальными клетками еще одного мощного вазоконстриктора – эндотелина–1;
– увеличение входа в клетку ионизированного Са2+ (раскрытие медленных кальциевых каналов).
иАПФ, блокируя активность РААС, уменьшают многогранность констрикторного действия АГ II , что лежит в основе протекторного эффекта иАПФ для сердца, сосудов и почек. Опосредованно снижая выработку НА и поступление в клетку Са2+ (главного внутриклеточного компонента сокращения), иАПФ повторяют механизм действия таких гипотензивных препаратов, как антагонисты Са и a2–адреноблокаторы.
Индапамидоподобные диуретики (в частности индапамид) гипотензивный эффект реализуют через удаление Na+ из сосудистой стенки (снижение чувствительности гладкой мышцы к симпатическому импульсу), уменьшение концентрации Ca2+ в миоплазме исполнительной клетки, снижение агрегационной активности тромбоцитов и выработки тромбоксана (мощного вазоконстриктора) через кальциевый механизм, сохранение нормального уровня концентрации Mg2+ внутри клетки – природного, физиологичного антагониста Ca.
Гипотензивный эффект индапамида и эналаприла в сочетании с метаболической нейтральностью (не оказывает отрицательного влияния на обмен глюкозы и липодов), подтвержденный данными наших исследований и других авторов [6,11,14,16,17], выгодно отличают их от других гипотензивных препаратов (тиазидные диуретики, b-блокаторы I–II поколения) и ставят в первый ряд программы лечения АГ.
Таким образом, препараты индапамид и эналаприл (иАПФ), обладая хорошей гипотензивной эффективностью в сочетании с метаболической нетральностью глюкозного и липидного обмена, имеют низкий процент побочных эффектов по сравнению с другими гипотензивными препаратами, их можно рекомендовать, как препараты первой линии в лечении АГ.
1. Бутрова С. А. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению. Русский медицинский журнал 2001; 2: 56 – 60.
2. Кобалава Ж. Д., Котовская Ю. В, Школьникова Е. Э. Динамика показателей суточного мониторирования артериального давления и качества жизни у больных с систолической гипертонией при монотерапии арифоном. Терапевтический архив 1998; 9: 67 – 69.
3. Оганов Р. Г., Александров А. А. Гиперинсулинемия и артериальная гипертония: возвращаясь к выводам United Kingdom Prospective Diabetes Study. Русский медицинский журнал 2002; 10; 11: 486 – 491.
4. Рекомендации всемирной организации здравоохранения и международного общества гипертонии. 1999.
5. Шестакова М. В., Чугунова Л. А., Шамхалова М. Ш. Сердечно – сосудистые факторы риска у пожилых больных сахарным диабетом 2 типа и методы их коррекции. Русский медицинский журнал 2002; 10; 11: 480 – 485.
6. Achimastos A., Liberopoulos E., Nikas S. et al. The effects of the addition of micronised fenofibrate on uric acid metabolism in patients receiving indapamide. Curr Med Res Opin 2002; 18(2): 59–63.
7. De Rosa M. L., Cardace P., Rossi M. et al. Comparative effects of chronic ACE inhibition and AT1 receptor blocked losartan on cardiac hypertrophy and renal function in hypertensive patients. J Hum Hypertens 2002; 16(2): 133–140
8. Devereux R., Reicher N. Echocardiographic assessment of left ventricular mass in man. Circulation 1977; 55: 613–618
9. Guidelines Subcommittee. 1999 World Health Organization: International Sosiety of Hypertension guidelines for the management of hypertension. J Hypertens 1999; 17; 2: 151–183.
10. Kuo S. W., Pei–Dee, Hung Y. J. et al. Effect of indapamide SR in the treatment of hypertensive patients with type 2 diabetes. Am J Hypertens 2003 Aug;16(8):623–8
11. Lacourciere Y., Belanger A., Godin C. Long–term comparison of losartan and enalapril on kidney function in hypertensive type 2 diabetics with early nephropathy. Kidney Int 2000; 58(2): 762–769.
12. Mancia G., Omboni S., Agabiti–Rosei E. et al. Antihypertensive efficacy of manidipine and enalapril in hypertensive diabetic patients. J Cardiovasc Pharmacol 2000; 35 (6): 926 –931.
13. . Nikas S., Rizos E., Milionis H. The effects of the addition of losartan on uric acid metabolism in patients receiving indapamide. J Renin Angiotensin Aldosterone Syst 2000;1(3):289–291.
14. Ocon J, Mora J. Twenty–four–hour blood pressure monitoring and effects of indapamide. Am J Cardiol. 1990 May 2;65(17):58H–61H
15. Resnick L. M. Ionic basis of hypertension, insulin resistance, vascular disease and related disorders. The mechanism of «sindrom X». Am J Hypertens 1993; 6:123S–134S.
16. Tan K. W., Frise S. A. Efficacy and tolerability of doxazosin versus enalapril in the treatment of patients with mild–to–moderate hypertension. Clin Ther 1997; 19(3): 459–470.
17. Verdecchia P., Schillaci G., Reboldi G. P. Long–term effects of losartan and enalapril, alone or with a diuretic, on ambulatory blood pressure and cardiac performance in hypertension: a case–control study. Blood Press Monit. 2000; 5(3): 187–193.
18. Weidmann P. Metabolic profile of indapamide sustained–release in patients with hypertension: data from three randomised double–blind studies. Drug Saf 2001; 24(15): 1155–1165.












