–Т–≤–µ–і–µ–љ–Є–µ
–Ь–Є–Њ–Ї–∞—А–і–Є—В вАФ —Н—В–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ–Љ–Њ–µ –њ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Ї—А–Є—В–µ—А–Є—П–Љ. –Ь–Є–Њ–Ї–∞—А–і–Є—В —П–≤–ї—П–µ—В—Б—П —В—А—Г–і–љ—Л–Љ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –≤ —Б–≤—П–Ј–Є —Б –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є [1]. –Ґ–∞–Ї, –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ –Љ–Њ–≥—Г—В –±—Л—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞, –Ї–Њ—В–Њ—А—Л–µ –љ–µ—А–µ–і–Ї–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї ¬Ђ–Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ¬ї: –∞—В—А–Є–Њ–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ—Л–µ –±–ї–Њ–Ї–∞–і—Л, –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є, –≤–Ї–ї—О—З–∞—П –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Г—О —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–Є—О (–Ц–≠), —Г—Б—В–Њ–є—З–Є–≤—Г—О –Є –љ–µ—Г—Б—В–Њ–є—З–Є–≤—Г—О –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Г—О —В–∞—Е–Є–Ї–∞—А–і–Є—О, –Њ—В–ї–Є—З–∞—О—Й–Є–µ—Б—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є [2]. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ—А–Є—З–Є–љ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є —Г –Љ–Њ–ї–Њ–і—Л—Е –ї—О–і–µ–є –Љ–Є–Њ–Ї–∞—А–і–Є—В –≤—Б—В—А–µ—З–∞–ї—Б—П –≤ 2вАУ42% —Б–ї—Г—З–∞–µ–≤ –∞—Г—В–Њ–њ—Б–Є–Є. [1] –†—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –љ–∞–ї–Є—З–Є–µ –њ—А–Є –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Ь–†–Ґ) –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –Љ–Є–Њ–Ї–∞—А–і–µ –Ї–∞–Ї –њ—А–µ–і—Б–µ—А–і–Є–є, —В–∞–Ї –Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –њ—А–Є ¬Ђ–Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є¬ї —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є (–§–Я) [3].–†–∞–Ј–≤–Є—В–Є–µ –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–Є—В–µ —Б–≤—П–Ј—Л–≤–∞—О—В —Б –љ–∞–ї–Є—З–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї —Б—В—А—Г–Ї—В—Г—А–∞–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ [1, 4], –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–°-—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї (–°–†–С), —Д–Є–±—А–Є–љ–Њ–≥–µ–љ, –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ (–Ш–Ы)-1, –Ш–Ы-2, –Ш–Ы-6, –Ш–Ы-8, —Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є ќ±), –∞ —В–∞–Ї–ґ–µ –Ј–Њ–љ —Д–Є–±—А–Њ–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В –Ї —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –њ–Њ–Є—Б–Ї –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–Є—В–µ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, –љ–∞–њ—А–Є–Љ–µ—А, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Ш–°–Ґ) –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞–Љ–Є (–У–Ъ–°) –≤–µ–і–µ—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–≤ –§–Я [4]. –Ю–і–љ–∞–Ї–Њ –У–Ъ–° –Є–Љ–µ—О—В —А—П–і –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –љ–µ –≤—Б–µ–≥–і–∞ –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Є—Е —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–Є–Њ–Ї–∞—А–і–Є—В–Њ–Љ. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–њ—Л—В–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Є–Љ–Љ—Г–љ–љ–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–Є—В–µ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Є–љ–і—А–Њ–Љ–∞ –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–Є. –£ —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—В–Њ–і—Л –∞—Д–µ—А–µ–Ј–∞ (–Є–Љ–Љ—Г–љ–Њ—Б–Њ—А–±—Ж–Є—П, –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј) —Г–ї—Г—З—И–∞—О—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–µ—А–і—Ж–∞ –Є —Б–љ–Є–ґ–∞—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є —Н–љ–і–Њ–Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –±–Є–Њ–њ—Б–Є–Є [5].
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ—В–Њ–і–Њ–≤ –∞—Д–µ—А–µ–Ј–∞ –њ—А–Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–Љ –≤–∞—А–Є–∞–љ—В–µ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ–њ–Є—Б—Л–≤–∞–µ—В—Б—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ. –Р–≤—В–Њ—А—Л –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л (–Р.–Т. –Э–µ–і–Њ—Б—В—Г–њ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Т.–Т. –Я–∞–љ–∞—Б—О–Ї–Њ–Љ (–њ–Њ –љ–µ–Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ)) –њ—А–Є–Љ–µ–љ—П–ї–Є –≥–µ–Љ–Њ—Б–Њ—А–±—Ж–Є—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ –Є –њ–Њ–ї—Г—З–∞–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –±–Њ–ї–µ–µ —З–µ–Љ –≤ 50% —Б–ї—Г—З–∞–µ–≤. –Т –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –Ї –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞–±–ї—О–і–∞–ї—Б—П —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ –µ–≥–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –Њ–Ї–Њ–ї–Њ 3 –Љ–µ—Б. [6]. –Ю–і–љ–∞–Ї–Њ –Љ–∞—А–Ї–µ—А—Л –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –њ—А–Є—А–Њ–і—Л –∞—А–Є—В–Љ–Є–є –≤ –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –љ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М, –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –Є –Ї–Њ–љ–Ї—А–µ—В–љ—Л–µ —В–Њ—З–Ї–Є –µ–≥–Њ –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –Њ—Б—В–∞–ї–Є—Б—М –љ–µ –і–Њ –Ї–Њ–љ—Ж–∞ —П—Б–љ—Л–Љ–Є.
–¶–µ–ї—М –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Є–Ј—Г—З–µ–љ–Є–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—А–Є—В–Љ–Є—П–Љ–Є –Є–Љ–Љ—Г–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –љ–µ—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –Љ–Є–Њ–Ї–∞—А–і–Є—В–Њ–Љ –Є –∞—А–Є—В–Љ–Є—П–Љ–Є, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –Ї –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –ї–Є–±–Њ –њ—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Љ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т—Б–µ–≥–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 48 –±–Њ–ї—М–љ—Л—Е, 22 –њ–∞—Ж–Є–µ–љ—В–∞–Љ –љ–∞—А—П–і—Г —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Ї–∞—А–і–Є–Њ—В—А–Њ–њ–љ–Њ–є –Є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–µ–є –њ—А–Њ–≤–µ–і–µ–љ –Ї—Г—А—Б –і–Є—Б–Ї—А–µ—В–љ–Њ–≥–Њ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (—Ж–µ–љ—В—А–Є—Д—Г–≥–∞ Sorvall RC 3BP+ Thermo scientific, –У–µ—А–Љ–∞–љ–Є—П) —Б —Г–і–∞–ї–µ–љ–Є–µ–Љ —В—А–Њ–Љ–±–Њ–ї–µ–є–Ї–Њ—Б–ї–Њ—П –Є –њ–Њ–ї–љ–Њ–≥–Њ —А–∞—Б—З–µ—В–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –њ–ї–∞–Ј–Љ—Л. –Ч–∞ –Њ–і–љ—Г –њ—А–Њ—Ж–µ–і—Г—А—Г –Ј–∞–Љ–µ—Й–∞–ї–Њ—Б—М –Њ—В 250 –і–Њ 500 –Љ–ї –њ–ї–∞–Ј–Љ—Л, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї—Г—А—Б–∞ –Є –Ї—А–∞—В–љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Ж–µ–і—Г—А –њ–Њ–і–±–Є—А–∞–ї–Є—Б—М –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–∞—Б—З–µ—В–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –њ–ї–∞–Ј–Љ—Л (–≤ —Б—А–µ–і–љ–µ–Љ 4вАУ6 —Б–µ–∞–љ—Б–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ –љ–µ–і–µ–ї–Є). –Ч–∞–Љ–µ—Й–µ–љ–Є–µ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ. –Я—А–Њ–≤–Њ–і–Є–ї—Б—П –Ї–Њ–љ—В—А–Њ–ї—М —Г—А–Њ–≤–љ—П –±–µ–ї–Ї–Њ–≤ –њ–ї–∞–Ј–Љ—Л. –≠—В–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є –Њ—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г. –Ю—Б—В–∞–ї—М–љ—Л–µ 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Њ—В–≤–µ—З–∞–ї–Є –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –Є –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б—В–∞–љ–і–∞—А—В–љ–∞—П –Ї–∞—А–і–Є–Њ—В—А–Њ–њ–љ–∞—П –Є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П (–±–µ–Ј –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞), –≤–Њ—И–ї–Є –≤ –≥—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є —Б—В–µ–њ–µ–љ—М –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ—Б—В–Є –Ш–°–Ґ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–і–њ–Є—Б–∞–ї–Є –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –Њ–і–Њ–±—А–µ–љ–Њ –ї–Њ–Ї–∞–ї—М–љ—Л–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ –њ–Њ —Н—В–Є–Ї–µ –Я–µ—А–≤–Њ–≥–Њ –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ (–њ—А–Њ—В–Њ–Ї–Њ–ї вДЦ 04-16 –Њ—В 13.04.2016).–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г–Ї—А–∞—В–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —В–Є—В—А–Њ–≤ –і–≤—Г—Е –Є –±–Њ–ї–µ–µ –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –≤–Є–і–Њ–≤ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ: —П–і–µ—А –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ (—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –∞–љ—В–Є–љ—Г–Ї–ї–µ–∞—А–љ—Л–є —Д–∞–Ї—В–Њ—А (–Р–Э–§)), —Н–љ–і–Њ—В–µ–ї–Є—П, –≤–Њ–ї–Њ–Ї–Њ–љ –њ—А–Њ–≤–Њ–і—П—Й–µ–є —Б–Є—Б—В–µ–Љ—Л –Є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М —З–∞—Б—В–∞—П –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–∞—П/–љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–∞—П —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–Є—П (–Э–Ц–≠), –±–Њ–ї–µ–µ 3000 –≤ —Б—Г—В–Ї–Є, –§–Я (–њ–∞—А–Њ–Ї—Б–Є–Ј–Љ—Л —З–∞—Й–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ –Љ–µ—Б—П—Ж), —Б–Њ—Е—А–∞–љ—П—О—Й–Є–µ—Б—П –љ–∞ —Д–Њ–љ–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–є –≤–∞—А–Є–∞–љ—В –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є:
1) –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞: —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, –љ–∞–ї–Є—З–Є–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, —В—А–µ–±—Г—О—Й–µ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П (—П–Ј–≤—Л, —Н—А–Њ–Ј–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –Њ–њ—Г—Е–Њ–ї–Є), –љ–µ—Б–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—З–∞–≥ –Є–љ—Д–µ–Ї—Ж–Є–Є, –Њ—Б—В—А–∞—П —Б—В–∞–і–Є—П –≥–љ–Њ–є–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ (—Н–њ–Є–Ј–Њ–і –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є, —Д–Є–±—А–Є–ї–ї—П—Ж–Є—П –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ), –Р–Ф –љ–Є–ґ–µ 90/60 –Љ–Љ —А—В. —Б—В.; 2) –љ–∞–ї–Є—З–Є–µ —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–µ—А–і—Ж–∞, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—Е–Њ–і–Є–ї–Є –Ј–∞ —А–∞–Љ–Ї–Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ (–≥–Є–њ–µ—А—В—А–Њ—Д–Є—П –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц) –Њ—В 14 –Љ–Љ –Є –±–Њ–ї–µ–µ, –Ї–Њ–љ–µ—З–љ–Њ-–і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є —А–∞–Ј–Љ–µ—А –Ы–Ц –±–Њ–ї–µ–µ 5,5 —Б–Љ, —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –Љ–µ–љ–µ–µ 45%); 3) –љ–∞–ї–Є—З–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–Њ—Б—В–Њ—П–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –љ–µ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Є—З–Є–љ—Л –∞—А–Є—В–Љ–Є–є (–Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ—Б—В—А—Л–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є —Б–Є–љ–і—А–Њ–Љ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ; –≤—А–Њ–ґ–і–µ–љ–љ—Л–µ –Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ—А–Њ–Ї–Є —Б–µ—А–і—Ж–∞; —В–Є—А–µ–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ, –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–µ —Б–µ—А–і—Ж–µ; –≥–Є–њ–µ—А—В—А–Њ—Д–Є—З–µ—Б–Ї–∞—П –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є—П; –∞–Љ–Є–ї–Њ–Є–і–Њ–Ј, –±–Њ–ї–µ–Ј–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П; –і–Є—Д—Д—Г–Ј–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є; —Б–Є—Б—В–µ–Љ–љ—Л–µ –≤–∞—Б–Ї—Г–ї–Є—В—Л; –ї–Є–Љ—Д–Њ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П; —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ—Б–ї–µ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤–Њ–≥–Њ —А—П–і–∞; –Њ–њ–µ—А–∞—Ж–Є—П –љ–∞ —Б–µ—А–і—Ж–µ –і–∞–≤–љ–Њ—Б—В—М—О –Љ–µ–љ–µ–µ 2 –Љ–µ—Б., –≤–Ї–ї—О—З–∞—П —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –Є —А–∞–і–Є–Њ—З–∞—Б—В–Њ—В–љ—Г—О –∞–±–ї—П—Ж–Є—О (–†–І–Р)).
–Ь–µ—В–Њ–і—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М —А—Г—В–Є–љ–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ–±—Й–Є–є, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј –±–µ–ї–Ї–Њ–≤, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –°–†–С, –Ф–Э–Ъ –Ї–∞—А–і–Є–Њ—В—А–Њ–њ–љ—Л—Е –≤–Є—А—Г—Б–Њ–≤ –≤ –Ї—А–Њ–≤–Є –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ–Њ–є —Ж–µ–њ–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є, —В–Є—А–µ–Њ—В—А–Њ–њ–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—П (–≠–Ъ–У), —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—П, —Е–Њ–ї—В–µ—А–Њ–≤—Б–Ї–Њ–µ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ –≠–Ъ–У. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М –≤ –§–Э–¶ —В—А–∞–љ—Б–њ–ї–∞–љ—В–Њ–ї–Њ–≥–Є–Є –Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є–Љ. –∞–Ї–∞–і. –Т.–Ш. –®—Г–Љ–∞–Ї–Њ–≤–∞ –Є –Э–Ш–Ш –њ–µ–і–Є–∞—В—А–Є–Є –Є–Љ. –∞–Ї–∞–і. –Ѓ.–Х. –Т–µ–ї—М—В–Є—Й–µ–≤–∞ –Љ–µ—В–Њ–і–Њ–Љ –љ–µ–њ—А—П–Љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ—Д–µ—А–Љ–µ–љ—В–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –Ф–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°) –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–µ —В–µ—Б—В—Л (—В—А–µ–і–Љ–Є–ї-—В–µ—Б—В –Є–ї–Є —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –љ–∞–≥—А—Г–Ј–Ї–Њ–є, n=21) –Є –Ї–Њ—А–Њ–љ–∞—А–Њ–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П (n=10). –Ф–ї—П –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ –њ—А–Њ–≤–µ–і–µ–љ—Л —В–∞–Ї–ґ–µ –Ь–†–Ґ —Б–µ—А–і—Ж–∞ —Б –≥–∞–і–Њ–ї–Є–љ–Є–µ–Љ (n=13), –Љ—Г–ї—М—В–Є—Б–њ–Є—А–∞–ї—М–љ–∞—П –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ь–°–Ъ–Ґ) —Б–µ—А–і—Ж–∞ —Б –≤/–≤ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ (n=15), —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ (n=25). –Я—А–Є–Љ–µ–љ—П–ї—Б—П –∞–ї–≥–Њ—А–Є—В–Љ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ [7], –≤–Ї–ї—О—З–∞—О—Й–Є–є –Њ—Ж–µ–љ–Ї—Г –∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Њ–є —В—А–Є–∞–і—Л (–Њ—Б—В—А–Њ–µ –љ–∞—З–∞–ї–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–≤—П–Ј—М —А–∞–Ј–≤–Є—В–Є—П —Б –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є, –і–∞–≤–љ–Њ—Б—В—М –Љ–µ–љ–µ–µ –≥–Њ–і–∞), –њ–Њ–≤—Л—И–µ–љ–Є—П —В–Є—В—А–∞ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї, –љ–∞–ї–Є—З–Є—П –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Ь–°–Ъ–Ґ –Є–ї–Є –Ь–†–Ґ –Є–ї–Є –і–Є—Д—Д—Г–Ј–љ–Њ–≥–Њ –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П —А–∞–і–Є–Њ—Д–∞—А–Љ–њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є–Є. –Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞ (—Н–љ–і–Њ–Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–∞—П –±–Є–Њ–њ—Б–Є—П) –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ —Г 5 (10,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (–і–ї—П –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л) –Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –≤ —Б—А–Њ–Ї–Є –њ–Њ–ї–≥–Њ–і–∞ –Є –≥–Њ–і (–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е) –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–µ —Е–Њ–ї—В–µ—А–Њ–≤—Б–Ї–Њ–µ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ –≠–Ъ–У. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є–Љ–Љ—Г–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞, —Н—Д—Д–µ–Ї—В–∞ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ) –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –Њ–±—К–µ–Љ –Ш–°–Ґ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞, —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Ї–Њ—В–Њ—А–Њ–є –±—Г–і–µ—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —А–∞–Ј–і–µ–ї–µ ¬Ђ–†–µ–Ј—Г–ї—М—В–∞—В—Л¬ї. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–∞–љ–љ—Л–Љ–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —З–∞—Б—В–Њ—В—Л –§–Я –Є–ї–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ц–≠/–Э–Ц–≠ –љ–∞ 75% –Є –±–Њ–ї–µ–µ –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В–љ–Њ—Б–Є–ї–Є—Б—М –Ї –≥—А—Г–њ–њ–µ –Њ—В–≤–µ—В–Є–≤—И–Є—Е –љ–∞ –ї–µ—З–µ–љ–Є–µ, –≤ –њ—А–Њ—В–Є–≤–љ–Њ–Љ —Б–ї—Г—З–∞–µ вАФ –Ї –≥—А—Г–њ–њ–µ –љ–µ –Њ—В–≤–µ—В–Є–≤—И–Є—Е –љ–∞ –ї–µ—З–µ–љ–Є–µ.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –њ—А–Њ–≥—А–∞–Љ–Љ—Л IBM SPSS Statistics v.21. –Я—А–Њ–≤–µ—А–Ї–∞ –љ–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В—М —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —В–µ—Б—В–∞ –®–∞–њ–Є—А–Њ вАФ –£–Є–ї–Ї–∞. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї–∞–Ї –Ь¬±SD (—Б—А–µ–і–љ–µ–µ ¬± 1 —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ) –Є–ї–Є –≤ –≤–Є–і–µ –Ї–≤–∞—А—В–Є–ї–µ–є 50 [25; 75]. –°—А–∞–≤–љ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ—А–Є –њ–Њ–Љ–Њ—Й–Є ѕЗ2 –Є–ї–Є —В–Њ—З–љ–Њ–≥–Њ —В–µ—Б—В–∞ –§–Є—И–µ—А–∞, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Ґ-—В–µ—Б—В–∞ –°—В—М—О–і–µ–љ—В–∞, U-—В–µ—Б—В–∞ –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є –Є –£–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞ –і–ї—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –†–∞–Ј–ї–Є—З–Є—П —Б—З–Є—В–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є –њ—А–Є p<0,05. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є ROC-–∞–љ–∞–ї–Є–Ј.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –±–Њ–ї—М–љ—Л—Е. –Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Є—Б—Е–Њ–і–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Љ–µ—В–Њ–і—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –ї–µ—З–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –Њ–±—К–µ–Љ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.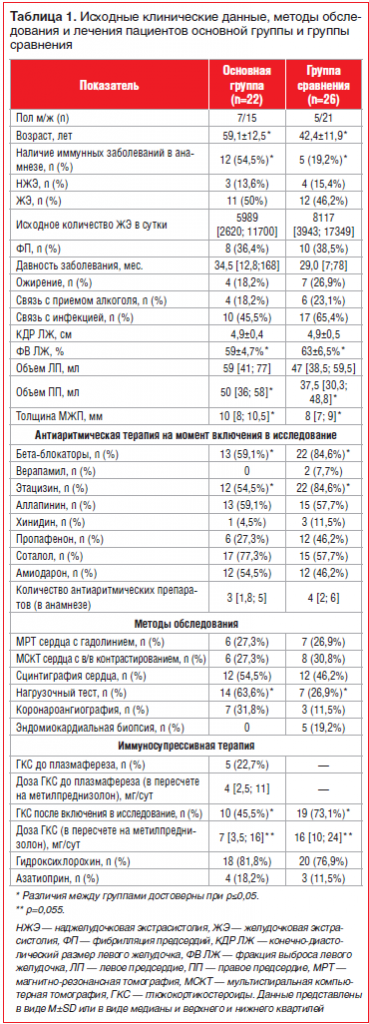
–Ю—Б–љ–Њ–≤–љ–∞—П –≥—А—Г–њ–њ–∞ –Є –≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –њ–Њ–ї—Г, —Е–∞—А–∞–Ї—В–µ—А—Г –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞, –і–∞–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–∞–ї–Є—З–Є—О –Њ–ґ–Є—А–µ–љ–Є—П, —Б–≤—П–Ј–Є —А–∞–Ј–≤–Є—В–Є—П –∞—А–Є—В–Љ–Є–є —Б –њ—А–Є–µ–Љ–Њ–Љ –∞–ї–Ї–Њ–≥–Њ–ї—П –Є –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є. –°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л –≥—А—Г–њ–њ—Л –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –±—Л–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б—В–∞—А—И–µ –±–Њ–ї—М–љ—Л—Е –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –Є —З–∞—Й–µ –Є–Љ–µ–ї–Є —В–∞–Ї–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–∞–Ї —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 1-–≥–Њ —В–Є–њ–∞, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є —В–Є—А–µ–Њ–Є–і–Є—В, —Г–Ј–ї–Њ–≤–Њ–є –Ј–Њ–±, –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Г—О –∞—Б—В–Љ—Г, –њ–Њ–ї–ї–Є–љ–Њ–Ј –Є –њ—А. –°—А–µ–і–Є –і–∞–љ–љ—Л—Е –≠—Е–Њ–Ъ–У –Њ–±—А–∞—Й–∞–ї–Є –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–Є–є –Њ–±—К–µ–Љ –њ—А–∞–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П –Є —В–Њ–ї—Й–Є–љ–∞ –Љ–µ–ґ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є, –∞ —В–∞–Ї–ґ–µ –Љ–µ–љ—М—И–∞—П —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є —Н—В–Њ–Љ –љ–µ –≤—Л—Е–Њ–і–Є–ї–Є –Ј–∞ —А–∞–Љ–Ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –Ш—Б—Е–Њ–і–љ–∞—П —З–∞—Б—В–Њ—В–∞ –Э–Ц–≠ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 4322, 5500 –Є 9505 –≤ —Б—Г—В–Ї–Є –і–ї—П –Ї–∞–ґ–і–Њ–є –Є–Ј —В—А–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є 11701 [1204; 23050] –≤ —Б—Г—В–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П.
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–µ–ґ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А—Л –Є —Н—В–∞—Ж–Є–Ј–Є–љ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–µ —В–µ—Б—В—Л (—В—А–µ–і–Љ–Є–ї-—В–µ—Б—В –Є–ї–Є —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –љ–∞–≥—А—Г–Ј–Ї–Њ–є), —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –±–Њ–ї–µ–µ —Б—В–∞—А—И–Є–Љ –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –Є—Б–Ї–ї—О—З–µ–љ–Є—П —Г –љ–Є—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є—И–µ–Љ–Є–Є) –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 1–° –Ї–ї–∞—Б—Б–∞. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ–Њ–і–±–Њ—А–∞ —В–µ—А–∞–њ–Є–Є (–љ–∞ —Н—В–∞–њ–µ, –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–≤—И–µ–Љ –≤–Ї–ї—О—З–µ–љ–Є—О –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ) –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –≤ —Б—А–µ–і–љ–µ–Љ –њ–Њ 3вАУ4 –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ –Ї –ї–µ—З–µ–љ–Є—О; –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤–Њ–Ј–љ–Є–Ї–ї–∞ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Ц–≠ —З–∞—Й–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М —Н—В–∞—Ж–Є–Ј–Є–љ –Є –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А—Л, —Б –§–Я вАФ –∞–Љ–Є–Њ–і–∞—А–Њ–љ, —Б–Њ—В–∞–ї–Њ–ї, –∞–ї–ї–∞–њ–Є–љ–Є–љ, –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А—Л, —Б –Ц–≠ вАФ —Н—В–∞—Ж–Є–Ј–Є–љ, –∞–ї–ї–∞–њ–Є–љ–Є–љ, —Б–Њ—В–∞–ї–Њ–ї –Є –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А—Л.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞. –£—А–Њ–≤–µ–љ—М –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –∞ –Ј–∞—В–µ–Љ –≤ —Б—А–Њ–Ї–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞, —З–µ—А–µ–Ј 6 [6; 7] –Є 12 [10,8; 15] –Љ–µ—Б. –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Є —З–µ—А–µ–Ј 6 [4; 7] –Є 12 [10; 15] –Љ–µ—Б. –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—В–∞–±–ї. 2). –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –њ–Њ—З—В–Є –≤—Б–µ—Е –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –∞–љ—В–Є—В–µ–ї –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤, —В–Є—В—А –Ї–Њ—В–Њ—А—Л—Е –Є—Б—Е–Њ–і–љ–Њ –±—Л–ї –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ, –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –љ–µ –і–Њ—Б—В–Є–≥–ї–Њ —Б—В–µ–њ–µ–љ–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є) –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞. –≠—Д—Д–µ–Ї—В –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В–Є—В—А–∞ –∞–љ—В–Є—В–µ–ї –±—Л–ї –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Б—В–Њ–є–Ї–Є–Љ: –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Е—А–∞–љ—П–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В–µ–ї –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ —Н–љ–і–Њ—В–µ–ї–Є—П –Є –њ—А–Њ–≤–Њ–і—П—Й–µ–є —Б–Є—Б—В–µ–Љ—Л, –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —В–Є—В—А–∞ –Р–Э–§, —Е–Њ—В—П –Ї –Ї–Њ–љ—Ж—Г –≥–Њ–і–∞ –љ–∞–Љ–µ—В–Є–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —З–∞—Б—В–Є—З–љ–Њ–є —Г—В—А–∞—В–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (—В–Є—В—А—Л –∞–љ—В–Є—В–µ–ї –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤–Њ–Ј—А–Њ—Б–ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Г—А–Њ–≤–љ–µ–Љ —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –Є —З–µ—А–µ–Ј –њ–Њ–ї–≥–Њ–і–∞ –њ–Њ—Б–ї–µ –љ–µ–≥–Њ). –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –ї–Є—И—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В–µ–ї –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ —З–µ—А–µ–Ј –њ–Њ–ї–≥–Њ–і–∞.

–Ф–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Е–Њ—А–Њ—И–µ–≥–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (—Б–љ–Є–ґ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Г–Љ–µ–љ—М—И–Є—В—М –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ—Б—В—М –Ш–°–Ґ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –±–µ–Ј —Г—В—А–∞—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞: –У–Ъ–° –±—Л–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–µ–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (—Б–Љ. —В–∞–±–ї. 1, —А–Є—Б. 1); –њ–Њ —З–∞—Б—В–Њ—В–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ–∞ –Є –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ–∞ –њ–∞—Ж–Є–µ–љ—В—Л –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М. –£ 5 (22,7%) –±–Њ–ї—М–љ—Л—Е —В–µ—А–∞–њ–Є—П –У–Ъ–° –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –µ—Й–µ –і–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –≤–і–≤–Њ–µ –љ–Є–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, —Б—А–µ–і–љ—П—П –і–Њ–Ј–∞ –У–Ъ–° –≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ, —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є –±–ї–Є–Ј–Ї–Є –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ (p=0,055). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –љ–µ–≤—Л—Б–Њ–Ї–Є–µ (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ—А–Є–љ—П—В—Л–Љ–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞) –і–Њ–Ј—Л –У–Ъ–°, —З–µ–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є —В–Є—В—А–∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П.

–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М, —Г –Њ–і–љ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є –љ–∞ —Д–Њ–љ–µ –Ш–°–Ґ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞–Љ–Є –≤ –і–Њ–Ј–µ 40 –Љ–≥/—Б—Г—В –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Љ–Є–Њ–њ–∞—В–Є–Є –Є —Б—Л–њ–Є. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Г 9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ—В –њ—А–Є–µ–Љ–∞ –У–Ъ–° (—Б—В–µ—А–Њ–Є–і–љ—Л–є –і–Є–∞–±–µ—В, –Љ–Є–Њ–њ–∞—В–Є—П, –≥–Є—А—Б—Г—В–Є–Ј–Љ –Є –і—А.). –Ю—Б–ї–Њ–ґ–љ–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –У–Ъ–° —Б—В–∞–ї–Є –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–Њ–Ј –Є–ї–Є –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–є –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –љ–Њ—Б–Є–ї–Є –Њ–±—А–∞—В–Є–Љ—Л–є —Е–∞—А–∞–Ї—В–µ—А.
–Ф–∞–ї–µ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є –Є –Ш–°–Ґ) —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –≤ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є —Б—А–∞–≤–љ–µ–љ–Є—П. –Ъ–Њ–љ—В—А–Њ–ї—М —Е–Њ–ї—В–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –≤ —Б—А–Њ–Ї–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞, —З–µ—А–µ–Ј 6 [5; 7] –Є 14 [12; 15] –Љ–µ—Б. –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Є —З–µ—А–µ–Ј 6 [4,3; 8,8] –Є 12 [10; 15,5] –Љ–µ—Б. –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (81,8%) –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –≤ –≤–Є–і–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–Є–Є –љ–∞ 75% –Є –±–Њ–ї–µ–µ –Є —З–∞—Б—В–Њ—В—Л –§–Я. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Њ—В–≤–µ—В–Є–ї–Є –љ–∞ —В–µ—А–∞–њ–Є—О 15 (57,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 2). –Я—А–Є —Н—В–Њ–Љ —Г 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (32%) –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–Є—В—М –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О –Ј–∞ —Б—З–µ—В —Б—В–Њ–є–Ї–Њ–≥–Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–Љ–Є–Њ–Ї–∞—А–і–Є—В–∞), —З–µ–≥–Њ –љ–Є —А–∞–Ј—Г –љ–µ –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П.

–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –њ—А–Є —А–∞–Ј–љ—Л—Е –≤–Є–і–∞—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ –±—Л–ї–∞ —А–∞–Ј–ї–Є—З–љ–Њ–є (—А–Є—Б. 3). –Ш–Ј 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Ц–≠ 2 –Њ—В–≤–µ—В–Є–ї–Є –љ–∞ –ї–µ—З–µ–љ–Є–µ. –£ –Њ–і–љ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є, –љ–µ –Њ—В–≤–µ—В–Є–≤—И–µ–є –љ–∞ –ї–µ—З–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–Њ–Љ, –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї –љ–∞ 73%, —З—В–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Д–Њ—А–Љ–∞–ї—М–љ–Њ –Њ—В–љ–µ—Б—В–Є –µ–µ –≤ –≥—А—Г–њ–њ—Г —Е–Њ—А–Њ—И–µ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј, –Њ–і–љ–∞–Ї–Њ –Ї –≥–Њ–і–Њ–≤–Њ–Љ—Г —Б—А–Њ–Ї—Г –љ–∞–±–ї—О–і–µ–љ–Є—П –µ–є –±—Л–ї–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–µ–љ–∞ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П —Б —Г—З–µ—В–Њ–Љ —Е–Њ—А–Њ—И–µ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ (—Б—В–Њ–є–Ї–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Э–Ц–≠). –£ 1 –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –Э–Ц–≠ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–љ–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–Є–Є, –Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–µ–љ–∞ –Ш–°–Ґ, –Њ–і–љ–∞–Ї–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г–≥–Њ–і–∞ –≤–Њ–Ј–љ–Є–Ї–ї–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Н–њ–Є–Ј–Њ–і–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є –љ–∞–ї–Є—З–Є–µ–Љ —Д–Є–±—А–Њ–Ј–љ–Њ–≥–Њ –Њ—З–∞–≥–∞ –≤ –Ы–Ц (–њ–Њ –і–∞–љ–љ—Л–Љ –Ь–†–Ґ –Є —Н–ї–µ–Ї—В—А–Њ–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є—П), –њ–Њ –њ–Њ–≤–Њ–і—Г —З–µ–≥–Њ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —Г—Б–њ–µ—И–љ–∞—П –†–І–Р.

–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ц–≠ (11 –±–Њ–ї—М–љ—Л—Е) –±—Л–ї –Њ—В–Љ–µ—З–µ–љ —Е–Њ—А–Њ—И–Є–є –Њ—В–≤–µ—В –љ–∞ –ї–µ—З–µ–љ–Є–µ. –Я—А–Є —Н—В–Њ–Љ —Г 4 (36%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ї –Ї–Њ–љ—Ж—Г —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –±—Л–ї–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–µ–љ–∞ –Ш–°–Ґ, —Г 3 (27%) –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–µ–љ–∞ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П, —Г 8 (73%) –Њ—В–Љ–µ—З–µ–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞–љ–µ–µ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є–Ї–Њ–≤ –њ–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —З–∞—Й–µ –≤—Б–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А—Л.
–•–Њ—А–Њ—И–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –Њ—В–Љ–µ—З–µ–љ —Г 5 (63%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –§–Я. –£ 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–Є –Њ–і–љ–Њ–≥–Њ –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–∞ –§–Я, 2 –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–µ–љ–∞ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П, —Г 3 —Б—В–∞–ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ —А–∞–љ–µ–µ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ. –£—Б–њ–µ—И–љ–∞—П –†–І–Р –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —Н—Д—Д–µ–Ї—В–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Њ–і–љ–Њ–Љ—Г –њ–∞—Ж–Є–µ–љ—В—Г –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ—Б—В–Є–Љ—Г–ї—П—В–Њ—А –≤ —Б–≤—П–Ј–Є —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —Б–Є–љ–і—А–Њ–Љ–∞ —Б–ї–∞–±–Њ—Б—В–Є —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —Г–Ј–ї–∞.
–Ш–Ј 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –§–Я –Њ—В–≤–µ—В–Є–ї–Є –љ–∞ –ї–µ—З–µ–љ–Є–µ 6 (60%), –њ—А–Є —Н—В–Њ–Љ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –љ–µ –±—Л–ї–∞ –Њ—В–Љ–µ–љ–µ–љ–∞ –љ–Є —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, –Ш–°–Ґ –±—Л–ї–∞ –Њ—В–Љ–µ–љ–µ–љ–∞ —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞. –Ш–Ј 4 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Ц–≠ –Њ—В–≤–µ—В–Є–ї –љ–∞ –ї–µ—З–µ–љ–Є–µ 1 (25%). –Ш–Ј 12 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ц–≠ –Њ—В–≤–µ—В–Є–ї–Є –љ–∞ –ї–µ—З–µ–љ–Є–µ 8 (66,7%). –£ 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –Њ—В–Љ–µ–љ–µ–љ–∞ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П, —Г 2 вАФ –Ш–°–Ґ.
–Ф–∞–ї–µ–µ –±—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ—А–µ–і–Є–Ї—В–Њ—А—Л —Е–Њ—А–Њ—И–µ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј (—В–∞–±–ї. 3). –Ъ–∞–Ї –Њ—В–Љ–µ—З–µ–љ–Њ –≤—Л—И–µ, –њ–µ—А–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б —Е–Њ—А–Њ—И–Є–Љ –Њ—В–≤–µ—В–Њ–Љ –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј, –±—Л–ї –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —В–Є–њ –∞—А–Є—В–Љ–Є–Є: –љ–∞–Є–ї—Г—З—И–Є–є –Њ—В–≤–µ—В –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –±—Л–ї –Њ—В–Љ–µ—З–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ц–≠, –±–ї–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є вАФ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Ц–≠. –Э–∞–ї–Є—З–Є–µ –§–Я –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є
—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Ї–∞–Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є, —В–∞–Ї –Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞).

–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Е–Њ—А–Њ—И–Є–є —Н—Д—Д–µ–Ї—В –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б —А—П–і–Њ–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –і–∞–≤–љ–Њ—Б—В—М –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞. –Ю—В–Љ–µ—З–µ–љ–∞ —Б–≤—П–Ј—М —Е–Њ—А–Њ—И–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Б –љ–∞–ї–Є—З–Є–µ–Љ —Б–≤—П–Ј–Є –і–µ–±—О—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є, –Љ–µ–љ—М—И–µ–є –і–∞–≤–љ–Њ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і—Л–Љ –≤–Њ–Ј—А–∞—Б—В–Њ–Љ (—А–Є—Б. 3), –Њ–і–љ–∞–Ї–Њ —А–∞–Ј–ї–Є—З–Є—П –њ–Њ —Н—В–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ –љ–µ –і–Њ—Б—В–Є–≥–∞–ї–Є —Б—В–µ–њ–µ–љ–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є.
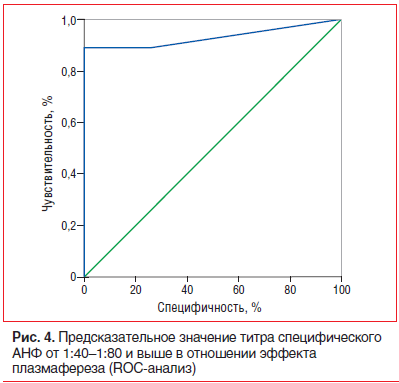
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Б—В–∞–ї –Є—Б—Е–Њ–і–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї —П–і—А–∞–Љ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ (—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Э–§). –Х–≥–Њ —В–Є—В—А –Њ—В 1:40 вАФ1:80 –Є –≤—Л—И–µ (–≤ –љ–Њ—А–Љ–µ –Њ–љ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В) –Њ–±–ї–∞–і–∞–ї —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 88,9% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О 100% –≤ –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–Є–Є —Е–Њ—А–Њ—И–µ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј, AUC вАФ 0,931 –њ–Њ –і–∞–љ–љ—Л–Љ ROC-–∞–љ–∞–ї–Є–Ј–∞ (p=0,008) (—А–Є—Б. 4).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–њ–µ—А–≤—Л–µ –Є–Ј—Г—З–µ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ –≤ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є —Б—А–∞–≤–љ–µ–љ–Є—П. –Ю—В–Љ–µ—В–Є–Љ, —З—В–Њ —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П—Е: –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б —Г—Б—В–Њ–є—З–Є–≤—Л–Љ–Є –Ї –ї–µ—З–µ–љ–Є—О –∞—А–Є—В–Љ–Є—П–Љ–Є —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –∞ —В–∞–Ї–ґ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ (–і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ) –Є–ї–Є –≤—Л—Б–Њ–Ї–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ (—Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—М–љ—Л–Љ, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ, –≤ —А–∞–Љ–Ї–∞—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є) –≤–∞—А–Є–∞–љ—В–∞–Љ–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞, –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П, –љ–∞—А—П–і—Г —Б –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є –Є –±–ї–Њ–Ї–∞–і–∞–Љ–Є, —А–∞–Ј–≤–Є—В–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–Є –Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є [5].–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П –ї–Є—И—М –µ–і–Є–љ–Є—З–љ—Л–µ —Г–њ–Њ–Љ–Є–љ–∞–љ–Є—П —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ—В–Њ–і–Њ–≤ –∞—Д–µ—А–µ–Ј–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞—А–Є—В–Љ–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ —Б–µ—А–і—Ж–∞: —В–∞–Ї, –љ–µ–і–∞–≤–љ–Њ –Њ–њ–Є—Б–∞–љ–∞ —Б–µ—А–Є—П –Є–Ј 12 —Б–ї—Г—З–∞–µ–≤ –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –±–ї–Њ–Ї–∞–і —Г –і–µ—В–µ–є —Б –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ –њ—А–Њ–≤–Њ–і—П—Й–µ–є —Б–Є—Б—В–µ–Љ—Л (SSA/Ro –Є SSB/La), –Ї–Њ—В–Њ—А—Л—Е –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Г—Б–њ–µ—И–љ–Њ –ї–µ—З–Є–ї–Є –љ–µ–і–µ–ї—М–љ—Л–Љ –Ї—Г—А—Б–Њ–Љ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞, –≤/–≤ –≤–ї–Є–≤–∞–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –Є –Љ–∞–ї—Л–Љ–Є –і–Њ–Ј–∞–Љ–Є –±–µ—В–∞–Љ–µ—В–∞–Ј–Њ–љ–∞ (–њ–Њ—Б–ї–µ 3 –ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П —Б—В–Є–Љ—Г–ї—П—В–Њ—А—Л –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ—Л –њ–Њ–ї–Њ–≤–Є–љ–µ –і–µ—В–µ–є —Б –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –±–ї–Њ–Ї–∞–і–Њ–є III —Б—В–µ–њ–µ–љ–Є, –њ—А–Є II —Б—В–µ–њ–µ–љ–Є –±–ї–Њ–Ї–∞–і—Л –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М) [8]. –Ґ–Њ–є –ґ–µ –≥—А—Г–њ–њ–Њ–є –∞–≤—В–Њ—А–Њ–≤ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±—Л–ї —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ —Г –±–µ—А–µ–Љ–µ–љ–љ–Њ–є –ґ–µ–љ—Й–Є–љ—Л —Б –Р–Т-–±–ї–Њ–Ї–∞–і–Њ–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є –љ–∞–ї–Є—З–Є–µ–Љ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї SSA/Ro –Є SSB/La [9]. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –њ—А–Є –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –±–ї–Њ–Ї–∞–і–∞—Е –≤ —А–∞–Љ–Ї–∞—Е —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є (–њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –≤—Л—А–∞–±–∞—В—Л–≤–∞—О—В—Б—П —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –≤–Є–і—Л –∞–љ—В–Є—В–µ–ї) –Њ–њ–Є—Б–∞–љ–Њ –Є –≤ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [10]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —А–∞–±–Њ—В –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –њ—А–Є –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–Љ —Б–њ–µ–Ї—В—А–µ –Є–Љ–Љ—Г–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г –љ–µ—В.
–Х–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–µ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ –њ—А–Њ–≤–µ–і–µ–љ–Њ –љ–∞–Љ–Є (–Р.–Т. –Э–µ–і–Њ—Б—В—Г–њ, –Р.–У. –†–∞–≥–Є–Љ–Њ–≤) —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Ф.–Р. –¶–∞—А–µ–≥–Њ—А–Њ–і—Ж–µ–≤—Л–Љ –љ–∞ —А—Г–±–µ–ґ–µ 2000-—Е –≥–Њ–і–Њ–≤ [6]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Є 52 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –ї–Є—И—М –≤ 19,6% —Б–ї—Г—З–∞–µ–≤ –∞—А–Є—В–Љ–Є–Є –±—Л–ї–Є —А–∞—Б—Ж–µ–љ–µ–љ—Л –Ї–∞–Ї –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ, —Г –Њ—Б—В–∞–ї—М–љ—Л—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є—З–Є–љ—Л –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–Є—Б—М –Ш–С–°, –њ–Њ—А–Њ–Ї–Є –Є –і—А—Г–≥–Є–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е —Г–њ–Њ–Љ–Є–љ–∞—О—В—Б—П –Љ–Є–Њ–Ї–∞—А–і–Є–Њ–і–Є—Б—В—А–Њ—Д–Є–Є –Є –њ–Њ—Б—В–Љ–Є–Њ–Ї–∞—А–і–Є—В–Є—З–µ—Б–Ї–Є–є –Ї–∞—А–і–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј (—Г —З–∞—Б—В–Є –±–Њ–ї—М–љ—Л—Е —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М –љ–∞–ї–Є—З–Є–µ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞). –Т –Ї–∞—З–µ—Б—В–≤–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е ¬Ђ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤¬ї –Є–Ј—Г—З–µ–љ—Л –љ–µ—Н—Б—В–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –њ—А–Њ–і—Г–Ї—В—Л –њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤, —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Ї—А–Њ–≤–Є, –Њ–і–љ–∞–Ї–Њ –љ–∞–є—В–Є –±–µ—Б—Б–њ–Њ—А–љ—Л–є –≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–є –Љ–∞—А–Ї–µ—А, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–є –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –∞—А–Є—В–Љ–Є–є –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є –Ї –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј—Г, –љ–µ —Г–і–∞–ї–Њ—Б—М.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –≤–ї–Є—П–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л: —Н—В–Є–Њ–ї–Њ–≥–Є—П –Є –≤–Є–і –∞—А–Є—В–Љ–Є–Є (—А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –ї—Г—З—И–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ш–С–° –Є –§–Я), —А–∞–Ј–Љ–µ—А—Л –ї–µ–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П, —Б–Њ—З–µ—В–∞–љ–љ–∞—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П; –Є–Ј –≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –ї–Є—И—М —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Б–≤—П–Ј–∞–љ—Л —Б —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –ї–µ—З–µ–љ–Є—П. –Ш–Љ–Љ—Г–љ–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л –Ї–∞–Ї –њ—А–µ–і–Є–Ї—В–Њ—А—Л –Њ—В–≤–µ—В–∞ –љ–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –≤ –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –љ–µ –Є–Ј—Г—З–∞–ї–Є—Б—М, —Е–Њ—В—П –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–ї–Њ—Б—М, —З—В–Њ –≤ –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–∞—А–Є—В–Љ–Є–Ї–∞–Љ, –і–Њ—Б—В–Є–≥–љ—Г—В–Њ–є —Г —А—П–і–∞ –±–Њ–ї—М–љ—Л—Е, –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М —А–Њ–ї—М —Г–і–∞–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –Ш–°–Ґ –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–∞—Б—М; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —А–∞–±–Њ—В–µ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–∞ –≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П.
–Я—А–Є —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –∞—А–Є—В–Љ–Є–є –Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—З–µ–≤–Є–і–љ–Њ–є —В–Њ—З–Ї–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 50%, —Н—Д—Д–µ–Ї—В –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Е—А–∞–љ—П–ї—Б—П –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б., —З—В–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –љ–∞—И–µ–є —А–∞–±–Њ—В–µ: —Е–Њ—А–Њ—И–Є–є —Н—Д—Д–µ–Ї—В –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –Њ—В–Љ–µ—З–µ–љ –љ–∞–Љ–Є —Г 81,8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є—З–µ–Љ –Њ–љ —Б–Њ—Е—А–∞–љ—П–ї—Б—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —Б—А–µ–і–љ–µ–Љ –і–Њ –≥–Њ–і–∞ (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ 45 –Љ–µ—Б.). –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –≤ —А–∞–±–Њ—В–µ –Ф.–Р. –¶–∞—А–µ–≥–Њ—А–Њ–і—Ж–µ–≤–∞ –Є —Б–Њ–∞–≤—В. —Е—Г–і—И–Є–є —Н—Д—Д–µ–Ї—В –±—Л–ї –њ–Њ–ї—Г—З–µ–љ —Г –±–Њ–ї—М–љ—Л—Е —Б —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–Є–µ–є (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –§–Я), –њ—А–Є—З–Є–љ—Л —З–µ–≥–Њ –Љ–Њ–ґ–љ–Њ –Є—Б–Ї–∞—В—М –≤ —А–∞–Ј–ї–Є—З–љ–Њ–є (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є?) –µ–µ —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –Ю–±—К—П—Б–љ–µ–љ–Є–µ–Љ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є (–≤ —Ж–µ–ї–Њ–Љ –Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–Є–і–∞–Љ–Є –∞—А–Є—В–Љ–Є–є) –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –і–≤–∞ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞: –Є–Љ–Љ—Г–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —Н—В–Є–Њ–ї–Њ–≥–Є—П –Є –љ–∞–ї–Є—З–Є–µ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Б—Г–±—Б—В—А–∞—В–∞ –і–ї—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ (–≤—Л—Б–Њ–Ї–Є—Е —В–Є—В—А–Њ–≤ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї), –∞ —В–∞–Ї–ґ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ш–°–Ґ, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Њ—Е—А–∞–љ–Є—В—М –і–Њ—Б—В–Є–≥–љ—Г—В—Л–є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞, –љ–Њ –Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–Є—В—М –∞–љ—В–Є–∞—А–Є—В–Љ–Є–Ї–Є —Г –Ї–∞–ґ–і–Њ–≥–Њ —В—А–µ—В—М–µ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ.
–≠—Д—Д–µ–Ї—В –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –љ–∞–Љ–Є –љ–µ —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е, —З—В–Њ –і–µ–ї–∞–ї–Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –њ–Њ–Є—Б–Ї –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –•—Г–і—И–Є–є —А–µ–Ј—Г–ї—М—В–∞—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –§–Я –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ—Л–Љ: —Г –±–Њ–ї—М–љ—Л—Е —Б –Љ–Є–Њ–Ї–∞—А–і–Є—В–Њ–Љ —Б—Г–±—Б—В—А–∞—В–Њ–Љ –і–∞–љ–љ–Њ–є –∞—А–Є—В–Љ–Є–Є —Б–ї—Г–ґ–∞—В –љ–µ—А–µ–і–Ї–Њ –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ вАФ —Д–Є–±—А–Њ–Ј –Є –ї–Є–њ–Њ–Љ–∞—В–Њ–Ј, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –±–Є–Њ–њ—Б–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–∞–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ —Г 5 –±–Њ–ї—М–љ—Л—Е –Є–Ј –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П. –І–µ—В–Ї–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –њ–Њ –і–∞–љ–љ—Л–Љ –Ь–†–Ґ –Є–ї–Є –Ь–°–Ъ–Ґ —Б–µ—А–і—Ж–∞ –љ–∞–Љ–Є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П –љ–µ–≤—Л—Б–Њ–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–∞–љ–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –њ—А–Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–Љ –≤–∞—А–Є–∞–љ—В–µ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞ (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Њ—Б—В—А—Л–Љ –Є –Є–љ—Д–∞—А–Ї—В–Њ–њ–Њ–і–Њ–±–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–∞–Љ–Є) [11]. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ —А–Њ–ї–Є –љ–µ–Њ–±—А–∞—В–Є–Љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Љ–Є–Њ–Ї–∞—А–і–µ –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Б–ї—Г–ґ–Є—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–∞—Б—М —Б –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і—Л–Љ –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Є —Б –Љ–µ–љ—М—И–µ–є –і–∞–≤–љ–Њ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Б—В–∞–ї –Є—Б—Е–Њ–і–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Э–§: –≤ —В–Є—В—А–µ 1:40вАУ1:80 –Є –±–Њ–ї–µ–µ –Њ–љ –Њ–±–ї–∞–і–∞–ї –≤—Л—Б–Њ–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О. –≠—В–Њ—В –≤–Є–і –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Њ—В—А–∞–ґ–∞–µ—В –≤—Л—Б–Њ–Ї—Г—О –Є–Љ–Љ—Г–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–Ј–љ–Є (–µ–≥–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П —Н–Љ–њ–µ—А–Є–њ–Њ–ї–µ–Ј–Є—Б —Б –ї–Є–Ј–Є—Б–Њ–Љ —П–і–µ—А –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј—Л–≤–∞—В—М —Н—Д—Д–µ–Ї—В –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞. –Э–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —Б –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–Љ–Є –Є –Ї–Њ–љ–µ—З–љ—Л–Љ–Є —В–Є—В—А–∞–Љ–Є –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї, –Њ–і–љ–∞–Ї–Њ —Н—В–Њ—В —Д–∞–Ї—В –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л–Љ, —З–µ–Љ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–µ —Г–і–∞–ї–µ–љ–Є–µ –Є–Ј –Ї—А–Њ–≤–Є –∞–љ—В–Є—В–µ–ї, —Н—Д—Д–µ–Ї—В–Њ–Љ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Г–і–∞–ї–µ–љ–Є–µ –Р–Э–§ –Є –і—А—Г–≥–Є—Е –≤–Є–і–Њ–≤ –∞–љ—В–Є—В–µ–ї –Є–Ј —В–Ї–∞–љ–µ–є (–Љ–Є–Њ–Ї–∞—А–і–∞) —Б –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Ї—А–Њ–≤–Є.
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —В–Є—В—А–∞ –∞–љ—В–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –±—Л–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –Є —Б–Њ—Е—А–∞–љ—П–ї–Њ—Б—М –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ю—В—Б—Г—В—Б—В–≤–Є–µ —В–∞–Ї–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –Њ–і–љ—Г –Є–Ј –≤–µ–і—Г—Й–Є—Е –њ—А–Є—З–Є–љ –Љ–µ–љ—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і–Њ–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –±—Л–ї–∞ –≤—Л—И–µ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ (81,8% –њ—А–Њ—В–Є–≤ 57,7%). –Ю–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –Є –Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л, —З—В–Њ, –≤–µ—А–Њ—П—В–љ–Њ, –Њ—В—А–∞–ґ–∞–ї–Њ –±–Њ–ї—М—И—Г—О –Є–Љ–Љ—Г–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –Љ–Њ–≥–ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –ї—Г—З—И–µ–Љ—Г –Њ—В–≤–µ—В—Г –љ–∞ –ї–µ—З–µ–љ–Є–µ. –Т –Њ–і–љ–Њ–є –Є–Ј —А–∞–±–Њ—В —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –§–Я, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –ї–µ—З–µ–љ–Є–µ –У–Ъ–°, –Њ—В–Љ–µ—З–µ–љ–∞ —Б–≤—П–Ј—М –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П –°–†–С –Є —З–∞—Б—В–Њ—В—Л –§–Я, –њ—А–Є—З–µ–Љ –ї–µ—З–µ–љ–Є–µ –У–Ъ–° —Б–љ–Є–ґ–∞–ї–Њ —З–∞—Б—В–Њ—В—Г –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–≤ –§–Я –Є —Г—А–Њ–≤–µ–љ—М –°–†–С [4].
–Ю—З–µ–љ—М –Ј–љ–∞—З–Є–Љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї—Б—П –ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ–љ–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –Ш–°–Ґ: —В–µ—А–∞–њ–Є—П —Б—В–µ—А–Њ–Є–і–∞–Љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–µ–ґ–µ –Є –≤ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–µ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ–Ј—Л –У–Ъ–° –±—Л–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ —Б—А–µ–і–љ–Є—Е, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б—А–µ–і–љ—П—П –і–Њ–Ј–∞ –У–Ъ–° (16 –Љ–≥/—Б—Г—В) –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Е–Њ—В—П –Є –љ–µ —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є, –љ–Њ —Б–Њ–њ—А—П–ґ–µ–љ–∞ —Б —А–µ–∞–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Э–∞–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П, —З—В–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є –≤–µ—Б—М–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Љ–Є–Њ–Ї–∞—А–і–Є—В–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г—Б—В–Њ–є—З–Є–≤–Њ–є –Ї –ї–µ—З–µ–љ–Є—О –∞—А–Є—В–Љ–Є–Є, –≤—Л—Б–Њ–Ї–Њ–є –Є–Љ–Љ—Г–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—А–µ–і–љ–Є—Е –Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ–°.












