–Э–µ–Ї–Њ—В–Њ—А—Л–µ –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Є –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Љ–Є–љ–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (–Ш–Ъ) –њ—А–Є –Р–Ъ–®, –Ї–Њ—В–Њ—А–Њ–µ —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Р–Ъ–® –љ–∞ —А–∞–±–Њ—В–∞—О—Й–µ–Љ —Б–µ—А–і—Ж–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –Т—Л–њ–Њ–ї–љ–µ–љ–Є–µ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П –±–µ–Ј –Ш–Ъ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–Њ–ї–µ–µ –љ–Є–Ј–Ї—Г—О –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М, –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Є–Љ–µ–µ—В —А—П–і –і—А—Г–≥–Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–µ—А–µ–і –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ш–Ъ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –≤–Є–і–∞ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Њ—З–µ–≤–Є–і–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Ш–Ъ.
–Ю–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –Њ—В–Ї—А—Л—В–Њ–Љ —Б–µ—А–і—Ж–µ —П–≤–ї—П—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ (–Э–†–°). –Т—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Є—Е –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞–Ј–ї–Є—З–љ–∞—П – –Њ—В –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –љ–µ–Ј–љ–∞—З–Є–Љ—Л—Е –і–Њ —Д–∞—В–∞–ї—М–љ—Л—Е.
–†–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л –∞—А–Є—В–Љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –Ш–С–° –њ–Њ—Б–ї–µ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ (–Р–Ъ–®) —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤–љ–µ–і—А–µ–љ–Є–µ –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –љ–Њ–≤–µ–є—И–Є—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є, —Г—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ј–∞—Й–Є—В—Л –Є –∞–љ–µ—Б—В–µ–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—Б–Њ–±–Є—П, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –∞—А–Є—В–Љ–Є–є –Њ—Б—В–∞–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є [6, 7].
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—Й–Є–µ—Б—П –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ – –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л —Б—Г–њ—А–∞–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ—Л—Е —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї, –∞ —В–∞–Ї–ґ–µ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ – —Д–Є–±—А–Є–ї–ї—П—Ж–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є (–§–Я). –Х–µ —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≤ —А–∞–љ–љ–Є–є –Є –Њ—В—Б—А–Њ—З–µ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, –Њ—В 20 –і–Њ 40% —Б–ї—Г—З–∞–µ–≤ [8].
–Ц–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є –њ–Њ—Б–ї–µ –Р–Ъ–® –≤—Б—В—А–µ—З–∞—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –Є —Б–Њ—Б—В–∞–≤–ї—П—О—В –Њ—В 2 –і–Њ 8% –Њ—В –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е. –Ю–і–љ–Є–Љ –Є–Ј —Б–∞–Љ—Л—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є–Ј –љ–Є—Е —П–≤–ї—П–µ—В—Б—П –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–∞—П —В–∞—Е–Є–Ї–∞—А–і–Є—П (–Ц–Ґ). –Ю—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –≤–Є–і–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –≤–Њ–Ј–љ–Є–Ї–∞—О—В —З–∞—Й–µ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–є –љ–µ–і–µ–ї–Є –њ–Њ—Б–ї–µ –Р–Ъ–®. –Э–Њ –љ–∞–Є–±–Њ–ї—М—И–Є–є –њ–Є–Ї —А–∞–Ј–≤–Є—В–Є—П –§–Я –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞ 2–3 —Б—Г—В. –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–µ –∞—А–Є—В–Љ–Є–Є –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М —Б–µ—А—М–µ–Ј–љ—Л–є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –і–ї—П –±–Њ–ї—М–љ–Њ–≥–Њ: –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞—О—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤—Л–Ј—Л–≤–∞—О—В –Є—И–µ–Љ–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞, —Б–љ–Є–ґ–∞—О—В —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞, –≤—Л–Ј—Л–≤–∞—П –Ј–∞—Б—В–Њ–є–љ—Г—О —Б–µ—А–і–µ—З–љ—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –љ–∞—Е–Њ–ґ–і–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –Є –≤—Л—П–≤–ї–µ–љ–Є—О –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞, –∞–≤—В–Њ—А–∞–Љ–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В–Є.
–Я–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ–Њ–≥–Њ (—Б—В–∞—А—И–µ 65 –ї–µ—В) —П–≤–ї—П–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –§–Я, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е –њ—А–µ–і—Б–µ—А–і–Є–є (—Н–љ–і–Њ–Ї–∞—А–і–µ, –Љ–Є–Њ–Ї–∞—А–і–µ –Є —Н–њ–Є–Ї–∞—А–і–µ) –њ—А–Њ–Є—Б—Е–Њ–і—П—В —Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї —Д—А–∞–≥–Љ–µ–љ—В–∞—Ж–Є–Є —Б–ї–Њ–µ–≤ —Н–љ–і–Њ–Ї–∞—А–і–∞, –∞—В—А–Њ—Д–Є–Є –Љ–Є–Њ—Ж–Є—В–Њ–≤ –њ—А–µ–і—Б–µ—А–і–Є—П, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–і–µ—А–ґ–Ї–µ –Є–ї–Є –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—О –≤–љ—Г—В—А–Є–њ—А–µ–і—Б–µ—А–і–љ–Њ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П, –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –∞–љ–Є–Ј–Њ—В—А–Њ–њ–Є–Є –Є –і–Є—Б–њ–µ—А—Б–Є–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є.
–Ґ–∞–Ї–ґ–µ –Њ —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–µ–і—Б–µ—А–і–Є–є –Љ–Њ–≥—Г—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Є —Г–≤–µ–ї–Є—З–µ–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –і–Є—Б–њ–µ—А—Б–Є–Є –†-–≤–Њ–ї–љ—Л (–і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М > 100 –Љ—Б, –і–Є—Б–њ–µ—А—Б–Є—П > 40 –Љ—Б), –Ї–Њ—В–Њ—А—Л–µ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –Љ–Њ–≥—Г—В –±—Л—В—М –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –§–Я –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–Њ–Ј—А–Њ—Б—И–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї—А—Г–≥–Њ–≤ re-entry.
–Я–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–µ—А–µ–і–љ–µ–Ј–∞–і–љ–µ–≥–Њ —А–∞–Ј–Љ–µ—А–∞ –ї–µ–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П (> 4,5 —Б–Љ –њ–Њ –і–∞–љ–љ—Л–Љ –і–Њ–њ–њ–ї–µ—А-–≠—Е–Њ–Ъ–У) —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –§–Я –њ–Њ—Б–ї–µ –Р–Ъ–®. –Ю–і–љ–∞–Ї–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —А–∞–Ј–Љ–µ—А–∞–Љ–Є –ї–µ–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П –Є —Б—В–µ–њ–µ–љ—М—О –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –§–Я –њ–Њ—Б–ї–µ –Р–Ъ–® –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ [6].
–£ –±–Њ–ї—М–љ—Л—Е, –Є–Љ–µ—О—Й–Є—Е –љ–Є–Ј–Ї—Г—О —Д—А–∞–Ї—Ж–Є—О –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–§–Т –Ы–Ц), –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Г—О –Љ–љ–Њ–≥–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞, –љ–∞–ї–Є—З–Є–µ–Љ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь), –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ —А–Њ–і–∞ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є—П–Љ–Є –Є –і—А—Г–≥–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Ї–∞–ґ–і—Л–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –Њ—Б–љ–Њ–≤–Њ–є –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Ж–Є–Ї–ї–Њ–≤ re-entry –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–µ, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –∞—А–Є—В–Љ–Є–є –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ–Њ—Б–ї–µ –њ—А—П–Љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞.
–Ф–ї–Є—В–µ–ї—М–љ–∞—П –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–∞—П –≤–µ–љ—В–Є–ї—П—Ж–Є—П –ї–µ–≥–Ї–Є—Е (–Ш–Т–Ы) –Љ–Њ–ґ–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е, –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–ї–Є –і—А—Г–≥–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П—Е, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –≥–Є–њ–Њ–Ї—Б–Є–µ–є, —З—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –§–Я –Ї–∞–Ї –њ–Њ—Б–ї–µ –Р–Ъ–® —Б –Ш–Ъ, —В–∞–Ї –Є –±–µ–Ј –Ш–Ъ.
–Ш–Ј –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Э–∞–њ—А–Є–Љ–µ—А, –≥–Є–њ–Њ–Љ–∞–≥–љ–Є–µ–Љ–Є—О –Є –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є—О, –Ї–Њ—В–Њ—А—Л–µ —З–∞—Б—В–Њ —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞. –Э–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Њ–љ–Њ–≤ –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –≤–ї–Є—П—О—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞: –Є–љ–Њ—В—А–Њ–њ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –і–Є—Г—А–µ—В–Є–Ї–Є, —Б–µ—А–і–µ—З–љ—Л–µ –≥–ї–Є–Ї–Њ–Ј–Є–і—Л, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є.
–Ч–љ–∞—З–Є–Љ–Њ—Б—В—М —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –µ–≥–Њ —Б–≤—П–Ј—М —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞—О—В—Б—П –Љ–љ–Њ–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є [9].
–Ю–і–љ–Є–Љ–Є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–∞—В–Є–Њ–љ–Њ–≤ –≤ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≤—Л–њ–Њ–ї–љ—П—О—Й–Є—Е –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞, —П–≤–ї—П—О—В—Б—П –Є–Њ–љ—Л –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П. –Ю–љ–Є –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –≤–∞–Ј–Њ–Љ–Њ—В–Њ—А–љ–Њ–≥–Њ —В–Њ–љ—Г—Б–∞, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Ш –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –і–µ—Д–Є—Ж–Є—В –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П –Љ–Њ–ґ–µ—В –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ –њ–Њ–≤–ї–Є—П—В—М –љ–∞ —А–∞–±–Њ—В—Г —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л.
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –§–Я, —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М β-–±–ї–Њ–Ї–∞—В–Њ—А—Л, –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –µ—Й–µ –Є –і–Є–≥–Њ–Ї—Б–Є–љ.
–Ш–Љ–µ—О—В—Б—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞, β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –Т —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –ї–µ—З–µ–љ–Є–µ —Б –њ–Њ–Љ–Њ—Й—М—О –љ–Њ–≤—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –Љ–∞–≥–љ–Є–є, —Б—В–∞—В–Є–љ—Л, –Њ–Љ–µ–≥–∞-3 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§, –≤—Б–µ –µ—Й–µ –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ—В—Б—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —А–Њ–ї—М –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ґ–∞–Ї, –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –±—Л–ї–Є —Б–≤—П–Ј–∞–љ—Л —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –Ш–С–°, —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞, –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ—О—В—Б—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —В–Њ–≥–Њ, —З—В–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Г—Е—Г–і—И–∞–µ—В —В–µ—З–µ–љ–Є–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ —Б–µ—А–і—Ж–µ, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –§–Я. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –±—Л–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ —Б–њ–Њ—Б–Њ–±—Л –Є —Б—Е–µ–Љ—Л –≤–≤–µ–і–µ–љ–Є—П –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П –і–ї—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –§–Я –Є –і—А—Г–≥–Є—Е –Э–†–° –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–Љ –њ–µ—А–Є–Њ–і–µ —Г –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е [10].
–Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —П–≤–ї—П—О—В—Б—П –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–Љ–Є.
–Э–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –њ—А–Є—З–Є–љ–∞ —Б—Г–њ—А–∞–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ–Њ–є –Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є. –Ю–љ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –§–Я –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–Љ –њ–µ—А–Є–Њ–і–µ —Г –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –Є–Ј—Г—З–∞–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ —Б—Г–ї—М—Д–∞—В–∞ –Љ–∞–≥–љ–Є—П –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –§–Я –њ–Њ—Б–ї–µ –Р–Ъ–® [11–14]. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М –Њ —А–µ–Ј–Ї–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є —З–∞—Б—В–Њ—В—Л –§–Я –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–∞–≥–љ–Є–є [11, 12], –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–Є–Ї–∞–Ї–Њ–є –њ–Њ–ї—М–Ј—Л –Њ—В –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П [13, 14].
A.A. Alghamdi –Є —Б–Њ–∞–≤—В. –Є–Ј –Ъ–∞–љ–∞–і—Б–Ї–Њ–≥–Њ –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –≤ –Ґ–Њ—А–Њ–љ—В–Њ (–Њ—В–і–µ–ї–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Е–Є—А—Г—А–≥–Є–Є) –њ—А–Њ–≤–µ–ї–Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј 8 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є (–†–Ъ–Ш), –≤ –Ї–Њ—В–Њ—А—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –≤–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–∞–≥–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Р–Ъ–®. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л —А–∞–Ј–≤–Є—В–Є—П –§–Я –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–∞–≥–љ–Є—П (–Ю–†: 0,64; 95% –Ф–Ш 0,47–0,87, —А=0,004) [15].
–Ъ–Є—В–∞–є—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є–Ј –Ш–љ—Б—В–Є—В—Г—В–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –У—Г–∞–љ—Б–Є W. J. Gu –Є —Б–Њ–∞–≤—В. –њ—А–Њ–≤–µ–ї–Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј 7 –і–≤–Њ–є–љ—Л—Е —Б–ї–µ–њ—Л—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –†–Ъ–Ш –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Љ–∞–≥–љ–Є—П –њ—А–Є –Њ–њ–µ—А–∞—Ж–Є—П—Е –Р–Ъ–® (—А–Є—Б. 1) [16].
–Ю–±—Й–µ–µ —З–Є—Б–ї–Њ –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї–Њ 1028 —З–µ–ї–Њ–≤–µ–Ї. –Ю–±–Њ–±—Й–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–∞–≥–љ–Є—П —Б–Њ–Ї—А–∞—Й–∞–ї–Њ —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–є –§–Я –њ–Њ—Б–ї–µ –Р–Ъ–® –љ–∞ 36% (–Ю–† 0,64; 95% –Ф–Ш 0,50–0,83; —А=0,001; –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М – —А=0,8, I2=0%; Trials. 2012. Apr. 20;13:41. doi: 10.1186/1745–6215–13–41).
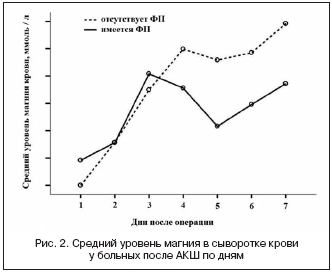
–°–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є —В–Ї–∞–љ—П—Е –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –§–Я –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Р–Ъ–® –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ –≤ –Ї–ї–Є–љ–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Е–Є—А—Г—А–≥–Є–Є Siyami Ersek (–°—В–∞–Љ–±—Г–ї, –Ґ—Г—А—Ж–Є—П) [17]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–Њ—Б—М –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Є –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ—Л–Љ. –Т –љ–µ–Љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–±–ї—О–і–µ–љ–Є—П 20 –±–Њ–ї—М–љ—Л—Е –Ш–С–°, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–ї–∞–љ–Њ–≤–Њ–µ –Р–Ъ–®. –Ю–±—А–∞–Ј—Ж—Л –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є–Ј –њ—А–∞–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П –Є —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –і–ї—П –∞–љ–∞–ї–Є–Ј–∞ —Г—А–Њ–≤–љ—П –Љ–∞–≥–љ–Є—П –і–Њ, –≤–Њ –≤—А–µ–Љ—П (–љ–∞ 60-–є –Љ–Є–љ.) –Є —З–µ—А–µ–Ј 30 –Љ–Є–љ. –њ–Њ—Б–ї–µ –Ш–Ъ. –Я—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –µ–ґ–µ–і–љ–µ–≤–љ–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –≤ –Ї—А–Њ–≤–Є —Г—А–Њ–≤–љ—П –Љ–∞–≥–љ–Є—П –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –љ–µ–њ—А–µ—А—Л–≤–љ—Л–Љ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≠–Ъ–У –њ–Њ –•–Њ–ї—В–µ—А—Г –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –§–Я –≤–Њ–Ј–љ–Є–Ї–ї–∞ —Г 5 –±–Њ–ї—М–љ—Л—Е –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ (25%). –Я–∞—Ж–Є–µ–љ—В—Л —Б –≤–Њ–Ј–љ–Є–Ї—И–µ–є –§–Я –Є –±–µ–Ј –§–Я –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –≤ –њ–ї–∞–љ–µ —Г—А–Њ–≤–љ—П –Љ–∞–≥–љ–Є—П –≤ –Ї—А–Њ–≤–Є –Є –Љ—Л—И–µ—З–љ—Л—Е —В–Ї–∞–љ—П—Е –≤–Њ –≤—А–µ–Љ—П –Р–Ъ–®, –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є –њ–Њ—Б–ї–µ –Р–Ъ–® –Є –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –£—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П –Ї—А–Њ–≤–Є –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ —Г –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –±–Њ–ї—М–љ—Л—Е —Б 3 –њ–Њ 7-–є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–µ –і–љ–Є (3-–є –і–µ–љ—М – 1,13±0,11 –Љ–Љ–Њ–ї—М/–ї; 4-–є –і–µ–љ—М – 1,18±0,07 –Љ–Љ–Њ–ї—М/–ї; 5-–є –і–µ–љ—М – 1,15±0,10 –Љ–Љ–Њ–ї—М/–ї; 6-–є –і–µ–љ—М – 1,17±0,08 –Љ–Љ–Њ–ї—М/–ї, –∞ –љ–∞ 7-–є –і–µ–љ—М – 1,22±0,08 –Љ–Љ–Њ–ї—М/–ї) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 1-–Љ –Є 2-–Љ –і–љ—П–Љ–Є (1-–є –і–µ–љ—М – 0,96±0,13 –Љ–Љ–Њ–ї—М/–ї –Є 2-–є –і–µ–љ—М – 1,02±0,12 –Љ–Љ–Њ–ї—М/–ї, —А=0,002 –і–ї—П –≤—Б–µ—Е —Б—А–∞–≤–љ–µ–љ–Є–є) (—А–Є—Б. 2).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Е–Њ—В—П –њ–∞—Ж–Є–µ–љ—В—Л —Б –≤–Њ–Ј–љ–Є–Ї—И–µ–є –§–Я –Є –±–µ–Ј –љ–µ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–Њ–≤–њ–∞–і–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –Њ—В–ї–Є—З–Є–µ–Љ —Г—А–Њ–≤–љ—П –Љ–∞–≥–љ–Є—П –Ї—А–Њ–≤–Є –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ (–њ–µ—А–≤—Л–µ 2 –і–љ—П) –Є –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–µ –і–љ–Є, –Є–Љ–µ—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —Б–≤—П–Ј–Є —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ –≤ —Н—В–Њ—В –њ–µ—А–Є–Њ–і –Є —В—А–µ–±—Г—О—В –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Т –ґ—Г—А–љ–∞–ї–µ Circulation –≤ —П–љ–≤–∞—А–µ 2013 –≥. –±—Л–ї–∞ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–∞ —Б—В–∞—В—М—П, –≤ –Ї–Њ—В–Њ—А–Њ–є –∞–≤—В–Њ—А—Л –Є–Ј –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –Я–µ–љ—Б–Є–ї—М–≤–∞–љ–Є–Є (–°–®–Р) –њ—А–Є–≤–Њ–і—П—В –і–∞–љ–љ—Л–µ –Є–Ј Framingham Offspring [18]. –Ю–љ–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є, —П–≤–ї—П–µ—В—Б—П –ї–Є –≥–Є–њ–Њ–Љ–∞–≥–љ–Є–µ–Љ–Є—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –§–Я –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є. –С—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л 3530 —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 44 –≥–Њ–і–∞, 52% –ґ–µ–љ—Й–Є–љ, 48% –Љ—Г–ґ—З–Є–љ) –Є–Ј –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –Є–Љ–µ–ї–Є –љ–Є–Ї–∞–Ї–Є—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –§–Я. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –±—Л–ї–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ –Љ–Њ–і–µ–ї—М —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ъ–Њ–Ї—Б–∞ –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –§–Я. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –±—Л–ї–Є –Њ—Ж–µ–љ–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л 20-–ї–µ—В–љ–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т –Є—В–Њ–≥–µ: —Г 228 —З–µ–ї–Њ–≤–µ–Ї –≤–Њ–Ј–љ–Є–Ї–ї–∞ –§–Я. –£—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї 1,88 (1,77; 1,99) –Љ–≥/–і–ї Me (25%; 75%). –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–љ–Њ–≥–Њ–Љ–µ—А–љ–Њ–є –Љ–Њ–і–µ–ї–Є —Б –њ–Њ–њ—А–∞–≤–Ї–∞–Љ–Є –ї–Є—Ж–∞, –Є–Љ–µ—О—Й–Є–µ —Г—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П –≤ –љ–Є–ґ–љ–µ–Љ –Ї–≤–∞—А—В–Є–ї–µ, –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –±–Њ–ї–µ–µ —Б–Ї–ї–Њ–љ–љ—Л –Ї —А–∞–Ј–≤–Є—В–Є—О –§–Я (—Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ю–† 1,52; 95% –Ф–Ш 1,00–2,31, —А=0,05) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є, —З–µ–є —Г—А–Њ–≤–µ–љ—М –љ–∞—Е–Њ–і–Є–ї—Б—П –≤ –≤–µ—А—Е–љ–µ–Љ –Ї–≤–∞—А—В–Є–ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –†–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є –њ–Њ—Б–ї–µ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –ї–Є—Ж, –њ—А–Є–Љ–µ–љ—П—О—Й–Є—Е –і–Є—Г—А–µ—В–Є–Ї–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П –±—Л–ї —Г–Љ–µ—А–µ–љ–љ–Њ —Б–≤—П–Ј–∞–љ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –§–Я —Г –ї–Є—Ж –±–µ–Ј —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Р–і–і–Є—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–∞–≥–љ–Є—П —В–∞–Ї–ґ–µ –±—Л–ї –Є–Ј—Г—З–µ–љ –Є –Њ–њ–Є—Б–∞–љ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е.
A.J. Solomon –Є —Б–Њ–∞–≤—В. –Є–Ј –Ф–ґ–Њ—А–і–ґ—В–∞—Г–љ—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ (–°–®–Р) –≤ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 167 —И—Г–љ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –±–Њ–ї—М–љ—Л—Е (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 61±10 –ї–µ—В) –Є–Ј—Г—З–∞–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –∞–і–і–Є—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Љ–∞–≥–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Р–Ъ–® [19]. –Ю–і–љ–∞ –≥—А—Г–њ–њ–∞ –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–∞ –њ–Њ 20 –Љ–≥ –њ—А–Њ–њ—А–∞–љ–Њ–ї–Њ–ї–∞ 4 —А–∞–Ј–∞/—Б—Г—В. –Ф—А—Г–≥–∞—П –≥—А—Г–њ–њ–∞ – –њ—А–Њ–њ—А–∞–љ–Њ–ї–Њ–ї –≤ —В–∞–Ї–Њ–є –ґ–µ –і–Њ–Ј–µ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–∞–≥–љ–Є–µ–Љ (18 –≥ –≤ —В–µ—З–µ–љ–Є–µ 24 —З). –Ь–∞–≥–љ–Є–є –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ –≤–Њ –≤—А–µ–Љ—П –Њ–њ–µ—А–∞—Ж–Є–Є, –∞ –њ—А–Њ–њ—А–∞–љ–Њ–ї–Њ–ї – –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ –≤—Л—П–≤–Є–ї–Є –Њ—В–ї–Є—З–Є—П –≤ –≥—А—Г–њ–њ–∞—Е –љ–∞–±–ї—О–і–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П –њ—А–Њ–њ—А–∞–љ–Њ–ї–Њ–ї–Њ–Љ –Є –њ—А–Њ–њ—А–∞–љ–Њ–ї–Њ–ї–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–∞–≥–љ–Є–µ–Љ (19,5% –њ—А–Њ—В–Є–≤ 22,4%, —А=0,65).
A. Sultan –Є —Б–Њ–∞–≤—В. –Є–Ј –У–∞–Љ–±—Г—А–≥—Б–Ї–Њ–є —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В—Б–Ї–Њ–є –Ї–ї–Є–љ–Є–Ї–Є (–У–µ—А–Љ–∞–љ–Є—П) –Є–Ј—Г—З–Є–ї–Є –≤–ї–Є—П–љ–Є–µ –≤–≤–µ–і–µ–љ–Є—П –Ї–∞–ї–Є—П –Є –Љ–∞–≥–љ–Є—П –љ–∞ —Г—Б–њ–µ—Е –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –њ—А–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –§–Я [20]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М 170 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –§–Я. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –і–≤–µ –≥—А—Г–њ–њ—Л: –њ–µ—А–≤–∞—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–∞–ї–Є—П –Є –Љ–∞–≥–љ–Є—П (n=84), –≤—В–Њ—А–∞—П – –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Ј—Г—З–∞–µ–Љ—Л—Е –Є–Њ–љ–Њ–≤ (n=86). –≠–љ–µ—А–≥–Є—П step-up –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞: 75, 100 –Є 150 –Ф–ґ (J). –Ъ–∞—А–і–Є–Њ–≤–µ—А—Б–Є—П –њ—А–Є –§–Я –±—Л–ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —Г 81 (9,4%) –±–Њ–ї—М–љ–Њ–≥–Њ –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є —Г 74 (86,0%) –±–Њ–ї—М–љ—Л—Е – –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (—А=0,005). –≠—Д—Д–µ–Ї—В–Є–≤–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Н–љ–µ—А–≥–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞, –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П (140,8±26,9 –Ф–ґ (J) –њ—А–Њ—В–Є–≤ 182,5±52,2 –Ф–ґ (J), —А=0,02). –Я–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є–ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—В–∞–Ї–Є—Е, –Ї–∞–Ї –≥–Є–њ–Њ—В–µ–љ–Ј–Є—П, –±—А–∞–і–Є–Ї–∞—А–і–Є—П), —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≥–Њ–≤–Њ—А—П—В –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П –љ–∞ —Г—Б–њ–µ—И–љ–Њ—Б—В—М –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –§–Я. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ —В—А–µ–±—Г–µ—В—Б—П —Н–љ–µ—А–≥–Є–Є –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є, —З—В–Њ–±—Л —Г—Б–њ–µ—И–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ.
–Ґ–∞–Ї–ґ–µ –≤–ї–Є—П–љ–Є–µ –Љ–∞–≥–љ–Є—П –љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є—О –Є–±—Г—В–Є–ї–Є–і–Њ–Љ –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Њ –∞—Д–Є–љ—Б–Ї–Є–Љ–Є —Г—З–µ–љ—Л–Љ–Є (–У—А–µ—Ж–Є—П) S. Patsilinakos –Є —Б–Њ–∞–≤—В. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Њ, –Љ–Њ–≥—Г—В –ї–Є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Љ–∞–≥–љ–Є—П –њ–Њ–≤—Л—Б–Є—В—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П –Є–±—Г—В–Є–ї–Є–і–∞ –і–ї—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є [21]. –Р–≤—В–Њ—А–∞–Љ–Є –Є–Ј—Г—З–µ–љ—Л 476 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Д–Є–±—А–Є–ї–ї—П—Ж–Є–µ–є –Є/–Є–ї–Є —В—А–µ–њ–µ—В–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞. –С–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л. –Я–µ—А–≤–∞—П –≥—А—Г–њ–њ–∞ (–≥—А—Г–њ–њ–∞ –Р) —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 229 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є —В–Њ–ї—М–Ї–Њ –Є–±—Г—В–Є–ї–Є–і –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞. –Т—В–Њ—А–∞—П –≥—А—Г–њ–њ–∞ (–≥—А—Г–њ–њ–∞ –Т) – –Є–Ј 247 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–µ –Є–љ—Д—Г–Ј–Є–Є 5 –≥ —Б—Г–ї—М—Д–∞—В–∞ –Љ–∞–≥–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 1 —З —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –Є–±—Г—В–Є–ї–Є–і–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–Њ–ї—М–љ—Л–Љ –≥—А—Г–њ–њ—Л –Т –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–µ 2 —З –≤–≤–Њ–і–Є–ї—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Б—Г–ї—М—Д–∞—В –Љ–∞–≥–љ–Є—П –≤ –і–Њ–Ј–µ 5 –≥. –≠—Д—Д–µ–Ї—В–Є–≤–љ–∞—П –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є—П —Г –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–∞—Е –Р –Є –Т –±—Л–ї–∞ –њ–Њ–ї—Г—З–µ–љ–∞ —Г 154 (67,3%) –Є 189 (76,5%) –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А=0,033). –Э–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –њ–Њ —В–Є–њ—Г –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –∞—А–Є—В–Љ–Є–є (—Г—Б—В–Њ–є—З–Є–≤–∞—П, –љ–µ—Г—Б—В–Њ–є—З–Є–≤–∞—П –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–∞—П —В–∞—Е–Є–Ї–∞—А–і–Є—П) –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –≤ –≥—А—Г–њ–њ–µ –Р, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –Т (7,4% –њ—А–Њ—В–Є–≤ 1,2% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —А=0,002). –†–µ—Ж–Є–і–Є–≤ –§–Я —А–∞–Ј–≤–Є–ї—Б—П —Г 8 (3,5%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Р –Є –љ–Є –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ (0%) –≤ –≥—А—Г–њ–њ–µ –Т (—А=0,009). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–∞–≥–љ–Є—П (–љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј) –љ–µ –≤—Л–Ј—Л–≤–∞–ї–Њ –љ–Є–Ї–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Я–Њ—Е–Њ–ґ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–µ–ї–Є –≤ –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–µ –Ъ–Њ–љ–љ–µ–Ї—В–Є–Ї—Г—В–∞ (–°–®–Р) –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є C.I. Coleman –Є —Б–Њ–∞–≤—В. [22]. –Ю—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б—Г–ї—М—Д–∞—В–∞ –Љ–∞–≥–љ–Є—П —Б –Є–±—Г—В–Є–ї–Є–і–Њ–Љ –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є—В—М —И–∞–љ—Б—Л –њ–∞—Ж–Є–µ–љ—В–∞ –≤ —Г—Б–њ–µ—И–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –њ—А–Є –§–Я –Є/–Є–ї–Є –Ґ–Я, –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є–Ј—Г—З–Є–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –∞–і–і–Є—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–∞–≥–љ–Є—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –µ–≥–Њ —Б –і–Њ—Д–µ—В–Є–ї–Є–і–Њ–Љ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–Њ—Б–Є–ї–Њ —Е–∞—А–∞–Ї—В–µ—А —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –Ї–Њ–≥–Њ—А—В—Л –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Љ–µ–ї–∞—Б—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –і–Њ—Д–µ—В–Є–ї–Є–і–Њ–Љ –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞. –Т—Б–µ –±–Њ–ї—М–љ—Л–µ —Б –§–Я –Є/–Є–ї–Є –Ґ–Я –њ–Њ–ї—Г—З–∞–ї–Є –і–Њ—Д–µ—В–Є–ї–Є–і –њ–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ—Г –њ—А–Њ—В–Њ–Ї–Њ–ї—Г. –Ю–љ–Є –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –≤ —В–µ—З–µ–љ–Є–µ –Љ–Є–љ–Є–Љ—Г–Љ 3 –і–љ–µ–є –Є –њ–Њ–ї—Г—З–∞–ї–Є 6 –і–Њ–Ј –і–Њ—Д–µ—В–Є–ї–Є–і–∞. –І–∞—Б—В—М –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Љ–∞–≥–љ–Є–є, —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≥—А—Г–њ–њ—Г –ї–µ—З–µ–љ–Є—П. –С–Њ–ї—М–љ—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–µ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ –≠–Ъ–У –њ–Њ –•–Њ–ї—В–µ—А—Г –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є. –Ф–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—Ж–µ–љ–Ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ–µ—В–Њ–і—Л –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –С—Л–ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Њ 160 –±–Њ–ї—М–љ—Л—Е —Б –§–Я –Є/–Є–ї–Є –Ґ–Я (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 66,6±11,0 –ї–µ—В, 70% –Љ—Г–ґ—З–Є–љ, 30% –ґ–µ–љ—Й–Є–љ). –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –§–Я –Є/–Є–ї–Є –Ґ–Я –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –±–Њ–ї–µ–µ 15 –і–љ–µ–є. –Ш–Ј —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є: —Г 54,4% –±–Њ–ї—М–љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П, —Г 37,5% – —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Г 16,3% –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ –њ–Њ—А–Њ–Ї–Є —Б–µ—А–і—Ж–∞, —Г 16,3% –±—Л–ї –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞. –Ш—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Љ–∞–≥–љ–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Б–Њ—Б—В–∞–≤–Є–ї 2,1±0,26 –Љ–≥/–і–ї, –њ–Њ–ї—Г—З–µ–љ–љ–∞—П —Б—А–µ–і–љ—П—П –і–Њ–Ј–∞ –і–Њ—Д–µ—В–Є–ї–Є–і–∞ – 428±118 –Љ–Ї–≥. –Ю–±—Й–∞—П –і–Њ–ї—П —Г—Б–њ–µ—И–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –і–Њ—Д–µ—В–Є–ї–Є–і–Њ–Љ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–∞–≥–љ–Є—П, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 41,9%. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–∞–≥–љ–Є—П (n=50) –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —Г—Б–њ–µ—И–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є –љ–∞ 107% (–Ю–® 2,07; 95%, –Ф–Ш 1,00–4,33) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є –±–Њ–ї—М–љ—Л–Љ–Є, –Ї—В–Њ –љ–µ –њ–Њ–ї—Г—З–∞–ї –Љ–∞–≥–љ–Є–є (n=110). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–∞–≥–љ–Є—П –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –і–Њ—Д–µ—В–Є–ї–Є–і–∞ —Г—Б–њ–µ—И–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є—О –њ—А–Є –§–Я –Є –Ґ–Я.
–Ъ–∞–љ–∞–і—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є–Ј –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –Ь–∞–Ї–Ь–∞—Б—В–µ—А K.A. Arsenault –Є —Б–Њ–∞–≤—В. –Њ—Ж–µ–љ–Є–ї–Є –≤–ї–Є—П–љ–Є–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –љ–µ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –§–Я –Є –Э–Ц–Ґ –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ —Б–µ—А–і—Ж–µ [23]. –Т—В–Њ—А–Є—З–љ—Л–µ —Ж–µ–ї–Є – –Њ–њ—А–µ–і–µ–ї–Є—В—М –≤–ї–Є—П–љ–Є–µ —Н—В–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Є–љ—Б—Г–ї—М—В, –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Є —Б—В–Њ–Є–Љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –≤–Њ –≤—А–µ–Љ—П –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ). –Р–≤—В–Њ—А–∞–Љ–Є –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ –±–∞–Ј–µ –і–∞–љ–љ—Л—Е –Ъ–Њ–Ї—А–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ —А–µ–≥–Є—Б—В—А–∞ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (CENTRAL) (–≤—Л–њ—Г—Б–Ї 8, 2011 –≥.), MEDLINE (—Б 1946 –≥. –њ–Њ –Є—О–ї—М 2011 –≥.), EMBASE (—Б 1974 –≥. –њ–Њ –Є—О–ї—М 2011 –≥.) –Є CINAHL (—Б 1981 –≥. –њ–Њ –Є—О–ї—М 2011 –≥.). –С—Л–ї–Є –Њ—В–Њ–±—А–∞–љ—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–†–Ъ–Ш), –≤–Ї–ї—О—З–∞—О—Й–Є–µ –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Њ–њ–µ—А–∞—Ж–Є—О –љ–∞ —Б–µ—А–і—Ж–µ, –Ї –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ—Л —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є –љ–µ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –§–Я –Є –Э–Ц–Ґ. 118 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б 138 –≥—А—Г–њ–њ–∞–Љ–Є –Є 17 364 –±–Њ–ї—М–љ—Л–Љ–Є –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –≤ –і–∞–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј. 57 –Є–Ј —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –≤ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є –≤–∞—А–Є–∞–љ—В –і–∞–љ–љ–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞, –∞ 61 –і–Њ–±–∞–≤–ї–µ–љ—Л, 27 –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –љ–µ –±—Л–ї–Є —А–∞—Б—Б–Љ–Њ—В—А–µ–љ—Л –≤ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–є –≤–µ—А—Б–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј—Г—З–∞–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞, β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, —Б–Њ—В–∞–ї–Њ–ї–∞, –Љ–∞–≥–љ–Є—П, —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –Є –Ј–∞–і–љ–µ–є –њ–µ—А–Є–Ї–∞—А–і–Є–Њ—В–Њ–Љ–Є–Є. –С—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ї–∞–ґ–і–Њ–µ –Є–Ј –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ. β-–±–ї–Њ–Ї–∞—В–Њ—А—Л (–Ю–® 0,33; 95% –Ф–Ш –Њ—В 0,26 –і–Њ 0,43; I (2)=55%) –Є —Б–Њ—В–∞–ї–Њ–ї (–Ю–® 0,34; 95% –Ф–Ш –Њ—В 0,26 –і–Њ 0,43; I (2)=3%) –Є–Љ–µ–ї–Є —Б—Е–Њ–і–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–∞–≥–љ–Є—П (–Ю–® 0,55; 95% –Ф–Ш –Њ—В 0,41 –і–Њ 0,73; I (2)=51%) –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ (–Ю–® 0,43; 95% –Ф–Ш –Њ—В 0,34 –і–Њ 0,54; I (2)=63%), —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є (–Ю–® 0,47; 95% –Ф–Ш –Њ—В 0,36 –і–Њ 0,61; I (2)=50%) –Є –Ј–∞–і–љ—П—П –њ–µ—А–Є–Ї–∞—А–і–Є–Њ—В–Њ–Љ–Є—П (–Ю–® 0,35; 95 % –Ф–Ш –Њ—В 0,18 –і–Њ 0,67; I (2)=66%) —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Є–Ј–љ–∞–љ—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Н—В–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ —Б–љ–Є–Ј–Є–ї–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ –і–≤–µ —В—А–µ—В–Є –≤ –і–µ–љ—М. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞—В—А–∞—В—Л –љ–∞ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —Б–љ–Є–Ј–Є–ї–Є—Б—М –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 1250 $ –°–®–Р. –Ш—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П —В–∞–Ї–ґ–µ —Б–љ–Є–Ј–Є–ї–Є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Є–љ—Б—Г–ї—М—В–Њ–≤, —Е–Њ—В—П —Н—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –љ–µ –і–Њ—Б—В–Є–≥–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є (–Ю–† 0,69; 95% –Ф–Ш –Њ—В 0,47 –і–Њ 1,01; I (2)=0%).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–∞–≥–љ–Є—П –Є –Ї–∞–ї–Є—П —Г –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ—В—Б—П –Љ–љ–Њ–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –±–Њ–ї—М–љ–Њ–≥–Њ (–≥–Є–њ–Њ–Љ–∞–≥–љ–Є–µ–Љ–Є—П –Є –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є—П). –Т–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ, –њ–Њ—Н—В–Њ–Љ—Г —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В—Л. –Ю–і–љ–Є–Љ –Є–Ј —В–∞–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Я–∞–љ–∞–љ–≥–Є–љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Ї–Њ–Љ–њ–∞–љ–Є–Є «–У–µ–і–µ–Њ–љ –†–Є—Е—В–µ—А», —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –≤—Л–њ—Г—Б–Ї–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–∞–Љ. –Ъ–∞–Ї —Г–Ї–∞–Ј—Л–≤–∞–ї–Њ—Б—М –≤—Л—И–µ, –≥–Є–њ–Њ–Љ–∞–≥–љ–Є–µ–Љ–Є—П –Є –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є–≥—А–∞—О—В —В—А–Є–≥–≥–µ—А–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –°–Њ—З–µ—В–∞–љ–Є–µ –Є–Њ–љ–Њ–≤ –Ї–∞–ї–Є—П –Є –Љ–∞–≥–љ–Є—П –≤ –Њ–і–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ (–Я–∞–љ–∞–љ–≥–Є–љ) –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Њ —В–µ–Љ, —З—В–Њ –і–µ—Д–Є—Ж–Є—В –Ї–∞–ї–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Є–ї–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Љ–∞–≥–љ–Є—П –Є —В—А–µ–±—Г–µ—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ–±–Њ–Є—Е –Ї–∞—В–Є–Њ–љ–Њ–≤. –Э–∞–ї–Є—З–Є–µ –≤ –Я–∞–љ–∞–љ–≥–Є–љ–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –∞—Б–њ–∞—А–∞–≥–Є–љ–∞—В–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–Љ—Г –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г –≤—Е–Њ–ґ–і–µ–љ–Є—О –Ї–∞–ї–Є—П –Є –Љ–∞–≥–љ–Є—П –≤ –Љ–Є–Њ—Ж–Є—В—Л, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ [24].
–Ю—З–µ–љ—М –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –љ–∞–ї–Є—З–Є–µ –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ—Л –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є –≤ 10 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞ 400 –Љ–≥ –Љ–∞–≥–љ–Є—П –∞—Б–њ–∞—А–∞–≥–Є–љ–∞—В–∞ (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В 33,7 –Љ–≥ –Љ–∞–≥–љ–Є—П) –Є 452 –Љ–≥ –Ї–∞–ї–Є—П –∞—Б–њ–∞—А–∞–≥–Є–љ–∞—В–∞ (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В 103,3 –Љ–≥ –Ї–∞–ї–Є—П).
![–†–Є—Б. 1. –†–Ъ–Ш, –≤–Ї–ї—О—З–µ–љ–љ—Л–µ –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј [16]. –Я—А–Є–Љ–µ—З–∞–љ–Є–µ: RR вАУ –Њ—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ (–Ю–†)](/data/articles/Image/t21/n12/617-1.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –У—Г–±–∞—А–µ–≤–Є—З –Ш.–У., –Ю—Б—В—А–Њ–≤—Б–Ї–Є–є –Ѓ.–Я. –†–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–∞–љ—Б–Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –ї–∞–Ј–µ—А–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є (–Њ–њ—Л—В 86 –Њ–њ–µ—А–∞—Ж–Є–є) // –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—П –≤ –С–µ–ї–∞—А—Г—Б–Є. 2011. вДЦ 6.–°. 36–41.
2. –С–∞–Ј—Л–ї–µ–≤ –Т.–Т., –С–µ–ї–Њ–≤ –Ѓ.–Т. –Р–љ–∞–ї–Є–Ј –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Р–Ъ–® —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤–љ—Г—В—А–µ–љ–љ–µ–є –≥—А—Г–і–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є –њ–Њ–ї—Л–Љ –∞—Г—В–Њ–≤–µ–љ–Њ–Ј–љ—Л–Љ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ // –С—О–ї–ї–µ—В–µ–љ—М –Т–Њ—Б—В–Њ—З–љ–Њ-–°–Є–±–Є—А—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –°–Ю –†–Р–Ь–Э. 2005. вДЦ 3. –°. 78–79.
3. –С–Њ–Ї–µ—А–Є—П –Ы.–Р., –Э–Є–Ї–Њ–љ–Њ–≤ –°.–§., –С–µ–љ–і–µ–ї–Є–∞–љ–Є –Э.–У. –Є –і—А. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –≤–ї–Є—П–љ–Є–µ –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –ї–µ—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ –њ–Њ—Б–ї–µ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П –Є –µ–≥–Њ —Б–Њ—З–µ—В–∞–љ–Є—П —Б –≥–µ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—П—Е (—А–µ–Ј—Г–ї—М—В–∞—В—Л 12-–Љ–µ—Б—П—З–љ–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) // –Р–љ–љ–∞–ї—Л –∞—А–Є—В–Љ–Њ–ї–Њ–≥–Є–Є. 2011. вДЦ 8(4). –°. 43–53.
4. –С—Л—Б—В—А–Њ–≤ –Ф.–Ю., –®–Њ–љ–±–Є–љ –Р.–Э., –Ч–∞–≤–Њ–ї–Њ–ґ–Є–љ –Р.–°., –Я–∞—А–Њ–Љ–Њ–≤ –Ъ.–Т. –Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ш–С–° —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ // –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ (—Н–ї–µ–Ї—В—А–Њ–љ–љ—Л–є –љ–∞—Г—З–љ—Л–є –ґ—Г—А–љ–∞–ї). 2011. вДЦ 8(4). –°. 98.
5. –Я—А–Є–±—Л–ї–Њ–≤–∞ –Э.–Э., –Ю—Б–Є–њ–Њ–≤–∞ –Ю.–Р., –Т–ї–∞—Б–µ–љ–Ї–Њ –Ь.–Р. –Є –і—А. –Т–ї–Є—П–љ–Є–µ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –љ–∞ —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–µ—А–і—Ж–∞ –Є –і–Є—Б—Б–Є–љ—Е—А–Њ–љ–Є–Ј–∞—Ж–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–Є –•–°–Э // –°–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М. 2011. вДЦ 12(3). –°. 154–159.
6. –С–Њ–Ї–µ—А–Є—П –Ы.–Р., –У–Њ–ї—Г—Е–Њ–≤–∞ –Х.–Ч., –Р–ї—И–Є–±–∞—П –Ь.–Ф. –Є –і—А. –Я—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ —А–∞–Ј–≤–Є—В–Є—П —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є –∞–Њ—А—В–Њ–Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П // –Р–љ–љ–∞–ї—Л –∞—А–Є—В–Љ–Њ–ї–Њ–≥–Є–Є. 2004. вДЦ 1(1). –°. 77–86.
7. –Ь–µ–ї–Є–Ї—Г–ї–Њ–≤ –Р.–•., –Ь–∞–≥–ї–∞–Ї–µ–ї–Є–і–Ј–µ –Ф.–Р. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Є —Б—В—А–∞—В–µ–≥–Є–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –Њ—В–Ї—А—Л—В–Њ–Љ —Б–µ—А–і—Ж–µ // –Р–љ–љ–∞–ї—Л –∞—А–Є—В–Љ–Њ–ї–Њ–≥–Є–Є. 2012. вДЦ 9(1). –°. 13–19.
8. –§–Є–ї–∞—В–Њ–≤ –Р.–У., –Ґ–∞—А–∞—И–≤–Є–ї–Є –≠.–У. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –Є —Б–Њ—Ж–Є–∞–ї—М–љ–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є // –Р–љ–љ–∞–ї—Л –∞—А–Є—В–Љ–Њ–ї–Њ–≥–Є–Є. 2012. вДЦ 9(2). –°. 5–13.
9. Sun K., Lu J., Jiang Y. et al. Low serum potassium level is associated with nonalcoholic fatty liver disease and its related metabolic disorders // Clin. Endocrinol. (Oxf). 2013. Feb. 13. doi: 10.1111/cen.12168.
10. Haghjoo M. Pharmacological and nonpharmacological prevention of atrial fibrillation after coronary artery bypass surgery // J. Tehran. Heart Cent. 2012. Vol. 7(1). P. 2–9.
11. Fanning W.J., Thomas C.S. Jr, Roach A. et al. Prophylaxis of atrial fibrillation with magnesium sulfate after coronary artery bypass grafting // Ann. Thorac. Surg. 1991. Vol. 52. P. 529–533.
12. Nurozler F., Tokgozoglu L., Pasaoglu I. et al. Atrial fibrillation after coronary artery bypass surgery: predictors and the role of MgSO4 replacement // J. Card. Surg. 1996. Vol. 11. P. 421–427.
13. Parikka H., Toivonen L., Pellinen T. et al. The influence of intravenous magnesium sulphate on the occurrence of atrial fibrillation after coronary artery by-pass operation // Eur. Heart J. 1993. Vol. 14. P. 251–258.
14. Kaplan M., Kut M.S., Icer U.A., Demirtas M.M. Intravenous magnesium sulfate prophylaxis for atrial fibrillation after coronary artery bypass surgery // J. Thorac. Cardiovasc. Surg. 2003. Vol. 125. P. 344–352.
15. Alghamdi A.A., Al-Radi O.O., Latter D.A. Intravenous magnesium for prevention of atrial fibrillation after coronary artery bypass surgery: a systematic review and meta-analysis // J. Card. Surg. 2005. Vol. 20. P. 293–299.
16. Gu W.J., Wu Z.J., Wang P.F. et al. Intravenous magnesium prevents atrial fibrillation after coronary artery bypass grafting: a meta-analysis of 7 double-blind, placebo-controlled, randomized clinical trials // Trials. 2012. Vol. 13. P. 41.
17. Sahin V., Kaplan M., Bilsel S., et al. The relation between blood and tissue magnesium levels and development of atrial fibrillation after coronary artery bypass surgery // Anadolu Kardiyol. Derg. 2010. Vol. 10(5). P. 446–451.
18. Khan A.M., Lubitz S.A., Sullivan L.M. et al. Low serum magnesium and the development of atrial fibrillation in the community: the Framingham Heart Stud // Circulation. 2013. Vol. 127(1). P. 33–38.
19. Solomon A.J., Berger A.K., Trivedi K.K. et al. The combination of propranolol and magnesium does not prevent postoperative atrial fibrillation // Ann. Thorac. Surg. 2000. Vol. 69(1). P. 126–129.
20. Sultan A., Steven D., Rostock T. et al. Intravenous administration of magnesium and potassium solution lowers energy levels and increases success rates electrically cardioverting atrial fibrillation // J. Cardiovasc. Electrophysiol. 2012. Vol. 23(1). P. 54–59.
21. Patsilinakos S., Christou A., Kafkas N. et al. Effect of high doses of magnesium on converting ibutilide to a safe and more effective agent // Am. J. Cardiol. 2010. Vol. 106(5). P. 673–676.
22. Coleman C.I., Sood N., Chawla D. et al. Intravenous magnesium sulfate enhances the ability of dofetilide to successfully cardiovert atrial fibrillation or flutter: results of the Dofetilide and Intravenous Magnesium Evaluation // Europace. 2009. Vol. 11(7). P. 892–895.
23. Arsenault K.A., Yusuf A.M., Crystal E. et al. Interventions for preventing post-operative atrial fibrillation in patients undergoing heart surgery // Cochrane Database Syst. Rev. 2013. Vol. 1: CD003611.
24. –®–Є–ї–Њ–≤ –Р.–Ь., –Ь–µ–ї—М–љ–Є–Ї –Ь.–Т., –Ю—Б–Є—П –Р.–Ю., –Ъ–љ—П–Ј–µ–≤–∞ –°.–Р. –Ы–µ—З–µ–љ–Є–µ –°–°–Ч –≤ –њ—А–∞–Ї—В–Є–Ї–µ –≤—А–∞—З–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П: –Љ–µ—Б—В–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї–Є—П –Є –Љ–∞–≥–љ–Є—П (–Я–∞–љ–∞–љ–≥–Є–љ) // –†–Ь–Ц. 2012. –Ґ. 20(3). –°. 102–106.












