Введение
Сердечная недостаточность (СН) — одна из самых частых причин смерти и госпитализаций в развитых странах. По эпидемиологическим данным, опубликованным в 2007 г., распространенность СН в западном мире составляет 1–2%, а заболеваемость приближается к 5–10 случаям на 1000 человек в год [1]. Распространенность СН увеличивается с возрастом с <1% среди лиц моложе 55 лет до 10% среди 80-летних [1]. В РФ хроническая СН (ХСН) также в числе основных нозологий в структуре сердечно-сосудистых заболеваний (ССЗ). Одной из основных причин развития ХСН до сих пор остается острый инфаркт миокарда (ОИМ) в момент ее манифестации или в анамнезе (постинфарктный кардиосклероз, ПИКС). Доля таких больных в 2016 г. составляла 15,3% [2], тогда как в 1998 г. — только 9,8%, т. е. весомость ОИМ как этиологического фактора ХСН увеличивается. Рост числа таких больных происходит за счет большей выживаемости больных с острым коронарным синдромом (ОКС). Несмотря на постоянное усовершенствование методов лечения ОКС, позволяющих добиться своевременной реваскуляризации миокарда [3], дисфункция левого желудочка (ЛЖ) и острая СН (ОСН) при ОИМ развиваются все еще достаточно часто. По данным ретроспективного анализа, частота развития ОСН — более 30% на момент госпитализации, еще у 5–8% больных ОИМ ОСН развивается во время госпитального периода [4]. Эти данные подтверждены в таких больших регистрах, как ADHERE, EURO HART survey, NRMI [5].
Ремоделирование сердца после ОИМ: особенности и механизмы
Процесс постинфарктного ремоделирования сердца, включающий дилатацию его полостей, изменение геометрии и нарушение сократимости ЛЖ, начинается с первых часов ОИМ и завершается к 2–6-му мес. заболевания. Ремоделирование сердца определяется как общий процесс адаптации, который позволяет кардиомиоцитам и коллагеновой сети приспосабливаться к работе в изменившихся условиях. Ремоделирование вследствие ОИМ имеет ряд особенностей. Например, оно асимметрично и связано с локализацией зоны некроза [6]. В литературе подробно освещены механизмы ремоделирования ЛЖ после ОИМ без восстановления реперфузии [7]. Однако ремоделирование происходит и у больных с ОИМ и успешной реперфузией миокарда. Раннее возобновление перфузии участка миокарда, подвергшегося острой ишемии, ограничивает размеры зоны гибели кардиомиоцитов, снижая тем самым вероятность как летального исхода, так и развития ОСН [8]. Но все же в силу изначальной потери кардиомиоцитов и, как следствие, снижения сократительной функции сердца все основные этапы ремоделирования сохраняются. Патофизиологической основой данного процесса, по современным представлениям, является активация нейрогуморальных механизмов. В ответ на развитие острой ишемии растут уровни норадреналина, цитокинов, эндотелина, вазопрессина, ангиотензина II (AT II) и альдостерона. Увеличение синтеза альдостерона реализуется посредством активации рецепторов к AT II 1 типа, роста кардиального уровня АТ II и активности альдостерон-синтазы мРНК [9]. Высокие уровни альдостерона в плазме и моче у больных ОИМ определяются уже в первые часы и достигают максимума к 3-му дню заболевания. У 58% пациентов уровень альдостерона остается высоким и в отдаленные сроки [10]. Как любой адаптационный процесс, первоначально активация симпатоадреналовой системы и ренин-ангиотензин-альдостероновой системы (РААС) служит защитным механизмом, действие которого направлено на компенсацию развивающихся гемодинамических нарушений (снижение сердечного выброса, уменьшение объема циркулирующей крови). Однако при хроническом течении заболевания происходит гиперактивация этих, изначально физиологических, процессов, в результате чего они приобретают патологический характер. Так, было установлено, что альдостерон играет основную роль в развитии ряда отрицательных клинических проявлений: задержки натрия и жидкости, эндотелиальной дисфункции, гипертрофии ЛЖ и фибротических изменений миокарда [11, 12]. Доказано, что повышение уровня альдостерона и АТ II сопряжено с более высокой смертностью пациентов с ХСН [13]. Высокий уровень альдостерона показал себя как отрицательный предиктор выживаемости больных после ОИМ. Так, у больных
с высокой (≥141 пг/мл) концентрацией альдостерона в крови риск смерти в течение 5 лет после ОИМ в 2 раза выше, чем с низкой (<83,2 пг/мл) концентрацией [14].
Основным результатом воздействия ишемии и вазоактивных пептидов становится повышение синтеза и концентрации коллагена [15, 16], преобладающих над его распадом и, как следствие, прогрессирование фиброза миокарда. Причиной развития ХСН выступает, таким образом, не только потеря мышечной ткани в результате некроза, но и развитие фиброза, который и является решающим фактором в данном процессе. Эти механизмы тесно взаимосвязаны. Через несколько месяцев после ОИМ в миокарде по-прежнему сохраняются зоны гибернации и апоптоза в комбинации с участками фиброза, с потерей вещества миокарда и частичной неспособностью к процессам адаптации и регенерации. Именно фиброз — главный маркер ХСН и решающий показатель миокардиальной гетерогенности, увеличивающей диастолическую жесткость и склонность к аритмиям. На сегодняшний день альдостерон как главный участник фиброзного процесса рассматривается в качестве важнейшего нейрогуморального фактора развития так называемого электрического ремоделирования миокарда при ХСН и после ОИМ. В частности, доказано, что альдостерон участвует в изменении функции ионных каналов мембраны кардиомиоцитов и нарушении реполяризации. При ОИМ этот процесс развивается уже на ранних этапах, предшествуя нарушениям структуры и функции ЛЖ. Он служит предиктором возникновения жизнеугрожающих желудочковых аритмий и внезапной сердечной смерти (ВСС). Исследования последних десятилетий доказали, что негативная роль гиперальдостеронизма при ХСН также связана с развитием периваскулярного воспаления, дисфункцией эндотелия и васкулопатией, индуцированием окислительного стресса в кардиомиоцитах [9, 17, 18]. Важная роль альдостерона в патогенезе ремоделирования сердца после ОИМ определяет ведущую роль блокады РААС (и альдостерона) в лечении и профилактике СН у этих больных.
Роль антагонистов минералокортикоидных рецепторов в профилактике и лечении СН после ОИМ
Ранее считалось, что применение ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов рецепторов к АТ II (БРА II) обеспечивает достаточное подавление активности альдостерона. Однако показано, что у 38% пациентов, длительно принимающих ИАПФ, напротив, отмечается повышение уровня альдостерона [19, 20].
В одном из исследований у пациентов, получавших одновременно ИАПФ и БРА II, наблюдался достоверно более низкий уровень альдостерона на 17-й нед. терапии, однако на 43-й нед. лечения этот эффект нивелировался [21]. Такой феномен получил название «эффект ускользания альдостерона». В его основе лежат несколько патофизиологических механизмов, и ведущим из них является реактивация АТ II (стимулятор высвобождения альдостерона) в ходе длительной терапии ИАПФ [19]. Причем «эффект ускользания альдостерона» развивается у пациентов независимо от дозы ИАПФ [22]. Кроме того, существуют данные, что некоторое количество альдостерона синтезируется непосредственно клетками эндотелия, кардиомиоцитами и гладкомышечными клетками кровеносных сосудов, тогда как ИАПФ и БРА II воздействуют только на синтез альдостерона надпочечниками [23]. При этом существует мнение, что именно локальный синтез альдостерона в сердце играет ведущую роль в постинфарктном ремоделировании [9].
Независимо от механизма «эффект ускользания альдостерона» может снижать эффективность ИАПФ и БРА II, что влечет за собой ухудшение прогноза пациентов с ХСН. Это служит дополнительным доводом в пользу назначения препаратов с «антиальдостероновым» действием, антагонистов минералокортикоидных рецепторов (АМР) альдостерона, этой категории пациентов.
К сожалению, именно эти препараты часто остаются невостребованными в реальной клинической практике. Причем низкая приверженность лечению ими касается как больных («зачем мне мочегонные, если нет отеков»), так и врачей. Согласно статистике в США эти препараты назначаются только 32% тех больных, которым они показаны [24, 25]. В европейских странах этот показатель в 2012 г. составлял 33–36% [26]. В РФ доля больных, принимающих спиронолактон, по данным исследования ЭПОХА (2014) [2], составляет всего 11%. Именно эти препараты наиболее часто «теряются» при длительной терапии ХСН. Прекращение приема АМР больными ХСН было отмечено в 54,7% случаев [2].
Как известно, к классу АМР относятся 3 препарата: спиронолактон, эплеренон и канренон, не зарегистрированный в РФ. Каждому из них свойственны особенности, отличающие его от остальных. Спиронолактон, неселективный конкурентный АМР, по структуре близок к прогестерону. Как результат, помимо основных свойств, присущих АМР, он обладает свойствами слабого антагониста андрогеновых и кортикостероидных рецепторов и агониста прогестероновых рецепторов. Это закономерно может привести к таким побочным эффектам, как импотенция, гинекомастия, нарушения менструального цикла, гирсутизм и снижение либидо [9]. Спиронолактон является пролекарством, его активные метаболиты, канреноат и канренон, образуются в печени, имеют период полувыведения от 17 до 22 ч и элиминируются с желчью и мочой. Эплеренон — это производное спиронолактона, селективный АМР, благодаря чему он не вызывает клинически значимых побочных эффектов, связанных с воздействием на половую сферу. Период полувыведения эплеренона составляет 4–6 ч, элиминируется он почками, печенью и через желудочно-кишечный тракт [9].
Клиническая эффективность антагонистов минералокортикоидных рецепторов
Ниже мы приведем данные основных исследований, доказавших эффективность АМР при ХСН, в т. ч. развившейся вследствие перенесенного ОИМ. Первые данные о положительном влиянии спиронолактона на течение тяжелой ХСН были получены в ходе многоцентрового плацебо-контролируемого исследования RALES (Randomized Aldactone Evaluation Study) в 1999 г. [27]. Прием спиронолактона в дополнение к стандартной терапии ХСН у больных с тяжелой ХСН (III–IV функционального класса (ФК) по NYHA) со сниженной фракцией выброса (ФВ) ЛЖ ишемической и неишемической этиологии приводил к снижению риска серьезных осложнений и увеличению выживаемости пациентов. Применение спиронолактона уменьшало число случаев ВСС и смерти от прогрессирующей недостаточности кровообращения, а также число госпитализаций из-за декомпенсации ХСН [27]. Больные с ПИКС в отдельную группу в этом исследовании не выделялись. Однако в ряде работ показана перспективность использования этого препарата после ОИМ. Доказано, что прием спиронолактона позволяет предотвратить ремоделирование миокарда ЛЖ после ОИМ даже у пациентов, принимающих ИАПФ. Спиронолактон подавляет избыточный синтез N-концевого фрагмента проколлагена III после ОИМ [28]. Схожие результаты — подавление фиброза и ремоделирования миокарда — были получены в исследовании, в котором эплеренон назначался в комбинации с БРА II [29]. В ряде исследований показано, что блокада рецепторов альдостерона в ранние сроки — в течение 7 дней [30] или 4 нед. [31] после ОИМ — уменьшала фиброз в жизнеспособном миокарде. При этом добавление к терапии ИАПФ спиронолактона у крыс с СН после ОИМ значительно увеличивало биодоступность оксида азота [32]. Эплеренон в эксперименте снижал окислительный стресс [33]. Исследования на животных и людях показали и другие кардиальные и периферические эффекты АМР, в т. ч. эплеренона: торможение развития воспалительных поражений коронарных артерий, ремоделирования миокарда и предсердий [34], улучшение вазомоторной реактивности [35] и противовоспалительное нефропротективное действие [36].
Эффективность эплеренона после ОИМ изучена в крупном рандомизированном двойном слепом плацебо-контролируемом исследовании EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study) [37]. В исследование включались больные на 3–14-е сут после ОИМ с ФВ ЛЖ <40%. Обязательным условием была хотя бы однократная регистрация клинических симптомов СН. Исключение было сделано для больных сахарным диабетом (СД), т. к. в этом случае риск развития сердечно-сосудистых осложнений (ССО) повышен настолько, что его сочли соответствующим таковому у пациентов с симптомами СН, но без СД. В исследование было включено 6642 больных. Больные получали стандартную терапию ХСН, 87% получали ИАПФ. За 16 мес. наблюдения было зарегистрировано 478 случаев смерти в группе эплеренона и 554 случая смерти в группе плацебо (ОР 0,85; р=0,008). Из них 407 смертей в группе эплеренона и 483 — в группе плацебо произошли по сердечно-сосудистым причинам (ОР 0,83; р=0,005) [37]. Эплеренон снижал риск другой первичной конечной точки — смерти от сердечно-сосудистых причин или госпитализации по поводу ССО на 13% и риск вторичной конечной точки — смерти от любой причины или любой госпитализации на 8% (р=0,02). Также наблюдалось снижение частоты ВСС (ОР 0,79; р=0,03). Таким образом, снижение сердечно-сосудистой смертности было в первую очередь обусловлено снижением частоты ВСС. Снижение риска смерти вследствие прогрессирующей ХСН и ОИМ было тоже значимым, но не столь впечатляющим. Эффективность эплеренона не зависела от возраста, концентрации сывороточного калия и креатинина, ФВ ЛЖ, пульсового давления, получаемой терапии и проведения или непроведения реперфузионной терапии. Однако авторы делают оговорку, что мощность этого исследования недостаточна для того, чтобы со всей ответственностью оценить эффективность препарата в различных подгруппах [37]. Важно, что позитивное воздействие эплеренона на долгосрочную выживаемость и ССО не определяется его ранними калийсберегающими или мочегонными эффектами [38]. По всей видимости, оно обусловлено способностью препарата устранять электрическую нестабильность миокарда, что особенно значимо на ранних этапах развития ОИМ. Очень важен с практической точки зрения анализ эффективности эплеренона в зависимости от сроков его назначения, опубликованный Ch. Adamopoulos et al. (табл. 1) [39]. Раннее назначение ассоциировалось со снижением риска смерти от всех причин на 31%, смерти от ССЗ и госпитализации по поводу ССЗ — на 24%, ВСС — на 34% (табл. 1). С поправкой на различные дополнительные факторы риска преимущество ранней инициации терапии эплереноном выражалось в снижении риска смерти от всех причин на 36%, смерти от ССЗ или госпитализации по поводу ССЗ на 18% и ВСС на 26%. Целесообразность раннего назначения АМР (однократное внутривенное введение канреноата калия с последующим пероральным приемом спиронолактона) при ОИМ, независимо от наличия дисфункции ЛЖ, изучалась в исследовании ALBATROSS, результаты которого опубликованы в 2016 г. [40]. Было получено снижение риска смерти в группе АМР по сравнению с группой стандартной терапии (ОР 0,20; р=0,0044) в подгруппе ИМ с подъемом сегмента ST (пST) (1,229 человека), но не в подгруппе ИМ без пST (374 человека). В исследовании REMINDER (Double-Blind, Randomized, Placebo-Controlled Trial Evaluating The Safety And Efficacy Of Early Treatment With Eplerenone In Patients With Acute Myocardial Infarction) 1012 больных ОИМ с пST без СН были рандомизированы с назначением эплеренона/плацебо в первые 24 ч после появления симптомов [41]. Через 10,5 мес. первичная комбинированная конечная точка (смерть по сердечно-сосудистой причине, повторная госпитализация или удлинение срока пребывания в стационаре из-за СН, устойчивая желудочковая тахикардия или фибрилляция, ФВ <40% или повышение натрийуретического пептида В-типа (BNP) / N-концевого натрийуретического пептида B-типа (NT-proBNP) зафиксирована у 18,2% пациентов исследуемой группы против 29,4% в группе плацебо (р<0,0001), но разница была обусловлена, главным образом, уровнями BNP.Логичным продолжением исследования EPHESUS стало исследование EMPHASIS-HF [42, 43], в которое было включено 2737 больных СН со II ФК по NYHA и ФВ не более 35%. ОИМ в анамнезе был приблизительно у половины включенных. Результатом стало доказательство того, что даже у больных на адекватной терапии и исходно хорошо скомпенсированных присоединение эплеренона улучшало клиническое течение и прогноз ХСН. Добавление эплеренона вело к снижению риска смерти по сердечно-сосудистым причинам или госпитализации из-за ХСН на 37% (p<0,001), снижению риска смерти по сердечно-сосудистым причинам на 24% (p=0,01) и числа госпитализаций вследствие декомпенсации ХСН на 42% (p<0,001). Следует особо отметить, что в группе терапии эплереноном риск фибрилляции предсердий был ниже на 42%. Эффект эплеренона не зависел от возраста, пола, расовой принадлежности, сопутствующей терапии, уровня артериального давления, функции почек, ФВ ЛЖ и этиологии ХСН.
![Таблица 1. Сердечно-сосудистые осложнения у больных ОИМ и ХСН в зависимости от сроков инициации терапии эплереноном (исследование EPHESUS) [39] Таблица 1. Сердечно-сосудистые осложнения у больных ОИМ и ХСН в зависимости от сроков инициации терапии эплереноном (исследование EPHESUS) [39]](/upload/medialibrary/286/40-1.png)
Эплеренон или спиронолактон: что выбрать?
Эплеренон продемонстрировал хороший профиль безопасности. Наиболее частым побочным эффектом было развитие гиперкалиемии. Так, в исследовании EPHESUS [38] частота значимой гиперкалиемии составила 5,5% в группе эплеренона и 3,9% в группе плацебо (p=0,002). Чаще это осложнение ожидаемо встречалось при исходно низком клиренсе креатинина (<50 мл/мин). С другой стороны, частота гипокалиемии (не менее серьезного осложнения) составила 8,4% в группе эплеренона против 13,1% в группе плацебо (р=0,002). Очевидно, что терапия эплереноном, как и спиронолактоном, требует тщательного контроля электролитного баланса и функции почек. Впрочем, такой контроль необходим всем больным ХСН. Главный вывод, который следует сделать: эта гиперкалиемия предсказуема, управляема и нефатальна [44]. Двойной путь выведения дает возможность более легкого «управления» этим препаратом. Еще один побочный эффект спиронолактона менее известен. Как показали исследования, он способен повышать уровень гликированного гемоглобина (HbA1c) и усугублять эндотелиальную дисфункцию у больных СД 2 типа [45]. В прямом сравнении с эплереноном [46] спиронолактон повышал уровень не только HbA1c, но и кортизола, параллельно снижая уровень адипонектина. Эплеренон таких эффектов не давал. Следовательно, эплеренон — оптимальный выбор при СД 2 типа, висцеральном ожирении, метаболическом синдроме [47].
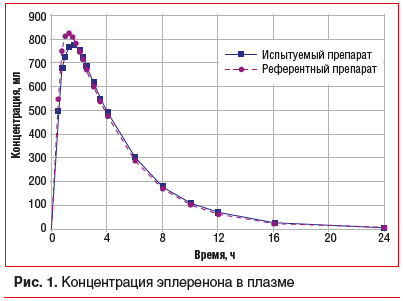
На сегодняшний день эффективность и профиль безопасности спиронолактона и эплеренона напрямую не сравнивались. В рекомендациях по лечению ХСН при ОИМ [48, 49] упоминаются АМР без указания конкретного препарата. Большинство врачей предпочитают более привычный препарат — спиронолактон [9]. Однако следует помнить, что, во‑первых, у эплеренона более широкая доказательная база. Именно для него доказана эффективность ранней инициации при ОИМ, а также у больных ХСН II ФК с низкой ФВ. Во-вторых, эплеренон имеет более благоприятный профиль переносимости, следовательно, больные, принимающие этот препарат, демонстрируют более высокую приверженность терапии [50]. При выборе АМР нередко определяющим фактором является цена. Именно высокая стоимость препятствует широкому применению эплеренона. Эту проблему призвано решить внедрение в лечебную практику более доступных и не менее эффективных дженериков эплеренона [9]. Один из них, Иплерон («Синтон Испания, С.Л.»), производится в Испании по стандартам GMP. Проведенное сравнительное исследование биоэквивалентности оригинального эплеренона (таблетки, покрытые пленочной оболочкой, 50 мг) и Иплерона (таблетки, покрытые пленочной оболочкой, 50 мг) дало положительные результаты (рис. 1).
Заключение
Таким образом, в рутинной терапии в острый, подострый и отдаленный периоды ОИМ с пST АМР рекомендованы пациентам с ФВ ЛЖ ≤ 40%, СН или СД, которые уже получают ИАПФ и бета-адреноблокаторы при условии отсутствия почечной недостаточности или гиперкалиемии [49]. Причем, строго говоря, эти рекомендации относятся именно к эплеренону как препарату, имеющему наиболее убедительную доказательную базу. Внедрение эффективных доступных дженериков эплеренона, таких как Иплерон, помогает расширить его использование в реальной клинической практике.












