–Ю—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Є–Р–Я–§ —П–≤–ї—П–µ—В—Б—П –±–ї–Њ–Ї–∞–і–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ –љ–∞ —Г—А–Њ–≤–љ–µ —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Є –љ–∞ —В–Ї–∞–љ–µ–≤–Њ–Љ —Г—А–Њ–≤–љ–µ (–љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —А–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л вАУ –†–Р–Р–°; –Ї–Њ—Б–≤–µ–љ–љ–Њ вАУ —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л вАУ –°–Э–° вАУ –Є –≤–∞–Ј–Њ–њ—А–µ—Б—Б–Є–љ–∞), –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞, —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –µ–≥–Њ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П, –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є—О –Є –Ј–∞–і–µ—А–ґ–Ї—Г –ґ–Є–і–Ї–Њ—Б—В–Є. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б —Г—З–∞—Б—В–Є–µ–Љ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Р–Я–§ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Њ–є –Є–Ј —А–µ–і–Ї–Є—Е –≥—А—Г–њ–њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В–∞–і–Є—П—Е —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: —В—П–ґ–µ–ї–Њ–є, –ї–µ–≥–Ї–Њ–є —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є–ї–Є –і–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є.
–Я–Њ—З–µ–Љ—Г –Є–Р–Я–§ –Љ–Њ–≥—Г—В –±—Л—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞?
–Ю—Б–љ–Њ–≤–љ–∞—П –Є–і–µ—П, –≤—Л—Б–Ї–∞–Ј–∞–љ–љ–∞—П –≤ —Б–≤–Њ–µ –≤—А–µ–Љ—П –і–Њ–Ї—В–Њ—А–Њ–Љ J.Pfeffer –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е —А–∞–±–Њ—В, –Ј–∞–Ї–ї—О—З–∞–ї–∞—Б—М –≤ —В–Њ–Љ, —З—В–Њ –Є–Р–Я–§ –Ј–∞ —Б—З–µ—В –±–ї–Њ–Ї–∞–і—Л –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II (A–Ґ-II) —Б–њ–Њ—Б–Њ–±–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П—В—М –љ–∞ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц) –Є —Г–ї—Г—З—И–∞—В—М –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ—Б–ї–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь).
–†–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Ы–Ц –њ–Њ—Б–ї–µ –Ш–Ь —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –≥–µ–Њ–Љ–µ—В—А–Є–Є –њ–Њ–ї–Њ—Б—В–Є –Ы–Ц, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Љ–∞—Б—Б—Л –љ–µ–њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ–≥–Њ –Љ–Є–Њ–Ї–∞—А–і–∞. –Ф–∞–љ–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤–Ї–ї—О—З–∞—П —А–∞—Б—И–Є—А–µ–љ–Є–µ –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—О –Љ–Є–Њ—Ж–Є—В–Њ–≤, —Б–Љ–µ—Й–µ–љ–Є–µ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ –і—А—Г–≥ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і—А—Г–≥–∞, —Г–і–ї–Є–љ–µ–љ–Є–µ –Љ–Є–Њ—Д–Є–±—А–Є–ї–ї –Є —А–∞–Ј–≤–Є—В–Є–µ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –Є/–Є–ї–Є –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞. –Т —А–∞–љ–љ–µ–Љ –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Ы–Ц –њ–Њ —Б–≤–Њ–µ–є —Б—Г—В–Є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–Љ –љ–∞ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –љ–∞ –і–Њ–ї–ґ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Љ–Є–Њ–Ї–∞—А–і–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б —В–µ—З–µ–љ–Є–µ–Љ –≤—А–µ–Љ–µ–љ–Є –њ—А–Њ—Ж–µ—Б—Б—Л —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –∞–љ–Њ–Љ–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–∞, —Б–љ–Є–ґ–µ–љ–Є—О –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞, –љ–∞—А—Г—И–µ–љ–Є—О –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц, –і–Є–ї–∞—В–∞—Ж–Є–Є –њ–Њ–ї–Њ—Б—В–Є –Ы–Ц, –њ–Њ—П–≤–ї–µ–љ–Є—О —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –°–Э, —З—В–Њ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Г—Е—Г–і—И–∞–µ—В –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–ї–Є—П—П –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь. –Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—Б—В–∞—О—В—Б—П –љ–µ –і–Њ –Ї–Њ–љ—Ж–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ–Є. –Ю–і–љ–∞–Ї–Њ –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —П–≤–ї—П–µ—В—Б—П –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–∞—П –љ–∞–≥—А—Г–Ј–Ї–∞ –љ–∞ —Б—В–µ–љ–Ї—Г –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц; –≤—Л—Б–Њ–Ї–Њ–≤–µ—А–Њ—П—В–љ–Њ —В–∞–Ї–ґ–µ —Г—З–∞—Б—В–Є–µ –≤ —Н—В–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ, –∞—Г—В–Њ–Ї—А–Є–љ–љ–Њ–≥–Њ –Є –њ–∞—А–∞–Ї—А–Є–љ–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤.
–Ю–±—Л—З–љ–Њ –∞–Ї—В–Є–≤–∞—Ж–Є—П –†–Р–Р–° –љ–∞—Б—В—Г–њ–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 72 —З –Њ—В –љ–∞—З–∞–ї–∞ –Ш–Ь. –Я—А–Є—З–µ–Љ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є–Љ–њ–∞—В–Є–Ї–Њ-–∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л –∞–Ї—В–Є–≤–∞—Ж–Є—П –†–Р–Р–° –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е. –Р–Ї—В–Є–≤–Є—А—Г—О—В—Б—П –Њ–±–∞ –Ј–≤–µ–љ–∞ –і–∞–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л: —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–µ –Є –ї–Њ–Ї–∞–ї—М–љ–Њ–µ. –Ш –µ—Б–ї–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–Ґ-II, —А–µ–љ–Є–љ–∞ –Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –Ї –Љ–Њ–Љ–µ–љ—В—Г –≤—Л–њ–Є—Б–Ї–Є –±–Њ–ї—М–љ–Њ–≥–Њ –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Є—Е–Њ–і–Є—В –Ї –љ–Њ—А–Љ–µ, —В–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–≤—Л—Е –†–Р–Р–°, –љ–∞–њ—А–Њ—В–Є–≤, –њ–Њ–≤—Л—И–∞–µ—В—Б—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–ї—Г—З–∞–µ –Њ–±—И–Є—А–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞.
–І–µ–Љ –ґ–µ –Њ–њ–∞—Б–љ–∞ —З—А–µ–Ј–Љ–µ—А–љ–∞—П –∞–Ї—В–Є–≤–∞—Ж–Є—П –†–Р–Р–° –њ–Њ—Б–ї–µ –Ш–Ь?
A–Ґ-II —Б–њ–Њ—Б–Њ–±–µ–љ –і–∞–≤–∞—В—М –њ—А–Њ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В, —Г—Б—Г–≥—Г–±–ї—П—П —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–є –і–Є—Б–±–∞–ї–∞–љ—Б –Љ–µ–ґ–і—Г –і–Њ—Б—В–∞–≤–Ї–Њ–є –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Є –µ–≥–Њ –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М—О –≤ —Е–Њ–і–µ –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь.
A–Ґ-II —Г—З–∞—Б—В–≤—Г–µ—В –≤ –љ–µ–Љ–µ–і–ї–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П, —Б—В–Є–Љ—Г–ї–Є—А—Г—П —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–Њ–≤ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤. –Т —Б–ї—Г—З–∞–µ –і–ї–Є—В–µ–ї—М–љ–Њ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Њ–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Ы–Ц, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П—П –љ–∞ —А–Њ—Б—В –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ –Є –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤.
A–Ґ-II –Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ, –њ–Њ–Љ–Є–Љ–Њ –Ј–∞–і–µ—А–ґ–Ї–Є –ґ–Є–і–Ї–Њ—Б—В–Є, –≤–µ–і—Г—В –Ї —А–∞–Ј–≤–Є—В–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Д–Є–±—А–Њ–Ј–∞ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Љ–∞—Б—Б—Л –Љ–Є–Њ–Ї–∞—А–і–∞ –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ–ї–ї–∞–≥–µ–љ–∞.
–Ъ–∞–Ї–Є–Љ –ґ–µ –Њ–±—А–∞–Ј–Њ–Љ –Є–Р–Я–§ —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–Њ—Б–ї–µ –Ш–Ь?
–Є–Р–Я–§ –Љ–Њ–≥—Г—В —Г–Љ–µ–љ—М—И–∞—В—М –Ј–Њ–љ—Г –Є–љ—Д–∞—А–Ї—В–∞ –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–µ–є –≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј–µ –Є—И–µ–Љ–Є–Є.
–Т–ї–Є—П—П –љ–∞ —В–Њ–љ—Г—Б –∞—А—В–µ—А–Є–Њ–ї –Є –≤–µ–љ—Г–ї –Є–Р–Я–§ —Г–Љ–µ–љ—М—И–∞—О—В –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ —Б–µ—А–і—Ж–µ –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П –і–∞–≤–ї–µ–љ–Є—П –µ–≥–Њ –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П, —В–µ–Љ —Б–∞–Љ—Л–Љ —Г–Љ–µ–љ—М—И–∞—П –љ–∞–њ—А—П–ґ–µ–љ–Є–µ —Б—В–µ–љ–Ї–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц вАУ –≥–ї–∞–≤–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–Є–Љ—Г–ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є.
–Я—А–Є–Њ—Б—В–∞–љ–Њ–≤–Ї–∞ –Є –Њ–±—А–∞—В–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–Њ—Б—В–∞ –Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е A–Ґ-II.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–ї–Є—З–Є–µ —В–∞–Ї–Є—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є–Р–Я–§ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Е–Њ–і —А–∞–Ј–≤–Є—В–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –†–Р–Р–° —П–≤–Є–ї–Њ—Б—М –Њ—Б–љ–Њ–≤–Њ–є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Ш–Ь.
–Э—Г–ґ–љ—Л –ї–Є –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь: –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–µ—А–≤—Л—Е –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є
–Ф–Њ —Б–µ—А–µ–і–Є–љ—Л 90-—Е –≥–Њ–і–Њ–≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ –њ–∞—Ж–Є–µ–љ—В—Г —Б –Њ—Б—В—А—Л–Љ –Ш–Ь –≤—Б–µ–≥–і–∞ –≤—Л–Ј—Л–≤–∞–ї–Њ –Љ–љ–Њ–≥–Њ –≤–Њ–њ—А–Њ—Б–Њ–≤ —Г –≤—А–∞—З–µ–є-–њ—А–∞–Ї—В–Є–Ї–Њ–≤. –Ф–∞–љ–љ–∞—П –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ—Б—В—М –±–∞–Ј–Є—А–Њ–≤–∞–ї–∞—Б—М –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –і–≤—Г—Е –њ–µ—А–≤—Л—Е –Љ–∞—Б—И—В–∞–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤–ї–Є—П–љ–Є—П –Є–Р–Я–§ –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь (SAVE –Є CONSENSUS II), —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –≤ 1992 –≥. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —Б—В—А–∞—В–µ–≥–Є—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ —Б –њ–µ—А–≤—Л—Е —З–∞—Б–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —Б –Ш–Ь –љ–µ –Є–Љ–µ–ї–∞ —Г—Б–њ–µ—Е–∞ (—Б–Љ–µ—А—В–љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 10,2%, –∞ –≤ –≥—А—Г–њ–њ–µ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ вАУ 11%; —А=0,26), –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CONSENSUS II –±—Л–ї–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Њ –і–Њ—Б—А–Њ—З–љ–Њ. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–њ—В–Њ–њ—А–Є–ї–∞ –љ–∞ 3вАУ16-–є –і–µ–љ—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Ш–Ь –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц (—Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ (–§–Т) –і–Њ 40%) –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAVE —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 19% (—А=0,019) —З–µ—А–µ–Ј 42 –Љ–µ—Б –ї–µ—З–µ–љ–Є—П. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В —В–µ—А–∞–њ–Є–Є –њ—А–Њ—П–≤–ї—П–ї—Б—П –ї–Є—И—М —Б–њ—Г—Б—В—П 1 –≥–Њ–і –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П. –Ъ–∞–Ї–Є–µ –ґ–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Є —Б—В–Њ–ї—М –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Є—Е –і–≤—Г—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є?
–Ю—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Є–Р–Я–§ –≤ –Њ–±–Њ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —П–≤–ї—П–ї–Њ—Б—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –Њ–≥—А–∞–љ–Є—З–Є—В—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞ –Є –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –њ—А–Є –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ш–Ь. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б—В—А–∞—В–µ–≥–Є—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –±—Л–ї–∞ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —А–∞–Ј–ї–Є—З–љ–∞. –Я–Њ–Љ–Є–Љ–Њ —В–Њ–≥–Њ, —З—В–Њ –±—Л–ї–Є –≤—Л–±—А–∞–љ—Л —А–∞–Ј–љ—Л–µ –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –і–µ–є—Б—В–≤–Є—П –Є–Р–Я–§ (–Ї–∞–њ—В–Њ–њ—А–Є–ї –≤ SAVE –Є —Н–љ–∞–ї–∞–њ—А–Є–ї –≤ CONSENSUS II), –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Љ–µ–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –њ—А–Є–љ—Ж–Є–њ–∞—Е –Њ—В–±–Њ—А–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –≤—А–µ–Љ–µ–љ–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б—Л–≥—А–∞–ї–Њ –Њ—Б–љ–Њ–≤–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–ї—Г—З–µ–љ–Є–Є –Ї–Њ–љ–µ—З–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є –Є–Љ–µ–µ—В –Њ–њ—А–µ–і–µ–ї—П—О—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SAVE –±—Л–ї–Є –Њ—В–Њ–±—А–∞–љ—Л –њ–∞—Ж–Є–µ–љ—В—Л —Б –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–±—И–Є—А–љ—Л–Љ –Ш–Ь, —З–∞—Б—В–Њ —В—А–∞–љ—Б–Љ—Г—А–∞–ї—М–љ—Л–Љ, —Б–њ–Њ—Б–Њ–±–љ—Л–Љ –њ—А–Є–≤–µ—Б—В–Є –Ї –Ј–љ–∞—З–Є–Љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц (–§–Т –Љ–µ–љ–µ–µ 40%), –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–њ–∞—Б–љ—Л–Љ —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–Ї–Њ–ї–Њ 40% –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ–ї–Є –њ—А–µ—Е–Њ–і—П—Й–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –°–Э, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ—Л –Ї –Љ–Њ–Љ–µ–љ—В—Г –≤–≤–Њ–і–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ф—А—Г–≥–∞—П –≤–∞–ґ–љ–∞—П –і–µ—В–∞–ї—М вАУ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ—Г–ґ–і–∞—О—Й–Є—Е—Б—П –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –° —Н—В–Њ–є —Ж–µ–ї—М—О –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є—И–µ–Љ–Є–Є –≤—Б–µ –±–Њ–ї—М–љ—Л–µ –њ—А–Њ—И–ї–Є –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–є —В–µ—Б—В, 60% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П, –∞ 25% вАУ –њ—А–Њ—Ж–µ–і—Г—А—Л –њ–Њ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞. –Ґ–µ—А–∞–њ–Є—О –Ї–∞–њ—В–Њ–њ—А–Є–ї–Њ–Љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAVE –љ–∞—З–Є–љ–∞–ї–Є –љ–∞ 3вАУ16-–є (–≤ —Б—А–µ–і–љ–µ–Љ 11-–є) –і–µ–љ—М –Ш–Ь.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CONSENSUS II –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ (–њ–µ—А–≤–∞—П –і–Њ–Ј–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–µ—А–µ–≤–Њ–і–Њ–Љ –љ–∞ –њ—А–Є–µ–Љ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –њ—А–µ–њ–∞—А–∞—В–∞) –±–Њ–ї–µ–µ 6000 –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 15 —З –Њ—В –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Ж–µ–і—Г—А—Л —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –∞–±—Б–Њ–ї—О—В–љ–Њ –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь (–љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ–ї–Њ—Й–∞–і–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —Б—В–µ–њ–µ–љ–Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц), –Ї—А–Њ–Љ–µ –±–Њ–ї—М–љ—Л—Е, –Є–Љ–µ–≤—И–Є—Е –Є—Б—Е–Њ–і–љ–Њ —Б–Є–Љ–њ—В–Њ–Љ—Л –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є. –Ґ–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –Ї –Њ—В–±–Њ—А—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–≥ –Ї–Њ—Б–≤–µ–љ–љ–Њ –Њ–±—Г—Б–ї–Њ–≤–Є—В—М –≤–≤–µ–і–µ–љ–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Б–Њ—Е—А–∞–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –Є –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –Є–Ј –љ–µ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –Њ—Б–Њ–±–µ–љ–љ–Њ —З–∞—Б—В–Њ –Є–Љ–µ—О—Й–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Є –≥–Є–њ–Њ—В–Њ–љ–Є–Є –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –Њ—Б—В—А–Њ–є —Д–∞–Ј—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —В–∞–Ї–Њ–є вАЬ—Б–µ–ї–µ–Ї—Ж–Є–ЄвАЭ –Љ–Њ–≥–ї–Њ —Б—В–∞—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –Ш–Ь –Є —Б–Њ—Е—А–∞–љ–љ–Њ–є –§–Т –Ы–Ц –љ–∞–і –±–Њ–ї—М–љ—Л–Љ–Є —Б –Њ–±—И–Є—А–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Р–Я–§ —Б–њ–Њ—Б–Њ–±–љ—Л –і–∞—В—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Н—Д—Д–µ–Ї—В.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞–Ј–ї–Є—З–Є—П –≤ –≤—Л–±–Њ—А–µ –Є–Р–Я–§, —Б—А–Њ–Ї–∞—Е –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є –Њ—В–±–Њ—А–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є–≤–µ–ї–Є –Ї –і–Њ—Б—В–Є–ґ–µ–љ–Є—О –њ—А—П–Љ–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAVE –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ:
вАҐ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 19% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ;
вАҐ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 21%;
вАҐ —З–∞—Б—В–Њ—В—Л –°–Э, —В—А–µ–±—Г—О—Й–µ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –љ–∞ 22%;
вАҐ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ш–Ь –љ–∞ 25%;
вАҐ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –њ–Њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ, –Њ—В –°–Э, –Ш–Ь –љ–∞ 24%.
вАҐ
–° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CONSENSUS II –±—Л–ї–Њ –Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –і–Њ—Б—А–Њ—З–љ–Њ –њ–Њ —Н—В–Є—З–µ—Б–Ї–Є–Љ —Б–Њ–Њ–±—А–∞–ґ–µ–љ–Є—П–Љ –≤–≤–Є–і—Г –Њ—В—Б—Г—В—Б—В–≤–Є—П –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —А–∞–љ–љ–µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ –њ–µ—А–µ–і –њ–ї–∞—Ж–µ–±–Њ –±–Њ–ї—М–љ—Л–Љ —Б –Њ—Б—В—А—Л–Љ –Ш–Ь (6-–Љ–µ—Б—П—З–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М 11% –њ—А–Њ—В–Є–≤ 9,9%) –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П вАЬ—А–∞–љ–љ–µ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —А–µ–∞–Ї—Ж–Є–ЄвАЭ, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –І–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П —Б—В–Њ–є–Ї–Њ–є –≥–Є–њ–Њ—В–Њ–љ–Є–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 12%. –Ф–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–µ—В–Ї–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є—В–Њ–≥ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CONSENSUS II –њ–Њ–і–≤–µ–ї –њ—А–Њ—Д–µ—Б—Б–Њ—А S.Ball –≤ —Б—В–∞—В—М–µ вАЬ–І—В–Њ –Љ–Њ–ґ–љ–Њ –ґ–і–∞—В—М –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–ЬвАЭ, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–є –≤ 1994 –≥.: вАЬ...–Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–љ–Њ—А–Њ–і–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ ... –Ш–Ь. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь —З–∞—Б—В–Њ –љ–µ–њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ –Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ї–∞–Ї –Њ–њ–∞—Б–љ–Њ, —В–∞–Ї –Є —Г—Б–њ–µ—И–љ–ЊвАЭ.
–Я–Њ–і–≤–Њ–і—П –Є—В–Њ–≥ –Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–Љ—Г, –Љ–Њ–ґ–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Г–≤–µ—А–µ–љ–љ–Њ —Б–Ї–∞–Ј–∞—В—М, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–≤—Г—Е –њ–µ—А–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є SAVE –Є CONSENSUS II –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ –њ—А–Њ—П—Б–љ–Є–ї–Є —Б–Є—В—Г–∞—Ж–Є—О —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь, –љ–Њ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –µ–µ –Њ—Б–ї–Њ–ґ–љ–Є–ї–Є, –Њ—Б—В–∞–≤–Є–≤ —Ж–µ–ї—Л–є —А—П–і –љ–µ—А–µ—И–µ–љ–љ—Л—Е –≤–Њ–њ—А–Њ—Б–Њ–≤.
вАҐ –Э–µ–Њ–±—Е–Њ–і –Љ–Њ –ї–Є—Б–Њ–±–ї—О–і–∞ —М–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л –Ї—А–Є—В–µ—А–Є–Є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь –Є–ї–Є –ґ–µ –Є—Е —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤?
вАҐ –Ъ–∞–Ї –≤—Л–Њ–њ—В–Є–Љ–∞–ї—М–љ –µ—Б—А–Њ–Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь?
вАҐ –Ъ–∞ –Ї–Њ–є–њ—А–µ–њ–∞ —А —В –Є–≤–Ї–∞–Ї —Е–і–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ?
вАҐ –Ъ–∞–Ї –≤–∞–і–Њ–ї–ґ –љ–∞–±—Л —М–і–ї–Є—В–µ–ї—М–љ–Њ—Б—В –ї–µ—З–µ–љ–Є—П –Є–Р–Я–§?
–Ю—В–±–Њ—А –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§. –°–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
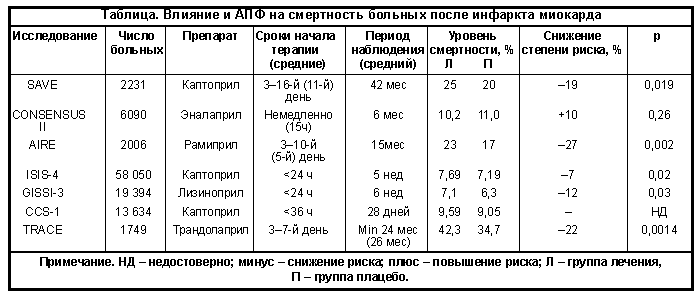
–Ъ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ—Л–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є —В—А–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –≤–ї–Є—П–љ–Є—П –Є–Р–Я–§ –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М: SAVE, AIRE –Є TRACE. –Ъ–∞–ґ–і–Њ–µ –Є–Ј –љ–Є—Е –Є–Љ–µ–µ—В —Б–≤–Њ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, –љ–Њ –≤—Б–µ –Њ–љ–Є –±—Л–ї–Є –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ –њ—А–Є–љ—Ж–Є–њ–µ –Њ—В–±–Њ—А–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –≤ —Б—А–Њ–Ї–Є –Њ—В 3-–≥–Њ –і–Њ 16-–≥–Њ –і–љ—П –Ш–Ь.
–Т—Л—И–µ –Љ—Л —Г–ґ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ–ї–Є –Њ—Б–љ–Њ–≤–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SAVE –Є —В–µ –≤–Њ–њ—А–Њ—Б—Л, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ—Б–ї–µ –µ–≥–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –≤–Њ–ї–љ–Њ–≤–∞—В—М –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є—Е –≤—А–∞—З–µ–є –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ AIRE (–≤–ї–Є—П–љ–Є–µ —А–∞–Љ–Є–њ—А–Є–ї–∞ –љ–∞ –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М —Г –±–Њ–ї—М–љ—Л—Е —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –°–Э –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ш–Ь) –і–Њ–ї–ґ–љ–Њ –±—Л–ї–Њ –і–∞—В—М –Њ—В–≤–µ—В –љ–∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е, —В–∞–Ї –Ї–∞–Ї –µ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–∞—В–Њ—А—Л —Г—З–ї–Є —В–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Љ–Њ–Љ–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —Б–≤–Њ–є—Б—В–≤–µ–љ–љ—Л –њ—А–µ–і—Л–і—Г—Й–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ SAVE –Є CONSENSUS II.
–Т AIRE –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ –±–Њ–ї–µ–µ 2000 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞–ї–Є –Ш–Р–Я–§ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —А–∞–Љ–Є–њ—А–Є–ї –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь. –Ю—Б–љ–Њ–≤–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П–ї–∞—Б—М —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –≤—Б–µ—Е –њ—А–Є—З–Є–љ. –Я–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї 15 –Љ–µ—Б. –Ы–µ—З–µ–љ–Є–µ –љ–∞—З–Є–љ–∞–ї–Є –љ–∞ 3вАУ10-–є –і–µ–љ—М (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 6-–є –і–µ–љ—М) –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь.
–Ю—В–±–Њ—А –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –Є —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь –Є –љ–∞–ї–Є—З–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –°–Э: III –і–Њ–±–∞–≤–Њ—З–љ–Њ–≥–Њ —В–Њ–љ–∞ –њ—А–Є —Б–Є–љ—Г—Б–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є, —Е—А–Є–њ–Њ–≤ –≤ –ї–µ–≥–Ї–Є—Е –њ—А–Є –∞—Г—Б–Ї—Г–ї—М—В–∞—Ж–Є–Є –Є —П–≤–ї–µ–љ–Є–є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ј–∞—Б—В–Њ—П –њ—А–Є —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є. –Я—А–Є–Ј–љ–∞–Ї–Є –°–Э –Љ–Њ–≥–ї–Є –±—Л—В—М —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–Љ–Є, –њ—А–Њ—Е–Њ–і—П—Й–Є–Љ–Є –њ–Њ—Б–ї–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–Є—Г—А–µ—В–Є–Ї–Њ–≤ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤, —В–Њ–≥–і–∞ –Ї–∞–Ї –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г –±–Њ–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —В—П–ґ–µ–ї–Њ–є –°–Э —П–≤–ї—П–ї–Њ—Б—М –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –≤–Ї–ї—О—З–µ–љ–Є—О –Є—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є —В—А–µ–±–Њ–≤–∞–ї–Њ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§.
–Ю—Б–љ–Њ–≤–љ—Л–Љ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П AIRE —П–≤–Є–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ (–љ–∞ 27%) –Є –≤—Л—Б–Њ–Ї–Њ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ (p<0,002) —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —А–∞–Љ–Є–њ—А–Є–ї. –Ф—А—Г–≥–Є–Љ —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤–∞–ґ–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ –±—Л–ї–Њ —А–∞–љ–љ–µ–µ —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ –Ї—А–Є–≤—Л—Е –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —А–∞–љ–љ–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤—Л—П–≤–Є–ї —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –љ–∞ 29% (p<0,053) —Г–ґ–µ —З–µ—А–µ–Ј 30 –і–љ–µ–є –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ. –≠—В–Њ—В —А–µ–Ј—Г–ї—М—В–∞—В –Є–Љ–µ–µ—В –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–≤–µ—В–µ –і–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SAVE, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В –і–Њ—Б—В–Є–≥–∞–ї—Б—П –ї–Є—И—М —Б–њ—Г—Б—В—П 1 –≥–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П.
–Я–Њ–і–≥—А—Г–њ–њ–Њ–≤–Њ–є –∞–љ–∞–ї–Є–Ј –њ—А–Є–љ–µ—Б —А—П–і –Є–љ—В–µ—А–µ—Б–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –њ—А–Є –Ш–Ь –љ–∞–Є—Е—Г–і—И–Є–є –њ—А–Њ–≥–љ–Њ–Ј –Є–Љ–µ—О—В –њ–∞—Ж–Є–µ–љ—В—Л —Б –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є –°–Э, –Ї–Њ—В–Њ—А—Л–µ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–∞—Е–Њ–і—П—В—Б—П –љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –і–Є—Г—А–µ—В–Є–Ї–∞–Љ–Є. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —А–∞–Љ–Є–њ—А–Є–ї–∞ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Г—А–Њ–≤–µ–љ—М —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ 19,5% –њ—А–Њ—В–Є–≤ 23,8% –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї–µ–µ –ї–µ–≥–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і–Є—Г—А–µ—В–Є–Ї–Є –љ–∞ –Љ–Њ–Љ–µ–љ—В —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є, –і–∞–љ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –љ–µ –±—Л–ї–Њ. –Я—А–Є–≤–µ–і–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–Њ–≥—Г—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Њ —В–Њ–Љ, —З—В–Њ —Н—Д—Д–µ–Ї—В –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь –ї—Г—З—И–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–∞ (—В.–µ. –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –і–Є—Г—А–µ—В–Є–Ї–Є –Є–Ј-–Ј–∞ —П–≤–ї–µ–љ–Є–є –°–Э). –Ф–∞–љ–љ—Л–є –≤—Л–≤–Њ–і –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –і—А—Г–≥–Њ–≥–Њ –њ–Њ–і–≥—А—Г–њ–њ–Њ–≤–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Є–ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—Б—Е–Њ–і–љ–Њ–є –§–Т –Ы–Ц –Љ–µ–љ–µ–µ 40%.
–Ґ–∞–Ї–ґ–µ –Є–љ—В–µ—А–µ—Б–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –ї—Г—З—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–∞–Љ–Є–њ—А–Є–ї–∞ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 65 –ї–µ—В, –∞ —В–∞–Ї–ґ–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є—Б—Е–Њ–і–љ–Њ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й—Г—О —В–µ—А–∞–њ–Є—О b-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –Ї–∞–ї—М—Ж–Є—П.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ TRACE –±—Л–ї–Њ –њ–Њ—Б–ї–µ–і–љ–Є–Љ –≤ —Б–µ—А–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е. –Ю—В –і—А—Г–≥–Є—Е –µ–≥–Њ –Њ—В–ї–Є—З–∞–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–њ—А–Њ—Й–µ–љ–Є–µ –Ї—А–Є—В–µ—А–Є–µ–≤ –Њ—В–±–Њ—А–∞. –С–Њ–ї—М–љ—Л—Е –≤–Ї–ї—О—З–∞–ї–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ—Б–ї–µ —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –Ш–Ь, —В–Њ–ї—М–Ї–Њ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е –і–≤—Г—Е–Љ–µ—А–љ–Њ–≥–Њ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –§–Т –Ы–Ц –і–Њ–ї–ґ–љ–∞ –±—Л–ї–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –±–Њ–ї–µ–µ 35%. –Ґ—А–∞–љ–і–Њ–ї–∞–њ—А–Є–ї –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –љ–∞–Ј–љ–∞—З–∞–ї–Є –љ–∞ 3вАУ7-–є –і–µ–љ—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 2 –≥–Њ–і–∞. –°–њ—Г—Б—В—П 26,5 –Љ–µ—Б –љ–∞–±–ї—О–і–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –і–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–∞–љ–µ–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е SAVE –Є AIRE: –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ –≥—А—Г–њ–њ–µ —В—А–∞–љ–і–Њ–ї–∞–њ—А–Є–ї–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ (–љ–∞ 22%; —А<0,0014). –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –±—Л–ї–Њ —Б–і–µ–ї–∞–љ–Њ –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, –Є–Љ–µ—О—Й–µ–µ —З–Є—Б—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ: вАЬ... –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ 2/3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –ї–µ–≤–Њ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –љ–∞ 3вАУ7-–є –і–µ–љ—М –њ–Њ—Б–ї–µ –Ш–Ь —П–≤–ї—П—О—В—Б—П –Ї–∞–љ–і–Є–і–∞—В–∞–Љ–Є –љ–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —В—А–∞–љ–і–Њ–ї–∞–њ—А–Є–ї–Њ–Љ, –Є —В–∞–Ї–∞—П —В–µ—А–∞–њ–Є—П —Г–ї—Г—З—И–∞–µ—В –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–љ–Є–ґ–∞–µ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—МвАЭ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є AIRE –Є TRACE –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –і–Њ–њ–Њ–ї–љ–Є–ї–Є —А–∞–љ–µ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SAVE –Є –њ–Њ—Б–ї—Г–ґ–Є–ї–Є —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Є–Р–Я–§ –±–Њ–ї—М–љ—Л–Љ –њ–Њ—Б–ї–µ –Ш–Ь.
–Х—Й–µ –Њ–і–љ–Є–Љ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ —Н—В–Њ–Љ—Г —П–≤–Є–ї–Є—Б—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є CCS-1, GISSI-3 –Є ISIS-4. –Ъ–∞–ґ–і–Њ–µ –Є–Ј –љ–Є—Е –≤–Ї–ї—О—З–∞–ї–Њ –Њ–≥—А–Њ–Љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 13 634, 19 394 –Є 58 050 —З–µ–ї–Њ–≤–µ–Ї), –Є –≤—Б–µ –Њ–љ–Є –±—Л–ї–Є –њ—А–Є–Ј–≤–∞–љ—Л –і–∞—В—М –Њ—В–≤–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞ –Њ–і–Є–љ –≤–Њ–њ—А–Њ—Б: –љ–∞–і–Њ –ї–Є –љ–∞–Ј–љ–∞—З–∞—В—М –Є–Р–Я–§ –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —Б –Њ—Б—В—А—Л–Љ –Ш–Ь –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —А–∞–Ј–ї–Є—З–љ—Л –њ–Њ –і–Є–Ј–∞–є–љ—Г (–≥—А—Г–њ–њ–∞–Љ –љ–∞–±–ї—О–і–µ–љ–Є—П) –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ–Њ–Љ—Г –Є–Р–Я–§ (–Ї–∞–њ—В–Њ–њ—А–Є–ї –Є–ї–Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї), –љ–Њ –≤ –Њ—Б—В–∞–ї—М–љ–Њ–Љ –Њ–љ–Є –±—Л–ї–Є –Њ—З–µ–љ—М –њ–Њ—Е–Њ–ґ–Є (—Б–Љ. —В–∞–±–ї–Є—Ж—Г): –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ (24вАУ36 —З –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞), –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П (1 –Љ–µ—Б вАУ 6 –љ–µ–і), —Б–ї–∞–±–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е (–Ї–Њ—В–Њ—А–Њ–µ –і–∞–ґ–µ –љ–µ –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CCS-1) –Є –љ–∞–ї–Є—З–Є–µ –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ 1-–µ —Б—Г—В–Ї–Є –Ш–Ь, —В—А–µ–±–Њ–≤–∞–≤—И–Є—Е –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Ґ–∞–Ї, –≤ –Ї–Є—В–∞–є—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б –Ї–∞–њ—В–Њ–њ—А–Є–ї–Њ–Љ (–°–°S-1) –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л.
вАҐ –Я–∞—Ж–Є–µ–љ—В—Л, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ –Ї–∞–њ—В–Њ–њ—А–Є–ї, –≤ 1,7 —А–∞–Ј–∞ —З–∞—Й–µ –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З–µ–Љ –±–Њ–ї—М–љ—Л–µ –Є–Ј –≥—А—Г–њ–њ—Л –њ–ї–∞—Ж–µ–±–Њ.
вАҐ –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –≥–Є–њ–Њ—В–µ–љ–Ј–Є—П —А–∞–Ј–≤–Є–≤–∞–ї–∞—Б—М –≤ 1-–µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ї–∞–њ—В–Њ–њ—А–Є–ї–∞.
вАҐ –Ч–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П —Г 37 –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –Ї–∞–њ—В–Њ–њ—А–Є–ї–Њ–Љ, —А–∞–Ј–≤–Є–ї—Б—П –Ї–∞—А–і–Є–Њ–≥–µ–љ–љ—Л–є —И–Њ–Ї.
–°—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –≤ –і–≤—Г—Е –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –І—В–Њ –ґ–µ –Ї–∞—Б–∞–µ—В—Б—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї–Є, —В–Њ, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї –њ–Њ–і–≥—А—Г–њ–њ–Њ–≤–Њ–є –∞–љ–∞–ї–Є–Ј –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е GISSI-3 –Є ISIS-4, –љ–µ—Б—А–∞–≤–љ–Є–Љ–Њ –ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –≤ –њ–Њ–і–≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –ї–µ–≤–Њ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Є –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –њ—А–Є—З–µ–Љ –±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Њ —Б–њ–∞—Б–µ–љ–Њ –Є–Љ–µ–љ–љ–Њ –≤ 1-–µ —Б—Г—В–Ї–Є –Њ—В –љ–∞—З–∞–ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ, –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–∞–Є–ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –±–Њ–ї—М–љ—Л–Љ –њ–Њ—Б–ї–µ –Ш–Ь —Б–ї–µ–і—Г–µ—В –Њ–ґ–Є–і–∞—В—М —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л вАЬ–њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞вАЭ. –Ґ–∞–Ї–Є–µ –±–Њ–ї—М–љ—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –ї–µ–≥–Ї–Њ –≤—Л—П–≤–ї–µ–љ—Л –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –ї—О–±—Л–Љ –≤—А–∞—З–Њ–Љ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є –±–µ–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –і–Њ—А–Њ–≥–Њ—Б—В–Њ—П—Й–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –ї–Є—И—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞, –і–∞–љ–љ—Л—Е —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є–Є, –≠–Ъ–У –Є –і–≤—Г—Е–Љ–µ—А–љ–Њ–є —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є–Є. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Н—В–Є –њ–∞—Ж–Є–µ–љ—В—Л –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М –Њ–і–Є–љ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–ї–µ–і—Г—О—Й–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤: –§–Т –Ы–Ц –Љ–µ–љ–µ–µ 40%, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ–ї–Њ—Б—В–Є –Ы–Ц, –Њ–±—И–Є—А–љ—Л–є –њ–µ—А–µ–і–љ–Є–є –Ш–Ь, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –°–Э, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–Є—Г—А–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ю —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Є–Р–Я–§ –ї—Г—З—И–µ –≤—Б–µ–≥–Њ –≥–Њ–≤–Њ—А—П—В —Ж–Є—Д—А—Л: —З—В–Њ–±—Л —Б–њ–∞—Б—В–Є –ґ–Є–Ј–љ—М –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –њ—А–Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–Њ–і—Е–Њ–і–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±—Л–ї–Њ –њ—А–Њ–ї–µ—З–Є—В—М –Њ–Ї–Њ–ї–Њ 200 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAVE вАУ 66, –≤ AIRE вАУ 22 –Є –≤ TRACE вАУ 24.
–Ъ–Њ–≥–і–∞ –љ–∞—З–Є–љ–∞—В—М —В–µ—А–∞–њ–Є—О –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь?
–Ю—В–≤–µ—В–Є–≤ –љ–∞ –≤–Њ–њ—А–Њ—Б, –Ї–Њ–Љ—Г –љ–∞–Ј–љ–∞—З–Є—В—М –Є–Р–Я–§, –≤—А–∞—З –і–Њ–ї–ґ–µ–љ —А–µ—И–Є—В—М, –Ї–Њ–≥–і–∞ —Н—В–Њ —Б–і–µ–ї–∞—В—М. –Ш–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ—Л—Е –≤—Л—И–µ —А–∞–±–Њ—В —Б–ї–µ–і—Г–µ—В, —З—В–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –і–≤–∞ –њ–Њ–і—Е–Њ–і–∞: –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –љ–∞ 3вАУ16 –і–µ–љ—М (—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SAVE, AIRE, TRACE) –Є —А–∞–љ–љ–µ–µ –Є–ї–Є –Њ—З–µ–љ—М —А–∞–љ–љ–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь (–і–Њ 36 —З) (CONSENSUS II, CCS-1, GISSI-3, ISIS-4, SMILE). –Ъ–∞–Ї–Њ–є –ґ–µ –≤–∞—А–Є–∞–љ—В –±–Њ–ї–µ–µ –Њ–њ—А–∞–≤–і–∞–љ –Є –Љ–µ–љ–µ–µ —А–Є—Б–Ї–Њ–≤–∞–љ?
–Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ —В–Њ–ї—М–Ї–Њ –≤ –Њ–і–љ–Њ–Љ –Є–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (SMILE) –±—Л–ї–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ: —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–ї—Г—З–∞–µ–≤ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є, —В—А–µ–±—Г—О—Й–µ–є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–µ, –±—Л–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–µ —Б –њ–ї–∞—Ж–µ–±–Њ (3,8% –њ—А–Њ—В–Є–≤ 2,7%), –Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–ї —А–Є—Б–Ї –≥–Њ–і–Є—З–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 29% (—А=0,011). –Э–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SMILE –±—Л–ї–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ, –Є –≤ –љ–µ–≥–Њ –≤–Њ—И–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —В–Њ–ї—М–Ї–Њ —Б –њ–µ—А–µ–і–љ–Є–Љ –Њ—Б—В—А—Л–Љ –Ш–Ь. –Ф–∞–љ–љ—Л–є —Д–∞–Ї—В —Б–ї—Г–ґ–Є—В –µ—Й–µ –Њ–і–љ–Є–Љ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь, –≥–∞—А–∞–љ—В–Є—А—Г—О—Й–µ–≥–Њ —Г—Б–њ–µ—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Б—А–Њ–Ї–Њ–≤ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П.
–Ю–і–љ–∞–Ї–Њ –њ–Њ –Љ–љ–µ–љ–Є—О –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–Љ—Г –љ–∞ –Њ–њ—Л—В–µ –Њ—Б—В–∞–ї—М–љ—Л—Е —З–µ—В—Л—А–µ—Е –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь –Љ–Њ–ґ–µ—В –±—Л—В—М —А–Є—Б–Ї–Њ–≤–∞–љ–љ–Њ, –∞ –Є–љ–Њ–≥–і–∞ –Є –њ—А–Њ—Б—В–Њ –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ–Њ –Њ–њ–∞—Б–љ–Њ:
вАҐCONSENSUS II –±—Л–ї–Њ –Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –і–Њ—Б—А–Њ—З–љ–Њ –Є–Ј-–Ј–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —Б–Љ–µ—А–љ–Њ—Б—В–Є –≤ –≥—А—Г–њ–њ–µ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ;
вАҐ –≤ –°–°S-1 –Є GISSI-3 –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Г—Б—В–Њ–є—З–Є–≤–Њ–є –≥–Є–њ–Њ—В–Њ–љ–Є–Є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§;
вАҐ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –°–°S-1 –Є ISIS-4 –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–ї—Г—З–∞–µ–≤ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–Њ–≥–µ–љ–љ–Њ–≥–Њ —И–Њ–Ї–∞.
–С–∞–Ј–Є—А—Г—П—Б—М –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є SAVE, AIRE –Є TRACE —В–∞–Ї–ґ–µ –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ш–Р–Я–§ –љ–∞ 3вАУ16 –і–µ–љ—М –њ–Њ—Б–ї–µ –Ш–Ь –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —В–Њ—А–Љ–Њ–Ј–Є—В —А–∞–Ј–≤–Є—В–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц, –Є —А–Є—Б–Ї –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Љ–Є–љ–Є–Љ–∞–ї–µ–љ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –µ—Б–ї–Є –≤–Ј–≤–µ—Б–Є—В—М —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Є –њ–Њ–ї—М–Ј—Л, —В–Њ —Б–Ї–µ–њ—В–Є–Ї—Г –і–Њ–≤–Њ–ї—М–љ–Њ –њ—А–Њ—Б—В–Њ –њ—А–Є–і—В–Є –Ї –Ј–∞–Ї–ї—О—З–µ–љ–Є—О, —З—В–Њ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ. –Ю–і–љ–∞–Ї–Њ, –µ—Б–ї–Є –љ–∞ –і—А—Г–≥—Г—О —З–∞—И—Г –≤–µ—Б–Њ–≤ –њ–Њ–ї–Њ–ґ–Є—В—М —В–µ —Д–∞–Ї—В—Л, –Ї–Њ—В–Њ—А—Л–µ –Љ—Л –Є–Љ–µ–µ–Љ –њ–Њ—Б–ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є SMILE, GISSI-3 –Є ISIS-4, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Р–Я–§ –Љ–Њ–ґ–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Б–њ–∞—Б—В–Є –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Ш–Ь, —В–Њ —В–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –≥—А—Г–њ–њ—Л вАЬ–њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞вАЭ (—Б –Њ–±—И–Є—А–љ—Л–Љ –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –°–Э) —П–≤–ї—П–µ—В—Б—П –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ, –µ—Б–ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Б–Є–Љ–њ—В–Њ–Љ—Л –≥–Є–њ–Њ—В–Њ–љ–Є–Є (–Є—Б—Е–Њ–і–љ–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Р–Ф –љ–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–Є–ґ–µ 100 –Љ–Љ —А—В.—Б—В.). –Я—А–Є –љ–∞—А—Г—И–µ–љ–Є–Є —Н—В–Њ–≥–Њ –њ—А–∞–≤–Є–ї–∞ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Б—В–Њ–є–Ї–Њ–є –≥–Є–њ–Њ—В–Њ–љ–Є–Є –Є –Ї–∞—А–і–Є–Њ–≥–µ–љ–љ–Њ–≥–Њ —И–Њ–Ї–∞, –∞ —Н—Д—Д–µ–Ї—В –Њ—В —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –Љ–Є–љ–Є–Љ–∞–ї–µ–љ.
–Т—Л–±–Њ—А –Є–Р–Я–§ –Є –і–Њ–Ј—Л
–£—З–Є—В—Л–≤–∞—П, —З—В–Њ —Г—Б–њ–µ—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ—Б–ї–µ –Ш–Ь –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Є–Р–Я–§, –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ –Ї–ї–∞—Б—Б-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –µ–≥–Њ –і–µ–є—Б—В–≤–µ–љ–љ–Њ—Б—В—М, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н—Д—Д–µ–Ї—В–∞, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —В–Ї–∞–љ–µ–≤–Њ–є –Р–Я–§ –Є –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞. –° —Н—В–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Є–љ—В–µ—А–µ—Б–љ–Њ —Б—А–∞–≤–љ–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є CONSENSUS II –Є ISIS-4. –Т CONSENSUS II —В–µ—А–∞–њ–Є—П —Н–љ–∞–ї–∞–њ—А–Є–ї–Њ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ/per os –±—Л–ї–∞ –љ–∞—З–∞—В–∞ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 15 —З –Њ—В –љ–∞—З–∞–ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–∞—Ж–Є–µ–љ—В—Л –≤ ISIS-4 –љ–∞—З–∞–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М –Ї–∞–њ—В–Њ–њ—А–Є–ї —Б–њ—Г—Б—В—П 6 —З –њ–Њ—Б–ї–µ –њ–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–≥—А—Г–і–Є–љ–љ—Л—Е –±–Њ–ї–µ–є. –Ю–і–љ–Њ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Њ—В–ї–Є—З–Є–є –Ї–∞–њ—В–Њ–њ—А–Є–ї–∞ –Њ—В —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ (–њ–Њ–Љ–Є–Љ–Њ –Є—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л) –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –µ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Х—Б–ї–Є —Г—З–µ—Б—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ –±—Л–ї–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–њ–∞—Б–љ–Њ –≤ CONSENSUS II, —В–Њ –ї–Њ–≥–Є—З–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–Р–Я–§ (–Ї–∞–њ—В–Њ–њ—А–Є–ї–∞) –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ—А–Є —А–∞–љ–љ–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–Њ—Б–ї–µ –Ш–Ь –Љ–Њ–ґ–µ—В –±—Л—В—М –±–Њ–ї–µ–µ –њ—А–µ–Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ.
–І—В–Њ –ґ–µ –Ї–∞—Б–∞–µ—В—Б—П –і–Њ–Ј, —В–Њ –Є—Е –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ—А–Є–±–ї–Є–ґ–∞—В—М –Ї —В–µ–Љ, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Э–∞–њ—А–Є–Љ–µ—А, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAVE –Ї–∞–њ—В–Њ–њ—А–Є–ї –њ—А–Є–Љ–µ–љ—П–ї–Є –≤ –і–Њ–Ј–µ 50 –Љ–≥ 3 —А–∞–Ј–∞ –≤ –і–µ–љ—М, –∞ —Н–љ–∞–ї–∞–њ—А–Є–ї –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є вАУ SOLVD вАУ 10вАУ20 –Љ–≥ 2 —А–∞–Ј–∞ –≤ –і–µ–љ—М. –Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ –Љ—Л, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ —Б—В–∞–ї–Ї–Є–≤–∞–µ–Љ—Б—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞. –Я–Њ–љ—П—В–љ–Њ, –∞ –њ–Њ—А–Њ–є –Є –Њ–њ—А–∞–≤–і–∞–љ–Њ –Њ–њ–∞—Б–µ–љ–Є–µ –≤—А–∞—З–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (—В–Њ–є –ґ–µ –≥–Є–њ–Њ—В–Њ–љ–Є–Є) –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –Є–Р–Я–§. –Э–Њ –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ–ї—М–Ј—П –Ј–∞–±—Л–≤–∞—В—М –Њ –њ—А–∞–≤–Є–ї–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Р–Я–§, –Њ —В–Њ–Љ, —З—В–Њ –њ–Њ—А–Њ–є –њ–Њ–і–±–Њ—А –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј—Л –Љ–Њ–ґ–µ—В –Є–і—В–Є –љ–µ –і–љ–Є –Є –љ–µ–і–µ–ї–Є, –∞ –Љ–µ—Б—П—Ж—Л. –Ш —В–Њ–ї—М–Ї–Њ –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Љ–Њ–ґ–љ–Њ –љ–∞–і–µ—П—В—М—Б—П –љ–∞ —Г—Б–њ–µ—Е.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–Є —Е–Њ—В–µ–ї–Њ—Б—М –±—Л –µ—Й–µ —А–∞–Ј –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–∞–Є–ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є (–і–∞–ґ–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–Љ–Є) –°–Э –Є —Б–љ–Є–ґ–µ–љ–љ–Њ–є –§–Т –Ы–Ц. –° —Ж–µ–ї—М—О —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Р–Я–§ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ —Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б—В–∞–±–Є–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ —А–∞–љ–µ–µ, —З–µ–Љ —З–µ—А–µ–Ј 24 —З –Њ—В –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞. –Э–µ —В—А–µ–±—Г–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ—Г–ґ–і–∞—О—Й–Є—Е—Б—П –≤ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§. –Ы—О–±–Њ–є –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–є –≤—А–∞—З –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ —В–Њ–ї—М–Ї–Њ –ї–Є—И—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ –Є –Њ–±—Л—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–≠–Ъ–У, —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Є –≠—Е–Њ–Ъ–У) –Љ–Њ–ґ–µ—В —Б –≤—Л—Б–Њ–Ї–Њ–є —В–Њ—З–љ–Њ—Б—В—М—О –≤—Л—П–≤–Є—В—М –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —В–µ—А–∞–њ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Pfeffer M.A., Braunwald E., Moye L.A., et al., on behalf of the SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival and Ventricular Enlargement Trial. N. Engl.J.Med. 1992; 327: 669вАУ77.
2.Swedberg K., Held P., Kjekshus J., et al., on behalf of the CONSENSUS II Study Group. Effects of early administration of enalapril on mortarlity in patients with acute myocardial infarction. Results of Cooperative North Scandinavian Enalapril Survival Study II (CONSENSUS II). N. Engl. J. Med.1992; 327: 678вАУ84.
3.The Acute Infarction Ramipril Efficacy (AIRE) Investigators.Effects of ramipril on mortality and morbidity or survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993; 342: 821вАУ8.
4.ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomized factorial trial assessing early oral captopril, oral mononitrate, and of intravenous magnesium sulfate in 58050 patients with suspected acute myocardial infarction. Lancet 1995; 345: 669вАУ85.
5.Chinese Cardiac Study Collaborative Group. Oral captopril versus placebo among 13634 patients with with suspected acute myocardial infarction: interim report from the Chinese Cardiac Study (CCS-1). Lancet 1995; 345: 686вАУ7.
6.GISSI-3 Investigators. GISSI-3:Effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Lancet 1994; 343: 1115вАУ22.
7.Kaber L., Torp-Pedersen C. Clinical characteristics and mortality of patiens sceened for entry into the Trandolapril Cardiac Evaluation (TRACE) study. Am.J.Cardiol. 1995; 76: 1вАУ5.
8.Ambroseoni E.,Borghi C., Magnani B., et al. The effect of the angiotensin-converting-enzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. N.Engl. J. Med. 1995; 332: 80вАУ5.
9.Ball S., Hall A., Murray G. Angiotensin-converting-enzyme inhibitors after myocardial infarction: indication and timing. J. Am. Cardiol. 1995; 25(Suppl.): 42SвАУ6S.
10.Poole-Wilson P.A. Angiotensin-converting-enzyme inhibitors and calcium antagonists after myocardial infarction. J.Am. Cardiol. 1995; 75: 4EвАУ9E.
11. Ball S, Hall A. What to expect from ACE inhibitors after myocardial infarction. Br. Heart J. 1994; 72 (Suppl): 70вАУ4.
| –Я—А–Є–ї–Њ–ґ–µ–љ–Є—П –Ї —Б—В–∞—В—М–µ |
| –Є–Р–Я–§ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О |
| –Т–ї–Є—П—П –љ–∞ —В–Њ–љ—Г—Б –∞—А—В–µ—А–Є–Њ–ї –Є –≤–µ–љ—Г–ї –Є–Р–Я–§ —Г–Љ–µ–љ—М—И–∞—О—В –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ —Б–µ—А–і—Ж–µ |
| –Я—А–Є –Є–љ—Д–∞—А–Ї—В–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –љ–∞–Є—Е—Г–і—И–Є–є –њ—А–Њ–≥–љ–Њ–Ј –Є–Љ–µ—О—В –њ–∞—Ж–Є–µ–љ—В—Л —Б –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є |
| –Я–∞—Ж–Є–µ–љ—В—Л —Б —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –ї–µ–≤–Њ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –Ї–∞–љ–і–Є–і–∞—В–∞–Љ–Є –љ–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Є–Р–Я–§ |