Артериальная гипертония представляет собой распространенное хроническое заболевание, осложняющееся такими поражениями сосудистой системы, как инфаркт миокарда, инсульт, аневризмы крупных артерий, сердечная и почечная недостаточность, микроваскулярные нарушения. В клинических и эпидемиологических исследованиях давно установлена связь атеросклероза и артериальной гипертонии, которая рассматривается, как один из основных факторов риска развития ишемической болезни сердца (ИБС). Иногда гиперлипидемия и гипертония являются следствиями заболеваний почек. Среди нелеченных больных артериальной гипертонией частота гиперхолестеринемии >240 мг/дл составляет 40%, с другой стороны, до половины лиц с повышенным уровнем холестерина (ХС) в крови имеют систолическую и диастолическую гипертонию і140/90 мм рт.ст. [1–4]. Одним из наиболее значимых исследований, показавших связь между уровнем общего ХС крови и сердечно–сосудистой смертностью больных артериальной гипертонией, является Multiple Risk Factor Intervention Trial (MRFIT) [5]. Его результаты свидетельствуют о том, что чем выше уровень ХС у пациентов с артериальной гипертонией, тем выше сердечно–сосудистая смертность. Вместе с тем при одном и том же уровне ХС смертность больных в связи с ИБС была в 3–4 раза выше при наличии артериальной гипертонии в сравнении с лицами без гипертонии. По данным этого исследования, важное прогностическое значение в отношении заболеваемости и смертности в связи с ИБС у больных артериальной гипертонией имеет также снижение ХС липопротеинов высокой плотности (ЛПВП). Уменьшение ХС ЛПВП <0,9 ммоль/л сопровождалось 4–кратным увеличением риска смертности в связи с ИБС.
Для многих больных артериальной гипертонией, особенно пожилого возраста, характерно наличие множественных факторов риска, составляющих основу так называемого метаболического синдрома – повышение ХС, липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ), глюкозы и инсулина, ожирение висцерального типа, снижение ЛПВП, резистентность к инсулину [6–8]. В настоящее время гиперинсулинемия рассматривается, как независимый фактор риска развития ИБС [9]. Резистентность к инсулину – состояние, при котором снижена способность инсулина осуществлять свои биологические эффекты. Если у таких лиц концентрация инсулина в крови не повышается до патологического уровня, необходимого для компенсации этого дефекта, необходимой стимуляции транспорта глюкозы в мышцы и жировую ткань, подавления печеночной продукции глюкозы, то развивается гипергликемия и сахарный диабет.
В связи с этим больных с артериальной гипертонией и гиперлипидемией относят к группе лиц с высоким риском развития сосудистых осложнений и рекомендуют применение гиполипидеми ческих средств, если концентрация общего ХС в сыворотке крови остается выше 6,5 ммоль/л на фоне гиполипидемической диеты [10, 11].
В настоящее время имеются убедительные доказательства того, что гиполипидемическая терапия снижает риск таких осложнений атеросклероза, как коронарная смерть, инфаркт миокарда, стенокардия и ишемический инсульт. Это стало возможным благодаря разработке и внедрению в практику нового класса гиполипидемических препаратов – ингибиторов 3–гидрокси–3–метилглутарил коэнзим А (ГМГ КоА) редуктазы, называемых статинами [12–15].
Так, в исследовании 4S по вторичной профилактике ИБС, продолжавшемся в среднем 5,4 года, в результате лечения симвастатином коронарная смертность снизилась на 42%, общая смертность – на 30%, частота основных коронарных событий уменьшилась на 34%. Среди 4444 больных 26% имели артериальную гипертонию. Благоприятный эффект лечения наблюдался независимо от исходного уровня ХС, пола и возраста больных [12]. Снижение общей и сердечно–сосудистой смертности в этом исследовании не сопровождалось увеличением смертности от заболеваний, не связанных с атеросклерозом.
В последние годы показано, что статины, кроме гиполипидемического действия, обладают плеотропным эффектом, положительно влияя на морфологическое и функциональное состояние сосудистой стенки у больных атеросклерозом и артериальной гипертонией. Благоприятные результаты лечения статинами могут быть связаны со стабилизацией атеросклеротических бляшек, уменьшением их наклонности к разрыву. С другой стороны, выраженный гиполипидемический эффект, вызываемый статинами, сопровождается улучшением эндотелиальной функции, уменьшением наклонности коронарных артерий к спастическим реакциям [16, 17].
P. Chan и соавт. [18] изучали влияние лечения правастатином (15 мг/сут) на уровень инсулина в крови больных артериальной гипертонией (n=96) и смешанной гиперлипидемией (средний уровень ХС 6,47 ммоль/л, ТГ 3,39 ммоль/л). Через 12 месяцев лечения концентрация ХС достоверно снизилась на 25%, ХС ЛПНП на 32% и ТГ на 11%, ХС ЛПВП повысился на 9%. При этом концентрация инсулина в крови натощак снизилась с 89,0 до 61,5 пкмоль/л (на 31%, p<0,05). Снижение уровня инсулина в крови наблюдалось, несмотря на сопутствующее лечение блокаторами b–адренергических рецепторов и диуретиками.
Артериальная гипертония является наиболее мощным фактором риска развития инсульта. Хотя в патогенезе ИБС и инсульта участвуют много общих факторов риска, вопрос о связи повышенного уровня ХС с инсультом остается дискутабельным [1,2,19,20]. Наблюдения в течение 6 и 12 лет в исследовании MRFIT показали, что гиперхолестеринемия существенно повышает риск фатального негеморрагического инсульта [5].
В некоторых эпидемиологических исследованиях показано, что ХС не является фактором риска инсульта [2]. Тем более интересными являются данные о снижении риска инсульта под влиянием статинов, тогда как другие гиполипидемические средства таким эффектом не обладают [12,20]. Возможным объяснением являются влияния статинов на цереброваскулярные болезни, не связанные с их действием на уровень ХС. Одним из таких механизмов может быть предполагаемое антигипертензивное действие статинов. С другой стороны, согласно мета–анализу, проведенному G. Blauw и соавт. [19], статины не снижают риска фатального инсульта.
Известно, что ряд антигипертензивных препаратов изменяют метаболизм липидов и нередко в неблагоприятную сторону (табл. 1). Так, большинство b–адреноблокаторов влияют на метаболизм липопротеинов очень низкой плотности (ЛПОНП), снижают активность липопротеинлипазы в скелетных мышцах. В результате содержание ТГ в частицах ЛПОНП и ЛПНП увеличивается, а концентрация ЛПВП снижается. Однако эти нарушения отмечаются в первые месяцы лечения и у большинства больных исчезают в течение первого года, особенно при применении малых доз мочегонных.

Значительное число больных артериальной гипертонией (43%) вошло в исследование CARE, в котором оценивалось влияние терапии правастатином на частоту возникновения сердечной смерти или инфаркта миокарда у больных с постинфарктным кардиосклерозом [13]. В исследование было включено 4159 пациентов, имеющих общий ХС<6,2 ммоль/л, ХС ЛПНП 3,0–4,5 ммоль/л, ТГ<4,0 ммоль/л. Терапия правастатином сопровождалась уменьшением риска возникновения осложнений ИБС на 24% (сердечной смерти, инфаркта миокарда, необходимости шунтирования коронарных артерий и баллонной ангиопластики), у больных с артериальной гипертонией относительный риск сосудистых осложнений снизился на 23%.
Учитывая связь между гипертриглицеридемией и возникновением ИБС у больных артериальной гипертонией, медикаментозная терапия рекомендуется при уровне ТГ>4,5 ммоль/л. Целью лечения является достижение концентрации ТГ<2,0 ммоль/л. Данную тактику следует использовать при гипертриглицеридемии у больных артериальной гипертонией, не имеющих ИБС или ее основных факторов риска. При наличии ИБС медикаментозная терапия рекомендована при уровне ТГ>1,7 ммоль/л.
Исследования, связанные с применением статинов у больных артериальной гипертонией, немногочисленны. Имеющиеся данные позволяют сделать вывод о схожести влияния статинов на ХС основных классов липопротеинов и ТГ и об одинаковой частоте возникновения побочных действий при приеме статинов у больных с артериальной гипертонией и нормальным давлением крови. Это суждение подтверждают результаты исследования 4S, согласно которым терапия симвастатином у больных артериальной гипертонией с изолированной гиперхолестеринемией сопровождалась изменениями основных показателей липидного обмена, идентичными тем, которые имели место у больных без гипертонии.
Уже в ранних исследованиях было показано, что первый препарат из группы статинов – ловастатин одинаково эффективен по всем липидным параметрам как у нормотензивных лиц, так и у больных артериальной гипертонией [27].
Д.М. Аронов и соавт. [28] проводили лечение флувастатином у 74 больных гипертонической болезнью средней тяжести, имевших повышенные уровни общего ХС (>6,6 ммоль/л) и ХС ЛПНП (>4,1 ммоль/л). К началу лечения флувастатином АД было нормализовано с помощью антагонистов кальция, b–адреноблокаторов, ингибиторов ангиотензинпревращающего фермента в виде монотерапии или комбинированного применения. Через 12 недель лечения флувастатином в дозе 20–40 мг в сутки отмечены следующие достоверные изменения липидов крови: снижение общего ХС на 14%, ХС ЛПНП на 21%, повышение ХС ЛПВП на 13%. В результате индекс атерогенности снизился на 29%. Переносимость препарата была хорошей у 95% больных, сохранялось состояние стабильной коррекции АД.
T. Peters и соавт. [29,30] провели ретроспективный анализ клинической базы данных о 1815 больных, получавших флувастатин в дозе 20–40 мг/сутки, в сравнении с группой плацебо (n=783). В группе, леченной флувастатином, было 18,3% больных артериальной гипертонией, а в группе плацебо 15,8%. Средняя длительность лечения составила 19,8±15,2 недель. Независимо от наличия артериальной гипертонии снижение ХС ЛПНП под влиянием 20 мг флувастатина составило 20% и 26% при дозе 40 мг (в группе плацебо 1,4%). Уровень ХС ЛПВП увеличился у всех больных в группе флувастатина, наибольший подъем (5,1%) отмечался у больных гипертонией, получавших 40 мг флувастатина. Наибольшее снижение ТГ (10,4%) было у больных гипертонией при дозе флувастатина 40 мг. Однако отмеченные различия в концентрации ХС ЛПВП и ТГ были статистически недостоверными при сравнении больных с артериальной гипертонией и нормальным давлением крови. В группе больных артериальной гипертонией трехкратное повышение уровня аспарагиновой трансаминазы отмечено у 0,2%, аланиновой трансаминазы у 0,7% больных, в группе плацебо аланиновая трансаминаза повысилась у 0,2% больных. Повышение креатинфосфокиназы более чем в 10 раз выше нормы отмечено у 0,3% больных обеих групп. Авторы делают вывод, что наличие артериальной гипертонии существенно не влияет на эффективность и толерантность больных при лечении гиперлипидемии флувастатином. Гиполипидемические эффекты флувастатина не изменялись при сочетании с такими антигипертензивными средствами, как блокаторы b–адренергических рецепторов, диуретики, антагонисты кальция и ингибиторы ангиотензинпревращающего фермента. Переносимость флувастатина также не зависела от характера сопутствующей терапии артериальной гипертонии [30]. Клинические испытания пролонгированной формы флувастатина (XL) 80 мг показали еще более высокую эффективность (снижение ХС ЛНП на 38%) и хорошую переносимость этого препарата [31, 32]. Кроме того, достигнуто снижение уровня общего ХС на 31% и повышение ХС ЛПВП на 21%.
Статины и фибраты оказывают различное влияние на показатели липидного спектра крови у больных артериальной гипертонией с изолированной гиперхолестеринемией в сравнении с больными, имеющими смешанную гиперлипидемию. Полученные результаты дали основание рекомендовать больным артериальной гипертонией лечение статинами при смешанной и изолированной гиперхолестеринемии, а назначение фибратов – у больных с преимущественным увеличением уровня ТГ.
Весьма интересны данные I. Jonkers и соавт. [33] о том, что назначение безафибрата 400 мг/сутки больным 17 больным с эндогенной гипертриглицеридемией >4,0 ммоль/л (из них у 5 была артериальная гипертония) сопровождалось снижением ТГ на 65%, систолического АД со 137 до 132 мм рт.ст. (p<0,01) и концентрации эндотелина–1 на 10%, при этом концентрация cGMP увеличилась с 4,7±1,4 до 5,8±1,8 нмоль/л (p=0,008). Отмеченные положительные результаты авторы связывают с улучшением эндотелиальной функции под влиянием гиполипидемической терапии.
В 1988 г. R. Williams и соавт. [34] описали семейную дислипидемическую гипертонию, частота которой среди больных эссенциальной гипертонией составляет 12%. Предполагают, что в основе этой генетической предрасположенности к гипертонии лежат нарушения Li+–Na+ противотранспорта в мембранах гладкомышечных клеток [35]. По данным A. Weder и соавт. [36], лечение ловастатином 40–80 мг/день сопровождалось снижением внутриклеточного Na+ в эритроцитах, но не изменяло мембранный Li+–Na+ противотранспорта или Na+–K+–Cl– котранспорта.
Влияние статинов на больных артериальной гипертонией не ограничивается их положительным действием на липидный спектр крови. В последние годы накоплено много данных, позволяющих предполагать прямое вазодилатирующее действие статинов на стенку сосудов [37,38]. S. Wassmann и соавт. [37] в опытах на нормолипидемических крысах со спонтанной гипертензией (SHR), представляющей собой экспериментальную модель гипертонической болезни человека, обнаружили снижение АД с 204±6 мм рт.ст. до 184±5 мм рт.ст. (p<0,05), что сопровождалось улучшением показателей эндотелиальной функции и снижением вазоконстрикции, индуцируемой ангиотензином II, уменьшением экспрессии рецепторов ангиотензиновых AT1 в стенке аорты на 50%. С другой стороны, активность эндотелиальной клеточной NO–синтазы увеличилась на 209±46% в сравнении с контролем [37].
Комбинированная терапия статинами и фибратами может быть рекомендована у больных со смешанной гиперлипидемией и высоким риском возникновения ИБС в тех случаях, когда назначение препарата одной из этих групп не позволяет добиться желаемого результата в отношении нормализации показателей липидного профиля. В случаях, когда высокий уровень ТГ не снижается под влиянием физических упражнений, снижения веса, применения фибратов, рекомендуется прием рыбьего жира в дозах от 1,5 г до 10 г в сутки, что позволяет снизить уровень ТГ на 50 мг/дл.
Важность лечения гиперлипидемии у больных артериальной гипертонией подчеркивается в международных и национальных рекомендациях по профилактике и лечению ИБС [39–42]. В связи с этим особый интерес представляет вопрос о возможных лекарственных взаимодействиях гиполипидемических препаратов со средствами лечения ИБС и артериальной гипертонии.
Выводы
1. У больных артериальной гипертонией в момент постановки диагноза необходимо оценивать концентрацию общего ХС, ТГ, ХС ЛПВП и ХС ЛПНП.
2. Цели гиполипидемической терапии у больных артериальной гипертонией определяются в зависимости от наличия сопутствующих факторов риска ИБС (табл. 2).
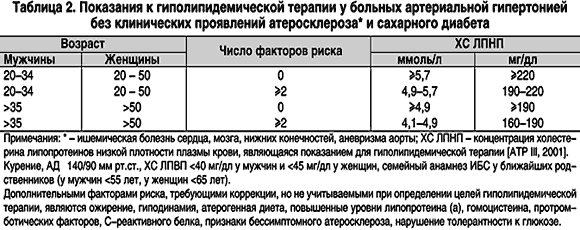
4. При сочетании артериальной гипертонии с ИБС или сахарным диабетом 2 типа показана интенсивная гиполипидемическая терапия, основные показатели липидного спектра должны поддерживаться на следующем уровне:
- ХС ЛПНП <100 мг/дл (<2,6 ммоль/л)
- ХС ЛПВП >40 мг/дл (>1,04 ммоль/л)
- триглицериды <180 мг/дл (<2,0 ммоль/л).
Литература:
1. Anderson K.M. et al. Cholesterol and mortality: 30 years of follow–up from the Framingham Study. JAMA, 1987, 257: 2176 – 2180.
2. Prospective Studies Collaboration. Cholesterol, diastolic blood pressure and stroke: 13000 strokes in 450000 people in 45 prospective cohorts. Lancet, 1995, 346: 1647 – 1653.
3. Weinberger M.H. Antihypertensive therapy and lipids. Arch. Intern. Med., 1985, 145: 1102 – 1105.
4. Zanchetti A. Hyperlipidemia in the hypertensive patient. Am. J. Med., 1994, 96, Suppl. 6A: 3 – 8.
5. Stamler J., Vaccaro O., Neaton J.D. et al. for the Multiple Risk Factor Intervention Trial Research Group: Diabetes, other risk factors, and 12–yr cardiovascular mortality for men screened in the Multiple Risk Factor Intervention Trial. Diabetes Care 1993; 16: 434 – 444.
6. Ferranini E., Buzzigoli G., Bonadonna R. et al. Insulin resistance in essential hypertension. N. Engl. J. Med., 1987, 317: 350 – 357.
7. Swislocki A.L., Hoffman B.B., Reaven G.M. Insulin resistance, glucose intolerance and hyperinsulinemia in patients with hypertension. Am. J. Hypertens., 1989, 2: 419 – 423.
8. Моисеев В.С., Ивлева А.Я., Кабалава Ж.Д. Гипертония, сахарный диабет, атеросклероз – клинические проявления метаболического синдрома Х. Перспективы фармакологической коррекции. Вестник РАМН, 1995, 5: 15 – 18.
9. Zavarony I., Bonora E., Pagliara M. et al. Risk factors for coronary artery disease in healthy persons with hyperinsulinemia and normal glucose tolerance. N. Engl. J. Med., 1989, 320: 702 – 706.
10. Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure and the National High Blood Pressure Education Program Committee. The sixth report of the Joint National Committee on prevention, detection, evaluation and treatment of high blood pressure. Arch. Intern, Med., 1988, 157: 2413 – 2446.
11. Expert panel on detection, evaluation, and treatment of high blood cholesterol in adults. Executive summary of the Third Report on National Cholesterol Education Program Expert Panel on detection, evaluation, and treatment of high blood cholesterol in adults. JAMA, 2001, 285: 2486 – 2497.
12. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet, 1994, 344: 1383 – 1389.
13. Sacks F.M., Pfeffer M.A., Moye L.A. et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N. Engl. J. Med., 1996, 335: 1001 – 1009.
14. Long–Term Intervention with Pravastatin in Ischemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N. Engl. J. Med., 1998, 339: 1349 – 1357.
15. Shepherd J., Cobble S.M., Ford J. et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N. Engl. J. Med., 1995, 333: 1301 – 1307.
16. Laufs U., La Fata V., Plutsky J. et al. Upregulation of endothelial nitric oxide synthase by HMG–CoA reductase inhibitors. Circulation, 1998, 97: 1129 – 1135.
17. O’Driscoll G., Green D., Taylor R.R. Simvastatin, an HMG–CoA reductase inhibitor, improves endothelial function within 1 month. Circulation, 1997, 95: 1126 – 1131.
18. Chan P., Tomlinson B., Lee C.–B. et al. Beneficial effects of pravastatin on fasting hyperinsulinemia in elderly hypertensive hypercholesterolemic subjects. Hypertension, 1996, 28: 647 – 651.
19. Blauw G.J. et al. Stroke, statins and cholesterol. A meta–analysis of randomized, placebo–controlled, double–blind trials with HMG–CoA reductase inhibitors. Stroke,1997, 28: 946 – 950.
20. Sandercock P. Statins for stroke prevention? Lancet, 2001, 357: 1548.
21. Lardinois C.K., Neuman S.L. The effects of antihypertensive agents on serum lipids and lipoproteins. Am. Heart J., 1991, 121: 696 – 701.
22. Yusuf S., Peto R., Lewis J. et al. Beta–blockade during and after myocardial infarction: an overview of the randomized trials. Progr. Cardiov. Dis., 1985, 27: 335 – 371.
23. Collins R., Peto R., MacMahon S. et al. Blood pressure, stroke and coronary heart disease. Part 2, short–term reductions in blood pressure: overview of randomized drug trials in their epidemiological context. Lancet, 1990, 335: 827 – 838.
24. The ALLHAT officers and coordinators for the ALLHAT collaborative research group. Major cardiovascular events in hypertensive patients randomised to doxazosin vs chlorthalidone. JAMA, 2000, 283: 1967 – 1975.
25. Pollare T., Lithell H., Berne C. Influence of beta–blockers and thiazide diuretics on glucose tolerance and insulin resistance in patients with arterial hypertension. Br. Med. J., 1989, 298: 1152 – 1157.
26. Leren P. The cardiovascular effects of alpha–receptor blocking agents. J. Hypertens., 1992, 10 (Suppl.. 3): S11 – S15.
27. Kannel W.B., D’Agostino R.B., Stepanias M. et al. Efficacy and tolerability of lovastatin in a six–month study: analysis by gender, age and hypertensive status. Am. J. Cardiol., 1990, 66: 1B – 10B.
28. Аронов Д.М., Ахмеджанов Н.М., Вартанова О.А. и др. Гиполипидемический эффект и переносимость лескола при лечении гипехолестеринемии у больных гипертонией (анализ данных многоцентрового исследования). Терап. Архив, 1995, 1: 45 – 48.
29. Peters T.K., Mehra M., Muratti E.N. et al. Efficacy and safety of fluvastatin in hypertensive patients. Analysis of a clinical trial database. Am. J. Hypertens., 1993, 6, Suppl.: 340S – 345S.
30. Peters T.K., Jewitt–Harris J., Mehra M. et al. Safety and tolerability of fluvastatin with concomitant use of antihypertensive agents. An analysis of a clinical trial database. Am. J. Hypertens., 1993, 6, Suppl.: 346S – 352S.
31. Olson A.G., Pauciullo P., Soska V. et al. Comparison of the efficacy and tolerability of fluvastatin extended–release and immediate–release formulations in the treatment of primary hypercholesterolemia: a randomized trial. Clin. Ther., 2001, 23: 45 – 61.
32. Ballantyne C.M., Pazzucconi F., Pinto X. et al. Efficacy and tolerability of fluvastatin extended–release delivery system: a pooled analysis. Clin. Ther., 2001, 23: 177 – 192.
33. Jonkers I.J., De Man F.H., Van der Laarse A. et al. Bezafibrate reduces heart rate and blood pressure in patients with hypertriglyceridemia. J. Hypertens., 2001, 19: 749 – 756
34. Williams R.R., Hunt S.C., Hopkins P.N. et al. Familial dyslipidemic hypertension. Jama, 1988, 259: 3579 – 3586.
35. Постнов Ю.В., Орлов С.Н. Первичная гипертензия как патология клеточных мембран. Москва, 1987.
36. Weder A.B., Serr C., Torretti B.A. et al. Effects of lovastatin treatment on red blood cell and platelet cation transport. Hypertension, 1991, 17: 203 – 209.
37. Wassman S., Laufs U., Baumer A.T. et al. HMG–CoA reductase inhibitors improve endothelial dysfunction in normochlesterolemic hypertension via reduced production of reactive oxygen species. Hypertension, 2001, 37: 1450 – 1457.
38. Chen H., Ikeda U., Shimpo M. et al. Fluvastatin upregulates inducible nitric oxide synthase expression in cytokine–stimulated vascular smooth muscle cells. Hypertension, 2000, 36: 923 – 928.
39. Assmann G. et al. Coronary Heart Disease Prevention Task Force. Eur. Heart J., 1999, 20: 841 – 844.
40. Gotto A.M. et al. Application of the National Cholesterol Education Program and joint European treatment criteria and clinical benefit in the Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS). Eur. Heart J., 2000, 21: 1627 – 1633.
41. Ramsay L.E., Williams B., Johnston J.D. et al. British Hypertension Society guidelines for hypertension management 1999. Br. Med. J., 1999, 319: 630 – 635.
42. Wood D., Durrington P., Poulter N. et al. Joint British recommendations on prevention of coronary heart disease in clinical practice. Heart, 1998, 80 (Suppl.2): S1 – S29.












