Данный информационный сайт предназначен исключительно для медицинских, фармацевтических и иных работников системы здравоохранения.
Вся информация сайта www.rmj.ru (далее — Информация) может быть доступна исключительно для специалистов системы здравоохранения. В связи с этим для доступа к такой Информации от Вас требуется подтверждение Вашего статуса и факта наличия у Вас профессионального медицинского образования, а также того, что Вы являетесь действующим медицинским, фармацевтическим работником или иным соответствующим профессионалом, обладающим соответствующими знаниями и навыками в области медицины, фармацевтики, диагностики и здравоохранения РФ. Информация, содержащаяся на настоящем сайте, предназначена исключительно для ознакомления, носит научно-информационный характер и не должна расцениваться в качестве Информации рекламного характера для широкого круга лиц.
Информация не должна быть использована для замены непосредственной консультации с врачом и для принятия решения о применении продукции самостоятельно.
На основании вышесказанного, пожалуйста, подтвердите, что Вы являетесь действующим медицинским или фармацевтическим работником, либо иным работником системы здравоохранения.
С
овременное представление о ведении пациентов с сердечно–сосудистыми заболеваниями (ССЗ), в том числе больных ИБС и АГ, предусматривает многоплановый подход к лечению, направленный не на один или несколько, а на все существующие факторы риска (ФР) у конкретного пациента с ССЗ. Такой подход диктует необходимость совместного применения препаратов с различной фармакологической направленностью, что создает определенные трудности в достижении нужного терапевтического эффекта. Появление в распоряжении практикующего врача препарата с плейотропными свойствами (сочетание одновременного воздействия на различные ФР) будет способствовать повышению приверженности пациентов к лечению.
Клиническую кардиологию невозможно представить без препаратов группы β–адреноблокаторов (β–АБ), которых в настоящее время известно более 30. За последние полвека клинической практики β–АБ заняли прочные позиции в профилактике осложнений и в фармакотерапии ССЗ: ИБС, ХСН, метаболического синдрома (МС), АГ. Традиционно в неосложненных случаях медикаментозное лечение АГ начинают с β–АБ и диуретиков, снижающих риск развития ИМ, нарушений мозгового кровообращения и внезапной кардиогенной смерти [1,2,4]. Выбор антигипертензивной терапии у больных АГ сложен. Он обусловлен необходимостью исключения препаратов, оказывающих неблагоприятные воздействия на процессы метаболизма глюкозы и липидов, особенно у пациентов с избыточной массой тела (и МС>25 кг/м2). Одновременно, лекарственные средства должны обладать нефро–, кардио– и сосудопротективными эффектами [5–7,11,14].
Концепция опосредованного действия лекарственных средств через рецепторы тканей различных органов была предложена N. Langly в 1905, а в 1906 г. H. Dale подтвердил ее в практике.
В 1948 году R.P. Ahlquist, после исследования фармакодинамики катехоламинов, впервые описал наличие в тканях α– и β–адренорецепторов, которые позднее были подразделены на подтипы [14].
В настоящее время в зависимости от локализации, характера физико–биологических свойств и силы ответов на катехоламины выделены три типа адренорецепторов:
1 – a–адренорецепторы (α);
2 – β–адренорецепторы (b);
3 – допаминовые адренорецепторы (d),
которые, в свою очередь, на уровне синапсов подразделяются на пресинаптические и постсинаптические.
В 90–е годы XX века было установлено, что β–адренорецепторы подразделяются на три подтипа:
• β1–адренорецепторы, которые расположены в сердце и через них опосредуются стимулирующие влияния катехоламинов на деятельность сердца – насоса (учащение ритма и силы сердечных сокращений);
• β2–адренорецепторы, которые расположены преимущественно в бронхах, гладкомышечных клетках сосудистой стенки, скелетных мышцах, в поджелудочной железе: их стимуляция вызывает бронхо– и вазодилатацию, релаксацию мышц и секрецию инсулина;
• β3–адренорецепторы, локализованные преимущественно на мембранах адипоцитов, принимают участие в термогенезе и липолизе [16,17].
Идея использования β–АБ в качестве кардиопротекторов принадлежит англичанину J.W. Black, а в 1988 году ему с сотрудниками, как cоздателям и исследователям роли β–АБ в клинической практике, была присуждена Нобелевская премия. Нобелевский комитет оценил клиническую значимость этих препаратов, как «величайший прорыв в борьбе с болезнями сердца после открытия дигиталиса 200 лет назад».
В последние 40 лет было синтезировано более 100 β–АБ. В клинической практике в настоящее время используется не более 30 препаратов.
β–АБ классифицируются по фармакологическим свойствам, характерными в разной степени для отдельных препаратов:
– по селективности к β1– адренорецепторам;
– по липо– или гидрофильности (растворимость в жирах или воде);
– по наличию внутренней симпатической активности;
– по наличию мембранстабилизирующей активности;
– по силе блокады специфических рецепторов;
– по стабильности и длительности действия.
По селективности отдельные представители в группе β–АБ различаются существенно. Селективность к β1–адренорецепторам не является абсолютной, и при увеличении дозы селективного β–АБ могут развиваться эффекты вследствие блокады β2–адренорецепторов.
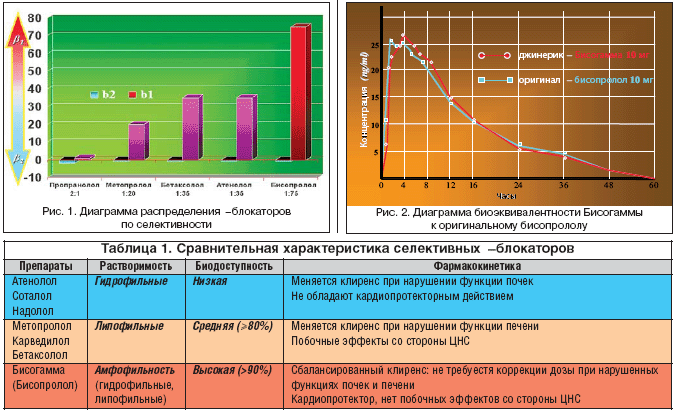
Кардиоселективность – одна из основных клинически значимых фармакокинетических характеристик β–блокаторов, обусловливающих низкую частоту побочных эффектов данного класса препаратов. Особенностью кардиоселективных β–АБ по сравнению с неселективными является большее сродство к β1–адренорецепторам сердца, чем к β2–адренорецепторам, размещенным в гладкой мускулатуре сосудов и бронхов. Следует учитывать, что степень кардиоселективности неодинакова у различных препаратов. Индекс ci/β2 к ci/β1, характеризующий степень кардиоселективности, составляет 1,8:1 для неселективного пропранолола, 1:20 – для метопролола, 1:35 – для атенолола и бетаксолола, 1:75 – для Бисогаммы (бисопролола) (рис. 1) [17].
При использовании селективных β1–адреноблокаторов в небольших и средних дозах эффекты влияния на гладкую мускулатуру бронхов и периферических артерий отсутствуют.
Фармакокинетическое различие β–АБ определяется свойствами растворимости в жирах или водной среде и распределяются на водорастворимые (гидрофильные), жирорастворимые (липофильные) и водо–жирорастворимые (амфофильные) (табл. 1).
Некоторые β–АБ обладают свойствами амфофильности – способность растворяться в воде и жирах (Бисогамма, ацебуталол, пиндолол и др.), имеют два пути элиминации. Сбалансированный клиренс этих β–АБ обеспечивает безопасность их применения у больных с умеренной почечной или печеночной недостаточностью.
β–АБ с выраженной β1–селективностью имеют существенные преимущества перед неселективными фармакопрепаратами с учетом суммарного их влияния на гемодинамику, метаболические процессы, реологические параметры крови и бронхи. Отсутствие у селективных адреноблокаторов блокирующего влияния на β2–адренорецепторы позволяет избежать нежелательного действия на функцию легких, периферическое кровообращение, липидный и углеводный спектры крови, функциональное состояние форменных элементов крови (агрегационная активность тромбоцитов, подвижность и эластичность эритроцитов).
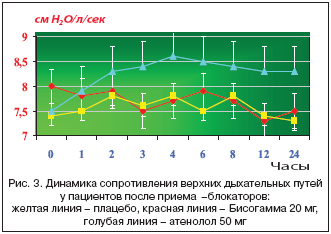
Существующая дискуссия об использовании в программе лечения ССЗ оригинальных препаратов или дженериков (generic – родовой, сходный) в настоящее время постулирует: «мы должны назначать эффективный, безопасный и качественный препарат и не важно – дженерический он или оригинальный». Два лекарственных препарата являются биоэквивалентными, если они фармацевтически эквивалентны, а их биодоступность после введения в одной и той же молярной дозе сходны до такой степени, что их эффекты в отношении эффективности и безопасности, будут по существу идентичны. В США до 70% лекарственных средств, используемых в клинической практике, являются хорошими, качественными дженерическими препаратами. На рисунке 2 представлена биоэквивалентность дженерика с брендовым названием Бисогамма к оригинальному кардиоселективному β1–блокатору бисопрололу.
Бисогамма (бисопролол) – высокоселективный β1–адреноблокатор, не обладающий внутренней симпатомиметической активностью и мембраностабилизирующим эффектом, с длительным периодом полувыведения (10–12 ч). В терапевтически рекомендуемых дозах (от 2,5 до 20 мг) препарат почти не проявляет антагонистической активности в отношении β2–адренорецепторов и поэтому не вызывает таких метаболических эффектов, как гипергликемия, дислипидемия или гипокалиемия, не оказывает ангиоспастического влияния на артерии, не вызывает бронхоспазм.
Фармакокинетической особенностью Бисогаммы (бисопролол) является его высокая биодоступность (>90%) и растворимость одновременно в липидах и в воде (амфофильность), что обусловливает двойной путь элиминации – через печень и почки, не требует коррекции терапевтической дозы при заболевании этих органов. Фармакокинетика бисопролола не зависит от патологических изменений белкового состава плазмы крови (например, при повышении концентрации кислых α1–гликопротеидов), так как только 30% активного вещества в крови связано с белком плазмы.
Расслабление гладкой мускулатуры бронхов осуществляется в основном через стимуляцию β2–адренорецепторов. Неселективная блокада β–адренорецепторов увеличивает риск развития бронхоспазма при лечении АГ у больных, предрасположенных к бронхообструкции (бронхиальная астма, хронический обструктивный бронхит). При этих заболеваниях дыхательной системы патологически повышенное сопротивление дыхательных путей (СДП) может еще более увеличиваться, соответственно объем форсированного выдоха за секунду (ОФВ1) – снижаться. Риск развития бронхоспазма при применении β–АБ тем меньше, чем выше их β1–адреноселективность. Бисогамма (бисопролол), являясь высокоселективным β1–адреноблокатором, не вызывает клинических проявлений блокады β2–адренорецепторов бронхов даже на фоне максимальной концентрации препарата в плазме крови при максимальной терапевтической дозе (20 мг).
Нарушение периферического кровообращения при действии β–АБ проявляется клинически такими побочными эффектами, как похолодание конечностей, ощущение покалывания и тяжести в ногах. Указанные побочные эффекты при применении Бисогаммы крайне редки и если возникают, то связаны с уменьшением сердечного выброса.
В перекрестном исследовании с использованием двойного слепого метода было установлено, что у больных АГ при лечении бисопрололом (10 мг в сутки) по данным импульсной допплерфлоуметрии диаметр сонной и плечевой артерий, а также кровоток и сопротивление в указанных сосудах не менялись. Скорость распространения пульсовой волны в обоих соcудах уменьшалась, а растяжимость плечевой артерии увеличивалась. Полученные данные свидетельствуют о том, что антигипертензивный эффект при блокаде β1–адренорецепторов сопровождается улучшением эластичности сосудистой стенки, что косвенно свидетельствует о восстановлении релаксационной функции эндотелия [14,15].
Бисопролол при длительном применении не влияет на уровни фракций атерогенного холестерина (триглицериды, ХС ЛПНП). В ряде клинических исследований (в течение 13 месяцев) среди больных АГ, которые получали бисопролол в суточной дозе от 5–10 мг, не было зарегистрировано статистически достоверных изменений содержания ОХС, ХС ЛПНП, ХС ЛПВП [12–14].
Антиишемический эффект Бисогаммы обусловлен снижением потребности миокарда в кислороде вследствие уменьшения ЧСС и силы сердечных сокращений, возникающего при блокировании b1–адренорецепторов миокарда. Бисогамма одновременно обеспечивает улучшение перфузии миокарда за счет увеличения времени диастолы, уменьшения конечного диастолического давления в левом желудочке и увеличения градиента давления, определяющего коронарную перфузию во время диастолы [8–11].
Последние годы клинической практики характеризуются повышенным вниманием к изучению процессов агрегации тромбоцитов, эластичности и подвижности эритроцитов в сопоставлении с плазменными компонентами крови у больных АГ [4,9]. Имеются данные, что под влиянием β–АБ снижается агрегационная активность тромбоцитов (ААТр) и увеличивается подвижность эритроцитов за счет улучшения эластичности мембраны [3]. β–АБ уменьшают проницаемость мембран клеточных элементов крови для Na+ и Cl– cо снижением внутриклеточной концентрации Ca++. Подобная динамика электролитов способствует улучшению морфофункциональных характеристик тромбоцитов и эритроцитов, что суммарно улучшает кровоток на уровне резистивных артериол и капиллярного русла [5].
С целью изучения антиишемического и гипотензивного эффекта Бисогаммы (Вёрваг Фарма, Германия) и его влияния на реологические свойства крови (функциональные состояния тромбоцитов и эритроцитов) нами были обследованы 63 больных стабильной стенокардией, ассоциированной с АГ 1–2 степени, 1–3 риском (ВОЗ/МОГ 1999 г.), в возрасте от 50 до 65 лет (средний возраст – 57,4±3,2 года), из них 35 мужчин и 28 женщин. Длительность анамнеза ИБС и АГ в среднем составила 7,4±2,1 года.
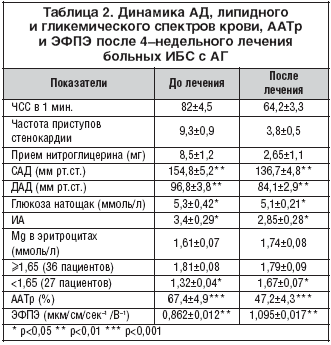
До лечения у 15 больных АГ, с сопутствующей в анамнезе ХОБЛ, с помощью суточного, почасового измерения объема форсированного выдоха за 1 с (ОФВ1) рассчитывали сопротивление дыхательных путей (СДП смН2О/л/с) после однократного приема максимальной дозы кардиоселективных β–блокаторов (Бисогамма – 20 мг, атенолол 50 мг). После приема 20 мг Бисогаммы (максимальная терапевтическая доза) исходное СДП практически не менялось в сторону увеличения по сравнению с плацебо, в то время как при однократном введении 50 мг атенолола отмечено значительное повышение СДП (на 12%) по сравнению с плацебо (рис. 3).
Селективный b1–блокатор Бисогамма применялся в качестве монотерапии по нарастающей схеме в зависимости от клинического эффекта от 2,5 до 10,0 мг однократно в сутки в течение 6 месяцев у 36 больных ИБС и АГ (средняя суточная доза составила 7,2±0,9 мг), у 27 больных АГ с сопутствующим дефицитом магния к антиангинальной и гипотензивной терапии (средняя суточная доза Бисогаммы составила 6,1±0,6 мг) был добавлен Магнерот 3 г/сут.
У всех пациентов со стабильной стенокардией и АГ до, после 4–недельной (выписка из стационара) и 6–месячной терапии изучали ААТр, электрофоретическую подвижность эритроцитов (ЭФПЭ), исследовали липидный спектр (с расчетом индекса атерогенности – ИА) и углеводный профиль крови.
Результаты исследования до и после лечения (через 4 месяца) представлены в таблице 2.
После проведенного лечения снижение частоты ритма сердечной деятельности на 22%, увеличивая время диастолы, увеличивает время эффективного коронарного кровоснабжения миокарда левого желудочка, что сопровождалось повышением толерантности к физической нагрузке в целом по группе на 57,3%, документируемое увеличением количества метров, пройденных за 6 минут (от 232,3±27,1 до 412,1±31,1 м/6 мин., р<0,001), и статистически достоверным снижением числа ишемических эпизодов (практически вдвое) на 59,1% (от 9,3±0,9 до 3,8±0,5 в сутки, р<0,001), регистрируемых при Холтеровском мониторировании ЭКГ до лечения и при выписке больных из стационара, что суммарно привело к снижению потребности в короткодействующих нитратах на две трети: до лечения средняя суммарная доза составляла 8,5±1,2 мг, после лечения – 2,65±1,1 мг.
Как видно из таблицы, к концу исследования (контрольная точка) САД статистически достоверно снизилось по сравнению с исходным уровнем на 11,7%, ДАД уменьшилось на 13,1%, т.е. через 4 недели лечения в среднем по группе были достигнуты целевые уровни давления (САД – 136,7±4,8, ДАД – 84,1±2,9 мм рт.ст.).
Следует отметить, что при лечении больных АГ II ст с «дефицитом магния» (референтные значения Mg в эритроцитах = 1,65–2,2 ммоль/л) Бисогаммой в дозе от 5 до 7,5 мг в сутки (средняя суточная доза – 6,1±0,6 мг) в сочетании с Магнеротом (3 г в сутки) практически в 90% наблюдений привело к снижению диастолического давления в среднем на 15,6±6,5 мм рт.ст. (на 16,3%, p<0,01).
Нормализация липидного профиля у больных АГ на фоне лечения Бисогаммой подтверждается результатами наших исследований: ИА в целом по группе снизился на 11% (р<0,05). Уменьшение ИА произошло в результате суммарного изменения липидного спектра крови в сторону антиатерогенного состава: ХС ЛПВП увеличился на 15,6% (от 0,96±0,04 до 1,11±0,07 ммоль/л, р<0,01), концентрации ТГ и ХС ЛПНП снизились соответственно на 23,8% (от 2,1±0,05 до 1,6±0,07 ммоль/л, р<0,01) и на 6,0% (от 3,36±0,09 до 3,16±0,07 ммоль/л, р<0,05). За период 4–недельного наблюдения не было выявлено случаев изменений углеводного уровня крови в сторону его патологического увеличения.
После проведенного лечения ААТр снизилась на 30,0% по сравнению с исходными величинами; ЭФПЭ увеличилась на 27%. Увеличение ЭФПЭ к концу исследования на 27% суммарно по всей группе больных ИБС, ассоциированной с АГ на фоне лечения Бисогаммой, возможно опосредовано через нормализацию липидного профиля в сторону антиатерогенности. Известно, что нарушения липидного состава эритроцитарных мембран является одной из причин снижения способности эритроцитов к деформации, а следовательно, к нарушению их подвижности и в целом текучести крови, что способствует повышению ОПСС и АД. Снижение агрегационной активности тромбоцитов к концу исследования на 30% суммарно по всей группе косвенно свидетельствует о наличии в тромбоцитарной мембране b–адренорецепторов. Использование b–адреноблокаторов при лечении АГ оказывает эффект «успокоения» тромбоцитов, делая их нечувствительными к катехоламинам, что подтверждается результатами исследования ряда авторов и нашими наблюдениями.
Метаболическая нейтральность (отсутствие «атерогенного и диабетогенного» эффектов), достоверная гипотензивная и дезагрегационная активность делают Бисогамму предпочтительным β–блокатором перед другими препаратами этой группы в программе лечения больных ИБС с АГ и ИМТ>25 кг/м2, сочетающихся с нарушением липидного и гликемического профилей сыворотки крови.
Таким образом, все вышеизложенное, данные литературы и результаты исследования, представленные в данной статье, свидетельствуют о положительных плейотропных свойствах Бисогаммы с метаболической нейтральностью, суммарно оказывающих антиишемический и гипотензивный эффекты при лечении ИБС и АГ, что позволяет рекомендовать данный кардиоселективный β–блокатор в клиническую практику лечения больных ИБС и АГ с ожирением, нарушениями липидного и гликемического профилей плазмы крови.
Литература
1. Ерофеева С.Б., Белоусов Ю.Б. Место ßβ–адреноблокатора Бисопролола в лечении артериальной гипертензии. //Фарматека. 2004, №6, 23–26.
2. Евдокимова М.А., Затейщиков Д.А. Место селективного бета–адреноблокатора Конкора (Бисопролола) в лечении ишемической болезни сердца. //Фарматека. 2005. №10,21–26.
3. Задионченко В.С., Богатырева К.М., Станкевич Т.В. Тромбоцитарно–сосудистый гемостаз и реологические свойства крови при лечении атенололом больных гипертонической болезнью. //Кардиология. 1993, 3, 40–44.
4. Ивлева А.Я., Сивкова Е.Б. Современные представления о клинической ценности β–адреноблокаторов. (доказательная медицина). Москва, 2003. 1–122.
5. Марцевич С.Ю. β–адреноблокаторы в леченнии гипертонической болезни – роль бисопролола (Конкор). //РМЖ. 2005. №15 (10), 25–28.
6. Недогода С.В., Барыкина И.Н., Брель У.А. и др. Возможности коррекции факторов риска у больных артериальной гипертензией на фоне ожирении. //Лечащий врач. 2008. №4, 91–92.
7. Мычка В.Б., Чазова И.Е. Метаболический синдром. Возможности диагностики и лечения. (Подготовлено на основе Рекомендаций экспертов ВНОК по диагностике и лечению метаболического синдрома). 2008. 1–16.
8. Маколкин В.И., Зябрев Ф.Н. Значение частоты сердечных сокращений в практике врача. 2008. 1–28.
9. Оганов Р.Г. Развитие профилактической кардиологии в России. Кардиоваскулярная терапия и профилактика. 2004. 3(3), ч.1, 10–14.
10. Основные положения рекомендаций Европейского общества кардиологов по ведению больных стабильной стенокардией (2006). Эффективная фармакотерапия в кардиологии и ангиологии. 2007. №2, 1–9.
11. Beteridge D.J. The interplay cardiovascular risk factors in the metabolic syndrome and type 2 diabetes. European Heart Journal (Supplements G). 2004. Vol.6, 3 – 7.
Полный список литературы Вы можете найти на сайте http://www.rmj.ru
12. Boraso A. Why is reduced heart rate beneficial. Dialogues in Cardiovascular Medicine. 2001, 6, 19–24.
13. Janssen I., Katzmarzyk P., Church T.S. and all. The Cooper Clinic Mortality Risk Index. Clinical Score Sheet for Men. Am.J.Prev.Med. 2005. 29, 194–203.
14. Fogari R., Zoppi A., Tettamanti F.. et al. b–blocer effects on plasma lipids in antihypertensive therapy. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5) 76–80.
15. Koning L., Merchant A.T., Pogue J. and all. Waist circumference and waist–to–hip ratio as predictors of cardiovascular events: meta–regression analysis of prospective studies. European Heart Jornal. 2007. Vol.28(7), 850–856.
16. Leopold G. Bisoprolol: pharmacokinetic profile. Reviews in Contemporary Pharmacotherapy. 1997, 8, 35–38.
17. Mengden Th., Vetter W. The efficacy of bisoprolol in the treatment of hypertension. Reviews in Contemporary Pharmacotherapy. 1997, 8, 55–67.
Литература
1. Ерофеева С.Б., Белоусов Ю.Б. Место ??–адреноблокатора Бисопролола в лечении артериальной гипертензии. //Фарматека. 2004, №6, 23–26.
2. Евдокимова М.А., Затейщиков Д.А. Место селективного бета–адреноблокатора Конкора (Бисопролола) в лечении ишемической болезни сердца. //Фарматека. 2005. №10,21–26.
3. Задионченко В.С., Богатырева К.М., Станкевич Т.В. Тромбоцитарно–сосудистый гемостаз и реологические свойства крови при лечении атенололом больных гипертонической болезнью. //Кардиология. 1993, 3, 40–44.
4. Ивлева А.Я., Сивкова Е.Б. Современные представления о клинической ценности ?–адреноблокаторов. (доказательная медицина). Москва, 2003. 1–122.
5. Марцевич С.Ю. ?–адреноблокаторы в леченнии гипертонической болезни – роль бисопролола (Конкор). //РМЖ. 2005. №15 (10), 25–28.
6. Недогода С.В., Барыкина И.Н., Брель У.А. и др. Возможности коррекции факторов риска у больных артериальной гипертензией на фоне ожирении. //Лечащий врач. 2008. №4, 91–92.
7. Мычка В.Б., Чазова И.Е. Метаболический синдром. Возможности диагностики и лечения. (Подготовлено на основе Рекомендаций экспертов ВНОК по диагностике и лечению метаболического синдрома). 2008. 1–16.
8. Маколкин В.И., Зябрев Ф.Н. Значение частоты сердечных сокращений в практике врача. 2008. 1–28.
9. Оганов Р.Г. Развитие профилактической кардиологии в России. Кардиоваскулярная терапия и профилактика. 2004. 3(3), ч.1, 10–14.
10. Основные положения рекомендаций Европейского общества кардиологов по ведению больных стабильной стенокардией (2006). Эффективная фармакотерапия в кардиологии и ангиологии. 2007. №2, 1–9.
11. Beteridge D.J. The interplay cardiovascular risk factors in the metabolic syndrome and type 2 diabetes. European Heart Journal (Supplements G). 2004. Vol.6, 3 – 7.
12. Boraso A. Why is reduced heart rate beneficial. Dialogues in Cardiovascular Medicine. 2001, 6, 19–24.
13. Janssen I., Katzmarzyk P., Church T.S. and all. The Cooper Clinic Mortality Risk Index. Clinical Score Sheet for Men. Am.J.Prev.Med. 2005. 29, 194–203.
14. Fogari R., Zoppi A., Tettamanti F.. et al. b–blocer effects on plasma lipids in antihypertensive therapy. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5) 76–80.
15. Koning L., Merchant A.T., Pogue J. and all. Waist circumference and waist–to–hip ratio as predictors of cardiovascular events: meta–regression analysis of prospective studies. European Heart Jornal. 2007. Vol.28(7), 850–856.
16. Leopold G. Bisoprolol: pharmacokinetic profile. Reviews in Contemporary Pharmacotherapy. 1997, 8, 35–38.
17. Mengden Th., Vetter W. The efficacy of bisoprolol in the treatment of hypertension. Reviews in Contemporary Pharmacotherapy. 1997, 8, 55–67.












