Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» – образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ [2].
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы – неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин – фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
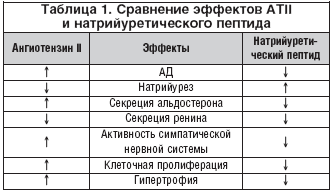
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрийуретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) [3, 4]. Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома [4].
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида [4].
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате – к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 [3].
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием – ингибиторы вазопептидаз (табл. 2, рис. 1) [1–3].
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат – 8,9:0,5; фазидоприлат – 5,1:9,8; сампатрилат – 8,0:1,2 [1]. В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ [5, 6].
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов [7]. Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла – 2,17% против 0,68% (относительный риск 3,4) [8]. Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина [4].
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, – илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП [9]. При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона [9]. Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4–8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6–12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно [9]. По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1–1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) [2]. Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат – блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 – LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства [11]. В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200–400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160–320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. [11]. Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ [12]. Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка – маркер повышения активности натрийуретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования [2]. Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А–тип рецепторов происходит вазоконстрикция, а через В-тип – вазодилатация [13]. В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация [14]. Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов [15]. Первый неселективный антагонист рецепторов эндотелина – бозентан – в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла [16]. Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии [17, 18]. В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана [19]. Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 [14]. Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание – лечение легочной гипертензии.
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу – ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) [2]. Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрийуретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований [20]. В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пероральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, – алискирен – был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24–40 ч), внепочечный путь элиминации [21]. Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150–300 мг/сут приводил к снижению САД на 8,7–13 и 14,1–15,8 мм рт.ст. соответственно и ДАД – на 7,8–10,3 и 10,3–12,3 мм рт.ст. [22]. Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) [23], регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) [24]. Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150–300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% – через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) [23]. Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ [25]. В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина – был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.
![Рис. 1. Комплементарный механизм действия ингибиторов НЭП/АПФ [2]](/data/articles/Image/t21/n17/886-2.gif)

![Рис. 2. Комплементарный механизм действия ингибиторов НЭП/блокаторов рецепторов АТII [2]](/data/articles/Image/t21/n17/886-4.gif)
![Рис. 3. Комплементарный механизм действия ингибиторов НЭП/ЭПФ [2]](/data/articles/Image/t21/n17/886-5.gif)
Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383–389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591–600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856–1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615–620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920–926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526–528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103–111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49–61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401–414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255–1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387–1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356–363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452–459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1–4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784–790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423–1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824–830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527–535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755–763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1–8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72–83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503–2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483–490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398–2404.












