С–РБ получил свое название из–за способности вступать в реакцию преципитации с С–полисахаридом пневмококков, что является одним из механизмов ранней защиты организма от инфекции. Его синтез происходит преимущественно в гепатоцитах и инициируется антигенами, иммунными комплексами, бактериями и грибами. Стимулируя иммунные реакции, в т.ч. фагоцитоз, С–РБ участвует во взаимодействии Т– и В–лимфоцитов, активирует классическую систему комплемента. Его уровень быстро и многократно увеличивается при воспалениях различной природы и локализации, паразитарных инфекциях, травмах и опухолях, сопровождающихся воспалением и некрозом тканей [3].
Практически отсутствуя в сыворотке здорового человека, при той или иной патологии концентрация С–РБ в крови имеет высокую корреляцию с активностью заболевания, стадией процесса. Было показано, что повышение С–РБ является единственным маркером воспаления, обладающим предсказательной силой в отношении инфаркта миокарда [4].
В настоящее время широко обсуждается значение белков фазы альтерации как важных медиаторов, модулирующих развитие воспаления. Проведены многочисленные параллели между синтезом этих белков и противовоспалительным действием лекарственных препаратов, обладающих протективным действием на миокард. Одной из групп таких лекарств являются ингибиторы ангиотензинпревращающего фермента. Доказано, что последние влияют на синтез белков острой фазы воспаления и регулируют их взаимодействие при ОИМ, а поэтому должны назначаться в первые минуты госпитализации, как можно раньше [5–7].
Среди множества ингибиторов АПФ особое внимание заслуживает рамиприл, эффективность которого при инфаркте миокарда и в постинфарктный период доказана в многочисленных международных клинических исследованиях [8–12].
С целью определения влияния раннего назначения рамиприла (Амприлана) на комбинированную конечную точку и его преимущества перед стандартной терапией в отношении влияния на показатели воспаления плазмы крови авторами было проведено клиническое исследование «КАЛИПСО» (открытое Контролируемое исследование влияния раннего назначения препарата Амприлан (рамиприл) на маркеры воспаЛения плазмы кровИ и на Прогноз у пациентов с оСтрым коронарным синдрОмом).
В исследование было включено 60 пациентов (34 мужчины и 26 женщин) в возрасте от 49 до 76 лет (в среднем 62±7 лет), госпитализированных в отделение неотложной кардиологии с диагнозом ОКС с подъемом или без подъема сегмента ST, а также с легкой и умеренной артериальной гипертензией (табл. 1). Всем пациентам в первые 24 ч с момента госпитализации, а также через 3 мес. лечения определяли уровни С–РБ, общего холестерина (ОХС), холестерина липопротеинов высокой (ХС–ЛПВП) и низкой (ХС–ЛПНП) плотности.
За время госпитализации всем больным однократно выполнялась ЭХО–КГ с целью оценки фракции выброса, массы миокарда левого желудочка (ММЛЖ) и размеров полостей сердца. Все пациенты были разделены на 2 группы по 30 человек в каждой. Пациентам 1–й группы в первые 24 ч с момента развития ангинозного приступа назначался Амприлан внутрь в стартовой дозе 2,5 мг 2 раза/сут. Если пациенты не переносили начальную дозу препарата (артериальная гипотензия), то доза уменьшалась до 1,25 мг 2 раза/сут. Спустя два дня доза вновь увеличивалась до 2,5 мг 2 раза/сут., а спустя еще два дня – до 5 мг 2 раза/сут. Максимальная суточная доза не превышала 10 мг. Ежедневно оценивались АД и ЧСС. После выписки из стационара предпочтительным был переход на однократный прием суточной дозы Амприлана, равной 5 мг или 10 мг в зависимости от переносимости лечения. Лечение продолжалось 90 суток. Пациенты 2–й группы получали стандартную терапию основного заболевания, включающую в себя прием какого–либо другого ингибитора АПФ.
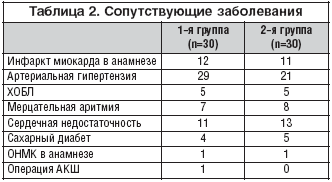
На этапе скрининга было выявлено, что у 37 пациентов инфаркт миокарда развился впервые в жизни, а другие 23 пациента когда–либо ранее уже переносили инфаркт миокарда. У 50 пациентов была диагностирована артериальная гипертензия, также было выявлено 10 случаев хронического обструктивного бронхита, 15 случаев мерцательной аритмии, у 24 больных имелась сердечная недостаточность. Из 60 включенных в исследование больных 9 пациентов страдали сахарным диабетом 2–го типа, у 2 больных в анамнезе было острое нарушение мозгового кровообращения, 1 пациент перенес операцию аортокоронарного шунтирования.
У всех пациентов и ранее до развития острого коронарного синдрома с различной частотой возникали загрудинные боли (табл. 2).
Пациенты с первых минут пребывания в кардиореанимационном отделении получали нитраты в/в (60 человек), гепарин в/в, п/к (60 человек), омепразол per os (60 человек), морфин в/в (36 человек), сердечные гликозиды в/в (27 человек), антиагреганты (60 человек) – ацетилсалициловую кислоту (АСК) per os (26 человек), клопидогрел per os (24 человека), АСК per os + клопидогрел per os (10 человек), диуретики в/в и per os (37 человек), b–блокаторы per os (29 человек), антагонисты кальция per os (12 человек), ингибиторы АПФ (кроме Амприлана) (22 человека), 6 пациентам выполнен тромболизис.
Проанализированы исходные клинические и лабораторные показатели отдельно для каждой группы больных. Структура частоты возникновения стенокардии до развития ОКС. В 1–й группе 1 приступ в неделю случался у 2 пациентов из 30, 2 – у 5, 3 – у 9, 4 – у 6 и 5 и более – у 8. Максимальное число стенокардии в неделю не превышало 6. При суммации стенокардии у всех пациентов – их общее количество в неделю составило 106. В контрольной группе 1 приступ – у 3, 2 – у 5, 3 – у 8, 4 – у 9, 5 и более – у 5. Максимальное число стенокардии в неделю также не превышало 6, а общее ее число составило 98.
У некоторых включенных в исследование пациентов на этапе СМП и в приемном отделении стационара были диагностированы высокие цифры артериального давления. Как известно, гипертоническая болезнь опасна прежде всего развитием гипертонических кризов – резкого повышения артериального давления выше 180/120 мм рт.ст. или до индивидуально высоких величин. Осложненный гипертонический криз сопровождается признаками ухудшения мозгового, коронарного, почечного кровообращения. Возможно, что инфаркт миокарда у этой подгруппы больных явился именно осложнением гипертонического криза. Т.о. терапия сопутствующей артериальной гипертензии (АГ) у пациентов, перенесших инфаркт миокарда, является неотъемлемой частью профилактики повторных ишемических событий и улучшает, таким образом, прогноз больных.
Повышенные цифры АД были диагностированы у 29 пациентов, в том числе у 8 она была выявлена впервые, у 16 – давность АГ не превышала 5 лет и только у 5 пациентов повышенное АД отмечалось более 5 лет. АГ 1 степени (140–159/90–99 мм рт.ст.) была у 12 человек, 2 (160–179/100–109 мм рт.ст.) – у 14 и 3 (более 180/110 мм рт.ст.) – у 3. Таким образом, 26 пациентов из 29 имели легкую и умеренную АГ и только 3 – тяжелую. Средний уровень систолического давления (САД) был равен 158 мм рт.ст., диастолического (ДАД) – 98 мм рт.ст. В контрольной группе АГ имела место у 21 пациента, в том числе впервые выявлена у 6 пациентов, у 8 – ее давность не превышала 5 лет, а у оставшихся 7 повышенное АД отмечалось более 5 лет. АГ 1–й степени была у 7 человек, 2 – у 9 и 3 – у 2. Средний уровень САД и ДАД составил 160 мм рт.ст. и 100 мм рт.ст. соответственно. 19 пациентов из 21 имели легкую и умеренную АГ (табл. 3).
Авторы оценили исходные концентрации маркеров воспаления плазмы крови (С–реактивный белок), а также липидный спектр на примере общего холестерина (ОХС), холестерина липопротеинов высокой (ХС ЛПВП) и низкой (ХС ЛПНП) плотности, а также триглицеридов (ТГ). Все показатели либо превышали допустимую норму, либо занимали пограничное положение с патологией (табл. 4).
Нормальные значения массы миокарда левого желудочка у мужчин <183 г, а у женщин <143 г. Как видно из таблицы 5, миокард левого желудочка у всех 60 пациентов был значительно гипертрофирован.
Через 3 мес. терапии Амприланом у 6 пациентов стенокардия исчезла, 1 приступ в неделю сохранялся у 14 пациентов, 2 – у 7 и 3 – у 3. Максимальная частота стенокардии в неделю сократилась до 3, а суммарное ее число – до 37. В группе контроля стенокардия исчезла у 2 пациентов, 1 приступ в неделю сохранялся у 8, 2 – у 9, 3 – у 7 и 4 – у 4. Стенокардия у данных больных возникала реже, но максимальное ее число в неделю доходило до 4, а суммарное – составило 63 (рис. 1).
Таким образом, под влиянием Амприлана частота стенокардии снизилась на 65% по сравнению с 36% – в группе контроля.
Второй по значимости жалобой у 50 больных было повышенное АД, цифры которого менялись в течение дня, а у некоторых пациентов ранее случались гипертонические кризы. На фоне монотерапии АГ препаратом Амприлан было выявлено достоверное снижение, как САД, так и ДАД. При этом целевой уровень АД (120–139/80–89 мм рт.ст.) был достигнут у 18 (62%) больных. У других 11 пациентов степени АГ распределились следующим образом: 1–я степень – у 8 и 2–я – у 3. Необходимо отметить, что больных с 3–й степенью АГ выявлено не было, а 3 пациента, которые на этапе скрининга имели тяжелую АГ, перешли в группу умеренной (табл. 6).
В контрольной группе, в которой пациенты после выписки из стационара получали стандартную гипотензивную терапию, включающую в себя b–блокаторы, иАПФ, антагонисты кальция и др., отмечалось также достоверное снижение цифр АД, но достичь целевого АД смогли лишь 9 (43%) пациентов. У оставшихся 12 пациентов через 3 мес. имелась следующая ситуация: 1–я степень была у 7, 2–я – у 5 (рис. 2).
Таким образом, 18 (62 %) пациентов достигли целевого уровня АД на монотерапии Амприланом и только 9 (43%) пациентов – на стандартной гипотензивной терапии.
Средний уровень САД на этапе скрининга у пациентов первой группы был 158 мм рт.ст., а ДАД – 98 мм рт.ст. За 1 мес. монотерапии Амприланом среднее значение САД уменьшилось до 148 мм рт.ст., а ДАД – до 96 мм рт.ст. Через 3 мес. лечения уровень САД составил 137 мм рт.ст., а ДАД – 89 мм рт.ст. (рис. 3 и табл. 6).
В группе контроля средний уровень САД был 160 мм рт.ст., а ДАД – 100 мм рт.ст. Через 3 мес. лечения уровень САД составил 141 мм рт.ст., а ДАД – 91 мм рт.ст.
Таким образом, снижение САД за 3 мес. монотерапии Амприланом составило 13,2%, ДАД – на 9,7% эквивалентно снижению САД на 11,9% и ДАД на 9,1% на фоне приема стандартной гипотензивной терапии.
Исходный уровень C–РБ в группе Амприлана составил 9,95 мг/л, а в группе контроля – 6,23 мг/л. Через месяц терапии Амприланом средний уровень C–реактивного белка снизился до 4,84 мг/л, а через 3 мес. – до 1,23 мг/л. В группе контроля наблюдалось менее интенсивное снижение уровня C–РБ: до 5,71 мг/л и до 3,98 мг/л, соответственно (рис. 4).
Таким образом, уровень C–РБ в группе пациентов, принимавших Амприлан в течение 3 мес., снизился на 87,6%, по сравнению с 36,4% в группе контроля.
За 3 мес. лечения в обеих группах концентрация в крови ОХС уменьшилась до 4,63 и 5,54 ммоль/л соответственно. Также в группе Амприлана мы наблюдали снижение уровня ТГ на 10,4%, уровня ХС–ЛПНП – на 7,8% и повышение уровня ХС–ЛПВП на 8,4%. В контрольной группе уровень ОХС снизился на 4,98%, уровень ТГ уменьшился на 7,3%, уровень ХС–ЛПНП снизился на 9,8%, а уровень ХС–ЛПВП увеличился лишь на 2,9% (рис. 5). Необходимо отметить, что ни в группе Амприлана, ни в контрольной группе пациенты не получали терапии статинами.
В группе Амприлана мы наблюдали увеличение массы миокарда левого желудочка, которая через 90 дней лечения составила в среднем 353,15 г у мужчин и 267,8 г – у женщин. В контрольной же группе отмечалось более значимое увеличение массы миокарда левого желудочка, как в подгруппе мужчин – 468,76 г, так и в подгруппе женщин – 368,12 г (рис. 6–7 и табл. 7).
Таким образом, масса миокарда левого желудочка у мужчин увеличилась в обеих группах, однако если на фоне терапии Амприланом всего на 10,1%, то в контрольной группе – на 28,5%. ММЛЖ у женщин уменьшилась в группе Амприлана на 5,4% и увеличилась в контрольной группе на 19,2%.
За 3 мес. терапии в группе пациентов, принимавших Амприлан фатальных событий, а также нефатальных инфарктов миокарда и инсультов зарегистрировано не было. Из 30 пациентов лишь двое были повторно госпитализированы по поводу дестабилизации стенокардии. В контрольной группе ситуация существенно отличалась. Было зарегистрировано 4 случая повторного инфаркта миокарда, в том числе в 3 – приведший к смерти больных, а у 1 через 2 мес. после выписки из стационара случился ишемический инсульт. По поводу дестабилизации стенокардии было госпитализировано 4 человека (помимо 4 – с повторным ИМ).
Казалось, на этом работа была закончена. Однако отсроченной целью данного исследования было определение прогноза и качества жизни пациентов, продолжающих прием рамиприла в течение года после завершения стационарного лечения по поводу инфаркта миокарда. Основным критерием качества жизни больных с ишемической болезнью сердца, на наш взгляд, является количество и тяжесть приступов ангинозных болей, которые ограничивают физическую активность и привычный образ жизни любого подобного больного. Нами было доказано, что непрерывная терапия Амприланом в течение года после сосудистой катастрофы приводит к значительному (на 82%) уменьшению частоты возникновения стенокардии в постинфарктный период (рис. 8).
Суммарное количество приступов сжимающей боли в груди в исследуемой группе уменьшилось со 106 до 19 в неделю (p<0,001). В группе же контроля суммарное количество ангинозных болей уменьшилось только на 68% (с 98 до 31).
Через год после окончания исследования мы обнаружили, что в параллельных, сопоставимых по тяжести течения инфаркта миокарда группах открылись резкие различия в отношении прогноза рандомизированных пациентов.
За 12 мес. терапии в группе пациентов, принимавших Амприлан, зарегистрировано лишь одно фатальное событие, причиной которого послужила тяжелая сердечная недостаточность. В этой же группе было зарегистрировано 2 повторных инфаркта миокарда, 6 повторных госпитализаций по поводу дестабилизации стенокардии, инсультов зарегистрировано не было. В контрольной группе ситуация существенно отличалась. Было зарегистрировано 6 случаев повторного инфаркта миокарда, причем в четырех случаях он привел пациентов к смерти. По поводу дестабилизации стенокардии было повторно госпитализировано 9 пациентов, кроме того, трое из них попадали на стационарное лечение в кардиологическое отделение в течение года неоднократно. У двоих больных (через 2 и 7 мес. соответственно) был зарегистрирован ишемический инсульт, ставший причиной смерти одного из пациентов. От недостаточности кровообращения в группе контроля в течение года скончалось двое больных. Итого, отсутствие рамиприла в перечне лекарственных препаратов, используемых с первых минут пребывания пациента в кардиореанимационном отделении, и последующем его неопределенно долгим приемом, привело к вероятно преждевременной смерти семерых «сосудистых» больных, в то время как на фоне терапии рамиприлом (Амприлан) многих кардио– и цереброваскулярных осложнений атеросклероза и коронарной болезни сердца удалось избежать. Очевидные результаты годового амбулаторного мониторинга больных в очередной раз продемонстрировали, что рамиприл, назначенный в первые 24 ч от развития острого коронарного синдрома и непрерывно принимаемый в последующие 12 мес., улучшает прогноз и качество жизни пациентов, перенесших инфаркт миокарда.
Таким образом, согласно исследованию «КАЛИПСО», иАПФ Амприлан, назначенный в первые 24 ч от развития ОКС и непрерывно принимаемый в последующие 3 мес. способствует:
• значительному (на 65% через 3 мес. и 82% через 12 мес.) уменьшению частоты возникновения стенокардии в постинфарктный период;
• снижению риска развития кардиальных и цереброваскулярных осложнений;
• выраженному снижению как систолического (на 13,2%), так и диастолического (на 9,7%) артериального давления;
• замедлению интенсивности нарастания гипертрофии миокарда левого желудочка;
• значительному (на 87,6%) снижению концентрации в крови C–реактивного белка;
• снижению уровня общего холестерина (на 8,1%), ТГ (на 10,4%) и ХС–ЛПНП (на 7,8%), а также повышению содержания ХС–ЛПВП (на 8,4%).
Полученные результаты позволяют широко использовать Амприлан в неотложной кардиологии.






Литература
1. Зайратьянц О.В., Ковальский Г.Б., Рыбакова М.Г. Медико–демографические показатели. Москва, 2005.
2. Чукаева И.И., Богова О.Т., Алешкин В.А., Новикова Л.И., Корочкин И.М. Сопоставление прогностического влияния острофазовых белков при инфаркте миокарда / Российский национальный конгресс «Человек и лекарство», тезисы докладов. М., 2001. C. 500.
3. Smith S.J., Bos G., Essvild R. Acute – phase proteins from the liver and enzymes from myocardial infarction, a quantitative relationship // Clin. Chem. Acta. – 1977. p. 75–85.
4. Ridker PM, Hennekens CH, Buring JE, Rifai N. C–reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women // N Engl J Med. 2000 Mar 23; 342(12): 836–43.
5. Ларский Э.Г., Комелькова Л.В., Белки острой фазы: современное состояние вопроса // МРЖ. – раздел XXII 1988; 12: с. 33–37.
6. Ridker P.M., Cushman M., Stampfer M.J. et al. Plasma concentration of C–reactive protein and risk of developing peripheral vascular disease // Circulation 1998; 97: 425–428.
7. Hudson M.P., Christenson R.H., Newby L.K. Cardiac markers: point of care testing // Clin. Chim. Acta 1999; Jun; 30; 284(2):223–37.
8. Effect of ramipril on morbidity and mode of death among survivors of acute myocardial infarction with clinical evidence of heart failure. A report from the AIRE Study Investigators // Eur Heart J. 1997 Jan; 18 (1): 41–51.
9. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators // Lancet. 1993 Oct 2; 342 (8875): 821–828.
10. Hall AS, Murray GD, Ball SG. Follow–up study of patients randomly allocated ramipril or placebo for heart failure after acute myocardial infarction: AIRE Extension (AIREX) Study. Acute Infarction Ramipril Efficacy // Lancet 1997; 349: 1493–1497.
11. Kober L, Torp–Pedersen C, Carlsen JE, Bagger H, Eliasen P, Lyngborg K, Videbaek J, Cole DS, Auclert L, Pauly NC. A clinical trial of the angiotensin–converting–enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. Trandolapril Cardiac Evaluation (TRACE) Study Group // N Engl J Med. 1995; 333:1670–1676.
12. Lonn E., Yusuf S. Clinical, public health, and research implications of the Heart Outcomes Prevention Evaluation (HOPE) Study // Eur Heart J. 2001 Jan; 22 (2):103–4.












