Введение
Ишемическая болезнь сердца (ИБС) является одной из ведущих причин заболеваемости и смертности во всем мире [1]. К традиционным факторам риска развития и прогрессирования ИБС относят ожирение, сахарный диабет (СД) 2 типа, гипертонию гиперхолестеринемию, курение. В последние годы большое внимание уделяется и нетрадиционным факторам риска, таким как гиперурикемия, гипергомоцистеинемия, хроническое воспаление и окислительный стресс [1].
Существует мнение, что риск развития сердечно-сосудистых событий (ССС) у пациентов с ИБС, ассоциированной с метаболическим синдромом или СД 2 типа, значительно выше, чем у лиц без метаболических нарушений [2].
В качестве одной из причин быстропрогрессирующей формы атеросклероза в последние годы все больше обсуждается роль дисфункции эндотелия, которая рассматривается как ранняя фаза развития атеросклероза и атеротромбоза и определяется как универсальный механизм реализации атерогенного потенциала различных факторов риска атеросклероза [3]. В исследовании E.G. Butkowski et al. (2017) установлен вклад воспаления и оксидативного стресса в прогрессирование СД 2 типа и продемонстрирована связь между гипергликемией, оксидативным стрессом и воспалительными биомаркерами [4].
Повышенные уровни гомоцистеина связаны с рядом сосудистых осложнений, и в связи с этим гипергомоцистеинемия была классифицирована как независимый фактор риска атеросклероза и сердечно-сосудистых заболеваний [5].
В последние годы появились данные, указывающие на то, что гомоцистеин является независимым модифицируемым фактором риска сердечно-сосудистых осложнений (ССО) [6, 7].
В связи с этим представляет интерес изучение взаимосвязи уровня биомаркеров с неблагоприятными ССС у больных с ИБС и метаболическими нарушениями.
Цель исследования: оценить роль предикторов воспалительного ответа, дисфункции эндотелия и гипергомоцистеинемии в прогнозировании риска развития неблагоприятных ССС у пациентов с ИБС и метаболическими нарушениями, перенесших чрескожное коронарное вмешательство (ЧКВ), в течение 12 мес. проспективного наблюдения.
Материал и методы
Протокол исследования одобрен локальным этическим комитетом. Все пациенты дали письменное информированное согласие до начала участия в исследовании.
Обследовано 132 пациента с ИБС в среднем возрасте 53 [47;61] года (данные представлены в виде Ме [Q25; Q75]). В зависимости от индекса инсулинорезистентности (HOMA-IR) все пациенты были распределены на 2 группы: 1-ю группу составили 63 пациента с нормальной тканевой чувствительностью к инсулину (ИР-); во 2-ю группу вошло 69 больных, у которых была выявлена инсулинорезистентность (ИР+) (табл. 1).

Критерии включения в исследование: наличие ИБС, плановой ЧКВ и метаболических нарушений.
Критерии исключения: менее 6 мес. после перенесенных острых коронарных или цереброваскулярных событий, неконтролируемая артериальная гипертензия, атриовентрикулярная блокада II–III степени, синдром слабости синусового узла, онкологические заболевания, воспалительные заболевания в стадии обострения.
Пациенты получали сахароснижающую терапию с использованием метформина, препаратов сульфонилмочевины II–III поколения и ингибиторов натрийзависимого транспортера глюкозы типа 2, 27% соблюдали диету.
Кроме оценки жалоб, анамнеза, объективного статуса всем пациентам проводились стандартные общеклинические и биохимические исследования. Уровень гликированного гемоглобина (НbА1с) оценивали с помощью иммунотурбидиметрического метода. Определение концентрации инсулина, фактора некроза опухоли α (ФНОα), интерлейкина-6 (ИЛ-6), а также эндотелина-1 и гомоцистеина в сыворотке крови выполняли методом иммуноферментного анализа. Показатели липидного спектра, аполипопротеин А-1 (Апо-А1) и аполипопротеин В (Апо-В) определяли ферментативным колориметрическим методом. ИР оценивали по индексу HOMА-IR. При значении более 2,77 диагностировали ИР.
Всем пациентам ранее было выполнено ЧКВ. По частоте поражения коронарных артерий, количеству окклюзий, устьевых и бифуркационных поражений группы не различались.
Пациентов наблюдали в течение 12 мес., затем оценивали частоту развития неблагоприятных ССС (сердечно-сосудистая смерть, прогрессирование хронической сердечной недостаточности (ХСН), коронарного атеросклероза, инфаркт миокарда (ИМ), церебральные катастрофы, рестеноз, тромбоз стента, повторная коронарная реваскуляризация (хирургическая, эндоваскулярная), развитие желудочковых нарушений ритма, фибрилляции предсердий, имплантация электрокардиостимулятора).
Статистическая обработка результатов исследования проводилась с использованием программ SPSS 17 и MedCalc 11.5.0.0. Критический уровень значимости
p принимали равным 0,05.
Результаты исследования
У пациентов 2-й группы установлено значимое превышение уровней базальной, постпрандиальной гликемии, а также HbA1c (р=0,003) (табл. 2). Значения инсулина в 2,1 раза превышали данный показатель у пациентов 2-й группы, и, как следствие, индекс HOMA-IR также был увеличен более чем в 2 раза, составив 4,9 [3,6;6,2] усл. ед. (р=0,001).

Во 2-й группе пациентов (ИР+) установлены более выраженные нарушения липидного обмена по сравнению с пациентами, у которых была нормальная чувствительность тканей к инсулину (табл. 3).
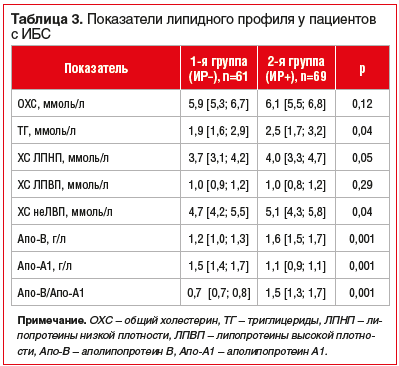
У больных 2-й группы установлено увеличение маркеров воспаления: ФНОα — в 5,4 раза (р=0,001), ИЛ-6 — в 4,3 раза (р=0,002), гомоцистеина — в 2,1 раза (р=0,003), эндотелина-1 — в 4,2 раза (р=0,002) (табл. 4).

Оценка взаимосвязей между исследуемыми параметрами выявила наличие прямой слабой корреляционной связи ФНОα с уровнем гомоцистеина (r=0,299, р=0,019), фибриногена (r=0,303, р=0,018) и умеренной силы с ИЛ-6 (r=0,412, р=0,001), а также отрицательной слабой связи с апо-А1 (r=-0,256, р=0,047).
В течение 12 мес. наблюдения в 1-й группе частота развития неблагоприятных ССС составила 33,3% (n=21), из них в 10 случаях — рестеноз стента, в 6 — прогрессирование ХСН, в 5 — ИМ, а во 2-й группе — 43,5% (n=30) случаев (р=0,03), из них 18 — нестабильная стенокардия, 7 — рестеноз стента, 2 — развитие нарушений ритма сердца, 4 — прогрессирование атеросклероза.
Проведенный однофакторный логистический регрессионный анализ показал, что наиболее информативными маркерами развития неблагоприятных ССО оказались перенесенный ИМ, фибрилляция предсердий, женский пол и курение. Наличие ИМ увеличивало шансы развития неблагоприятного события в 1,7 (95% доверительный интервал (ДИ) 1,159–2,235; р=0,038) раза, а фибрилляция предсердий и женский пол — в 2,4 (95% ДИ 1,378–4,141; р<0,001) и 2,3 (95% ДИ 1,330–3,845; р=0,002) раза соответственно, курение — в 1,6 (95% ДИ 1,152–2,224; р=0,015) раза.
Среди биохимических маркеров вероятность развития неблагоприятного исхода возрастала в 1,5 (95% ДИ 1,199–1,889) раза при повышении концентрации ИЛ-6 на более чем 6,69 пг/мл (AUC=0,97, чувствительность — 90%, специфичность — 97,4%; р<0,001) и в 1,6 (95% ДИ 1,191–1,819) раза при повышении ФНОα на более чем 5,19 пг/мл (AUC=0,97, чувствительность — 96,9%, специфичность — 97%; р<0,001).
Кроме того, прогностической значимостью обладали уровень гомоцистеина более 16,59 мкмоль/л (AUC= 0,878, чувствительность — 77,3%, специфичность — 89,2%; р<0,001) и уровень эндотелина-1 более 0,854 фмоль/мл (AUC=0,889, чувствительность — 86%, специфичность — 84%; р<0,001).
С целью расчета индивидуального риска развития неблагоприятных событий в отдаленный период после ЧКВ с помощью логистической регрессии создана модель, в которую вошло 5 показателей: концентрация гомоцистеина, эндотелина-1, а также ФК сердечной недостаточности по NYHA, уровень глюкозы натощак, постпрандиальная гликемия (табл. 5).
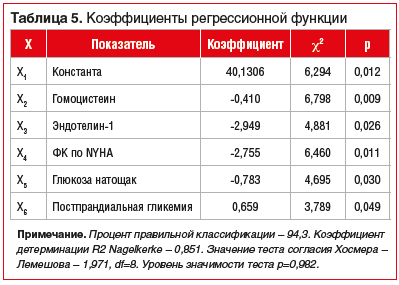
Определяли значение функции F(x) по формуле:
F(x) = x1 + a × x2 + b × x3+ c × x4+ d × x5+ е × x6,
где a — гомоцистеин; b — эндотелин-1; c — ФК по NYHA;
d — глюкоза натощак; е — постпрандиальная глюкоза.
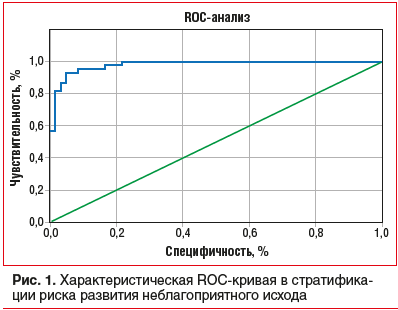
Для оценки качества построенной модели использовали ROC-анализ.
По результатам анализа площадь под ROC-кривой составила 0,982 с чувствительностью 93,3% и специфичностью 95,2% при пороге отсечения р=0,479, что говорит о высоком качестве модели (рис. 1).
Обсуждение
Согласно литературным данным наличие нарушений углеводного обмена увеличивает риск развития неблагоприятных ССС, а также существенно влияет на тяжесть заболевания и ухудшает прогноз [8].
В течение последних десятилетий ИР не только рассматривают в качестве фактора риска атеросклероза, но и описывают сходство патогенеза этих двух патологических состояний. Существует точка зрения, что ИР может повышать концентрацию воспалительных биомаркеров [9]. Считается, что ФНОα и ИЛ-6 могут изменять функцию бета-клеток путем прямого действия или стимуляции продукции свободных жирных кислот. Эти процессы усиливают или способствуют развитию СД 2 типа, подтверждая связь между ИР и воспалением. Из этого взаимодействия мы можем получить более глубокое понимание роли воспаления и его взаимодействия с другими факторами в патогенезе СД 2 типа. Хроническое воспаление низкой интенсивности является ключевым фактором развития ИР и СД 2 типа [10].
Помимо метаболического действия инсулин обладает также противовоспалительным эффектом, усиливает продукцию в эндотелии оксида азота, что обусловливает антиатерогенные, вазомоторные свойства эндотелия и подавляет митотическую активность клеток сосудистой стенки. В связи с этим избыточное потребление липидов с последующим развитием ИР сопровождается глобальными изменениями гомеостаза с нарушением метаболизма липидов и углеводов, развитием дислипидемии и гипергликемии, дисфункции эндотелия с ремоделированием сосудистой стенки и активацией в ней воспаления [10].
В исследовании О.В. Груздевой (2015) установлено, что ИР, определяемая с помощью индекса QUICKI в госпитальном периоде ИМ, имеет важное значение в качестве предиктора развития новых ССС в течение 1 года после перенесенного ИМ. Наличие ИР в госпитальном периоде ИМ ассоциировано с 7-кратным увеличением риска развития отдаленных ССО. Кроме того, кумулятивный риск развития неблагоприятного исхода статистически значимо выше у пациентов с ИР [12].
По результатам настоящего исследования у больных после успешной коронарной реваскуляризации с наличием ИР установлена гиперэкспрессия маркеров воспаления (ФНОα и ИЛ-6), взаимосвязанная с параметрами липидного профиля, эндотелиальной дисфункции и гипергомоцистеинемией.
Существует мнение, что данные нарушения являются отражением вялотекущего системного воспалительного процесса, который может носить самостоятельный характер, независимо от степени выраженности коронарного атеросклероза, являясь, с одной стороны, прогностическим, с другой стороны, провоцирующим фактором процесса дестабилизации атеросклеротической бляшки с развитием острого коронарного события [13].
Полученные результаты согласуются с литературными данными о наличии более выраженного нарушения атерогенного профиля липидов у пациентов с наличием гипергликемии на фоне ИБС [14, 15].
По данным однофакторного анализа установлено, что у пациентов с ИБС и метаболическими нарушениями маркерами развития неблагоприятных ССО в течение 12-месячного наблюдения являются гиперэкспрессия ИЛ-6, ФНОα, гомоцистеина и эндотелина-1.
Высокий уровень гомоцистеина признается независимым фактором риска неблагоприятных ССС вследствие его проатеротромботического потенциала. В исследовании Framingham Offspring гомоцистеин указан как один из четырех факторов, которые увеличивают риск возникновения ишемического инсульта [16], каротидного атеросклероза [17]. При этом более ранние исследования показали связь между повышением уровня гомоцистеина и риском развития ИМ, а также повторной реваскуляризацией миокарда [18].
Предложенная нами модель индивидуальной оценки прогноза в течение 12 мес. включала не только клинические переменные (функциональный класс сердечной недостаточности), но и лабораторные параметры — уровень гомоцистеина и эндотелина-1, базальной, постпрандиальной гликемии. При этом площадь под ROC-кривой AUC составила 0,982 с чувствительностью 93,3% и специфичностью 95,2%, что говорит о высоком качестве модели.
Это согласуется с данными, полученными в исследовании А.П. Голикова и соавт. (2017). В нем установлены наиболее значимые предикторы, влияющие на развитие неблагоприятных исходов в течение 1 года наблюдения у больных СД с острым коронарным синдромом без подъема сегмента ST, которыми явились мультифокальный атеросклероз, снижение фракции выброса левого желудочка менее 51% и уровень эндотелина-1 более 0,87 фмоль/мл [19].
Наше исследование демонстрирует неблагоприятную прогностическую роль эндотелина-1 не только у пациентов с острым коронарным синдромом без подъема сегмента SТ, но и при наступлении коронарных событий в течение первого года наблюдения после плановых эндоваскулярных вмешательств у больных со стабильной ИБС.
Заключение
Таким образом, установлены предикторы неблагоприятных кардиоваскулярных осложнений у больных ИБС с метаболическими нарушениями после планового ЧКВ, которые позволят улучшить прогнозирование риска развития неблагоприятных ССС независимо от других факторов.
Тем не менее остается актуальным поиск новых биомаркеров и факторов риска развития сосудистых катастроф после эндоваскулярной реваскуляризации с целью формирования перспективной стратегии лечения и профилактики осложнений коронарной реваскуляризации, а также улучшения отдаленного прогноза.
Источники финансирования
Исследование проведено в рамках фундаментальных научных исследований по государственному заданию АААА-А15-115123110026-3.












