Введение
Венозные тромбоэмболические осложнения (ВТЭО) считаются одними из самых грозных состояний, имеющих отношение к различным областям клинической медицины. По данным статистических отчетов Министерства здравоохранения Российской Федерации, у нас в стране ежегодно регистрируются около 80 000 новых случаев данного заболевания, к которым относят тромбоз глубоких (ТГВ) и подкожных вен, тромбоэмболию легочных артерий (ТЭЛА) [1, 2].В пожилом и старческом возрасте частота ТГВ увеличивается в несколько раз и достигает 200 случаев на 100 000 в год. Легочную эмболию регистрируют ежегодно с частотой 35–40 на 100 000 человек [1]. Даже в случаях своевременного выявления ТГВ от легочной эмболии умирают 6% пациентов, в то время как частота ТЭЛА может быть и больше, поскольку не всегда диагноз ТГВ ставится своевременно в связи с нечеткой клинической картиной заболевания [3]. Но даже благополучный исход острого периода не означает разрешения проблемы. В отдаленном периоде после ТГВ формируется посттромботическая болезнь (ПТБ) нижних конечностей или хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ). Если в первом случае возникает глубокая дезорганизация работы венозной системы нижних конечностей с высокой вероятностью развития трофических язв и рецидива венозного тромбоза, то в случае с ХТЭЛГ формируется правожелудочковая недостаточность, напрямую связанная с массивностью поражения легочного русла [4]. Тяжелая ХТЭЛГ в течение 5 лет приводит к смерти 10–15% больных, перенесших массивную ТЭЛА [1].
К предрасполагающим факторам формирования хронической легочной гипертензии часто относят молодой возраст пациентов и крупный дефект перфузии по данным сцинтиграфии легких в период острой ТЭЛА [5, 6]. Недостаточная антикоагулянтная терапия, большая масса тромботических масс, остаточные тромбы и рецидивы ТЭЛА также вносят вклад в развитие ХТЭЛГ [7].
Следует, однако, сказать, что эти критерии носят размытый характер, без четкой их характеристики, и не всегда можно с большой вероятностью говорить о риске развития ХТЭЛГ у того или иного больного после перенесенной ТЭЛА.
Цель исследования: определить роль тромболитической и антикоагулянтной терапии в снижении риска развития хронической легочной гипертензии после перенесенной ТЭЛА.
Материал и методы
Работа проводилась на базе ГКБ № 1 им. Н.И. Пирогова г. Москвы. В исследование было включено 210 пациентов, поступивших в клинику с диагнозом субмассивной и массивной ТЭЛА с 2013 по 2017 г. В дальнейшем эти больные были вызваны в сроки от 1 до 3 лет после первичной госпитализации для контрольного обследования. В зависимости от того, была или нет выявлена у них на тот момент ХТЭЛГ, пациенты были разделены на две группы: 1-я группа была представлена 45 пациентами, у которых при контрольном обследовании были выявлены признаки легочной гипертензии; во 2-ю группу вошли 165 больных без признаков ХТЭЛГ.
В данной работе мы оценивали множество различных факторов, способных привести к развитию ХТЭЛГ, в т. ч. возраст больных, сопутствующую патологию, длительность заболевания, эмболоопасность и локализацию венозного тромбоза, варианты тромболитической и антикоагулянтной терапии.
Следует отметить, что в исследовании принимали участие только те пациенты, которые поступили в клинику с подтвержденным диагнозом ТЭЛА. В связи с этим были исключены больные с другими видами хронической легочной гипертензии.
Из инструментальных методов диагностики для выявления венозного тромбоза в системе нижней полой вены мы использовали ультразвуковое ангиосканирование с помощью аппарата HD11 (Нидерланды) с линейными датчиками 7–10 МГц и конвексными датчиками 3,5–5 МГц.
Для неинвазивного ангиографического обследования мы использовали мультиспиральную компьютерную томоангиографию (МСКТ-ангиографию). Исследование проводилось на аппарате Aquilion Prime (Япония).
Обработку данных проводили с применением программы Statistica 12.0, StatSoft Inc. Для проверки нормальности распределения в совокупности мы использовали тест Шапиро — Уилка. Сравнение количественных показателей из совокупностей с нормальным распределением выполняли при помощи t-теста Стьюдента для двух зависимых и независимых выборок. Количественные данные представлены в виде средних значений и ошибки среднего (M±m). При отличном от нормального распределения данных для проверки статистических гипотез при сравнении числовых данных для двух независимых групп применяли U-критерий Манна — Уитни. Различия между группами считали значимыми при p≤0,05.
Для оценки значимости различий между выявленным в результате исследования количеством исходов или качественных характеристик выборки, попадающих в каждую категорию, и теоретическим количеством, которое можно ожидать в изучаемых группах, при справедливости нулевой гипотезы использовался критерий хи-квадрат Пирсона. Анализ отдаленных результатов проводили с помощью метода Каплана — Мейера.
Результаты и обсуждение
По окончании математического анализа были выявлены следующие факторы, достоверно влияющие на формирование ХТЭЛГ после перенесенной ТЭЛА.Одним из таких факторов можно считать длительность заболевания, а именно сроки возникновения тромбоза. У пациентов, у которых в процессе наблюдения не развилась ХТЭЛГ, давность развития тромботических масс в венах нижних конечностей составила 8,16±1,13 сут, в то время как у больных с ХТЭЛГ — 13,70±2,05 сут (p=0,015). По-видимому, это связано с процессами организации тромботических масс, наиболее полно, по мнению многих авторов, заканчивающихся к концу 2-недельного срока [8–10]. В связи с этим в случаях ТЭЛА тромболитическая или антикоагулянтная терапия не достигает значимого клинического эффекта по сравнению с таковой при наличии более свежих тромботических масс, что было подтверждено нами при дальнейшем изучении исследуемых параметров.
Вторым фактором, имеющим отношение к вероятности ХТЭЛГ, явился уровень тромба в нижних конечностях. Более благоприятной оказалась дистальная локализация тромба: в венах голени (у пациентов без ХТЭЛГ она встречалась почти в 2 раза чаще (25,45% против 13,33%)) и подколенной вене (27,27% и 8,89% соответственно). Наиболее неблагоприятная локализация тромба была определена на уровне поверхностной бедренной вены — в 42,22% случаев у пациентов с ХТЭЛГ и в 27,27% у больных без ХТЭЛГ.
Объяснить это можно следующим образом. При дистальном венозном тромбозе сами по себе размеры тромботических масс не такие большие, в связи с чем при свершившейся эмболии происходит меньшее поражение легочного русла, а артериальные ветви, заполненные тромботическими массами, легче подвергаются реканализации. При тромбозе поверхностной бедренной вены тромботические массы, как правило, имеют большие размеры, в первую очередь по толщине. Клиническая же картина заболевания часто стерта из-за сохранения кровотока по глубокой вене бедра, на фоне этого флотирующая верхушка тромба может вырасти до значительных размеров в окклюзивно тромбированной и отключенной из кровотока поверхностной бедренной вене.
Выяснилось, что локализация тромба в общей бедренной вене также является благоприятным фактором, способствующим более редкому развитию легочной гипертензии. Так, у пациентов без ХТЭЛГ данная локализация встречалась в 27,27% случаев, у больных ХТЭЛГ — в 8,89% случаев. На наш взгляд, связано это может быть с более яркой клинической картиной заболевания и своевременным обращением больных за медицинской помощью, а также более прочной фиксацией тромботических масс в области основания тромба.
Значимым фактором отсутствия развития ХТЭЛГ после ТЭЛА явилась проводимая тромболитическая терапия. И если сам факт ее проведения у пациентов, поступивших в стационар, достоверно не влиял на развитие хронической легочной гипертензии (она проводилась в 46,67% и 41,82% случаев соответственно в группе пациентов с и без ХТЭЛГ), то выбор препарата, которым она выполнялась, существенно повлиял на результаты лечения. Так, алтеплаза в группе с ХТЭЛГ применялась в 15,56% случаев по сравнению с 5,45% случаев у пациентов без хронической легочной гипертензии, урокиназа соответственно — в 4,4% и 16,3%, стрептокиназа (Республика Беларусь) — в 6,67% и 12,73%, стрептокиназа (Индия) — в 13,33% и 3,64%. Таким образом, наши данные свидетельствуют, что адекватно проводимая тромболитическая терапия благоприятно сказывается на результатах лечения пациентов с ТЭЛА, приводя к снижению риска развития ХТЭЛГ в дальнейшем, что не совсем совпадает с мнением тех авторов, которые не различают по эффективности тромболитики и гепарины [11, 12].
Следующим важным показателем, имеющим отношение к развитию ХТЭЛГ после перенесенной ТЭЛА, следует считать вид назначаемой антикоагулянтной терапии. В подавляющем большинстве случаев применение короткого курса гепаринотерапии (нефракционированный гепарин или низкомолекулярные гепарины) с переходом на варфарин для вторичной профилактики венозных тромбоэмболических осложнений не способствовало уменьшению легочной гипертензии, в то время как прием ривароксабана в течение длительного срока с первого дня лечения приводил к ее снижению. Так, в группе пациентов с ХТЭЛГ варфарин применялся в 91,11% случаев, а у пациентов, у которых ХТЭЛГ не развилась, — только в 5,09%; ривароксабан соответственно — в 4,44% и 89,09%. Полученные нами результаты могут свидетельствовать о более благоприятной положительной роли ривароксабана в активизации собственной тромболитической системы. Другие антикоагулянты, такие как дабигатрана этексилат, и длительный курс низкомолекулярных гепаринов использовались в нашем исследовании в единичных наблюдениях и не повлияли на результаты лечения.
Степень поражения легочного русла, определяемая посредством МСКТ-ангиографии, достоверно не отличалась при первичном поступлении пациентов в стационар с ТЭЛА и составила 12,43±2,51 и 13,12±2,46 балла (p=0,812), в то время как при контрольном (через 1–3 года) обследовании пациентов разница между двумя группами была достоверной (10,55±1,13 и 6,63±0,50 балла соответственно, p=0,046). При контрольной сцинтиграфии легких количество пораженных сегментов, в которых наблюдалось снижение перфузии, также было различным. Если у пациентов, у которых в итоге развилась ХТЭЛГ, этот показатель увеличился с 6,24±0,77 до 9,52±1,01, то в группе без ХТЭЛГ он снизился с 6,29±0,56 до 3,22±0,41. В итоге разница между двумя группами при контрольном обследовании была достоверной (p=0,013). Объяснить это можно с нескольких позиций. Во-первых, как было сказано выше, в 1-й группе чаще использовалась алтеплаза, в отличие от 2-й группы, где обычно применялись урокиназа или стрептокиназа, что, по-видимому, не оказывало должного тромболитического воздействия, не способствовало адекватному восстановлению проходимости легочного русла и приводило к развитию ХТЭЛГ. Одним из подтверждений данного предположения может служить то, что у пациентов с возникшей в отдаленном периоде ХТЭЛГ в 6,66% случаев после тромболизиса алтеплазой приходилось проводить дополнительный курс тромболитической терапии посредством урокиназы. В группе без ХТЭЛГ комбинированной тромболитической терапии не требовалось. Во-вторых, увеличение количества пораженных сегментов легочного русла при динамическом наблюдении в 1-й группе может быть связано с рецидивирующим характером ТЭЛА на фоне продленного приема варфарина, чего не наблюдалось при применении ривароксабана. Кроме этого, неадекватно проведенная тромболитическая терапия могла привести к ремоделированию дистального сосудистого легочного русла и увеличению хронической легочной гипертензии. Эти механизмы ее развития могли дополнять друг друга.
Как уже было сказано выше, по данным некоторых авторов, одним из факторов риска развития ХТЭЛГ является изначально высокая степень поражения легочного русла по данным перфузионной сцинтиграфии легких [5, 6]. Наше исследование показало, что данный показатель не отличался в обеих группах при первичном поступлении пациентов в стационар с острой ТЭЛА — разница наблюдалась в гемодинамических характеристиках эхокардиографии (ЭхоКГ), что и привело в дальнейшем к усугублению легочной гипертензии у пациентов с ХТЭЛГ при контрольном обследовании (табл. 1).
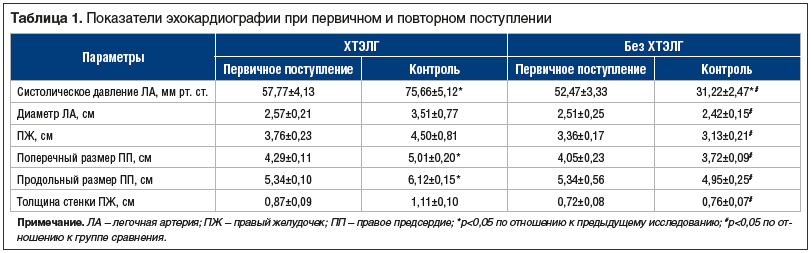
Так, давление, с которым они поступили в стационар с ТЭЛА, составило 57,77±4,13 мм рт. ст. и в дальнейшем (через 1–3 года) повысилось до 75,66±5,12 мм рт. ст., диаметр легочной артерии увеличился с 2,57±0,21 до 3,51±0,77 см, правый желудочек — с 3,76±0,23 до 4,50±0,81 см, поперечный размер правого предсердия — с 4,29±0,11 до 5,01±0,20 см, продольный размер правого предсердия — с 5,34±0,10 до 6,12±0,15 см, толщина стенки правого желудочка — с 0,87±0,09 до 1,11±0,10 см.
В группе пациентов без ХТЭЛГ, напротив, отмечалась положительная динамика при повторном контрольном обследовании. Давление в легочной артерии снизилось с 52,47±3,33 до 31,22±2,47 мм рт. ст., анатомические размеры также уменьшились: легочная артерия — с 2,51±0,25 до 2,42±0,15 см, правый желудочек — с 3,36±0,17 до 3,13±0,21 см, поперечный размер правого предсердия — с 4,05±0,23 до 3,72±0,09 см, продольный размер правого предсердия — с 5,34±0,56 до 4,95±0,25 см (при незначительном недостоверном увеличении толщины стенки правого желудочка — с 0,72±0,08 до 0,76±0,07 см).
Интересные данные были получены при оценке степени трикуспидальной регургитации. При первичном поступлении с ТЭЛА у пациентов 1-й группы трикуспидальная регургитация 1–3 степени наблюдалась приблизительно в равных долях: 1-я степень — у 37,78%, 2-я степень — у 28,89%, 3-я степень — у 33,33% (табл. 2). Во 2-й группе этот показатель распределился следующим образом: 1-я степень — у 29,09%, 2-я степень — у 54,55%, 3-я степень — у 14,55%. Как видно из представленных данных, во 2-й группе преобладала 2-я степень трикуспидальной регургитации, а больных с 3-й степенью было в 2 раза меньше, чем в 1-й группе. Средняя трикуспидальная регургитация составила в 1-й группе 1,93±0,23 ед., а во 2-й — 1,81±0,19 ед. Таким образом, более высокая степень трикуспидальной регургитации (особенно 3-я), при поступлении пациентов с ТЭЛА является одним из важных предикторов развития ХТЭЛГ в будущем.
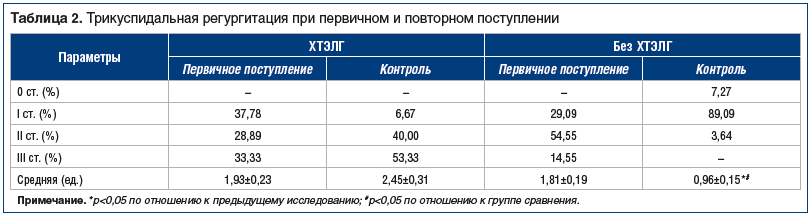
При контрольном обследовании пациентов (через 1–3 года) в 1-й группе количество пациентов с 1-й степенью трикуспидальной регургитации значительно уменьшилось и составило 6,67%. При этом значительно увеличилось количество больных с более тяжелыми степенями: до 40% со 2-й степенью, до 53,33% — с 3-й степенью.
Во 2-й группе динамика этого показателя была более благоприятной за счет увеличения числа пациентов с более легкой степенью и уменьшения числа с более тяжелой: 1-я степень — 89,09%, 2-я степень — 3,64%, больных с 3-й степенью не было. В 7,27% случаев мы наблюдали отсутствие какой-либо трикуспидальной регургитации.
Средняя степень регургитации в 1-й группе увеличилась с 1,93±0,23 до 2,45±0,31 ед., а во 2-й группе уменьшилась с 1,81±0,19 до 0,96±0,15 ед., что определило достоверную разницу между группами (p=0,031).
Для объективизации полученных результатов и лучшего понимания гемодинамических процессов мы ввели понятие «гемодинамический индекс», отражающий динамику показателей ЭхоКГ на фоне того или иного лечения во время первичной госпитализации пациентов с ТЭЛА. Определяли его как отношение первичных данных, полученных при поступлении больных, к показателям, определяемым нами в процессе лечения перед выпиской их из стационара. Данный индекс отражает не столько начальные цифры патологической гемодинамики при ТЭЛА, сколько эффективность проведенного лечения во время нахождения пациентов в стационаре.
Из всех гемодинамических показателей, определяемых при ЭхоКГ, достоверные показатели гемодинамического индекса были получены при оценке динамики давления в легочной артерии и трикуспидальной регургитации (табл. 3).
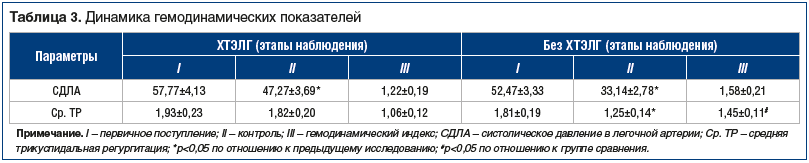
Так, у пациентов 1-й группы после лечения в стационаре (тромболитической и/или антикоагулянтной терапии) отмечалось снижение давления в легочной артерии с 57,77±4,13 до 47,27±3,69 мм рт. ст. Гемодинамический индекс при этом составил 1,22±0,19 ед. С другой стороны, у пациентов 2-й группы давление в легочной артерии снизилось с 52,47±3,33 до 33,14±2,78 мм рт. ст., а индекс составил 1,58±0,21 ед., что достоверно больше соответствующего показателя у пациентов 1-й группы (p=0,016).
Еще большая разница была получена при оценке динамики средней трикуспидальной регургитации. В 1-й группе она снизилась незначительно — с 1,93±0,23 до 1,82±0,20 ед., а индекс составил 1,06±0,12 ед. Во 2-й группе трикуспидальная регургитация уменьшилась с 1,81±0,19 до 1,25±0,14 ед., а гемодинамический индекс составил 1,45±0,11 ед., что в 1,37 раза больше, чем у пациентов с ХТЭЛГ (p=0,041). Как уже было сказано выше, подобная положительная динамика при лечении в стационаре может быть связана с выбором тромболитика или антикоагулянта. На наш взгляд, это также было одним из важных предикторов развития ХТЭЛГ в отдаленном после перенесенной ТЭЛА периоде.
При анализе сопутствующих заболеваний было установлено, что значимыми факторами риска развития ХТЭЛГ служили перенесенные заболевания на органах брюшной полости, особенно спленэктомия, гипертоническая болезнь
3-й степени, сахарный диабет, постинфарктный кардиосклероз. С другой стороны, возраст, пол, степень тяжести на момент поступления, наличие инфарктной пневмонии, хирургическая профилактика рецидива ТЭЛА, количество беременностей и родов в анамнезе, травматологический и онкологический анамнез, нарушения ритма сердца не имели достоверного влияния на возможное развитие ХТЭЛГ.
Прогностическая ценность исследуемых нами показателей заключается в возможности получения информации при первичном нахождении пациента в стационаре с острой ТЭЛА до выписки его на амбулаторное лечение. Также полученные данные обозначают ключевые точки патогенеза развития ХТЭЛГ, на которые возможно направить необходимое терапевтическое воздействие.
Заключение
Таким образом, результаты нашего исследования позволяют с высокой степенью достоверности выявлять пациентов, предрасположенных к развитию ХТЭЛГ после перенесенной ТЭЛА, что создает основу для своевременного проведения мероприятий, направленных на снижение риска возникновения данного осложнения. Это позволяет надеяться на улучшение отдаленных результатов лечения ТЭЛА у данного контингента больных.Полученные нами данные позволяют под иным углом взглянуть на проблему развития ХТЭЛГ после перенесенной ТЭЛА. Мы надеемся, что своевременное определение категории пациентов, входящих в группу риска ХТЭЛГ, позволит проводить за ними более активное динамическое наблюдение, вовремя применять различные варианты тромболитической и антикоагулянтной терапии, способствовать длительной компенсации функции правых отделов сердца и легких, предотвращению выраженной сердечно-легочной недостаточности после перенесенной ТЭЛА.












