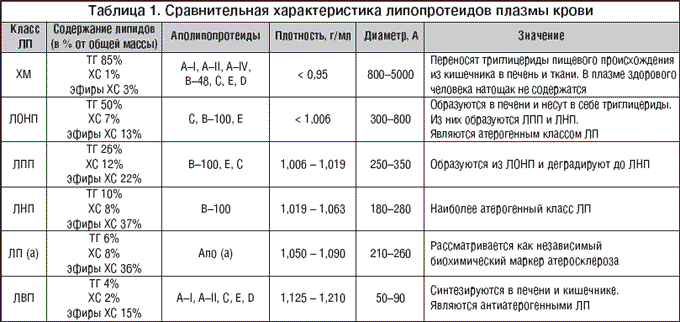
–У–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П (–У–Ы–Я) – –Њ–±–Њ–±—Й–∞—О—Й–Є–є —В–µ—А–Љ–Є–љ, –Њ—В—А–∞–ґ–∞—О—Й–Є–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –ї–Є–њ–Є–і–Њ–≤ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є. –Ы–Є–њ–Є–і—Л –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є —З–µ–ї–Њ–≤–µ–Ї–∞ – —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л, —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Л –Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ – –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Б–≤—П–Ј–∞–љ–љ–Њ–Љ —Б –±–µ–ї–Ї–∞–Љ–Є —Б–Њ—Б—В–Њ—П–љ–Є–Є, —В.–µ. –≤ —Д–Њ—А–Љ–µ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤. –†–∞–Ј–ї–Є—З–љ—Л–µ –Ї–ї–∞—Б—Б—Л –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –њ–Њ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–Љ—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –±–µ–ї–Ї–∞, –Ґ–У, –•–° –Є –µ–≥–Њ —Н—Д–Є—А–Њ–≤, –њ–Њ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є –і–Є–∞–Љ–µ—В—А—Г, –∞ —В–∞–Ї–ґ–µ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л–і–µ–ї—П—О—В —Е–Є–ї–Њ–Љ–Є–Ї—А–Њ–љ—Л (–•–Ь), –Ы–Я –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Ю–Э–Я), –Ы–Я –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Я), –Ы–Я –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Э–Я) –Є –Ы–Я –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Т–Я), –∞ —В–∞–Ї–ґ–µ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і (–∞). –Ш—Е —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1. –Э–Њ—А–Љ–∞–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–Є–њ–Є–і–Њ–≤ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –≤ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є III –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ (2003 –≥.) [1]:
J –Ю–±—Й–Є–є –•–° – –Љ–µ–љ–µ–µ 5 –Љ–Љ–Њ–ї—М/–ї;
J –•–° –Ы–Э–Я – –Љ–µ–љ–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї;
J –•–° –Ы–Т–Я – –±–Њ–ї–µ–µ 1 –Љ–Љ–Њ–ї—М/–ї —Г –Љ—Г–ґ—З–Є–љ –Є –±–Њ–ї–µ–µ 1,2 –Љ–Љ–Њ–ї—М/–ї —Г –ґ–µ–љ—Й–Є–љ;
J –Ґ–У – –Љ–µ–љ–µ–µ 1,77 –Љ–Љ–Њ–ї—М/–ї.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–≥–Њ–≤–Њ—А–Є—В—М—Б—П, —З—В–Њ –≤ —А—П–і–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –≤ –Љ–≥ % (–Є–ї–Є –Љ–≥/–і–ї). –Ф–ї—П –њ–µ—А–µ—Б—З–µ—В–∞ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ –Љ–≥ % —Б–ї–µ–і—Г–µ—В —Г–Љ–љ–Њ–ґ–Є—В—М –љ–∞ 0,0259, –∞ —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ – –љ–∞ 0,0113.
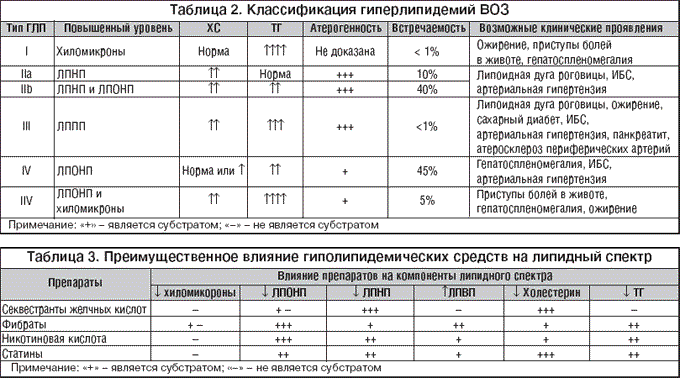
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –≤—Л–і–µ–ї—П—О—В –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є—О, –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—О –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—О. –≠–Ї—Б–њ–µ—А—В–∞–Љ–Є –Т–Ю–Ч –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–є, –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—Й–∞—П 5 –Є—Е —В–Є–њ–Њ–≤ (—В–∞–±–ї. 2). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ј–Є—Ж–Є–є –≤–∞–ґ–љ–Њ –Њ—В–ї–Є—З–∞—В—М –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ:
–Я–µ—А–≤–Є—З–љ—Л–µ –У–Ы–Я:
I. –Я–Њ–ї–Є–≥–µ–љ–љ—Л–µ –У–Ы–Я
II. –Ь–Њ–љ–Њ–≥–µ–љ–љ—Л–µ –У–Ы–Я
–°–µ–Љ–µ–є–љ–∞—П –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П
J –°–µ–Љ–µ–є–љ–∞—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П
J –°–µ–Љ–µ–є–љ–∞—П –і–Є—Б–±–µ—В–∞–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–µ–Љ–Є—П
J –°–µ–Љ–µ–є–љ–∞—П —Н–љ–і–Њ–≥–µ–љ–љ–∞—П –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є—П
J –°–µ–Љ–µ–є–љ–∞—П —Е–Є–ї–Њ–Љ–Є–Ї—А–Њ–љ–µ–Љ–Є—П
–Т—В–Њ—А–Є—З–љ—Л–µ –У–Ы–Я:
1. –Т—В–Њ—А–Є—З–љ–∞—П –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П
J –Я—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ
J –Я—А–Є –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј–µ
J –Я—А–Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ
J –Я—А–Є —Е–Њ–ї–µ—Б—В–∞–Ј–µ
J –Я—А–Є –њ–∞—А–∞–њ—А–Њ—В–µ–Є–љ–µ–Љ–µ–Є—П—Е (–љ–∞–њ—А–Є–Љ–µ—А, –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–∞—П –Љ–Є–µ–ї–Њ–Љ–∞)
2. –Т—В–Њ—А–Є—З–љ–∞—П –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є—П
J –Я—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ
J –Я—А–Є –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј–µ
J –Я—А–Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ
J –Я—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–Љ–µ
J –Я—А–Є –њ—А–Є–µ–Љ–µ b––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, —В–Є–∞–Ј–Є–і–љ—Л—Е –і–Є—Г—А–µ—В–Є–Ї–Њ–≤.
–Т—Л–і–µ–ї–µ–љ–Є–µ –≤—В–Њ—А–Є—З–љ—Л—Е –У–Ы–Я, –Њ—Б–ї–Њ–ґ–љ—П—О—Й–Є—Е —В–µ—З–µ–љ–Є–µ —А—П–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–Є–љ–і—А–Њ–Љ–Њ–≤ –Є–ї–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ы–°, –Њ–њ—А–∞–≤–і–∞–љ–Њ —Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ј–Є—Ж–Є–є. –Т –њ–Њ–і–Њ–±–љ—Л—Е —Б–ї—Г—З–∞—П—Е –≤–µ–і—Г—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –±–Њ–ї—М–љ—Л–Љ —Б –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ–Є –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є (–±–Є–ї–ї–Є–∞—А–љ—Л–є —Ж–Є—А—А–Њ–Ј –њ–µ—З–µ–љ–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ—З–µ–Ї) –Љ–Њ–ґ–µ—В –њ–Њ—В—А–µ–±–Њ–≤–∞—В—М—Б—П –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П.
«–§—Г–љ–і–∞–Љ–µ–љ—В–Њ–Љ» –≤ –ї–µ—З–µ–љ–Є–Є –ї—О–±–Њ–є –У–Ы–Я —П–≤–ї—П—О—В—Б—П –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –њ–Є—В–∞–љ–Є—П –Є –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є. –Ф–∞–ї–µ–µ –≤—А–∞—З—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–µ—И–Є—В—М –≤–Њ–њ—А–Њ—Б –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –Є –≤—Л–±—А–∞—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В, –∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е – –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П
–≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤
–У–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞–Ј—Л–≤–∞—О—В —В–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, –Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±–љ—Л —Б–љ–Є–ґ–∞—В—М —Г—А–Њ–≤–µ–љ—М –Ґ–У, –Њ–±—Й–µ–≥–Њ –•–°, –•–° –Ы–Э–Я –Є –Ы–Ю–Э–Я. –Я–Њ–ї–µ–Ј–љ—Л–Љ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П —Б–≤–Њ–є—Б—В–≤–Њ –њ–Њ–≤—Л—И–∞—В—М —Г—А–Њ–≤–µ–љ—М –Ы–Т–Я. –Т—Б–µ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –њ—А–Є–Љ–µ–љ—П—О—Й–Є–µ—Б—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –Љ–Њ–ґ–љ–Њ –њ–Њ–і—А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ —Б–ї–µ–і—Г—О—Й–Є–µ –≥—А—Г–њ–њ—Л:
1. –°—В–∞—В–Є–љ—Л – –Є–љ–≥–Є–±–Є—В–Њ—А—Л –У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј—Л (–∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ, –ї–Њ–≤–∞—Б—В–∞—В–Є–љ, –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ, —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ, —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ, —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ);
2. –≠–Ј–µ—В–Є–Љ–Є–±;
3. –§–Є–±—А–∞—В—Л – –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ —Д–Є–±—А–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Ї–ї–Њ—Д–Є–±—А–∞—В, –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї, –±–µ–Ј–∞—Д–Є–±—А–∞—В, —Д–µ–љ–Њ—Д–Є–±—А–∞—В, —Н—В–Њ—Д–Є–±—А–∞—В);
4. –°–µ–Ї–≤–µ—Б—В—А–∞–љ—В—Л –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В – –∞–љ–Є–Њ–љ–Њ–Њ–±–Љ–µ–љ–љ—Л–µ —Б–Љ–Њ–ї—Л (—Е–Њ–ї–µ—Б—В–Є—А–∞–Љ–Є–љ, –Ї–Њ–ї–µ—Б—В–Є–њ–Њ–ї);
5. –Я—А–µ–њ–∞—А–∞—В—Л –љ–Є–Ї–Њ—В–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–љ–Є–∞—Ж–Є–љ, —Н–љ–і—Г—А–∞—Ж–Є–љ);
6. –°–Њ–µ–і–Є–љ–µ–љ–Є—П –Њ–Љ–µ–≥–∞–3––ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В.
–Я—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є —Н—В–Є—Е –≥—А—Г–њ–њ –Њ—В–ї–Є—З–∞—О—В—Б—П –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –і–µ–є—Б—В–≤–Є—П –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ, –љ–Њ –Є –њ–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П—В—М –љ–∞ —А–∞–Ј–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ (—В–∞–±–ї. 3).
–°—В–∞—В–Є–љ—Л – –Є–љ–≥–Є–±–Є—В–Њ—А—Л –У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј—Л
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Б—В–∞—В–Є–љ—Л —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є –≥—А—Г–њ–њ–Њ–є –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –±–ї–∞–≥–Њ–і–∞—А—П —Б–≤–Њ–µ–є –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –±–Њ–≥–∞—В–Њ–Љ—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –Њ–њ—Л—В—Г –Є —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Я–µ—А–≤—Л–є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М —Н—В–Њ–є –≥—А—Г–њ–њ—Л – –ї–Њ–≤–∞—Б—В–∞—В–Є–љ – –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –Є–Ј –≥—А–Є–±–Ї–∞ Monascus ruber –Є —Б 1987 –≥. –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ —В–µ—А–∞–њ–Є–Є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–є, –Њ—В—В–µ—Б–љ–Є–≤ –љ–∞ –≤—В–Њ—А–Њ–є –њ–ї–∞–љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–і—Б—В–≤–∞ – –љ–Є–Ї–Њ—В–Є–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, —Д–Є–±—А–∞—В—Л, –∞–љ–Є–Њ–љ–Њ–Њ–±–Љ–µ–љ–љ—Л–µ —Б–Љ–Њ–ї—Л. –Ф—А—Г–≥–Є–µ —Б—В–∞—В–Є–љ—Л –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ–Ј–ґ–µ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ (—Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ, –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ, —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ) –Є–ї–Є –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ—Г—В–µ–Љ (—Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ –Є –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ).
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П. –≠—Д—Д–µ–Ї—В —Б—В–∞—В–Є–љ–Њ–≤ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –њ—Г—В–µ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —Д–µ—А–Љ–µ–љ—В–∞ 3––≥–Є–і—А–Њ–Ї—Б–Є–3––Љ–µ—В–Є–ї–≥–ї—Г—В–∞—А–Є–ї––Ї–Њ—Д–µ—А–Љ–µ–љ—В –Р–—А–µ–і—Г–Ї—В–∞–Ј—Л (–У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј—Л) –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, —Б–ї–µ–і—Б—В–≤–Є–µ–Љ —З–µ–≥–Њ —П–≤–ї—П–µ—В—Б—П —Г–≥–љ–µ—В–µ–љ–Є–µ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –У–Ь–У––Ъ–Њ–Р –≤ –Љ–µ–≤–∞–ї–Њ–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г – –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–є –њ—А–Њ–і—Г–Ї—В –≤ —Б–Є–љ—В–µ–Ј–µ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ы–Э–Я–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є—Е –Ј–∞—Е–≤–∞—В –Є–Ј –Ї—А–Њ–≤–Є —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Ы–Э–Я, –Є –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є – –Ы–Ю–Э–Я –Є –Ы–Я–Я. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ы–Э–Я –Є –•–°, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ—А–µ–љ–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ы–Ю–Э–Я –Є –Ґ–У. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є–Ј–Њ–њ—А–µ–љ–Њ–Є–і–Њ–≤, —З—В–Њ, –≤–µ—А–Њ—П—В–љ–Њ, –Є –ї–µ–ґ–Є—В –≤ –Њ—Б–љ–Њ–≤–µ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е «–њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л—Е» —Н—Д—Д–µ–Ї—В–Њ–≤ —Б—В–∞—В–Є–љ–Њ–≤, –∞ –Є–Љ–µ–љ–љ–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ, –∞–љ—В–Є–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Г–ї—Г—З—И–∞—В—М —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П [6]. –Ф–ї—П —А–∞–Ј–≤–Є—В–Є—П —Н—Д—Д–µ–Ї—В–∞ —Б—В–∞—В–Є–љ–Њ–≤ —В—А–µ–±—Г–µ—В—Б—П 1–2 –Љ–µ—Б., –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Њ–≤–Њ–і–Є—В—Б—П –і–ї–Є—В–µ–ї—М–љ–∞—П, –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П [2].
–Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є —Б—В–∞—В–Є–љ–Њ–≤. –Я—А–Є –љ–∞–ї–Є—З–Є–Є —А—П–і–∞ –Њ–±—Й–Є—Е —З–µ—А—В –≤ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–µ —А–∞–Ј–љ—Л—Е —Б—В–∞—В–Є–љ–Њ–≤ –Є–Љ–µ–љ–љ–Њ –≤ —Н—В–Њ–є –Њ–±–ї–∞—Б—В–Є –ї–µ–ґ–∞—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤–љ—Г—В—А–Є –≥—А—Г–њ–њ—Л. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Г—З–∞—Б—В–Є–µ —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є (–Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В—Л —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –†450, –£–Ф–§––≥–ї—О–Ї—Г—А–Њ–љ–Є–ї—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л) –Є–ї–Є —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ (–≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ –†, —В—А–∞–љ—Б–њ–Њ—А—В–µ—А—Л –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –∞–љ–Є–Њ–љ–Њ–≤) –≤ –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –±—Г–і–µ—В –Њ–њ—А–µ–і–µ–ї—П—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, –≤ —В.—З. –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ –Њ–њ–∞—Б–љ–Њ—Б—В—М –≤ –њ–ї–∞–љ–µ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –Ф–ї—П –≤—Б–µ—Е —Б—В–∞—В–Є–љ–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –±–µ–ї–Ї–∞–Љ–Є –Ї—А–Њ–≤–Є –±–Њ–ї–µ–µ 95%, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ, —Б–≤—П–Ј—Л–≤–∞—О—Й–Є–є—Б—П —Б –±–µ–ї–Ї–∞–Љ–Є –Ї—А–Њ–≤–Є –љ–∞ 50%. –Ф–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ґ1/2 —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ–Њ—А—П–і–Ї–∞ 2–3 —З–∞—Б–Њ–≤, –і–ї—П –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ – 15 —З–∞—Б–Њ–≤. –•–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є —Б—В–∞—В–Є–љ–Њ–≤ —П–≤–ї—П–µ—В—Б—П –≤—Л–≤–µ–і–µ–љ–Є–µ –Є—Е —Б –ґ–µ–ї—З—М—О –љ–∞ 90% –Є –±–Њ–ї–µ–µ [3, 4].
–Ы–Њ–≤–∞—Б—В–∞—В–Є–љ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ, –≤ –њ–µ—З–µ–љ–Є –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Ї–∞—А–±–Њ–Ї—Б–Є—Н—Б—В–µ—А–∞–Ј –Њ–љ –≥–Є–і—А–Њ–ї–Є–Ј—Г–µ—В—Б—П –і–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞, –Ї–Њ—В–Њ—А—Л–є —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Є –Є–љ–≥–Є–±–Є—А—Г–µ—В –У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј—Г. b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П CYP3A4 –і–Њ –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤. –І–∞—Б—В–Є—З–љ–Њ b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –≥–ї—О–Ї—Г—А–Њ–љ–Є—А–Њ–≤–∞–љ–Є—О UGT1A1 –Є UGT1A3. –°–∞–Љ –ї–Њ–≤–∞—Б—В–∞—В–Є–љ –Є –µ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л —Б–њ–Њ—Б–Њ–±–љ—Л –∞–Ї—В–Є–≤–љ–Њ —Б–µ–Ї—А–µ—В–Є—А–Њ–≤–∞—В—М—Б—П –≤ –ґ–µ–ї—З—М –њ—А–Є —Г—З–∞—Б—В–Є–Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––†. –°–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ CYP3A4 (–Љ–∞–Ї—А–Њ–ї–Є–і—Л, –∞–Ј–Њ–ї–Њ–≤—Л–µ –∞–љ—В–Є–Љ–Є–Ї–Њ—В–Є–Ї–Є, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Т–Ш–І––њ—А–Њ—В–µ–Є–љ–∞–Ј—Л – –Є–љ–і–Є–љ–∞–≤–Є—А, —А–Є—В–Њ–љ–∞–≤–Є—А, —Б–∞–Ї–≤–Є–љ–∞–≤–Є—А) –Є–ї–Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––† (–≤–µ—А–∞–њ–∞–Љ–Є–ї, —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ, —Е–Є–љ–Є–і–Є–љ, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ) –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Ї—А–Њ–≤–Є —Б–∞–Љ–Њ–≥–Њ –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –µ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤. –Я—А–Є—З–Є–љ–Њ–є –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –њ—А–Є –µ–≥–Њ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї–Њ–Љ (–Є–љ–≥–Є–±–Є—В–Њ—А UGT1A1 –Є UGT1A2) —П–≤–ї—П–µ—В—Б—П —Г–≥–љ–µ—В–µ–љ–Є–µ –≥–ї—О–Ї—Г—А–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П. –Т–Њ –≤—Б–µ—Е —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Ј–љ–∞—З–Є–Љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞.
–°–Є–Љ–≤–∞—Б—В–∞—В–Є–љ, –Ї–∞–Ї –Є –ї–Њ–≤–∞—Б—В–∞—В–Є–љ, —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ, –≤ –њ–µ—З–µ–љ–Є –Њ–љ –њ—Г—В–µ–Љ –≥–Є–і—А–Њ–ї–Є–Ј–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Ї–∞—А–±–Њ–Ї—Б–Є—Н—Б—В–µ—А–∞–Ј –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Л–є b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В. b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П CYP3A4, —З–∞—Б—В–Є—З–љ–Њ CYP2D6, –Є –≤ –љ–µ–±–Њ–ї—М—И–Њ–є —Б—В–µ–њ–µ–љ–Є CYP2C9 –і–Њ –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤—Л–≤–Њ–і—П—В—Б—П —Б –ґ–µ–ї—З—М—О. –І–∞—Б—В—М b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –≥–ї—О–Ї—Г—А–Њ–љ–Є—А–Њ–≤–∞–љ–Є—О –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ UGT1A1 –Є UGT1A3.
–Р—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ —П–≤–ї—П–µ—В—Б—П –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ. –Т—Б–Њ—Б–∞–≤—И–Є—Б—М –Є –њ–Њ–њ–∞–≤ –≤ –≤–Њ—А–Њ—В–љ—Г—О –≤–µ–љ—Г, –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ «–њ–Њ–≥–ї–Њ—Й–∞–µ—В—Б—П» –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞–Љ–Є —Б —Г—З–∞—Б—В–Є–µ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –∞–љ–Є–Њ–љ–Њ–≤ OATP–C. –Р—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ CYP3A4 –і–Њ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤. –І–∞—Б—В—М –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –µ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –≥–ї—О–Ї—Г—А–Њ–љ–Є—А–Њ–≤–∞–љ–Є—О UGT1A1 –Є UGT1A2. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ —Б–µ–Ї—А–µ—В–Є—А–Њ–≤–∞—В—М—Б—П –≤ –ґ–µ–ї—З—М —Б –њ–Њ–Љ–Њ—Й—М—О –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––† [5].
–§–ї—Г–≤–∞—Б—В–∞—В–Є–љ —В–Њ–ґ–µ —П–≤–ї—П–µ—В—Б—П –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ. –Ю—Б–љ–Њ–≤–љ—Л–Љ —Д–µ—А–Љ–µ–љ—В–Њ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П CYP2C9. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Њ–Ї–Є—Б–ї–µ–љ–Є—П —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ CYP2C9 –Њ–±—А–∞–Ј—Г—О—В—Б—П 2 –Љ–µ—В–∞–±–Њ–ї–Є—В–∞, —Б–Њ—Е—А–∞–љ—П—О—Й–Є–µ —Б–≤–Њ—О –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М. –Ш–љ–≥–Є–±–Є—А—Г—О—Й–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М 5––≥–Є–і—А–Њ–Ї—Б–Є—Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 85% –Њ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞, –∞ 6––≥–Є–і—А–Њ–Ї—Б–Є—Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ– 45%. –Ґ—А–µ—В–Є–є –Љ–µ—В–∞–±–Њ–ї–Є—В —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ N––і–µ–Ј–Њ–њ—А–Њ–њ–Є–ї—Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–µ–љ.
–Я—А–∞–≤–∞—Б—В–∞—В–Є–љ «–њ–Њ–≥–ї–Њ—Й–∞–µ—В—Б—П» –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞–Љ–Є —Б —Г—З–∞—Б—В–Є–µ–Љ OATP–C. –Я—А–∞–≤–∞—Б—В–∞—В–Є–љ –љ–µ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –Є –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ –∞–Ї—В–Є–≤–љ–Њ —Б–µ–Ї—А–µ—В–Є—А—Г–µ—В—Б—П –≤ –ґ–µ–ї—З—М —Б –њ–Њ–Љ–Њ—Й—М—О —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ MRP–2.
–†–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ —В–∞–Ї–ґ–µ «–њ–Њ–≥–ї–Њ—Й–∞–µ—В—Б—П» –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞–Љ–Є —Б —Г—З–∞—Б—В–Є–µ–Љ OATP–C. –Т –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е 10% –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ CYP2C9, –Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є CYP2C19 –Є –Ї–∞—А–±–Њ–Ї—Б–Є—Н—Б—В–µ—А–∞–Ј —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤. 90% —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –≤—Л–і–µ–ї—П–µ—В—Б—П –≤ –ґ–µ–ї—З—М.
–Я–Є—В–∞–≤–∞—Б—В–∞—В–Є–љ, –њ—А–Њ—Е–Њ–і—П—Й–Є–є III —Д–∞–Ј—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –Є –њ–Њ–Ї–∞ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ –†–Њ—Б—Б–Є–Є, –њ–µ—А–µ–љ–Њ—Б–Є—В—Б—П –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В—Л –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ OATP–C. –Т –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е –њ–Є—В–∞–≤–∞—Б—В–∞—В–Є–љ –≤ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ CYP3A4, CYP2C9 –Є –Ї–∞—А–±–Њ–Ї—Б–Є—Н—Б—В–µ—А–∞–Ј —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤.
–Э–∞–≥–ї—П–і–љ–Њ —А–∞–Ј–ї–Є—З–Є—П –≤ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–µ —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 4.
–Я–Њ–±–Њ—З–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –°—А–µ–і–Є –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б—В–∞—В–Є–љ–Њ–≤ —Б–ї–µ–і—Г–µ—В —Г–њ–Њ–Љ—П–љ—Г—В—М –њ–Њ–≤—Л—И–µ–љ–Є–µ –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, —А–µ–ґ–µ –≥–µ–њ–∞—В–Є—В, –Љ–Є–Њ–њ–∞—В–Є—О –Є –Љ–Є–Њ–Ј–Є—В, –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј. –Ґ–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ—Л—И—Ж—Л, –≤–µ—А–Њ—П—В–љ–Њ, —Б–≤—П–Ј–∞–љ–Њ —Б —Г—Б–Є–ї–µ–љ–Є–µ–Љ –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –±–µ–ї–Ї–∞ –Є –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –њ–Њ —Г—А–Њ–≤–љ—О –Ъ–§–Ъ. –°—В–∞—В–Є–љ—Л –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М –≥–Њ–ї–Њ–≤–љ—Г—О –±–Њ–ї—М, –±–Њ–ї—М –≤ –ґ–Є–≤–Њ—В–µ, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ, –Ј–∞–њ–Њ—А—Л, –і–Є–∞—А–µ—О, —В–Њ—И–љ–Њ—В—Г –Є —А–≤–Њ—В—Г. –Я–Њ—П–≤–ї–µ–љ–Є–µ —Б—Л–њ–Є –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є (–≤–Ї–ї—О—З–∞—П –∞–љ–≥–Є–Њ–љ–µ–≤—А–Њ—В–Є—З–µ—Б–Ї–Є–є –Њ—В–µ–Ї –Є –∞–љ–∞—Д–Є–ї–∞–Ї—Б–Є—О) –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ—З–∞—Б—В–Њ. –Т —Ж–µ–ї–Њ–Љ —В—П–ґ–µ–ї—Л–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –њ—А–Є –њ—А–Є–µ–Љ–µ —Б—В–∞—В–Є–љ–Њ–≤ –љ–∞–±–ї—О–і–∞—О—В—Б—П –љ–µ—З–∞—Б—В–Њ (1 —Б–ї—Г—З–∞–є —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞ –љ–∞ 100 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї –≤ –≥–Њ–і). –Ю–і–љ–∞–Ї–Њ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤, –љ–∞–±–ї—О–і–∞—О—Й–µ–µ—Б—П –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л, –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –љ–µ–±–Њ–ї—М—И–Њ–Љ—Г –њ—А–Њ—Ж–µ–љ—В—Г –Љ–Њ–ґ–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞—В—М –±–Њ–ї—М—И–Њ–µ —А–µ–∞–ї—М–љ–Њ–µ —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–Є –≤—Л–±–Њ—А–µ –≤–љ—Г—В—А–Є –≥—А—Г–њ–њ—Л –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –љ–∞–Є–±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –Є –Є–Ј—Г—З–µ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, –њ–Њ –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Ї–Њ–њ–ї–µ–љ –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –Њ–њ—Л—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ FDA, –Ј–∞ 2003–2004 –≥–≥. –љ–∞–Є–Љ–µ–љ—М—И–µ–µ —З–Є—Б–ї–Њ —Б–ї—Г—З–∞–µ–≤ —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї—М—И–µ–µ – –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ –Є —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞.
–Т–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ. –Ъ–∞–Ї —Г–ґ–µ —Г–Ї–∞–Ј—Л–≤–∞–ї–Њ—Б—М –≤—Л—И–µ, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј–≤–Є—В–Є–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–ґ–µ—В –≤–љ–Њ—Б–Є—В—М –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б –і—А—Г–≥–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є –љ–∞ —Г—А–Њ–≤–љ–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—В–∞—В–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є. –Ш–љ–≥–Є–±–Є—В–Њ—А—Л CYP3A4 –Ї–µ—В–Њ–Ї–Њ–љ–∞–Ј–Њ–ї, —Д–ї—Г–Ї–Њ–љ–∞–Ј–Њ–ї, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ, —Ж–Є–Љ–µ—В–Є–і–Є–љ, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Т–Ш–І––њ—А–Њ—В–µ–Є–љ–∞–Ј—Л –њ–Њ–≤—Л—И–∞—О—В —А–Є—Б–Ї –њ–Њ–±–Њ—З–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞, —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞, –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞, —Ж–µ—А–Є–≤–∞—Б—В–∞—В–Є–љ–∞ –њ—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є. –Ш–љ–≥–Є–±–Є—В–Њ—А—Л –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––† –≤–µ—А–∞–њ–∞–Љ–Є–ї, –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї, –Є—В—А–∞–Ї–Њ–љ–∞–Ј–Њ–ї, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ, —Б–µ—А—В—А–∞–ї–Є–љ, —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ, —Д–ї—Г–Њ–Ї—Б–µ—В–Є–љ, —Е–ї–Њ—А–њ—А–Њ–Љ–∞–Ј–Є–љ, —Е–Є–љ–Є–і–Є–љ, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ, —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ —Б–њ–Њ—Б–Њ–±–љ—Л –њ–Њ–≤—Л—И–∞—В—М —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞. –Ю—Б–Њ–±–µ–љ–љ–Њ –Њ–њ–∞—Б–љ–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Б—В–∞—В–Є–љ–Њ–≤ —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–Љ–Є CYP3A4 –Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ––†, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞. –Ґ–∞–Ї, –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–Њ–µ —Б—А–µ–і—Б—В–≤–Њ –Є—В—А–∞–Ї–Њ–љ–∞–Ј–Њ–ї (–Є–љ–≥–Є–±–Є—В–Њ—А CYP3A4 –Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––†) –њ–Њ–≤—Л—И–∞–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О b––≥–Є–і—А–Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ 10–20 —А–∞–Ј. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Д–µ–љ–Њ–Љ–µ–љ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Є –њ—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–∞ –Є —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ (–Є–љ–≥–Є–±–Є—В–Њ—А CYP3A4 –Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞––†) —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–µ—А–µ—Б–∞–ґ–µ–љ–љ–Њ–є –њ–Њ—З–Ї–Њ–є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є. –Ю–њ–Є—Б–∞–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞, –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –Є —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞, —В.–Ї. CYP3A4 –Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ––† –љ–µ –њ—А–Є–љ–Є–Љ–∞—О—В —Г—З–∞—Б—В–Є—П –≤ –Є—Е —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–µ. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞, —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –Є–ї–Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ —Б –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї–Њ–Љ, —П–≤–ї—П—О—Й–Є–Љ—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ OATP–C, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б—В–∞—В–Є–љ–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –Є —А–Є—Б–Ї –њ–Њ–±–Њ—З–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –≤–Њ–Ј—А–∞—Б—В–∞–µ—В [7].
–Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П. –Ъ –∞–±—Б–Њ–ї—О—В–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –∞–Ї—В–Є–≤–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є (–њ—А–Є —Б—В–Њ–є–Ї–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є–Є –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤), –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Є –Ї–Њ—А–Љ–ї–µ–љ–Є–µ –≥—А—Г–і—М—О. –Ю—Б–Њ–±–∞—П –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М —В—А–µ–±—Г–µ—В—Б—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б—В–∞—В–Є–љ–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –њ–µ—З–µ–љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є–ї–Є —З–∞—Б—В–Њ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –∞–ї–Ї–Њ–≥–Њ–ї—М. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј–Њ–Љ –њ–µ—А–µ–і –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ —Б—В–∞—В–Є–љ–Њ–≤ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –њ—А–Њ–≤–µ–і–µ–љ–Њ –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–µ –ї–µ—З–µ–љ–Є–µ. –Э–µ —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М —Б—В–∞—В–Є–љ—Л –њ—А–Є –њ–Њ—А—Д–Є—А–Є–Є, –Њ–і–љ–∞–Ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞.
–Ф–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞ —Б—В–∞—В–Є–љ–Њ–≤
–Я–µ—А–≤—Л–Љ –Ї—А—Г–њ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л–Љ –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞—В–Є–љ–Њ–≤, –±—Л–ї–Њ –Ч–∞–њ–∞–і–љ–Њ––®–Њ—В–ї–∞–љ–і—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ш–С–° – WOSCOPS. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 6595 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–µ–Љ –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ –і–Њ–Ј–µ 40 –Љ–≥ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ –•–° –љ–∞ 20%, –•–° –Ы–Я–Э–Я – –љ–∞ 26%, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–С–° –љ–∞ 31% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є–Љ–Є –њ–ї–∞—Ж–µ–±–Њ [8]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–Њ—Б–≤—П—Й–µ–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PROSPER, CARE, LIPID, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ —Б—Г–Љ–Љ–∞—А–љ–Њ –±–Њ–ї–µ–µ 25 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –°–Є–Љ–≤–∞—Б—В–∞—В–Є–љ –Є–Ј—Г—З–∞–ї—Б—П –≤ —Б–Ї–∞–љ–і–Є–љ–∞–≤—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 4S —Г 4444 –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї–Њ–≤–Є–љ–∞ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ, –і—А—Г–≥–∞—П –њ–Њ–ї–Њ–≤–Є–љ–∞ – –њ–ї–∞—Ж–µ–±–Њ, –Њ—В–Љ–µ—З–µ–љ–∞ –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 42% –Є –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 30% [9]. –Т –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ Heart Protection Study, A to Z –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ –µ—Й–µ 25 —В—Л—Б. –±–Њ–ї—М–љ—Л—Е. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ —В–∞–Ї–ґ–µ –Є–Ј—Г—З–∞–ї–Њ—Б—М –љ–∞ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Њ—И–µ–і—И–Є—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ASCOT, CARDS, PROVE IT, TNT. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л–µ –ї–Њ–≤–∞—Б—В–∞—В–Є–љ—Г –Є —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ—Г, –≤–Њ—И–ї–Є –Љ–µ–љ–µ–µ 10 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї, —В–Њ–≥–і–∞ –Ї–∞–Ї –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –њ–Є—В–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –µ—Й–µ –љ–µ –Ј–∞–Ї–Њ–љ—З–µ–љ—Л.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Ј—Г—З–∞–ї–Њ—Б—М –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –Њ—В–і–µ–ї—М–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ (–Ю–Ъ–°), –Ї–∞–Ї —Б –њ–Њ–і—К–µ–Љ–Њ–Љ —Б–µ–≥–Љ–µ–љ—В–∞ ST, —В–∞–Ї –Є –±–µ–Ј –љ–µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –Њ–њ—А–∞–≤–і–∞–љ–Њ –і–ї—П –±–Њ–ї–µ–µ —Г—Б–њ–µ—И–љ–Њ–є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –љ–Њ –і–Њ–ї–ґ–љ–Њ –љ–∞—З–Є–љ–∞—В—М—Б—П –њ–Њ—Б–ї–µ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ (–њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 7––є –і–µ–љ—М). –Я—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –Ј–і–µ—Б—М –Љ–Њ–ґ–µ—В —Б—З–Є—В–∞—В—М—Б—П –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ, —В–∞–Ї –Ї–∞–Ї –Є–Љ–µ–љ–љ–Њ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є –Ю–Ъ–° –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є PROVE–IT. –Я—А–Є —Н—В–Њ–Љ —Б—В–∞—В–Є–љ—Л –љ–µ –Љ–Њ–≥—Г—В —Б—З–Є—В–∞—В—М—Б—П –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П —А–∞–Ј–≤–Є–≤—И–µ–≥–Њ—Б—П –Ю–Ъ–°. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CARDS –њ–Њ–Ї–∞–Ј–∞–ї–Њ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –њ—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ. –Я—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б—В–∞—В–Є–љ–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э –Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц), –Њ–ґ–Є–і–∞–µ—В—Б—П, —З—В–Њ –±–Њ–ї–µ–µ —В–Њ—З–љ—Л–є –Њ—В–≤–µ—В –±—Г–і–µ—В –њ–Њ–ї—Г—З–µ–љ –њ–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є CORONA –Є GISSI–HF. –†—П–і —Б–Њ–Њ–±—Й–µ–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –њ–Њ–ї—М–Ј—Г –Њ—В —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –§–Т –Ы–Ц (—В. –љ–∞–Ј. –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Ы–Ц).
–≠–Ј–µ—В–Є–Љ–Є–±
–≠–Ј–µ—В–Є–Љ–Є–± – —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–Њ–≤—Л–є –њ—А–µ–њ–∞—А–∞—В, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–є –≤ —В–µ—А–∞–њ–Є–Є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б–Њ —Б—В–∞—В–Є–љ–Њ–Љ [10].
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П —Б–≤—П–Ј–∞–љ —Б –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ NPC1L1 –≤ —Н–љ—В–µ—А–Њ—Ж–Є—В–∞—Е, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ —Г–≥–љ–µ—В–∞–µ—В—Б—П –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ. –≠–Ј–µ—В–Є–Љ–Є–± –і–Њ–±–∞–≤–ї—П—О—В –Ї –ї–µ—З–µ–љ–Є—О –і–Є–µ—В–Њ–є –Є —Б—В–∞—В–Є–љ–Њ–Љ –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л —Б—В–∞—В–Є–љ—Л, –∞ —В–∞–Ї–ґ–µ –њ—А–Є —Б–µ–Љ–µ–є–љ–Њ–є —Б–Є—В–Њ—Б—В–µ—А–Њ–ї–µ–Љ–Є–Є. –°—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–Њ–є –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П 10 –Љ–≥ –Њ–і–Є–љ —А–∞–Ј –≤ —Б—Г—В–Ї–Є.
–°—А–µ–і–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–≥—Г—В –Њ—В–Љ–µ—З–∞—В—М—Б—П –і–Є—Б–њ–µ–њ—Б–Є—П, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, —Б–ї–∞–±–Њ—Б—В—М, –Љ–Є–∞–ї–≥–Є—П, —А–µ–ґ–µ –Њ–њ–Є—Б–∞–љ—Л —А–µ–∞–Ї—Ж–Є–Є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –≥–µ–њ–∞—В–Є—В. –Ъ—А–∞–є–љ–µ —А–µ–і–Ї–Њ –Љ–Њ–≥—Г—В –≤—Б—В—А–µ—З–∞—В—М—Б—П –њ–∞–љ–Ї—А–µ–∞—В–Є—В, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –Љ–Є–Њ–њ–∞—В–Є—П –Є —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј.
–Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П. –≠–Ј–µ—В–Є–Љ–Є–± –љ–µ –љ–∞–Ј–љ–∞—З–∞—О—В –њ—А–Є –Ї–Њ—А–Љ–ї–µ–љ–Є–Є –≥—А—Г–і—М—О –Є –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 10 –ї–µ—В, –Њ—Б–Њ–±—Г—О –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М —Б–ї–µ–і—Г–µ—В —Б–Њ–±–ї—О–і–∞—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ –Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –±–Њ–ї–µ–Ј–љ—П–Љ–Є –њ–µ—З–µ–љ–Є.
–§–Є–±—А–∞—В—Л – –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ —Д–Є–±—А–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л
–§–Є–±—А–∞—В—Л —П–≤–ї—П—О—В—Б—П –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–Љ–Є —Д–Є–±—А–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ю–љ–Є —Г—Б—В—Г–њ–∞—О—В —Б—В–∞—В–Є–љ–∞–Љ –њ–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б–љ–Є–ґ–∞—В—М –Њ–±—Й–Є–є –•–° –Є –•–° –Ы–Э–Я, –∞ —В–∞–Ї–ґ–µ –њ–Њ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –±–∞–Ј–µ. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ —Д–Є–±—А–∞—В–Њ–≤ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –Є—Е –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤. –Я–µ—А–≤—Л–Љ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–Љ –±—Л–ї –Ї–ї–Њ—Д–Є–±—А–∞—В, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П–≤—И–Є–є—Б—П –≤ 60–70––µ –≥–≥. XX –≤–µ–Ї–∞, –љ–Њ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –≤—Л—В–µ—Б–љ–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—В–Њ—А–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П: –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї–Њ–Љ, –±–µ–Ј–∞—Д–Є–±—А–∞—В–Њ–Љ, —Ж–Є–њ—А–Њ—Д–Є–±—А–∞—В–Њ–Љ, —Д–µ–љ–Њ—Д–Є–±—А–∞—В–Њ–Љ.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П —Б–≤—П–Ј—Л–≤–∞—О—В —Б –∞–Ї—В–Є–≤–Є—А—Г—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –Њ—Б–Њ–±—Л–є –њ–Њ–і–Ї–ї–∞—Б—Б —П–і–µ—А–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ – –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Њ—А–Њ–≤ –њ–Є—А–Њ–Ї—Б–Є—Б–Њ–Љ (–†–†–РRs), –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ—Л–Љ–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —П–і—А–µ –Ї–ї–µ—В–Ї–Є, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ы–Я, —Б–Є–љ—В–µ–Ј –∞–њ–Њ–±–µ–ї–Ї–Њ–≤, –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В.
–§–Є–±—А–∞—В—Л –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –њ—А–Є –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є (—В–Є–њ IV), –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є (—В–Є–њ—Л IIb –Є III).
–§–Є–±—А–∞—В—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б—П—В—Б—П. –°—А–µ–і–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Д–Є–±—А–∞—В–Њ–≤ –Њ—В–Љ–µ—З–∞—О—В—Б—П —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –Ї–Њ–ґ–љ—Л–µ –≤—Л—Б—Л–њ–∞–љ–Є—П, –Є–љ–Њ–≥–і–∞ –Љ–µ—А—Ж–∞–љ–Є–µ –њ—А–µ–і—Б–µ—А–і–Є–є, —А–µ–і–Ї–Њ —Г–≥–љ–µ—В–µ–љ–Є–µ –Ї—А–Њ–≤–µ—В–≤–Њ—А–µ–љ–Є—П, –Љ–Є–Њ–Ј–Є—В, –љ–∞—А—Г—И–µ–љ–Є—П –Ј—А–µ–љ–Є—П. –§–Є–±—А–∞—В—Л –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–Љ–µ, –±–Њ–ї–µ–Ј–љ—П—Е –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, —В—П–ґ–µ–ї—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–µ–Ї, –∞ —В–∞–Ї–ґ–µ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є –Ї–Њ—А–Љ—П—Й–Є—Е.
–Я—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б –љ–µ–њ—А—П–Љ—Л–Љ–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є —Д–Є–±—А–∞—В—Л —Б–њ–Њ—Б–Њ–±–љ—Л –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –Є—Е —Н—Д—Д–µ–Ї—В, –њ–Њ—Н—В–Њ–Љ—Г –≤ —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –љ–µ–њ—А—П–Љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ (–≤–∞—А—Д–∞—А–Є–љ–∞) –≤ –і–≤–∞ —А–∞–Ј–∞. –Ъ–∞–Ї —Г–ґ–µ —Г–Ї–∞–Ј—Л–≤–∞–ї–Њ—Б—М, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Д–Є–±—А–∞—В–Њ–≤ —Б–Њ —Б—В–∞—В–Є–љ–∞–Љ–Є —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–њ–∞—Б–љ–Њ–є –Є–Ј––Ј–∞ –њ–Њ–≤—Л—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –Љ–Є–Њ–њ–∞—В–Є–Є –Є —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е HHS –Є VaHIT –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї–∞ –њ–Њ–≤—Л—И–∞—В—М —Г—А–Њ–≤–µ–љ—М –•–° –Ы–Т–Я, —Б–љ–Є–ґ–∞—В—М —А–Є—Б–Ї –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ–і–љ–∞–Ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–∞—П —А–∞–Ј–љ–Є—Ж–∞ –Љ–µ–ґ–і—Г —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є DAIS –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є —Г –±–Њ–ї—М–љ—Л—Е –°–Ф 2 —В–Є–њ–∞ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Д–µ–љ–Њ—Д–Є–±—А–∞—В–Њ–Љ. –Ф–Њ —Б–Є—Е –њ–Њ—А –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤–Њ—Б—В—М –і–∞–љ–љ—Л—Е –Њ –≤–ї–Є—П–љ–Є–Є —Д–Є–±—А–∞—В–Њ–≤ –љ–∞ –Њ—В–і–∞–ї–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј —Б–і–µ—А–ґ–Є–≤–∞–µ—В –Є—Е —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–С–°. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–≤, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є—Е —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е —Б –Ш–С–° –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Д–Є–±—А–∞—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–µ–љ–Њ.
–Я—А–µ–њ–∞—А–∞—В—Л –Њ–Љ–µ–≥–∞–3––ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В
–Я—А–µ–њ–∞—А–∞—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ —Н—В–Є–ї–Њ–≤—Л–µ —Н—Д–Є—А—Л –Њ–Љ–µ–≥–∞–3––ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л —Д–Є–±—А–∞—В–∞–Љ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б–Њ —Б—В–∞—В–Є–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –љ–µ —Г–і–∞–µ—В—Б—П –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —Б—В–∞—В–Є–љ–Њ–Љ.
–≠—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М –љ–∞—А—Г—И–µ–љ–Є—П –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, —А–µ–ґ–µ – —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –≤–Ї—Г—Б–∞, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —А–µ–∞–Ї—Ж–Є–Є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –≤ —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П, –Ї–Њ–ґ–љ—Л–µ –≤—Л—Б—Л–њ–∞–љ–Є—П, –≤ –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е – –≥–Є–њ–Њ—В–µ–љ–Ј–Є—П, –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј. –Ю–љ–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л –њ—А–Є –Ї–Њ—А–Љ–ї–µ–љ–Є–Є –≥—А—Г–і—М—О, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ–Є –і–Є–∞—В–µ–Ј–∞–Љ–Є, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –њ–µ—З–µ–љ–Є, –∞ —В–∞–Ї–ґ–µ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л, —В—А–µ–±—Г–µ—В –Њ—Б–Њ–±–Њ–є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В–Є.
–Т –њ—А–Њ—И–ї–Њ–Љ —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї–Є –∞–љ–Є–Њ–љ–Њ–Њ–±–Љ–µ–љ–љ—Л–µ —Б–Љ–Њ–ї—Л –Є –њ—А–µ–њ–∞—А–∞—В—Л –љ–Є–Ї–Њ—В–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є—Е –Ј–љ–∞—З–µ–љ–Є–µ –≤ —В–µ—А–∞–њ–Є–Є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–є —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П –њ–Њ—П–≤–ї–µ–љ–Є—О –љ–Њ–≤—Л—Е –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ –Њ—В–і–µ–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, –љ–Њ –Є –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е, –љ–∞ —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Ш–С–° –Є –µ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Т—Л–±–Њ—А –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ
–њ—А–µ–њ–∞—А–∞—В–∞ –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є
–С–Њ–ї—М—И–µ–є —З–∞—Б—В–Є –±–Њ–ї—М–љ—Л—Е –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞—А—В–Њ–≤–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –љ–∞–Ј–љ–∞—З–∞—О—В –і–Є–µ—В—Г —Б–Њ —Б–љ–Є–ґ–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –ґ–Є—А–∞, –і–∞—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є: –Ї–Њ—А—А–µ–Ї—Ж–Є—П –≤–µ—Б–∞, –Њ—В–Ї–∞–Ј –Њ—В –Ї—Г—А–µ–љ–Є—П, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –І–µ—А–µ–Ј 3 –Љ–µ—Б—П—Ж–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–µ—И–∞—О—В –≤–Њ–њ—А–Њ—Б –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т —Б–ї—Г—З–∞–µ –µ—Б–ї–Є —Ж–µ–ї–µ–≤—Л–µ —Г—А–Њ–≤–љ–Є –Њ–±—Й–µ–≥–Њ –•–° –Є –•–° –Ы–Э–Я –љ–µ –і–Њ—Б—В–Є–≥–љ—Г—В—Л, –љ–∞–Ј–љ–∞—З–∞—О—В –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–∞–Ј–љ–∞—З–µ–љ–∞ —Б—А–∞–Ј—Г, –±–µ–Ј –њ–µ—А–Є–Њ–і–∞ –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Г –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е, –∞ –Є–Љ–µ–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–Љ–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П–Љ–Є –•–° –Ы–Э–Я. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–ї—П –ї–µ—З–µ–љ–Є—П –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ —П–≤–ї—П—О—В—Б—П —Б—В–∞—В–Є–љ—Л. –Ы–µ—З–µ–љ–Є–µ –Љ–Њ–ґ–љ–Њ –љ–∞—З–Є–љ–∞—В—М —Б –і–Њ–Ј—Л 10 –Є–ї–Є 20 –Љ–≥ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –≤–µ—З–µ—А–Њ–Љ. –Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –і–Њ–Ј–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г–≤–µ–ї–Є—З–µ–љ–∞ –і–Њ 40 –Љ–≥, –∞ –і–ї—П –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –Є —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ – –і–Њ 80 –Љ–≥. –Т —Б–ї—Г—З–∞–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О —Б —Н–Ј–µ—В–Є–Љ–Є–±–Њ–Љ –њ–Њ 10 –Љ–≥ –≤ —Б—Г—В–Ї–Є. –Ъ–∞–Ї –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Г —Н–Ј–µ—В–Є–Љ–Є–±—Г –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –∞–љ–Є–Њ–љ–љ–Њ––Њ–±–Љ–µ–љ–љ—Л–µ —Б–Љ–Њ–ї—Л: –Ї–Њ–ї–µ—Б—В–Є–њ–Њ–ї –Є–ї–Є —Е–Њ–ї–µ—Б—В–Є—А–∞–Љ–Є–љ.
–Я—А–Є –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є, –љ–µ –њ–Њ–і–і–∞—О—Й–µ–є—Б—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–Є–µ—В–Њ–є, –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П —Д–Є–±—А–∞—В—Л. –Т —Б–ї—Г—З–∞—П—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є, –Ї–Њ–≥–і–∞ –њ–Њ–≤—Л—И–µ–љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤, –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –љ–∞—З–Є–љ–∞—О—В —В–∞–Ї–ґ–µ —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤. –Х—Б–ї–Є –љ–∞ —Н—В–Њ–Љ —Д–Њ–љ–µ —Г—А–Њ–≤–µ–љ—М —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Њ—Б—В–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ, –Ї –ї–µ—З–µ–љ–Є—О –і–Њ–±–∞–≤–ї—П—О—В —Д–Є–±—А–∞—В—Л, –∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е – –љ–Є–Ї–Њ—В–Є–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г. –Ю–і–љ–∞–Ї–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б—В–∞—В–Є–љ–∞ —Б —Д–Є–±—А–∞—В–Њ–Љ –Є–ї–Є –љ–Є–Ї–Њ—В–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –≤–Ї–ї—О—З–∞—П —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј, –Є –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞ –Є –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є –Є –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –≥–µ–Љ—Д–Є–±—А–Њ–Ј–Є–ї–∞ —Б–Њ —Б—В–∞—В–Є–љ–Њ–Љ –љ–µ –і–Њ–ї–ґ–љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤–Њ–≤—Б–µ –Є–Ј––Ј–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —А–Є—Б–Ї–∞ —А–∞–±–і–Њ–Љ–Є–Њ–ї–Є–Ј–∞. –Т –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л —Д–Є–±—А–∞—В–∞–Љ –Є –љ–Є–Ї–Њ—В–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –≤ —В–µ—А–∞–њ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В—Л –Њ–Љ–µ–≥–∞–3––ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б—В–∞—А—И–µ 40 –ї–µ—В —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ (–Ї–∞–Ї 1––≥–Њ, —В–∞–Ї –Є 2––≥–Њ —В–Є–њ–∞) —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М —Б—В–∞—В–Є–љ—Л –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–¶–µ–ї–µ–≤—Л–µ —Г—А–Њ–≤–љ–Є –•–° –Є —Г—А–Њ–≤–љ–Є
–і–ї—П –љ–∞—З–∞–ї–∞ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–°–Њ–≥–ї–∞—Б–љ–Њ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –њ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—О —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є III –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ (2003 –≥.), –њ—А–Є–љ—П—В—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –ї–Є–њ–Є–і–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –њ–ї–∞–Ј–Љ—Л –і–ї—П –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Ж–µ–ї–Њ–Љ:
J –Ю–±—Й–Є–є –•–° – –Љ–µ–љ–µ–µ 5 –Љ–Љ–Њ–ї—М/–ї;
J –•–° –Ы–Э–Я – –Љ–µ–љ–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї;
J –•–° –Ы–Т–Я – –±–Њ–ї–µ–µ 1 –Љ–Љ–Њ–ї—М/–ї —Г –Љ—Г–ґ—З–Є–љ –Є –±–Њ–ї–µ–µ 1,2 –Љ–Љ–Њ–ї—М/–ї —Г –ґ–µ–љ—Й–Є–љ;
J –Ґ–У – –Љ–µ–љ–µ–µ 1,77 –Љ–Љ–Њ–ї—М/–ї.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г –±–Њ–ї—М–љ—Л—Е –Ш–С–° –Є–ї–Є –µ–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ –µ–µ —А–∞–Ј–≤–Є—В–Є—П —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –•–° –Ы–Э–Я –Љ–Њ–ґ–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞—В—М—Б—П –Њ—В —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ. –£ –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –Ш–С–° –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —А–Є—Б–Ї–∞ –µ–µ —А–∞–Ј–≤–Є—В–Є—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є: –≤–Њ–Ј—А–∞—Б—В (–і–ї—П –Љ—Г–ґ—З–Є–љ –±–Њ–ї–µ–µ 45 –ї–µ—В, –і–ї—П –ґ–µ–љ—Й–Є–љ –±–Њ–ї–µ–µ 55 –ї–µ—В –Є–ї–Є —А–∞–љ–љ—П—П –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞ –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є), —Б–µ–Љ–µ–є–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј (–±–ї–Є–ґ–∞–є—И–Є–µ —А–Њ–і—Б—В–≤–µ–љ–љ–Є–Ї–Є –±–Њ–ї—М–љ—Л—Е —Б —А–∞–љ–љ–Є–Љ –љ–∞—З–∞–ї–Њ–Љ –Ш–С–°: —Г –Љ—Г–ґ—З–Є–љ –Љ–Њ–ї–Њ–ґ–µ 55 –ї–µ—В, —Г –ґ–µ–љ—Й–Є–љ – 65 –ї–µ—В), –Ї—Г—А–µ–љ–Є–µ, –Р–Ф –≤—Л—И–µ 140 –Є 90 –Љ–Љ. —А—В. —Б—В., –љ–Є–Ј–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –•–° –Ы–Т–Я, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В. –Ф–ї—П —А–∞—Б—З–µ—В–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–С–° –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л —В–∞–±–ї–Є—Ж—Л SCORE. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–µ–Ј –Ш–С–°, –Є–Љ–µ—О—Й–Є—Е –љ–µ –±–Њ–ї–µ–µ 1 —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞, –Њ—А–Є–µ–љ—В–Є—А—Г—О—В—Б—П –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–µ –і–ї—П –њ–Њ–њ—Г–ї—П—Ж–Є–Є: —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –•–° –Ы–Э–Я –Љ–µ–љ–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї. –Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Г—О —В–µ—А–∞–њ–Є—О —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –њ—А–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –•–° –Ы–Э–Я –±–Њ–ї–µ–µ 4 –Љ–Љ–Њ–ї—М/–ї. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е 2 –Є –±–Њ–ї–µ–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, —В–∞–Ї–ґ–µ —Б–ї–µ–і—Г–µ—В —Б—В—А–µ–Љ–Є—В—М—Б—П –Ї —Ж–µ–ї–µ–≤–Њ–Љ—Г –Ј–љ–∞—З–µ–љ–Є—О –•–° –Ы–Э–Я –Љ–µ–љ–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї, –Њ–і–љ–∞–Ї–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ —Г–ґ–µ –њ—А–Є –•–° –Ы–Э–Я 3,5 –Љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ. –Ф–ї—П –±–Њ–ї—М–љ—Л—Е –Ш–С–° –Є–ї–Є –µ–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–∞–Љ–Є —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –•–° –Ы–Э–Я –і–Њ–ї–ґ–µ–љ —Б–Њ—Б—В–∞–≤–ї—П—В—М –Љ–µ–љ–µ–µ 2,5 –Љ–Љ–Њ–ї—М/–ї, –∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Љ–µ–љ–µ–µ 2 –Љ–Љ–Њ–ї—М/–ї, —В–Њ–≥–і–∞ –Ї–∞–Ї –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –±–Њ–ї–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї —Г —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–ї—Г–ґ–Є—В –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞—З–∞–ї–∞ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є. –Ъ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–∞–Љ –Ш–С–° –Њ—В–љ–Њ—Б—П—В –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –∞—А—В–µ—А–Є–є, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –∞—А—В–µ—А–Є–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –∞–љ–µ–≤—А–Є–Ј–Љ—Г –±—А—О—И–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–†–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–∞–ї—М–љ–Њ –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–С–° –Є –µ–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–∞–Љ–Є, —Б–љ–Є–Ј–Є—В—М —Б—Г–Љ–Љ–∞—А–љ—Л–є —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Г–ї—Г—З—И–Є—В—М –њ—А–Њ–≥–љ–Њ–Ј. –Т—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –Є–ї–Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–Њ–ї–ґ–µ–љ –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М—Б—П –љ–∞ —В–Є–њ–µ –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є, —Б—В–µ–њ–µ–љ–Є –њ–Њ–≤—Л—И–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, —Б—В–µ–њ–µ–љ–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ –Є –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —Б —Г—З–µ—В–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –±–Њ–ї—М–љ–Њ–≥–Њ, –≤ —В.—З. –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є. –§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є, —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–Њ, –∞ –њ—А–Є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–Є –ї–µ—З–µ–љ–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –≤–Њ–Ј–≤—А–∞—Й–∞—О—В—Б—П –Ї –Є—Б—Е–Њ–і–љ—Л–Љ.
–°–Њ–Ї—А–∞—Й–µ–љ–Є—П:
–У–Ы–Я – –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П
–Ґ–У – —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л
–•–° – —Е–Њ–ї–µ—Б—В–µ—А–Є–љ
–•–Ь – —Е–Є–ї–Њ–Љ–Є–Ї—А–Њ–љ—Л
–Ы–Я – –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і—Л
–У–Ь–У – –Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј–∞ – 3––≥–Є–і—А–Њ–Ї—Б–Є–3––Љ–µ—В–Є–ї–≥–ї—Г—В–∞—А–Є–ї––Ї–Њ—Д–µ—А–Љ–µ–љ—В –Р–—А–µ–і—Г–Ї—В–∞–Ј–∞

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. European guidelines on cardiovascular disease prevention in clinical practice. Third Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of eight societies and invited experts). Eur Heart J 2003; 24: 1601.10.
2. –Р—А–Њ–љ–Њ–≤ –Ф.–Ь. –Ы–µ—З–µ–љ–Є–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Ь., 2000, 411 —Б—В—А.
3. –Ъ—Г–Ї–µ—Б –Т.–У. –Ь–µ—В–∞–±–Њ–ї–Є–Ј–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤: –Ї–ї–Є–љ–Є–Ї–Њ–—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л. –Ь.: –†–µ–∞—Д–∞—А–Љ, 2004.
4. Garcia MJ, Reinoso RF, Sanchez Navarro A, Prous JR. Clinical pharmacokinetics of statins. Methods Find Exp Clin Pharmacol. 2003 Jul–Aug;25(6):457–81.
5. Lennernas H. Clinical pharmacokinetics of atorvastatin. Clin Pharmacokinet. 2003;42(13):1141–60.
6. Martin G, Duez H, Blanquart C, Berezowski V, Poulain P, Fruchart JC, Najib–Fruchart J, Glineur C, Staels B. Statin–induced inhibition of the Rho–signaling pathway activates PPARalpha and induces HDL apoA–I. J Clin Invest. 2001 Jun;107(11):1423–32.
7. –Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –њ–Њ–і —А–µ–і. –Я–∞–ї—М—Ж–µ–≤–∞ –Ь.–Р., –Ъ—Г–Ї–µ—Б–∞ –Т.–У., –§–Є—Б–µ–љ–Ї–Њ –Т.–Я. –Ь., 2004. 224 —Б.
8. West of Scotland Coronary Prevention Study: implications for clinical practice. The WOSCOPS Study Group. Eur Heart J. 1996 Feb;17(2):163–4.
9. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S) Lancet. 1994 Nov 19;344(8934):1383–9.
10. Pearson TA, Denke MA, McBride PE, Battisti WP, Brady WE, Palmisano J. A community–based, randomized trial of ezetimibe added to statin therapy to attain NCEP ATP III goals for LDL cholesterol in hypercholesterolemic patients: the ezetimibe add–on to statin for effectiveness (EASE) trial. Mayo Clin Proc. 2005 May;80(5):587–95.












