В патогенезе ишемических болезней органов и систем человеческого организма (ишемической болезни сердца (острый коронарный синдром (ОКС), инфаркт миокарда (ИМ)); ишемического мозгового инсульта; гангрены конечностей и других регионов артериального русла) ключевым звеном являются воспалительные и атеросклеротические повреждения эндотелия сосудов, которые сопровождаются нарушением целостности интимы, замедлением кровотока, дисбалансом свертывающей и противосвертывающей системы крови, нарушением ее реологических параметров. При повреждении эндотелия сосудов различной этиологии происходит активация агрегации тромбоцитов и эритроцитов с формированием тромба и, вследствие этого, критическое сужение просвета сосудов или его полное закрытие (частичная или полная окклюзия) [1,5,6,9,10,14].
Современное лечение и профилактика сердечно–сосудистых осложнений (ССО), в частности ОКС, ИМ, невозможны без четкого представления механизмов тромбообразования, материальным субстратом которого являются тромбоциты, эритроциты, фибрин [2,4,10].
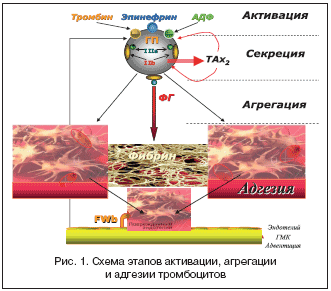
В процессе тромбообразования тромбоцит проходит четыре стадии: 1–ю – стадию активации, 2–ю – стадию секреции активных биологических веществ (АДФ, тромбоксаны, лабилизация гликопротеидных рецепторов – GPIIIaIIb), 3–ю – стадию агрегации, 4–ю – стадию адгезии (рис. 1). Эти процессы (макро– и микротромбообразование) особенно бурно проявляются при дестабилизации коронарного кровотока – ОКС и ИМ. В основе макро– и микротромбообразования лежат механизмы, стимулирующие агрегационную активность тромбоцитов и эритроцитов, Ускоренный, турбулентный ток крови в суженном атеросклеротической бляшкой участке сосуда способствует повреждению эндотелия с развитием эндотелиальной дисфункции, обнажению коллагена – одного из главных факторов, активизирующих агрегацию и адгезию тромбоцитов. Тромбоциты вступают в контакт с субэндотелиальным слоем, в частности, с главным стимулятором адгезии – коллагеном, образуют отростки с формированием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, образуя белый тромб (рис. 1).
Активация тромбоцитов осуществляется катехоламинами, АДФ, тромбином, серотонином, коллагеном, тромбаксаном 2 (ТАх2) – продуктом метаболизма арахидоновой кислоты.
В результате активации тромбоцитов происходят высвобождение (секреция) из последних биологически активных веществ (АДФ, ТАх2, серотонина) и под действием АДФ и ТАх2 лабилизация гликопротеидных комплексов–рецепторов GPIIIaIIb.
Агрегация тромбоцитов – формирование тромбоцитарных конгломератов в плазме крови, происходящее при активации и взаимодействии GPIIIaIIb путем образования из фибриногена фибриновых мостиков между тромбоцитами.
Адгезия – прилипание тромбоцитарных конгломератов к поврежденной интиме сосудов при непосредственном участии фактора Виллибранда (FWb) (рис. 1).
Таким образом, агрессивная активация тромбоцитов – ключевой момент патогенеза сердечно–сосудистых осложнений, во многом определяющий выраженность нарушений кровоснабжения органов и тканей (сердце, головной мозг, периферические сосуды), поэтому терапия и профилактика ССО антиагрегационными препаратами являются патогенетически обоснованными.
В настоящее время для клинического применения выделяют три группы антитромбоцитарных препаратов, в основе разделения которых лежат принципы доказательной медицины, использующие понятие эффективности и наличие побочных эффектов. Первая группа вышеуказанных препаратов, составляющая основу современной антитромбоцитарной терапии, – ингибиторы циклооксигеназы 1 (ацетилсалициловая кислота (АСК)). Вторая группа – тиенопиридины (тиклопидин – тиклин, клопидогрел – Агрегаль) и третья группа – блокаторы GPIIIaIIb рецепторов для внутривенного применения (абциксимаб, эптифибатид, тирофибан, фрамон) [3,4,12].
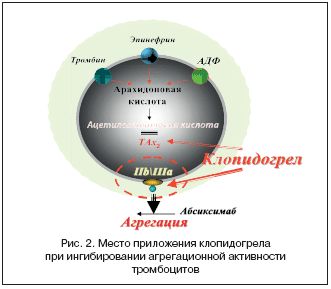
АСК и другие нестероидные противовоспалительные препараты (НПВП) (индометацин) действуют на уровне метаболизма арахидоновой кислоты – блокируют циклооксигеназу 1 (ЦОГ–1) тромбоцитов, которая участвует в синтезе ТАх2, необратимо подавляя агрегацию тромбоцитов, индуцированную АДФ, коллагеном и тромбином. В то же время АСК в больших дозах (от 300 до 500 мг) одновременно блокирует синтез простациклинов, что может опосредованно поддерживать агрегационное состояние тромбоцитов в результате количественного уменьшения простациклинов и их дезагрегационного эффекта. Имеются указания на то, что некоторые ингибиторы ЦОГ–1 повышают риск развития коронарных осложнений у больных с различным сердечно–сосудистым риском (SCORE), способствуя развитию сердечной недостаточности и АГ [1,4,5,12].
Тиенопиридины – оральные лекарственные дезагреганты, подавляющие АДФ–индуцированную агрегацию тромбоцитов, необратимо связываясь с GP2Y12 рецепторами мембраны тромбоцитов. Экспериментальные исследования механизмов действия тиенопиридинов показали, что препараты высокоэффективны только in vivo. В отличие от АСК, которая ингибирует только вторую фазу агрегации тромбоцитов, индуцированную АДФ, тиенопиридины ингибируют обе фазы – агрегацию и адгезию. Тиенопиридины также тормозят активацию тромбоцитов, вызванную коллагеном, адреналином, тромбином и серотонином. При этом (в отличие от АСК) они не затрагивают метаболизм арахидоновой кислоты и, таким образом, не влияют на синтез простациклина (эндогенный, внутрисосудистый дезагрегант) эндотелием сосудов [2,3,11].
Кроме вышеперечисленного, тиенопиридины повышают пластичность (деформируемость) эритроцитов, способствуя улучшению реологических параметров крови и микроциркуляции. В настоящее время накоплен значительный клинический опыт применения тиенопиридинов при различных сердечно–сосудистых патологиях, таких как ОКС, инсульт головного мозга, облитерирующий атеросклероз сосудов нижних конечностей и диабетические ангиопатии [3,4,7,13].
По данным исследования TASS (Ticlopidine Aspirine Stroke Stady), которое было выполнено с целью сравнения профилактической активности тиклопидина (500 мг/сут.) и АСК (1300 мг/сут.) у больных с ИБС, эффективность тиклопидина была значительно выше при меньшем количестве побочных эффектов: риск развития инсультов и ИМ в группе тиклопидина был на 24% меньше в первый год наблюдения по сравнению с группой пациентов, принимавших только АСК в указанной дозе. Однако тиклопидин – эффективное лекарственное средство, имеющее ряд нежелательных побочных эффектов: при его применении возможно развитие гиперхолестеринемии, нейтропении, тромбоцитопении, анемии и тромботической тромбоцитопенической пурпуры [3,5–7].
В 2002 г. были представлены результаты мета–анализа сравнительных исследований, в которых был документирован профиль безопасности клопидогрела, оказавшийся в 2 раза лучше, чем у тиклопидина. Это позволило практически полностью заменить тиклопидин на клопидогрел в большинстве клинических ситуаций и в рекомендациях по лечению ССЗ [3,8].
Клопидогрел препятствует агрегации тромбоцитов за счет селективной блокады связывания АДФ с его рецептором на тромбоцитах и активации комплекса GPIIb/IIIа. При наличии атеросклеротического поражения сосуда клопидогрел препятствует развитию атеротромбоза независимо от локализации сосудистого процесса (цереброваскулярные, кардиоваскулярные или периферические поражения) (рис. 2).
Изменения АДФ–рецепторов тромбоцитов, вызванные клопидогрелом, необратимы: тромбоциты остаются нефункциональными на протяжении всего периода жизни, антиагрегантный эффект сохраняется все это время. Восстановление нормальной функции происходит по мере обновления тромбоцитов (приблизительно через 7–10 дней), а восстановление нормального коагуляционного потенциала крови – по мере появления новых тромбоцитов [2,11–14].
После приема внутрь в дозе 75 мг клопидогрел быстро абсорбируется из ЖКТ и биотрансформируется в печени под действием изоферментов цитохромной системы Р450 (в частности, под действием ферментов CYP3A4, CYP3A5) до двух основных метаболитов: неактивного (SR26334) и активного (рис. 3). Последний быстро связывается с тромбоцитами, и поэтому концентрации активного метаболита и клопидогрела в плазме крови практически не определяются. Неактивный карбоксильный метаболит клопидогрела обратимо связывается с белками крови, составляет около 85% циркулирующего в плазме соединения, и его концентрация находится в линейной зависимости от дозы препарата: через 2 ч после приема начальной дозы 75 мг не достигает предела измерения (0,025 мкг/л), после повторных приемов той же дозы составляет около 3 мг/л и наблюдается приблизительно через 1 ч после приема. Клопидогрел и основной метаболит необратимо связываются с белками плазмы крови in vitro (98% и 94% соответственно). После приема внутрь 14С–меченого клопидогрела около 50% принятой дозы выделяется с мочой и приблизительно 46% с калом в течение 12 ч после приема (T1/2 основного метаболита составляет 8 ч) [2–4,11].
Концентрация основного метаболита в плазме значительно выше у пожилых (старше 75 лет) по сравнению со здоровыми добровольцами молодого возраста. Однако более высокие концентрации в плазме не сопровождались изменением агрегации тромбоцитов и времени кровотечения. Концентрация основного метаболита в плазме крови при приеме 75 мг/сут. оказалась более низкой у пациентов с тяжелыми заболеваниями почек (КК 5–15 мл/мин.) по сравнению с тем же показателем у больных, имеющих заболевания почек средней тяжести (КК 30–60 мл/мин.), и у здоровых добровольцев. Хотя ингибирующий эффект на АДФ–индуцированную агрегацию тромбоцитов оказался сниженным (25%) по сравнению с таким же эффектом у здоровых добровольцев, время кровотечения было увеличено в той же мере, что и у здоровых добровольцев, получавших клопидогрел в дозе 75 мг/сут.
Статистически значимое и зависящее от дозы торможение агрегации тромбоцитов наблюдается через 2 ч после приема внутрь разовой дозы клопидогрела – 75 мг. Повторный прием той же дозы приводит к значительному торможению агрегации тромбоцитов. Эффект усиливается прогрессивно, и стабильное состояние достигается через 3–7 дней. При этом средний уровень торможения агрегации под действием дозы 75 мг составляет 40–60%.
Клинические области применения клопидогрела:
• профилактика атеротромботических нарушений:
1) у больных с окклюзирующим атеросклерозом магистральных сосудов;
2) у больных, перенесших ИМ;
3) у больных, перенесших ишемический инсульт;
4) у больных с диагностированными заболеваниями периферических артерий;
• у больных с ОКС с подъемом и без подъема сегмента ST (нестабильная стенокардия или ИМ без зубца Q), в комбинации с АСК;
• интервенционная кардиология (баллонная дилатация, стентирование).
При стабильной стенокардии стартовое лечение клопидогрелом – от 75 до 150 мг (при резистентности к препарату) 1 раз/сут. независимо от приема пищи. У больных с ОКС без подъема сегмента ST лечение клопидогрелом должно быть начато приемом однократной дозы 300 мг, а затем продолжено дозой 75 мг/сут. в сочетании с АСК в дозе 75–325 мг/сут. В случаях ОКС у больных с планируемыми пластическими вмешательствами на коронарных артериях (баллонная ангиопластика, стентирование, АКШ) за 2–4 ч до процедуры назначают нагрузочную дозу клопидогрела – от 600 до 900 мг 1 раз/сут. При разовом приеме препарата в дозе 600 мг (количество, эквивалентное 8 стандартным таблеткам по 75 мг) здоровыми добровольцами побочные явления не отмечены, при этом время кровотечения было удлинено в 1,7 раза, что соответствует величине, зарегистрированной после приема терапевтической дозы (75 мг/сут.) [6,7,9,13].
По данным проспективного исследования CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the American College of CardiologyAmerican Heart), среди 93 045 пациентов с ИМ без подъема сегмента ST применение клопидогрела в ранние сроки после начала заболевания приводит к значительному снижению госпитальной летальности без существенного увеличения времени кровотечений. По данным Европейского регистра, при ИМ с подъемом сегмента ST длительное применение клопидогрела в сочетании с АСК (по сравнению с монотерапией АСК) сопровождалось снижением риска внезапной смерти как в группе пациентов, получавших тромболитическую терапию, так и у больных, которым не проводилась артифициальная реперфузионная терапия [2,5,6].
Клопидогрел, так же как и тиклопидин, предотвращает развитие осложнений после проведения ангиопластики коронарных артерий со стентированием. Однако переносимость клопидогрела лучше по сравнению с тиклопидином – при его применении побочных эффектов развивается в 2 раза меньше [5,8].
Доктор Eric J. Topol с коллегами из клиники Кливленда (США) провели мета–анализ результатов трех рандомизированных исследований и семи исследований, осуществленных медицинскими центрами. В основе этих исследований – сравнение результатов использования тиклопидина и клопидогрела у больных после ангиопластики со стентированием. Общее количество пациентов составило 13 955 человек. При применении клопидогрела количество осложнений достигло 2,1%, при применении тиклопидина – 4,04% (р<0,001), смертность составила 1,09% в группе тиклопидина и 0,48% – в группе клопидогрела (р<0,003). «Лучшие результаты при использовании клопидогрела могут объясняться более ранним началом его действия (влияние на тромбоцитарное звено) и лучшей переносимостью», – считают авторы. «Это исследование продемонстрировало, что комбинация клопидогрел + АСК должна стать стандартной при лечении пациентов после ангиопластики», – заявил доктор Eric J. Topol. Интервенционная кардиология является приоритетной сферой применения клопидогрела [3,5,6,8].
В настоящее время интенсивно изучаются клинические результаты применения клопидогрела при различных вариантах коронарной ангиопластики у больных с ИБС как в виде монотерапии, так и в сочетании с АСК. Накопленный опыт наблюдения (от 28 дней до 18 мес.) за 91 744 пациентами с ОКС, которым проводилось стентирование, позволил в 2007 г. в рекомендациях Американской коллегии кардиологов/Американской ассоциации сердца и Европейского кардиологического общества постулировать применение клопидогрела в виде нагрузочной дозы – 300 мг за 24 ч до ангиопластики. После инвазивной процедуры экспертами рекомендовано продолжить прием клопидогрела и АСК в течение месяца (при имплантации металлического стента) или 12 мес. (в случаях имплантации стента с лекарственным покрытием) [2,3,5,13].
В большинстве случаев клопидогрел в обсуждаемых дозировках и при краткосрочном приеме хорошо переносится. Тромбоциты являются источником ростковых факторов, стимулирующих ангиогенез в стенке желудка, поэтому клопидогрел, не оказывая прямого воздействия на слизистую желудка, опосредованно (через ингибицию тромбоцитов) может препятствовать заживлению эрозий и язв желудочно–кишечного тракта (ЖКТ). Соответственно, у пациентов с заболеваниями ЖКТ и высоким риском кровотечения целесообразно избегать длительного использования клопидогрела, при этом эффективной профилактикой осложнений считалось назначение ингибиторов протонной помпы (ИПП). В рекомендациях Американского колледжа кардиологов и Американской ассоциации сердца, опубликованных в октябре 2008 г. (что отражено в Российских рекомендациях ВНОК по диагностике и лечению стабильной стенокардии), признается целесообразным применение ИПП в качестве гастропротектора у больных, получающих двойную антитромбоцитарную терапию (ДАТ) – клопидогрел и АСК [1,6,7].
Однако недавно появились сообщения о неблагоприятном взаимодействии ИПП с клопидогрелом, которое увеличивает риск атеротромботических событий.
На ежегодной научной сессии Американского общества сердечно–сосудистой ангиографии и интервенции (SCAI) 6 мая 2009 г. были доложены результаты исследования Clopidogrel Medco Outcomes Study, в котором оценивалась клиническая эффективность комбинации различных ИПП с ДАТ в сравнении с только одной ДАТ у больных, подвергнутых коронарному стентированию [13]. В исследование было включено 16 690 пациентов, которые получали клопидогрел после имплантации стентов в коронарные артерии. В группе ИПП больные принимали пантопразол, эзомепразол, омепразол или лансопразол в среднем в течение 9 мес. Основные клинические исходы включали госпитализации по поводу сердечных приступов (heart attack), нестабильной стенокардии, инсультов и повторной реваскуляризации миокарда.
Общий риск неблагоприятных исходов в группе контроля (только ДАТ) составил 17,9% за один год. У больных, принимавших ИПП с клопидогрелом, в сравнении с больными, не принимавшими ИПП, риск коронарных событий был выше на 50%, в том числе сердечных приступов и нестабильной стенокардии – на 70%, инсульта и событий, подозрительных на инсульт, – на 48%, повторных коронарных процедур – на 35%. При анализе подгрупп пациентов, принимавших ИПП, оказалось, что увеличение риска нежелательных явлений при комбинации различных ИПП и клопидогрела было примерно одинаковым: при терапии лансопразолом – на 24,3%, эзомепразолом – на 24,9%, омепразолом – на 25,1%, пантопразолом – на 29,2% (все различия с контролем статистически значимы). С учетом полученных данных эксперты SCAI рекомендуют практическим врачам, ведущим больных с имплантированными коронарными стентами и получающих ДАТ, использовать для гастропротекции вместо ИПП антациды или блокатор Н2–рецепторов гистамина – ранитидин. Последние препараты, в отличие от ИПП, не метаболизируются ферментной системой CYP450, ответственной за превращение пролекарства клопидогрела в активное вещество [10–14].
Одно из наиболее тяжелых осложнений приема клопидогрела (хотя и достаточно редкое) – развитие тромботической тромбоцитопенической пурпуры в результате формирования антител к металлопротеазе, проявляемое тромбоцитопенией, повреждением эритроцитов, почечной недостаточностью и неврологическими расстройствами, лечение которого предусматривает переливание плазмы крови [2,10]. Со стороны свертывающей системы крови отмечаются желудочно–кишечные кровотечения (1,99%), геморрагический инсульт (0,35%), нейтропения; со стороны пищеварительной системы – боли в животе, диспепсия, гастрит, запор, язвы желудка и двенадцатиперстной кишки (0,68%), диарея (4,46%); развиваются дерматологические реакции – кожная сыпь (4,2%) [2,4,8].
Противопоказаниями для применения клопидогрела являются:
• повышенная чувствительность к компонентам препарата;
• острое кровотечение (например, при пептической язве или внутричерепном кровоизлиянии).
Клопидогрел следует назначать с осторожностью при повышенном риске кровотечений вследствие травмы, оперативных вмешательств, нарушений системы гемостаза. При планируемых хирургических вмешательствах (если антиагрегантное действие нежелательно) курс лечения следует прекратить за 7 дней до операции. С осторожностью назначают клопидогрел больным с тяжелыми нарушениями функции печени, при которых возможно возникновение геморрагического диатеза, поскольку опыт применения препарата у таких пациентов ограничен. Больных следует предупредить о том, что они должны сообщать врачу о каждом случае необычного кровотечения. Больные также должны информировать врача и стоматолога о приеме препарата, если им предстоят оперативные вмешательства или если врач назначает новое для пациента лекарственное средство.
При появлении симптомов чрезмерной кровоточивости (кровоточивость десен, меноррагии, гематурия) показано исследование системы гемостаза (время кровотечения, количество тромбоцитов, тесты функциональной активности тромбоцитов). Рекомендуется регулярный контроль лабораторных показателей функции печени.
Несмотря на то, что статины (ингибиторы ГМГ–КоФ– редуктазы) в большинстве случаев метаболизируются теми же цитохромами печени, не установлено отрицательного влияния статинов на содержание активного метаболита клопидогрела и его антиагрегантное действие. Фармакодинамическая активность клопидогрела осталась практически неизменной при одновременном применении с фенобарбиталом, циметидином или эстрогенами [11].
Также не выявлены клинически манифестируемые взаимодействия клопидогрела с иАПФ (рамиприл), β–блокаторами (атенолол), блокаторами кальциевых каналов (нифедипин), рекомбинантным эритропоэтином. Фармакокинетические свойства дигоксина или теофиллина не изменяются при совместном применении с клопидогрелом [14].
При одновременном применении с гепарином, по данным клинического испытания, проведенного на здоровых добровольцах, клопидогрел не изменял общей потребности в гепарине. И наоборот, одновременное длительное применение гепарина не изменяло ингибирующего действия клопидогрела на агрегацию тромбоцитов. Однако безопасность такой комбинации до настоящего времени не установлена, и одновременное применение этих препаратов требует осторожности.
Безопасность совместного применения клопидогрела и варфарина до настоящего времени не установлена, одновременное применение вышеуказанных препаратов не рекомендуется, поскольку такая комбинация может усилить кровотечение [10].
При одновременном применении с рекомбинантным активатором тканевого плазминогена (rt–PA) безопасность совместного применения клопидогрела, rt–PA и гепарина была исследована у больных, недавно перенесших ИМ; при этом частота клинически значимого кровотечения была аналогична той, что наблюдалась в случае совместного применения rt–PA и гепарина. Безопасность совместного применения клопидогрела с другими тромболитиками еще не установлена, и одновременно применять эти препараты необходимо с осторожностью [5,10].
В настоящее время на отечественном фармакологическом рынке представлен препарат клопидогрела с доказанными фармакологическими и фармакодинамическими свойствами – Агрегаль.
Агрегаль – антиагрегантное средство, содержит 75 мг клопидогрела. Агрегаль, так же как и клопидогрел, избирательно уменьшает связывание АДФ с рецепторами на тромбоцитах и активацию рецепторов гликопротеина GPIIb/IIIa под действием АДФ, блокируя агрегацию тромбоцитов. Торможение агрегации тромбоцитов наблюдается через 2 ч после приема (40% ингибирования) начальной дозы 400 мг. Максимальный эффект (60% подавление агрегации) развивается через 4–7 дней постоянного приема дозы 50–100 мг/сут. Антиагрегантный эффект сохраняется в течение всего периода жизни тромбоцитов.
Используя градацию частоты нежелательных эффектов (очень часто – более 1/10, часто – более 1/100 и менее 1/10, нечасто – более 1/1000 и менее 1/100, редко – более 1/10 000 и менее 1/1000, очень редко – менее 1/10 000, включая единичные случаи), можно отметить, в каких случаях при применении Агрегаля в клинической практике наблюдались побочные эффекты:
• со стороны органов кроветворения (тромбоцитопения, лейкопения, эозинофилия): редко – нейтропения;
• со стороны нервной системы: нечасто – головная боль, головокружение, парестезии; очень редко – спутанность сознания, галлюцинации, нарушение вкуса;
• со стороны ССС: часто – гематома; очень редко – тяжелые кровотечения, кровотечение из операционной раны, васкулит, снижение АД;
• со стороны дыхательной системы: очень часто – носовое кровотечение;
• со стороны пищеварительной системы: часто – диарея, боль в животе, диспепсия, кровотечение из ЖКТ; нечасто – язва желудка и двенадцатиперстной кишки, гастрит, рвота, тошнота, запор, метеоризм; редко – забрюшинное кровотечение;
• со стороны кожных покровов: часто – подкожные кровоизлияния; нечасто – кожная сыпь, зуд, пурпура;
• местные реакции: часто – кровотечения в месте инъекции;
• лабораторные показатели: нечасто – увеличение времени кровотечения.
Способ применения и дозы Агрегаля: внутрь, независимо от приема пищи, для профилактики тромботических осложнений у пациентов с ИМ, ишемическим инсультом или окклюзией периферических артерий – по 75 мг 1 раз/сут. У больных с ИМ лечение можно начинать с первых дней по 35–й день болезни, а у больных с ишемическим инсультом – в сроки от 7 дней до 6 мес. после начала заболевания. Для профилактики тромботических осложнений при ОКС без подъема сегмента ST (нестабильная стенокардия, ИМ без зубца Q) начинают с однократного приема нагрузочной дозы в 300 мг, а затем принимают по 75 мг/сут. (в сочетании с АСК в дозах 75–325 мг/сут., рекомендуемая доза – 100 мг/сут.). Комбинированную терапию начинают после появления симптомов как можно раньше и продолжают в течение 4 нед. У пациентов старше 75 лет лечение клопидогрелом должно начинаться без приема его нагрузочной дозы. У пациентов с генетически обусловленным снижением функции изофермента CYP2C19 возможно уменьшение эффекта клопидогрела, оптимальный режим дозирования препарата у таких пациентов не установлен [11,12].
Таким образом, профилактика тромбозов и тромбоэмболий, являющихся ключевым моментом в развитии сердечно–сосудистых патологий (ОКС, острый ИМ, ишемические инсульты, тромбоэмболии легочной артерии, поражение почек, периферические ангиопатии), с помощью антиагрегантных препаратов является определяющим направлением лечения больных в терапевтической, хирургической и интервенционной кардиологической практике. Тиенопиридины, в частности Агрегаль (клопидогрел), АСК способствуют активной профилактике тромбоэмболизма, а их сочетание позволяет уменьшить количество принимаемого препарата с повышением терапевтической активности и снижением побочных эффектов.
Литература
1. Диагностика и лечение стабильной стенокардии. Российские рекомендации (2–й пересмотр). Разработаны Комитетом экспертов ВНОК. – М., 2008. – С. 25–26.
2. Добровольский А.В. Клопидогрел в лечении заболеваний сердечно– сосудистой системы. // РМЖ. – 2009. – Т. 17. – № 8 (347). – С. 558–569.
3. Лупанов В.П. Клопидогрел в профилактике тромботических осложнений у пациентов с коронарным атеросклерозом после чрескожных коронарных вмешательств. // РМЖ. – 2010. – Т. 18. – № 10. – С. 675–681.
4. Метелица В.И. Справочник по клинической фармакологии сердечно–сосудистых средств. 2–е изд.. – М.: Бином, 2002. – С. 625–655.
5. Шилов А.М. Инфаркт миокарда. – М.: Миклош, 2008. – С. 85–90.
6. 2007 focused update of the ACCAHASCAI 2005 guideline update for percutaneous coronary intervention: a report of American College of CardiologyAmerican Heart Association Task Force on Practice guidelines. King. S.B. 3rd, Smith S.C.Jr., Hirshfeld J.W.Jr. et al. // J. Am. Coll. Cardiol. – 2008. – Jan. 15, 51(2). – Р. 172–209.
7. The ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the atrial fibrillation clopidogrel trial with irbesartan for prevention of vascular events (ACTIVE–W): a randomised controlled trial. // Lancet. – 2006. – Vol. 367. – Р. 1903–1912.
8. Bhatt D.L., Bertrand M.E., Berger P.V. and al. Meta–analysis of randomized and registry comparisons of ticlopidine with clopidogrel after stending. // JACC. – 2002. – Vol. 39. – Р. 9–14.
9. Husted S. New developments in oral antiplatelet therapy. // Eur. Heart J. Supplements. – 2007. – Vol. 9. – Р. 20–26.
10. Jarvis B., Simpson K. Clopidogrel: a review of its use in the prevention of atherothrombosis . // Drugs. – 2000. – Vol. 60. – Р. 347–77.
11. Mega J.L., Close S.L., Wiviott S.D. et al. Cytochrome P–450 polymorphisms and response to Clopidogrel. N. Engl. J. Med. 2009. DOI: 10.1056/NEJMoa0809171. Available at: http://www.nejm.org.;
12. Storey R. Clopidogrel in acute coronary syndrome: to genotype or not? Lancet. 2008. Vol. 6736(08).61846–61852. Available at: http://www.the lancet.com.
13. SCAI Statement on “A National Study of the Effect of Individual Proton Pump Inhibitors on Cardiovascular Outcomes in Patients Treated with Clopidogrel Following Coronary Stenting: The Clopidogrel Medco Outcomes Study”. // J. Am, Coll. Cardiol. – 2009. – Jul, 25 – 950. – Р. 187–195.
14. Van Hout B.A., Tangelder M.J.D., Bervoets P., Gabriel S. Cost. effectiveness analysis of antithrombotic treatment with clopidogrel in patients with myocardial infarction, stroke and peripheral arterial disease in The Netherlands. ISPOR Congress Barcelona, November 2003.












