В 1971 г. доктор Akira Endo, работавший в Токио (Япония), предположил, что продукты жизнедеятельности грибов, которые растут на питательной среде (для получения пенициллина лучшего качества), должно быть, также содержат естественные ингибиторы синтеза холестерина. После 2 лет работы и проведения около 6000 тестов было обнаружено, что среда культуры Penicillium citrinium содержала поразительно мощный ингибитор синтеза холестерина, который был выделен и назван ML–236B, позже – компактином. Именно этот препарат стал родоначальником статинов.
Каждая более–менее значимая фармацевтическая компания вскоре начала проводить скрининг культур микроорганизмов не только на антибиотики, но и на ингибиторы синтеза холестерина. В компании Merck в 1978 г. начался поиск собственного статина, и уже через 2 нед. был выделен свой ингибитор – соединение, синтезируемое грибами (Aspergillus terreus), отличными от тех, что использовал Endo. Вещество получило название мевинолин (позднее замененное на ловастатин). Структуры монаколина К, полученного Endo, и ловастатина, полученного Alberts, оказались совершенно идентичными. Одно и то же соединение, синтезируемое двумя разными видами микроорганизмов, было независимо открыто в двух разных лабораториях практически одновременно! С этого времени, с некоторыми серьезными остановками, началось победное шествие статинов [1].
Ранее ни одному из препаратов не удавалось настолько значимо снижать уровень липидов плазмы. Например, в исследовании NIH Coronary Primary Prevention Trial 1984 г. при применении холестирамина уровень общего холестерина снизился лишь на 10%, а ХС ЛПНП – на 20%. Даже этого оказалось достаточно, чтобы сократить количество коронарных осложнений на 20%. Результат едва достиг статистической достоверности. Недавний метаанализ 14 исследований статинов, в общем включающий 90 056 больных, пролеченных ловастатином, симвастатином, правастатином, флувастатином и аторвастатином, показал, что наилучшим предиктором снижения коронарных событий является снижение уровня ХС ЛПНП. Снижение ХС ЛПНП на 1 ммоль/л уменьшает риск основных сосудистых осложнений на 20% (рис. 1).
В настоящее время механизм действия статинов хорошо изучен. Они тормозят активность фермента гидроксиметилглутарил–коэнзим А редуктазы (ГМГ–КоА–редуктазы), который превращает ацетил коэнзим А в мевалонат, т.е. прерывают первое звено в цепочке синтеза холестерина: ацетил коэнзим А > мевалонат > 5 пирофосфомевалонат > изопектилпирофосфат > 3,3 диметилпирофосфат > геранилпирофосфат > фарнезилпирофосфат > сквален > ланостерол > холестерин.
Доказательная история. Успешная доказательная история применения статинов в клинической практике началась с подтверждения в ходе выполнения исследования 4S (Scandinavian Simvastatin Survival Study) [8] гипотезы о том, что прием небольшой дозы статина по сравнению с плацебо приводит к улучшению прогноза больных со стабильным течением ишемической болезни сердца (ИБС) – пятилетний прием симвастатина у больных ИБС привел к снижению коронарной летальности на 42%, а общей – на 30%. Также было отмечено снижение частоты инсульта (на 30%), что до этого считалось недостижимым при использовании гиполипидемической терапии.
В других рандомизированных клинических исследованиях: CARE, LIPID, AF/Tex CAPS, HPS, ASCOT–LLA была продемонстрирована высокая эффективность не только статинов по снижению общего ХС и ХС ЛПНП, но основное – снижение частоты повторных осложнений ИБС – инфаркта миокарда (ИМ), нестабильной стенокардии, внезапной смерти – более чем на 25–40%. Снижалась и общая смертность. При этом влияние на конечные точки было получено как у больных ИБС (4S, CARE, LIPID), так и у лиц без признаков ИБС (WOSCOPS, AFCAPS/TexCAPS), не только у лиц с выраженной гиперхолестеринемией, но и при относительно невысоком уровне ХС ЛПНП [2–7].
Базовыми исследованиями, на которых основывается современная доказательная практика применения статинов, можно считать семь крупнейших рандомизированных исследований. В хронологическом порядке они выглядят следующим образом:
• 1994 г. – 4S (Scandinavian Simvastatin Survival Study) – первое исследование такого масштаба, в котором продемонстрировано 42% снижение коронарной летальности в группе из 4444 больных ИБС (с общим холестерином плазмы 5,5–8,0 ммоль/л) на фоне более чем 5–летнего приема симвастатина в суточной дозировке 20–40 мг [8].
• 1995 г. – WOSCOPS (West of Scotland Coronary Prevention Study). На фоне 5–летнего (4,9 года) приема правастатина (40 мг/сут.) в группе из 6595 мужчин, не переносивших инфаркт миокарда и страдающих гиперхолестеринемией (средний уровень общего холестерина – 7,0 ммоль/л), отмечено уменьшение частоты развития нефатального инфаркта миокарда и смерти от ИБС на 31% [5].
• 1996 г. – CARE (Cholesterol and Recurrent Events). Продемонстрировано 24% уменьшение частоты развития нефатального инфаркта миокарда и летального исхода от ИБС в группе из 4159 больных ИБС, перенесших инфаркт миокарда (уровень общего холестерина<6,2 ммоль/л), на фоне 5–летнего приема правастатина в суточной дозировке 40 мг [3].
• 1997 г. – Post CABG (Post Coronary Artery Bypass Graft). Отмечено замедление прогрессирования коронарного атеросклероза (на 31%) в группе из 1351 больных, перенесших операцию аортокоронарного шунтирования. Эффект наступал на фоне 4–летнего (4,3 года) приема ловастатина (40 мг/сут.), обеспечивающего стойкое снижение уровня холестерина липопротеидов низкой плотности до 2,5 ммоль/л.
• 1997 г. – LCAS (Lipoprotein and Coronary Atherosclerosis Study). В группе из 429 больных с ангиографически документированной ИБС и умеренной гиперхолестеринемией отмечено замедление роста атеросклеротических бляшек в коронарных артериях. Эффект получен на фоне приема флувастатина (по 40 мг/сут. в течение 2,5 года). При этом частота развития тяжелых клинических проявлений коронарной недостаточности на фоне приема препарата достоверно не менялась.
• 1998 г. – AFCAPS/TexCAPS (Air Force / Texas Atherosclerosis Prevention Study). В группе из 6805 мужчин и женщин (средний уровень общего холестерина – 5,71 ммоль/л), получавших на протяжении 5 лет ежедневно 20–40 мг ловастатина, отмечено 37% снижение риска развития таких проявлений ИБС, как инфаркт миокарда, нестабильная стенокардия и внезапная коронарная смерть [6].
• 1998 г. – LIPID (Long–Term Intervention with Pravastatin in Ischemic Disease). В группе из 9014 больных ИБС, перенесших в прошлом инфаркт миокарда или эпизоды нестабильной стенокардии (уровень общего холестерина – от 4 до 7 ммоль/л), отмечено 24% снижение коронарной летальности. Эффект получен на фоне 6–летнего (6,1 года) приема правастатина (40 мг/сут.) [2].
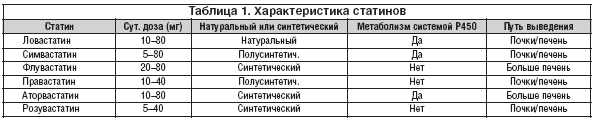
Поиск «идеального» статина. Со времени появления на рынке первого статина – ловастатина в 1987 г. – прошло немало времени. За это время целевые значения уровня общего ХС и ХС ЛПНП постоянно снижались на основании все новых клинических данных. Одновременно проводились поиски и исследования все более эффективных статинов. После природного ловастатина были получены полусинтетические правастатин и симвастатин (первое поколение статинов). Затем наступил черед полностью синтетических статинов: флувастатина (второе поколение), аторвастатина и церивастатина (третье поколение). Последним из клинически изученных и активно применяемых стал розувастатин (четвертое поколение). В настоящее время ведутся исследования новых ингибиторов ГМГ–КоА–редуктазы – гленвастатина, питавастатина и др. Какое место займут эти препараты, покажут исследования, которые ведутся в настоящее время. Сегодня деление статинов по поколениям не имеет значения, поскольку различий в эффективности по этому параметру не выявлено. Исследования по прямому сравнению статинов практически отсутствуют или не отвечают требованиям доказательной медицины (т.е. учитывают не твердые клинические, а суррогатные конечные точки), либо в них сравниваются неэквивалентные дозы разных статинов (как, например, PROVE IT). Поэтому при выборе статина приходится основываться на доказанной эффективности в сравнении с плацебо. Выраженность гиполипидемического эффекта статинов возрастает в следующем порядке: правастатин<симвастатин<аторвастатин<розувастатин. Основные характеристики статинов представлены в таблице 1.
Выраженность гиполипидемического действия статинов изучалась при их прямом сравнении в исследовании МERCURY I (в рамках программы GALAXY). Оценивалось влияние статинов на уровень холестерина ЛПНП и ЛПВП (рис. 2) [11]. Другой работой, в которой напрямую сравнивались эффекты розувастатина и аторвастатина, было исследование STELLAR. Сравнительный анализ показал, что розувастатин в дозе 10–40 мг/сут. позволил достичь целевого уровня липидов в 82–89% случаев, в то время как аторвастатин в дозе 10–80 мг/сут. – в 69–85% случаев [10]. Однако выраженность клинических эффектов статинов и количественные показатели их влияния на прогноз значительно превосходили степень изменений липидного спектра крови и степень влияния на ангиографические показатели. Анализ результатов крупных клинических исследований (4S, WOSCOPS, CARE, HPS) обнаружил существенные различия между собственно гиполипидемической составляющей терапии статинами и степенью ее влияния на прогноз. По данным исследования 4S рассчитано, что риск смерти от ИБС и число случаев нефатального ИМ снижаются на 7% на каждые 0,6 ммоль/л снижения сывороточного ХС в течение первых двух лет лечения статином и на 22% – в течение последующих 3–5 лет [8]. Уменьшение количества сердечно–сосудистых осложнений наблюдалось в более ранние сроки, чем это можно было бы предположить, рассчитывая только на гиполипидемический эффект статина. В исследованиях MARS (ловастатин 40 мг/сут.) и MAAS (симвастатин 20 мг/сут.) наблюдалось не только достоверное снижение уровней холестерина и холестерина ЛПНП, но и достоверное влияние на процесс прогрессирования атеросклероза по данным ангиографии. Кроме того, статины предотвращают развитие ишемических инсультов, что не имеет непосредственной связи с повышением уровня холестерина [12]. Наконец, в исследовании HPS положительные клинические результаты были достигнуты у больных с высоким риском развития сосудистых осложнений атеросклероза, независимо от исходного уровня ХС и ХС ЛПНП, т.е. в том числе и у лиц с нормальными показателями липидограммы [4].
Таким образом, категории пациентов, у которых статины способны улучшить прогноз, включают в себя широкий спектр нозологий: ИБС (первичная и вторичная профилактика инфаркта миокарда), сахарный диабет, атеросклероз периферических артерий, пациенты, перенесшие нарушение мозгового кровообращения, имеющие высокий риск фатальных неблагоприятных кардиальных событий по шкале SCORE – более 5%, риск ИБС по Фрамингемской шкале более 20%.
Теория и практика. По данным исследований EUROASPIRE I и II, проведенных в 1996 и 2001 гг., всего за 5 лет средняя частота назначения статинов в Европе выросла в 5 раз – с 10,5 до 55,3% соответственно. Частота применения этой группы препаратов в Аргентине и Бразилии у больных после ИМ достигает 13%, а в Великобритании и США – 40–60%. Однако в России это менее 10% от должного, и это при том, что наша страна занимает одно из первых мест в мире по ранней смертности от сердечно–сосудистых заболеваний. Основной причиной, по–видимому, является высокая стоимость при отсутствии конкретного ощутимого результата от приема препарата (приверженность к приему ацетилсалициловой кислоты в различных формах намного выше, вероятно, в связи с меньшей стоимостью). Также переоценивается риск побочных эффектов и осложнений терапии и, наконец, формальное отношение к достижению целевых значений липидного спектра. Даже в благополучных странах Западной Европы, где 70% пациентов получают статины для снижения уровня ХС, целевые значения достигаются только у 53% больных. Наиболее частой является классическая ситуация «уровень холестерина стал нормальным, курс лечения можно завершить» или «временно прервать, пусть печень отдохнет». Однако эти «нормальные» цифры являются не целевыми значениями, а некоторой «средней по стране» величиной. Уровень липидов вскоре после прекращения «курса лечения» вновь возвращается к исходным значениям, сохраняясь таким месяцы и годы, при этом пациент пребывает в уверенности, что он прошел «высокоэффективный» курс лечения. Другой распространенный вариант – пациент, исправно принимающий минимальные дозы статинов с далеко не целевыми значениями липидного спектра, при этом уверенный, что у него–то «атеросклероз под контролем». Отчасти такая ситуация обусловлена недофинансированием здравоохранения, но спасение утопающих остается все равно в первую очередь их делом.
Одним из выходов, помимо разъяснительной работы, является снижение стоимости лечения одновременно с достижением максимального липидснижающего эффекта на фоне приема небольшой дозы статина. Над этим более 30 лет работает фармацевтическая промышленность, создавая все новые препараты. В настоящее время наиболее эффективным гиполипидемическим средством является розувастатин – препарат IV генерации. Ставшие уже классическими исследования STELLAR (2003), SOLAR (2007), COMPELL (2006), MERCURY (2006), ORION (2008), JUPITER (2008), LUNAR (2012) показали, что розувастатин значительно превосходит другие статины по гиполипидемической активности. В среднем снижение ХС–ЛПНП на фоне терапии составляет 52–63% для доз 10 и 40 мг соответственно.
Другим реальным способом снижения стоимости лечения становится использование дженерических препаратов. В настоящее время одним из популярных дженериков розувастатина является препарат Мертенил в дозировке 5, 10, 20 и 40 мг. Мертенил по фармакологическим свойствам, лекарственной форме, силе действия, способу назначения и качеству нисколько не уступает оригинальному препарату. Препарат является высокоэффективным и безопасным лекарственным средством для первичной и вторичной профилактики ССЗ.
Доказательная база розувастатина не так обширна ввиду его «молодости», однако препарат обладает класс–эффектом. Поэтому в настоящее время исследования в основном сосредоточены на изучении новых перспектив мощных статинов (розувастатина) – возможности торможения и обратного развития стенозирующего атеросклероза, оценке эффективности лечения у лиц с нормальным уровнем липидов, но другими «маркерами» повышенного риска.
В исследовании JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin) прием розувастатина по 20 мг/сут. у 8900 лиц с низким риском развития атеросклероза, имевших нормальный уровень ХС и повышенный уровень
С–реактивного белка, приводил к статистически значимому снижению относительного риска развития тяжелых осложнений ССЗ на 44% и общей смертности – на 20% [13]. Впервые была продемонстрирована возможность регресса атеросклероза: в исследовании
ASTEROID у 507 больных изучено влияние приема
40 мг розувастатина в течение 2 лет на течение атеросклероза коронарных артерий с использованием внутрисосудистого ультразвукового исследования. В исследовании было достигнуто снижение уровня
ХС–ЛПНП на 53%, что привело к достижению среднего уровня ХС–ЛПНП, равного 1,6 ммоль/л. Было показано уменьшение нормализованного объема бляшки в наиболее пораженном сегменте коронарной артерии на 6,8%, уменьшение абсолютного объема бляшки – на 9,1% (р<0,001). У 78% больных было продемонстрировано обратное развитие объема атеросклеротической бляшки [14]. В исследовании ORION за два года лечения розувастатином в дозах 5 и 40 мг/сут. было получено уменьшение количества «опасных» бляшек в сонных артериях более чем на 40%.
Для препарата Мертенил (розувастатин, компании «Гедеон Рихтер») помимо доказательств биоэквивалентности выполнен также ряд исследований по изучению плейотропных эффектов терапии. В частности, в отечественном рандомизированном исследовании СТРЕЛА изучено влияние розувастатина на показатели микроциркуляции и функцию эндотелия сосудов у пациентов с АГ высокого риска и дислипидемией в сравнении с аторвастатином. В исследование включены 82 пациента. Отмечены достоверное снижение индекса жесткости, индексов аугментации и отражения, прирост амплитуды пульсовой волны (как отражение эндотелиальной дисфункции). Все эти эффекты были более выражены в группе розувастатина (Мертенил 20 мг/сут.).
В группе под руководством проф. В.С. Задионченко (Москва) проводилось контролируемое рандомизированное исследование эффективности и безопасности Мертенила (40 мг/сут.) у 78 больных с ОКС. На 30–е сут. от начала лечения было достигнуто 59% снижение уровня ХС ЛПНП в сравнении с исходными значениями; лечение переносилось хорошо. На фоне лечения Мертенилом выявлено уменьшение частоты аритмических событий и продолжительности эпизодов (по данным суточного мониторирования ЭКГ). Также отмечено, что Мертенил благоприятно влияет на показатели центральной гемодинамики, замедляет процессы ремоделирования ЛЖ. Выявлен ряд закономерностей, отражающих улучшение показателей микрогемодинамики у больных с ОКС на фоне терапии розувастатином [21,22].
Основной целью исследования «40х40» была оценка гиполипидемической эффективности, безопасности и переносимости розувастатина (Мертенил) в высшей дозе 40 мг/сут. у больных очень высокого сердечно–сосудистого риска, которые не достигали целевых уровней ХС ЛПНП на фоне текущей терапии статинами (большинство больных (18) принимали аторвастатин, 10 – симвастатин, 12 – розувастатин). При переводе пациентов с текущей терапии статинами на лечение Мертенилом (40 мг/сут.) без титрования дозы достигнуто дополнительное снижение уровня ХС ЛПНП на 22,4%, в результате чего значительно увеличилось число пациентов с целевым уровнем ХС ЛПНП.
Нередкой причиной прекращения приема или неназначения статинов становится опасение развития побочных эффектов. Метаанализ крупнейших исследований со статинами, включивший более 30 тыс. случаев наблюдения средней длительностью более 4 лет, однозначно показал, что суммарная встречаемость побочных эффектов статинов – около 1–3%, что сопоставимо с переносимостью плацебо. Развитие рабдомиолиза на фоне терапии статинами за всю историю их применения во всем мире привело не более чем к 100 фатальным случаям, т.е. 0,15 случая на один 1 млн назначений. Для сравнения: на 1 млн назначений ацетилсалициловой кислоты во всем мире приходится более 1000 случаев желудочно–кишечных кровотечений, в том числе и смертельных. В сопоставлении с количеством предотвращенных фатальных сердечно–сосудистых событий на фоне терапии статинами вывод очевиден. Однако стоит помнить о лекарственных препаратах, которые не рекомендовано комбинировать со статинами из–за риска развития миозитов и рабдомиолиза: фибраты (риск рабдомиолиза и гепатотоксичности), никотиновая кислота и ее производные (риск гепатотоксичности), макролидные антибиотики (эритромицин, кларитромицин), циклоспорин, азольные противогрибковые средства, верапамил, амиодарон, ингибиторы протеаз ВИЧ. Состояния, которые увеличивают риск развития миозитов и рабдомиолиза при применении статинов: сочетанная патология (сахарный диабет, хроническая почечная недостаточность, хирургические вмешательства (отмена статинов) у пожилых больных, недостаточное питание, печеночная недостаточность, полипрагмазия, избыточное употребление алкоголя, употребление грейпфрутового сока [15]. В этих случаях больные должны находиться под более тщательным наблюдением врача с контролем ферментов (АЛТ, АСТ, ГГТП, КФК) не реже 2 раз в месяц.
По указанию Американской ассоциации по контролю над продуктами питания и лекарственными препаратами (FDA), ранее в разделе «меры предосторожности» было рекомендовано периодически проводить контроль ферментов печени. Ставился вопрос об отмене контроля уровня трансаминаз вообще. Однако проблема гепатотоксичности оставалась: редкие, но тяжелые формы структурно–функциональных нарушений печени нередко диагностировались несвоевременно. В настоящее время, по указанию FDA, инструкция должна быть изменена и содержать рекомендацию обязательно сдать кровь для анализа содержания печеночных ферментов до начала курса лечения статинами и после его окончания.
Одновременно с расширением области, где статины приносят ощутимую пользу, определяются и границы их эффективности. Длительное время дискутируется целесообразность назначения этой группы препаратов пациентам с хронической сердечной недостаточностью. Результаты ранее выполненных крупных исследований не позволяли ответить на этот вопрос [16,17]. Было отмечено, что частота развития инфаркта миокарда у таких больных невысока. В связи с этим высказывались сомнения по поводу эффективности применения статинов у пациентов с ИБС при наличии ХСН, поскольку в основном их преимущество проявлялось в профилактике развития инфаркта миокарда. В то же время результаты многих нерандомизированных исследований позволяли предполагать, что применение статинов сопровождается улучшением прогноза больных с ХСН и указывали на положительное влияние на функцию ЛЖ и клиническое состояние больных с ХСН ишемической и неишемической природы.
Ответом на этот вопрос стали два исследования: CORONA – международное многоцентровое проспективное рандомизированное двойное слепое плацебо–контролируемое исследование более 5000 больных, включая Россию, которое было спланировано с целью проверки гипотезы о том, что прием розувастатина в дозе 10 мг по сравнению с плацебо приведет к уменьшению частоты развития неблагоприятных клинических исходов у больных с клиническими проявлениями ХСН ишемической природы и сниженной систолической функцией ЛЖ. Включали больных в возрасте 60 лет и старше с ХСН, соответствующей II–IV функциональному классу по классификации NYHA, ишемической этиологии и ФВ ЛЖ менее 35–40%. По результатам исследования не отмечено снижения комбинированного показателя смертности от осложнений сердечно–сосудистых заболеваний (ССЗ) и частоты развития несмертельных ИМ или инсульта [18]. Аналогичные результаты продемонстрированы в исследовании GISSI–HF, включавшем пациентов с ХСН ишемической и неишемической этиологии. Таким образом, в настоящее время нет доказательств, свидетельствующих в поддержку начала терапии статинами у пациентов с выраженной ХСН ишемической и неишемической этиологии. В то же время данных о негативном влиянии статинов также не получено.
В настоящее время огромную перспективу несет в себе назначение препаратов с учетом генетических особенностей пациента. Сегодня известно до 13 аллелей риска коронарной болезни. Результаты нескольких крупных проспективных исследований свидетельствуют о том, что полиморфизм гена KIF6, который заключается в замене аргинина на триптофан в позиции 719, ассоциирован с коронарной болезнью сердца. KIF6 кодирует кинезины – класс протеинов, участвующих во внутриклеточном транспорте по микроканальцам органеллов мембран, белковых комплексов, mРНК. Носители аллели 719 Arg были более подвержены риску первичных и вторичных коронарных событий. Эта аллель риска весьма распространена среди населения и увеличивает риск инфаркта миокарда примерно на 50%. В то же время терапия статинами у данной группы больных значительно снижает риск развития коронарных событий у данной категории пациентов, в отличие от «неносителей». Число пациентов, которых необходимо пролечить для предотвращения одного коронарного события, среди носителей аллели 719 Arg варьировало от 10 до 20 человек, по сравнению с более чем 80 пациентами для «неносителей» (по данным исследований CARE, WOSCOPS, PROVE IT–TIMI 22 STUDY) [19]. Оценка носительства данного генетического полиморфизма открывает широкую перспективу для улучшения оценки риска коронарных событий и оптимизации терапии.
Таким образом, атеросклероз считается необратимым и неотъемлемым спутником старения. Появление статинов позволило отчасти взять под контроль этот процесс и снизить смертность. За время, прошедшее после открытия первого ингибитора ГМГКоА –редуктазы японским ученым Еndo, статины (Мертенил) стали поворотным пунктом в профилактике сердечно–сосудистых заболеваний, обусловленных атеросклерозом. Многочисленные исследования продемонстрировали, что статины могут продлить не просто жизнь человека, но именно его активную, полноценную жизнь.

![Рис. 2. Влияние терапии статинами на уровень холестерина ЛПНП и ЛПВП (результаты исследования STELLAR) [10]](/data/articles/Image/t21/n4/199-3.gif)
Литература
1. Daniel Steinberg // J. Lipid. Research. 2004. Vol. 47. P. 1339–1351.
2. LIPID study group. Titles (a) Design features and baseline characteristics of the LIPID (Long–term Intervention with Pravastatin in Ischemic Disease) study: a randomized trial in patients with previous acute myocardial infarction and/or unstable angina pectoris (b) Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. References (a) // Am. J. Cardiol. 1995. Vol. 76. P. 474–479 (b); N. Engl. J. Med. 1998. Vol. 339. P. 1349–1357.
3. Sacks F.M., Pfeffer M.A., Moye L.A. et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators // N. Engl. J. Med. 1996. Vol. 335. P. 1001–1009.
4. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high–risk individuals: a randomised placebo–controlled trial // Lancet. 2002. Vol. 360. P. 7–22.
5. Shepherd J., Cobbe S.M., Ford I. et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group // N. Engl. J. Med. 1995. Vol. 333. P. 1301–1307.
6. Gotto A.M. et al. Relation Between Baseline and On–Treatment Lipid Parameters and First Acute Major Coronary Events in the Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS) // Circulation. 2000. Vol. 101. P. 477.
7. Sever P.S., Dahlof B., Poulter N.R. et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower–than–average cholesterol concentrations, in the Anglo–Scandinavian Cardiac Outcomes Trial – Lipid Lowering Arm (ASCOT–LLA): a multicentre randomised controlled trial // Drugs. 2004. Vol. 64 (Suppl. 2). P. 43–60.
8. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S) // Lancet. 1994. Vol. 344. P. 1383–1389.
9. Martin M.J. et al. //Lancet. 1986 ii. P. 933–936.
10. Jones P.H., Davidson M.H., Stein E.A. et al. for the STELLAR Study Group. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial) // Am. J. Cardiol. 2003. Vol. 92. P. 152–160.
11. Schuster H. et al. Effects of switching statins on achievement of lipid goals: Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I) study // Am. Heart J. 2004. Vol. 147. P. 705–712.
12. Bellosta S., Ferri N., Paoletti R., Corsini A. Non–lipid–related effects of statins // Ann. Med. 2000. Vol. 32. P. 164–176.
13. Ridker P.M., Danielson E., Fonseca F.A.H. et al. Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C–Reactive Protein // N. Engl. J. Med. 2008. Vol. 359. P. 2195–207.
14. Nissen S. et al. Effect of very high–intensity statin therapy on regression of coronary atherosclerosis . The ASTEROID // JAMA. 2006. Vol. 295 (13). P. 1556–1565.
15. Фармакотерапия хронических сердечно–сосудистых заболеваний. Руководство для врачей / Под ред. Л.И. Ольбинской. – М.: Медицина, 2006.
16. Collins R., Armitage J., Parish S. et al. Effects of cholesterol–lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high–risk conditions // Lancet. 2004. Vol. 363. P. 757–767.
17. Shepherd J., Blauw G.J., Murphy M.B. et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomized controlled trial // Lancet. 2002. Vol. 360. P. 1623–1630.
18. Kjekshus J., Dunselman P., Blideskog M. et al. A statin in the treatment of heart failure? Controlled rosuvastatin multinational study in heart failure (CORONA): study design and baseline characteristics // Eur. J. Heart Fail. 2005. Vol. 7. P. 1059–1069.
19. American Journal of Cardiology. 2010. Vol. 106, Issue 7. P. 994–998.
20. Iakoubova O.A. et al.// JACC. 2008. Vol. 51. P. 449.
21. Задионченко В.С., Шахрай Н.Б., Шехян Г.Г. и др. Особенности фарма–кологических и клинических свойств розувастатина // РМЖ. – 2011. – № 12. – С. 772–778.
22. Задионченко В.С., Шехян Г.Г., Шахрай Н.Б. и др. Влияние розувастатина на липидный обмен, микроциркуляцию и показатели центральной гемодинамики у больных с острым коронарным синдромом // Consilium Medicum. – 2011. – № 5. – С. 85–89.
23. Гиляревский С.Р., Орлов В.А., Кузьмина И.М. и др. Гиполипидемические эффекты интенсивных режимов применения статинов при лечении больных с острым коронарным синдромом: подходы к выбору препарата и его дозы // Кардиол. и сердечно–сосуд. хир. – 2012. – № 5 (4). – С. 36–41.












