–Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –°–Э —П–≤–ї—П–µ—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ, —Б–Њ–њ—А—П–ґ–µ–љ–љ—Л–Љ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ (–Ъ–Ь–¶) –Ї —Б–Є–љ—В–µ–Ј—Г —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є—Е —Б—Г–±—Б—В—А–∞—В–Њ–≤ –≤ –≤–Є–і–µ –Р–Ґ–§ –Є –Ї—А–µ–∞—В–Є–љ—Д–Њ—Б—Д–∞—В–∞ [5, 6].
–Ю–і–љ–Є–Љ –Є–Ј –≤–µ–і—Г—Й–Є—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–Є—Е –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –Є —В—П–ґ–µ–ї–Њ–µ –±—Л—Б—В—А–Њ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ –°–Э, —Г –±–Њ–ї—М–љ—Л—Е —Б –°–Ф —П–≤–ї—П–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ —Б—Г–±—Б—В—А–∞—В–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ъ–Ь–¶ вАУ –Є–Ј–≤–µ—Б—В–љ–Њ–µ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–µ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–Є [7, 8]. –Ю–і–љ–Є–Љ –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –і–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤ –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ —Г–і–µ–ї—М–љ–Њ–≥–Њ –≤–µ—Б–∞ —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Г–≥–ї–µ–≤–Њ–і–љ—Л—Е —Б—Г–±—Б—В—А–∞—В–Њ–≤ [9]. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ –≤ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–µ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –љ–µ—Г—В–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –Є –Є—Е –і–µ—А–Є–≤–∞—В–Њ–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–µ–µ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ъ–Ь–¶ [10, 11].
–Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ–∞—Ж–Є–µ–љ—В—Л —Б –°–Э, —Б—В—А–∞–і–∞—О—Й–Є–µ –°–Ф, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –Ї–Њ–≥–Њ—А—В—Г, –≤ –Ї–Њ—В–Њ—А–Њ–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ъ–Ь–¶, —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ.
–Ю–і–љ–Є–Љ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –њ–Њ–≤–ї–Є—П—В—М –љ–∞ —Б—Г–±—Б—В—А–∞—В–љ—Л–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ъ–Ь–¶, —П–≤–ї—П–µ—В—Б—П –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ. –Т –Њ—Б–љ–Њ–≤–µ –µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –ї–µ–ґ–Є—В —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г–≥–љ–µ—В–µ–љ–Є—П –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Ж–Є–Ї–ї–µ –Ъ—А–µ–±—Б–∞, —Г—Б–Є–ї–µ–љ–Є–µ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –∞–љ–∞—Н—А–Њ–±–љ–Њ–≥–Њ –≥–ї–Є–Ї–Њ–ї–Є–Ј–∞, —З—В–Њ –≤ –Є—В–Њ–≥–µ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –≤ –≤–Є–і–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Р–Ґ–§ –Ј–∞ —Б—З–µ—В —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Н–љ–µ—А–≥–Є–Є –љ–∞ —В—А–Є–Ї–∞—А–±–Њ–љ–Њ–≤–Њ–Љ —Г—З–∞—Б—В–Ї–µ –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –і–Є–Ї–∞—А–±–Њ–љ–Њ–≤–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ —Н–љ–µ—А–≥–Њ—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–њ–Є [12, 13]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –Ї–Њ—В–Њ—А–Њ–µ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –Ї–∞–Ї –Ј–∞ —Б—З–µ—В —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–љ—Л—Е —Б–Є—Б—В–µ–Љ, —В–∞–Ї –Є –Ј–∞ —Б—З–µ—В –њ—А—П–Љ–Њ–є –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ [14, 15]. –°—Г—Й–µ—Б—В–≤—Г–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ–∞ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [16, 17].
–¶–µ–ї—М—О —А–∞–±–Њ—В—Л —П–≤–Є–ї–Њ—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–ї–Є—П–љ–Є—П –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ–∞ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–≤–µ–љ—М–µ–≤ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э –љ–∞ —Д–Њ–љ–µ –°–Ф 2-–≥–Њ —В–Є–њ–∞.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 86 –±–Њ–ї—М–љ—Л—Е —Б –°–Э II–РвАУII–С —Б—В–∞–і–Є–Є IIвАУIII —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ (52 –Љ—Г–ґ—З–Є–љ—Л –Є 34 –ґ–µ–љ—Й–Є–љ—Л; —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 56,8¬±1,1 –≥–Њ–і–∞). –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –°–Ф —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Њ—В 4 –і–Њ 14 –ї–µ—В (–≤ —Б—А–µ–і–љ–µ–Љ 8,2¬±0,6 –≥–Њ–і–∞). –Т—Б–µ –±–Њ–ї—М–љ—Л–µ –Є–Љ–µ–ї–Є –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ—Л–є –Ї–∞—А–і–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј (–њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л–є –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –Ј—Г–±—Ж–Њ–Љ Q –і–∞–≤–љ–Њ—Б—В—М—О –Њ—В 2 –і–Њ 5 –ї–µ—В) вАУ –≥—А—Г–њ–њ–∞ –°–Ф+–°–Э. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –±–∞–Ј–Є—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –°–Э –≤ –≤–Є–і–µ ќ≤-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ (88% –±–Њ–ї—М–љ—Л—Е), –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (92% –±–Њ–ї—М–љ—Л—Е), –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (53% –±–Њ–ї—М–љ—Л—Е), –і–Є—Г—А–µ—В–Є–Ї–Њ–≤ (81% –±–Њ–ї—М–љ—Л—Е). –Ґ–∞–Ї–ґ–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Є–љ–Є–Љ–∞–ї–Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В—Л (93% –±–Њ–ї—М–љ—Л—Е), —Б—В–∞—В–Є–љ—Л (94% –±–Њ–ї—М–љ—Л—Е) –Є, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є, –і—А—Г–≥–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Т –Ї–∞—З–µ—Б—В–≤–µ –ї–µ—З–µ–љ–Є—П –°–Ф 64 (74%) –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ–ї—Г—З–∞–ї–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ, 8 (9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАУ –њ—А–µ–њ–∞—А–∞—В—Л —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, 5 (6%) вАУ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, 9 (11%) вАУ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ —Б –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ.
–Я–µ—А–≤—Г—О –≥—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є 20 –±–Њ–ї—М–љ—Л—Е –°–Ф 2-–≥–Њ —В–Є–њ–∞ –±–µ–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –°–Э –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (12 –Љ—Г–ґ—З–Є–љ –Є 8 –ґ–µ–љ—Й–Є–љ; —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 54,4¬±2,3 –≥–Њ–і–∞; –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –°–Ф –≤ —Б—А–µ–і–љ–µ–Љ 7,2¬±1,5 –≥–Њ–і–∞) (–≥—А—Г–њ–њ–∞ –°–Ф). –І–∞—Б—В–Њ—В–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ—Л—Е –∞–љ—В–Є–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ —В–∞–Ї–Њ–≤–Њ–є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ. –°—В–µ–њ–µ–љ—М –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –°–Ф –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ —В–∞–Ї–Њ–≤–Њ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л (—Б—А–µ–і–љ–Є–µ —Г—А–Њ–≤–љ–Є –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ 7,8¬±0,3% –Є 7,9¬±0,1% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–Т—В–Њ—А—Г—О –≥—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є 20 –±–Њ–ї—М–љ—Л—Е —Б –°–Э, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –Ј—Г–±—Ж–Њ–Љ Q, –љ–µ —Б—В—А–∞–і–∞—О—Й–Є–µ –°–Ф (13 –Љ—Г–ґ—З–Є–љ –Є 7 –ґ–µ–љ—Й–Є–љ; —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 55,4¬±2,1 –≥–Њ–і–∞) вАУ –≥—А—Г–њ–њ–∞ –°–Э. –Ф–∞–љ–љ–∞—П –≥—А—Г–њ–њ–∞ –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В –≥—А—Г–њ–њ—Л –°–Ф+–°–Э –њ–Њ –і–∞–≤–љ–Њ—Б—В–Є –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –°–Э, —З–∞—Б—В–Њ—В–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±–∞–Ј–Є—Б–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —В–µ—А–∞–њ–Є–Є.
–Я–Њ —З–∞—Б—В–Њ—В–µ —В–∞–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞, –Ї–∞–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –Ї—Г—А–µ–љ–Є–µ, –љ–∞—А—Г—И–µ–љ–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞, –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–є —Б–µ–Љ–µ–є–љ—Л–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–є –∞–љ–∞–Љ–љ–µ–Ј –≥—А—Г–њ–њ—Л –°–Ф+–°–Э, –°–Э –Є –°–Ф —В–∞–Ї–ґ–µ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є.
–Т –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й—Г—О –≥—А—Г–њ–њ–∞–Љ –°–Ф+–°–Э, –°–Э –Є –°–Ф –њ–Њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ-–њ–Њ–ї–Њ–≤–Њ–Љ—Г —Б–Њ—Б—В–∞–≤—Г, –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 20 –ї–Є—Ж –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –°–Ф.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –ї–Є—Ж–∞, —Б—В—А–∞–і–∞—О—Й–Є–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–Љ–Є (–њ–Њ–Љ–Є–Љ–Њ –°–Ф), –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Є–ї–Є –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —Б–њ–Њ—Б–Њ–±–љ—Л–Љ–Є –њ–Њ–≤–ї–Є—П—В—М –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї—М–љ—Л–µ —Б –љ–∞–ї–Є—З–Є–µ–Љ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ—А–Њ–Ї–Њ–≤ —Б–µ—А–і—Ж–∞, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞, —Б—В—А–∞–і–∞—О—Й–Є–µ –љ–µ–Ї–Њ—А–Њ–љ–∞—А–Њ–≥–µ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б–µ—А–і—Ж–∞.
–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—П (–∞–њ–њ–∞—А–∞—В CARDIMAX FX-326U, FUCUDA DENSHI CO., LTD., –ѓ–њ–Њ–љ–Є—П) –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Є —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (–∞–њ–њ–∞—А–∞—В SIM 5000 PLUS ESAOTE BIOMEDICA, –Ш—В–∞–ї–Є—П).
–° —Г—З–µ—В–Њ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —Б–ї–Њ–ґ–љ–Њ—Б—В–µ–є –њ—А—П–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–і–µ–ї–Є –Є–Ј—Г—З–µ–љ–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –±—Л–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л–µ –ї–µ–є–Ї–Њ—Ж–Є—В—Л (–Я–Ь–ѓ–Ы) –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є. –Р–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М —Г–Ї–∞–Ј–∞–љ–љ–Њ–є –Љ–Њ–і–µ–ї–Є –≤ –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤, –≤—Л—П–≤–Є–≤—И–Є—Е –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ—Г—О —Б–≤—П–Ј—М —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є —Д–Њ—А–Љ–µ–љ–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –Ї—А–Њ–≤–Є –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Љ—Л—И—Ж—Л —Б–µ—А–і—Ж–∞ [18вАУ20].
–¶–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–∞–Ї—В–∞—В–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј—Л (–Ы–Ф–У), —Б—Г–Ї—Ж–Є–љ–∞—В-–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј—Л (–°–Ф–У) –Є ќ±-–≥–ї–Є—Ж–µ—А–Њ—Д–Њ—Б—Д–∞—В–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј—Л (ќ±-–У–§–Ф–У) –Я–Ь–ѓ–Ы –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б—Г–њ—А–∞–≤–Є—В–∞–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —Б –њ–Њ–і—Б—З–µ—В–Њ–Љ —Б—А–µ–і–љ–µ–≥–Њ —Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ –≤ —Г—Б–ї–Њ–≤–љ—Л—Е –µ–і–Є–љ–Є—Ж–∞—Е –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (–£–Х–Р) [19, 20]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–Є–∞—Д–Њ—А–∞–Ј—Л –љ–Є–Ї–Њ—В–Є–љ–∞–Љ–Є–і–∞–і–µ–љ–Є–љ–і–Є–љ—Г–Ї–ї–µ–Њ—В–Є–і–∞ (–Э–Р–Ф) –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б—Г–њ—А–∞–≤–Є—В–∞–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ–Њ–є –≤–Ј–≤–µ—Б–Є –Э–Р–Ф –Є –љ–Є—В—А–Њ—Б–Є–љ–µ–≥–Њ —В–µ—В—А–Њ–Ј–Њ–ї–Є—П [21, 22]. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –° –≤ –Я–Ь–ѓ–Ы –Ї—А–Њ–≤–Є –≤—Л—П–≤–ї—П–ї–Є –Љ–µ—В–Њ–і–Њ–Љ Flatmark [23]. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –њ–Њ —Б–њ–Њ—Б–Њ–±—Г Astaldi-Verga [24]. –Ю—В –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞–Ї–µ—В–∞ –њ—А–Њ–≥—А–∞–Љ–Љ STATISTICA 6.0 (StatSoft, Inc., USA). –Ф–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≤–Є–і–µ M¬±m. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ UвАУ–Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞-–£–Є—В–љ–Є (Mann-Whitney test). –†–∞–Ј–ї–Є—З–Є—П —Б—З–Є—В–∞–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є –њ—А–Є —А<0,05. –°–Є–ї—Г —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –ї–Є–љ–µ–є–љ—Л—Е –Ї–Њ—А—А–µ–ї—П—Ж–Є–є –°–њ–Є—А–Љ–µ–љ–∞. –Ъ–Њ—А—А–µ–ї—П—Ж–Є—П —Б—З–Є—В–∞–ї–∞—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є –њ—А–Є p<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±–∞–Ј–Є—Б–љ–Њ–є —Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Ј—Г—З–∞–≤—И–Є—Е—Б—П —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Н–љ–µ—А–≥–Њ–Њ–±–Љ–µ–љ–∞ –Я–Ь–ѓ–Ы –≤ –≥—А—Г–њ–њ–∞—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.

–Ш–Ј –і–∞–љ–љ—Л—Е —В–∞–±–ї–Є—Ж—Л 1 –≤–Є–і–љ–Њ, —З—В–Њ –Ї–∞–Ї –њ–∞—Ж–Є–µ–љ—В—Л –≥—А—Г–њ–њ—Л –°–Ф+–°–Э, —В–∞–Ї –Є –±–Њ–ї—М–љ—Л–µ –≥—А—Г–њ–њ –°–Ф –Є –°–Э —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–Є—Б—М –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є —Г—А–Њ–≤–љ—П–Љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є ќ±-–У–§–Ф–У, –Э–Р–Ф-–і–Є–∞—Д–Њ—А–∞–Ј—Л –Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –° –≤ –Я–Ь–ѓ–Ы –Ї—А–Њ–≤–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Б–µ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –±—Л–ї–Є –≤ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ—Л –≤ –≥—А—Г–њ–њ–µ –°–Ф+–°–Э –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–∞–Љ–Є –°–Ф –Є –°–Э. –Р–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ф–У –Є –°–Ф–У —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е.
–Ф–∞–љ–љ—Л–є —Д–∞–Ї—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –Ї–∞–Ї –°–Ф, —В–∞–Ї –Є –°–Э —Б–∞–Љ–Є –њ–Њ —Б–µ–±–µ —П–≤–ї—П—О—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї—О—З–µ–≤—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–є—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–Є–Њ–Ј–Њ—Д–Њ—Б—Д–∞—В–љ–Њ–≥–Њ —И—Г–љ—В–∞, —Б–Є—Б—В–µ–Љ—Л –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П –Є —Ж–Є—В–Њ—Е—А–Њ–Љ–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –≤ —В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л—Е –Ј–≤–µ–љ—М—П—Е —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Э–∞–±–ї—О–і–∞–µ–Љ–Њ–µ —Г–≥–љ–µ—В–µ–љ–Є–µ –≥–ї–Є—Ж–µ—А–Њ—Д–Њ—Б—Д–∞—В–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ, –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Ј–∞–≤–Є—Б—П—Й–µ–≥–Њ –Њ—В —Б–Њ—Б—В–Њ—П–љ–Є—П —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, —З—В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—О —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї. –°–Њ—З–µ—В–∞–љ–Є–µ –ґ–µ –°–Ф –Є –°–Э –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—О —Г–≥–љ–µ—В–µ–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞.
–Я–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –±–∞–Ј–Є—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј –±–Њ–ї—М–љ—Л—Е –≥—А—Г–њ–њ—Л –°–Ф+–°–Э –±—Л–ї–Є –≤—Л–і–µ–ї–µ–љ—Л 2 –њ–Њ–і–≥—А—Г–њ–њ—Л (1 –Є 2), —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –њ–Њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ-–њ–Њ–ї–Њ–≤–Њ–Љ—Г —Б–Њ—Б—В–∞–≤—Г, –Њ—Б–љ–Њ–≤–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –°–Э –Є –°–Ф, —Г—А–Њ–≤–љ—П–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Ј—Г—З–∞–≤—И–Є—Е—Б—П —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Я–Ь–ѓ–Ы –Ї—А–Њ–≤–Є. –У—А—Г–њ–њ–∞ –°–Ф+–°–Э1 (36 —З–µ–ї–Њ–≤–µ–Ї; 23 –Љ—Г–ґ—З–Є–љ—Л –Є 13 –ґ–µ–љ—Й–Є–љ; —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 57,2¬±1,8 –≥–Њ–і–∞) –њ—А–Њ–і–Њ–ї–ґ–∞–ї–∞ –њ–Њ–ї—Г—З–∞—В—М —Б—В–∞–љ–і–∞—А—В–љ—Г—О –±–∞–Ј–Є—Б–љ—Г—О —В–µ—А–∞–њ–Є—О. –У—А—Г–њ–њ–∞ –°–Ф+–°–Э2 (38 —З–µ–ї–Њ–≤–µ–Ї; 24 –Љ—Г–ґ—З–Є–љ –Є 14 –ґ–µ–љ—Й–Є–љ; —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 55,8¬±2,1 –≥–Њ–і–∞) –њ–Њ–Љ–Є–Љ–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–ї—Г—З–∞–ї–∞ –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ –њ–Њ 200 –Љ–≥ 3 —А./—Б—Г—В –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 30 –і–љ–µ–є. –Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –њ–Њ–≤—В–Њ—А–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Н–љ–µ—А–≥–Њ–Њ–±–Љ–µ–љ–∞ –Я–Ь–ѓ–Ы.
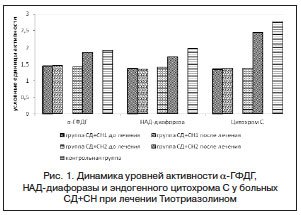
–І–µ—А–µ–Ј 1 –Љ–µ—Б. –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ–Њ–Љ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є ќ±-–У–§–Ф–У (1,42¬±0,02 –£–Х–Р –і–Њ –ї–µ—З–µ–љ–Є—П, 1,86¬±0,04 –£–Х–Р –њ–Њ—Б–ї–µ; p<0,05), –∞ —В–∞–Ї–ґ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –Э–Р–Ф-–і–Є–∞—Д–Њ—А–∞–Ј—Л (1,41¬±0,03 –£–Х–Р –і–Њ –ї–µ—З–µ–љ–Є—П, 1,73¬±0,05 –£–Х–Р –њ–Њ—Б–ї–µ; p<0,05) –Є —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –° (1,39¬±0,02 –£–Х–Р –і–Њ –ї–µ—З–µ–љ–Є—П, 2,44¬±0,06 –£–Х–Р –њ–Њ—Б–ї–µ; p<0,05), –Ї–Њ—В–Њ—А—Л–µ, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ —Г—А–Њ–≤–љ—П –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (—А–Є—Б. 1). –Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ –±–∞–Ј–Є—Б–љ—Г—О —В–µ—А–∞–њ–Є—О, –Ї–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –і–Є–∞–≥—А–∞–Љ–Љ—Л, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–є –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1, —Г—А–Њ–≤–љ–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Є –°–Ф, –Є –°–Э –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —А—П–і–∞ —Б–Є—Б—В–µ–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–Њ–Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≥–ї–Є—Ж–µ—А–Њ—Д–Њ—Б—Д–∞—В–љ–Њ–≥–Њ —И—Г–љ—В–∞ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є —Ж–µ–њ–Є. –°–Њ—З–µ—В–∞–љ–Є–µ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї—О—З–µ–≤—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤–љ—Г—В—А–Є–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л—Е –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ–∞, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П —А–µ–≥—Г–ї—П—В–Њ—А–Њ–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, —Г –±–Њ–ї—М–љ—Л—Е —Б –°–Ф –Є –°–Э –њ—А–Є–≤–Њ–і–Є—В –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є –Љ–Њ–і—Г–ї—П—Ж–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –Ј–≤–µ–љ—М–µ–≤ –≤–љ—Г—В—А–Є–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Н–љ–µ—А–≥–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤ –≤–Є–і–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї—О—З–µ–≤–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –≥–ї–Є—Ж–µ—А–Њ—Д–Њ—Б—Д–∞—В–љ–Њ–≥–Њ —И—Г–љ—В–∞ вАУ ќ±-–У–§–Ф–У –Є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–є —Ж–µ–њ–Є вАУ –Э–Р–Ф-–і–Є–∞—Д–Њ—А–∞–Ј—Л –Є —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –°. –Э–∞–ї–Є—З–Є–µ —Г –њ—А–µ–њ–∞—А–∞—В–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –і–µ–ї–∞–µ—В –µ–≥–Њ –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —Б—А–µ–і—Б—В–≤ –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–Љ —Н–љ–µ—А–≥–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ, –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ—Л–Љ–Є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П—О—В—Б—П –°–Ф –Є –°–Э.
–Т—Л–≤–Њ–і—Л
1. –£ –±–Њ–ї—М–љ—Л—Е –°–Ф 2-–≥–Њ —В–Є–њ–∞ –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –і–Є—Б–±–∞–ї–∞–љ—Б —Б –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≥–ї–Є—Ж–µ—А–Њ—Д–Њ—Б—Д–∞—В–љ–Њ–≥–Њ —И—Г–љ—В–∞, —Б–Є—Б—В–µ–Љ—Л –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П –Є —Ж–Є—В–Њ—Е—А–Њ–Љ–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤, –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є.
2. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ґ–Є–Њ—В—А–Є–∞–Ј–Њ–ї–Є–љ–∞ –њ—А–Є–≤–Њ–і–Є—В –≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї—О—З–µ–≤—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤–љ—Г—В—А–Є–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л—Е –њ—Г—В–µ–є —Н–љ–µ—А–≥–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞.












