–Ш–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —А—П–і—Г —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤: –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–µ–є—Б—В–≤–Є—П, –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М, —Б–њ–Њ—Б–Њ–± –≤—Л–≤–µ–і–µ–љ–Є—П –Є —В.–і. –Ю–і–љ–Є–Љ –Є–Ј –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–≤—И–Є—Е—Б—П –љ–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –Є–Р–Я–§ —П–≤–ї—П–µ—В—Б—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї. –Ю–љ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –і—А—Г–≥–Є—Е –Є–Р–Я–§ –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–µ–є –≤—Л—Б–Њ–Ї–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ –Ї —В–Ї–∞–љ–µ–≤–Њ–є –†–Р–Р–°, –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –±–ї–∞–≥–Њ–і–∞—А—П —В–Њ–Љ—Г (–Ї–∞–Ї –≤—Л—В–µ–Ї–∞–µ—В –Є–Ј –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є), —З—В–Њ –Њ–љ —Б–Њ–і–µ—А–ґ–Є—В SH––≥—А—Г–њ–њ—Г, –Њ–±–ї–∞–і–∞—О—Й—Г—О –њ—А—П–Љ—Л–Љ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Э–∞–ї–Є—З–Є–µ SH––≥—А—Г–њ–њ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ —Б–≤–Њ–є—Б—В–≤–Њ–Љ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Ї–∞–Ї –Є–Р–Я–§, —Б–Њ—З–µ—В–∞—О—Й–µ–≥–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –Р–Я–§ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ —Б–µ—А–і–µ—З–љ–Њ–є —В–Ї–∞–љ–Є. –≠—В–Є –Ї–∞—З–µ—Б—В–≤–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Є –µ–≥–Њ —Г–љ–Є–Ї–∞–ї—М–љ—Л–є –∞–љ—В–Є–Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Љ–Њ–≥—Г—В –Њ–±—К—П—Б–љ—П—В—М —А—П–і –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е.
–С—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ —Г —Б—В—А—Г–Ї—В—Г—А–љ–Њ –±–ї–Є–Ј–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–Я–§––Є–љ–≥–Є–±–Є—А—Г—О—Й–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М in vivo –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В–Є. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П –Є–Р–Я–§ —Б –≤—Л—Б–Њ–Ї–Њ–є –∞—Д—Д–Є–љ–љ–Њ—Б—В—М—О –Ї —В–Ї–∞–љ–µ–≤–Њ–Љ—Г –Р–Я–§ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ.
–Т –љ–µ–і–∞–≤–љ–Њ –≤—Л—И–µ–і—И–µ–Љ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –і–Њ–Ї–ї–∞–і–µ –Њ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –≤–∞–ґ–љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –Р–Я–§ –†–∞–±–Њ—З–∞—П –≥—А—Г–њ–њ–∞ –њ–Њ —В–Ї–∞–љ–µ–≤–Њ–Љ—Г –Р–Я–§ –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–і–ї–Њ–ґ–Є–ї–∞ —Б–ї–µ–і—Г—О—Й—Г—О –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М –Є–Р–Я–§ –њ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Б—А–Њ–і—Б—В–≤–∞: –Ї–≤–Є–љ–∞–њ—А–Є–ї–∞—В = –±–µ–љ–∞–Ј–µ–њ—А–Є–ї–∞—В > —А–∞–Љ–Є–њ—А–Є–ї–∞—В > –њ–µ—А–Є–љ–і–Њ–њ—А–Є–ї–∞—В > –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї > —Н–љ–∞–ї–∞–њ—А–Є–ї–∞—В > —Д–Њ–Ј–Є–љ–Њ–њ—А–Є–ї–∞—В > –Ї–∞–њ—В–Њ–њ—А–Є–ї. –Ю–±–Њ–±—Й–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і–Њ–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є–Р–Я–§ —Б –≤—Л—Б–Њ–Ї–Є–Љ —В–Ї–∞–љ–µ–≤—Л–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Б–Є–љ—В–µ–Ј –Р–Ґ II de novo –Є —Г—Б–Є–ї–Є–≤–∞—В—М –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М NO, –њ–Њ–і—З–µ—А–Ї–Є–≤–∞—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і–љ–Є—Е. –≠—В–Њ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Б–µ –Ї—А—Г–њ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П –Є–Р–Я–§ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –і–ї—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —В–Ї–∞–љ–µ–≤—Л–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ – –љ–∞–њ—А–Є–Љ–µ—А, PROGRESS —Б –њ–µ—А–Є–љ–і–Њ–њ—А–Є–ї–Њ–Љ, HOPE —Б —А–∞–Љ–Є–њ—А–Є–ї–Њ–Љ, EUROPA —Б –њ–µ—А–Є–љ–і–Њ–њ—А–Є–ї–Њ–Љ, QUIET —Б –Ї–≤–Є–љ–∞–њ—А–Є–ї–Њ–Љ, PEACE —Б —В—А–∞–љ–і–Њ–ї–∞–њ—А–Є–ї–Њ–Љ. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤–Њ–њ—А–Њ—Б –Њ —В–Њ–Љ, –Њ–Ј–љ–∞—З–∞–µ—В –ї–Є –≤—Л—Б–Њ–Ї–Њ–µ —В–Ї–∞–љ–µ–≤–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ –Є–Р–Я–§ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞, –і–Њ–ї–ґ–µ–љ –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –Є–Ј—Г—З–∞—В—М—Б—П –≤ –Ї—А—Г–њ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–Ю–і–љ–∞–Ї–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ш–С–° –≤—Л—В–µ–Ї–∞—О—В –Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ш—Б—В–Њ—А–Є—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Р–Я–§ –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є CONSENSUS –Є V–HEFT, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є–Р–Я–§ —Г–ї—Г—З—И–∞—О—В –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э.
–Я–Њ–Ј–і–љ–µ–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є SOLVD –Є SAVE –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –Є–Р–Я–§ –њ–Њ–≤—Л—И–∞—О—В –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц) –±–µ–Ј —П–≤–љ–Њ–є –•–°–Э. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SOLVD –Є SAVE –≤–Љ–µ—Б—В–µ —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ AIRE –Є TRACE –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Р–Я–§, –≤ –Ї–Њ—В–Њ—А—Л—Е —В–µ—А–∞–њ–Є—П –Є–Р–Я–§ –љ–∞—З–Є–љ–∞–ї–∞—Б—М —З–µ—А–µ–Ј 2–14 –і–љ–µ–є –Њ—В —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –Є –љ–∞–±–ї—О–і–µ–љ–Є–µ –≤ —Б—А–µ–і–љ–µ–Љ –њ—А–µ–≤—Л—И–∞–ї–Њ 2,8 –≥–Њ–і–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В–∞–Ї–ґ–µ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Р–Я–§. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ GISSI–3, ISIS–4 –Є CCS, –≤ –Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–µ–Ј —П–≤–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –±—Л–ї–Є (–±–Њ–ї–µ–µ –Є–ї–Є –Љ–µ–љ–µ–µ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ) —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є–Р–Я–§ –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –≤ –њ–µ—А–≤—Л–µ 24–36 —З –њ–Њ—Б–ї–µ —А–∞–Ј–≤–Є—В–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ш–Ь. –Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї —Г–Љ–µ—А–µ–љ–љ–Њ–µ, –Њ–і–љ–∞–Ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ 30––і–љ–µ–≤–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ –Ш–Ь. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ–ґ–Є–і–∞–µ–Љ–Њ–≥–Њ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Р–Я–§ –Ј–∞ —Б—З–µ—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ–Њ–є –і–Є–ї–∞—В–∞—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ (>80%) –і–Њ—Б—В–Є–≥–∞–ї—Б—П –≤ –њ–µ—А–≤—Г—О –љ–µ–і–µ–ї—О –Њ—В —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь. –≠—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ —В–Њ–Љ, —З—В–Њ –њ–Њ–ї—М–Ј–∞ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–µ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Њ–і–љ–Є–Љ –Є–Ј –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤ –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–∞ –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —А–µ–ґ–Є–Љ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е –Є —Б–њ–Њ—Б–Њ–±–∞—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—П. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CONSENSUS–II –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –љ–∞—З–∞–ї—М–љ–Њ–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞. –Ф–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ, —Е–Њ—В—П –Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є. –≠—В–Њ –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —Г—З–∞—Й–µ–љ–Є–µ–Љ —А–∞–љ–љ–µ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є, –Ш–Ь –Є –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –Є –≤ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Е–Њ—В—П —А–∞–љ–љ–Є–є —А–∞–Ј—А—Л–≤ –Љ–Є–Њ–Ї–∞—А–і–∞ –Љ–Њ–ґ–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М—Б—П (–Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П), –љ–Њ —З–∞—Б—В–Њ—В–∞ –Ш–Ь, –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П (–Њ—В—А–∞–ґ–∞—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞). –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GISSI–3 —З–Є—Б–ї–Њ —Б–њ–∞—Б–µ–љ–љ—Л—Е –ґ–Є–Ј–љ–µ–є —З–µ—А–µ–Ј 42 –і–љ—П – 8 –љ–∞ 1000 —З–µ–ї–Њ–≤–µ–Ї —Г–Љ–µ–љ—М—И–∞–ї–Њ—Б—М –і–Њ 4 —З–µ—А–µ–Ј 6 –Љ–µ—Б—П—Ж–µ–≤.
–Ъ–∞–Ї –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –љ–Є–ґ–µ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SMILE —Б –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–Њ–Љ –і–Њ–њ–Њ–ї–љ–Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤—Л—И–µ—Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SMILE–I –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ –њ–Њ–ї—М–Ј—Г —А–∞–љ–љ–µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ш–Ь, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Р–Я–§, –љ–Њ –Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –Њ—В–і–∞–ї–µ–љ–љ—Л–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —А–∞–љ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –њ–Њ—Б–ї–µ –Ю–Ш–Ь, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –ї–µ–≥–ї–Є –≤ –Њ—Б–љ–Њ–≤—Г –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Є –і–Є–Ј–∞–є–љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –Є–Р–Я–§, –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –±–µ–Ј —А–µ–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е —Б—Е–Њ–і–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, SMILE–I –≤–Ї–ї—О—З–∞–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ—Б—П –њ–Њ–і—К–µ–Љ–Њ–Љ —Б–µ–≥–Љ–µ–љ—В–∞ ST, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ –≤—Л–њ–Њ–ї–љ—П–ї—Б—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б. –£ —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–ґ–Є–і–∞–ї—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–є —А–Є—Б–Ї (–Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–і–∞–≤–љ–Њ —А–µ–њ–µ—А—Д—Г–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є, —Б–њ–Њ—Б–Њ–±–љ–Њ–є –≤–љ–Њ–≤—М –Њ–Ї–Ї–ї—О–Ј–Є—А–Њ–≤–∞—В—М—Б—П). –І—В–Њ–±—Л –Њ–±–Њ—Б–љ–Њ–≤–∞—В—М —А–∞–љ–љ–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§, –±—Л–ї–∞ –≤—Л–і–≤–Є–љ—Г—В–∞ –≥–Є–њ–Њ—В–µ–Ј–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, –∞ —В–∞–Ї–ґ–µ –±—Л—Б—В—А–Њ–є –±–ї–Њ–Ї–∞–і—Л –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є. –° —Г—З–µ—В–Њ–Љ —Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –≤—Л—И–µ –Ї—А–∞—В–Ї–Њ– –Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–Р–Я–§ —Б—В–∞–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—А–∞–њ–Є–Є —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Ш–Ь (–≤–Љ–µ—Б—В–Њ –Њ—В—Б—А–Њ—З–Ї–Є —В–µ—А–∞–њ–Є–Є –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤–Њ–Ј–љ–Є–Ї —А—П–і –≤–Њ–њ—А–Њ—Б–Њ–≤ –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є: –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є—П —П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤–∞–ґ–љ—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Є–Р–Я–§. –Ґ–∞–Ї –Ї–∞–Ї –і–ї–Є—В–µ–ї—М–љ–Њ–µ —З—А–µ–Ј–Љ–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ–µ—А—Д—Г–Ј–Є–Є –Є —Д—Г–љ–Ї—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞, —Н—В–Њ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П —Б–µ—А—М–µ–Ј–љ—Л–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ –≤ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј–µ –Ш–Ь.
–Я—А–Є –њ–µ—А–µ—Е–Њ–і–µ –Њ—В –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –ї–Є—Ж–∞ —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц, –Ї –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В –≥—А—Г–њ–њ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –Ї –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –≤—Л–±–Њ—А–Ї–∞–Љ –±–Њ–ї—М–љ—Л—Е —Б –Ш–Ь. –Т —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Н—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О —А—П–і–∞ –≤–Њ–њ—А–Њ—Б–Њ–≤: –Ї–Њ–≥–Њ –Є–Љ–µ–љ–љ–Њ –ї–µ—З–Є—В—М, –Ї–∞–Ї –і–Њ–ї–≥–Њ –Є –Ї–∞–Ї —А–∞–љ–Њ –љ–∞—З–Є–љ–∞—В—М –њ—А–Є–µ–Љ –Є–Р–Я–§. –Ю–њ–Є—Б–∞–љ–љ—Л–µ –љ–Є–ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Њ–µ–Ї—В SMILE —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞, –Њ—В—З–∞—Б—В–Є —Г–Љ–µ–љ—М—И–∞—О—В —А–∞–Ј—А—Л–≤ –Љ–µ–ґ–і—Г —А–∞–љ–µ–µ —Г–њ–Њ–Љ—П–љ—Г—В—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є, –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П—П —Ж–µ–љ–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞–љ–љ–µ–≥–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ш–Ь –Є —Г—В–Њ—З–љ—П—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –Ї—А–∞—В–Ї–Њ– –Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –њ–Њ–і–Њ–±–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Я—А–Њ–µ–Ї—В SMILE —П–≤–Є–ї—Б—П –Ї—А—Г–њ–љ–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ–Њ–є –њ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О —А–Њ–ї–Є –Є–Р–Я–§, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞, –≤ –ї–µ—З–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ш–Ь. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Њ–µ–Ї—В SMILE –≤–Ї–ї—О—З–∞–ї —Б–µ—А–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ш–Ь, —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —А—П–і–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ–µ—З–љ—Л—Е —В–Њ—З–µ–Ї –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е, –≥–Є–њ–Њ—В–µ–Ј–∞ –Њ —В–Њ–Љ, —З—В–Њ –Њ—Б–Њ–±—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Ї–∞–Ї –Є–Р–Я–§ –Љ–Њ–≥—Г—В –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ, –њ–Њ–Љ–Є–Љ–Њ –Є –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—О –Р–Я–§, –±—Л–ї–∞ —Г—З—В–µ–љ–∞ –≤ –і–Є–Ј–∞–є–љ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Я–µ—А–≤—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ш–Ь –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –≤ –њ–Є–ї–Њ—В–љ–Њ–Љ –Є—Б–њ—Л—В–∞–љ–Є–Є SMILE, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–Љ –љ–∞ –Є–Ј—Г—З–µ–љ–Є–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–Љ –љ–∞ 200 –њ–∞—Ж–Є–µ–љ—В–∞—Е —Б –Ю–Ш–Ь, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б. –≠—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ –≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј–µ –Ш–Ь. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Є–ї–Њ—В–љ–Њ–≥–Њ –Є—Б–њ—Л—В–∞–љ–Є—П SMILE —Б–і–µ–ї–∞–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є–є –њ–Њ –Њ—Ж–µ–љ–Ї–µ –≤–ї–Є—П–љ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –љ–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Г—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SMILE–I –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ —Б —Ж–µ–ї—М—О –Є–Ј—Г—З–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ш–Ь. –≠—В–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б–њ—Л—В–∞–љ–Є–µ –≤–Ї–ї—О—З–Є–ї–Њ 1556 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —Б –Ю–Ш–Ь –њ–µ—А–µ–і–љ–µ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ –±—Л–ї –њ–Њ–Ї–∞–Ј–∞–љ —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б. –Я–∞—Ж–Є–µ–љ—В—Л –Њ–±–Њ–µ–≥–Њ –њ–Њ–ї–∞, –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18–80 –ї–µ—В —Б—З–Є—В–∞–ї–Є—Б—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П, –µ—Б–ї–Є –Њ–љ–Є –њ–Њ—Б—В—Г–њ–∞–ї–Є –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –њ–µ—А–≤—Л–µ 24 —З –Њ—В —А–∞–Ј–≤–Є—В–Є—П —В–Є–њ–Є—З–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –±–Њ–ї–Є –≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–µ, –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ–Љ–Њ–≥–Њ —Б —З–µ—В–Ї–Є–Љ–Є —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –њ–µ—А–µ–і–љ–µ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞, –Є –љ–µ –њ–Њ–і–ї–µ–ґ–∞–ї–Є —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б—Г –Є–Ј––Ј–∞ –њ–Њ–Ј–і–љ–µ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–ї–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї —Б–Є—Б—В–µ–Љ–љ–Њ–Љ—Г —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј—Г. –°–∞–Љ—Л–Љ –≤–∞–ґ–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –•–°–Э, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є–є –њ—А–Є–µ–Љ –Є–Р–Я–§ –Є–ї–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Є–Р–Я–§. –Я–∞—Ж–Є–µ–љ—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ—А–Є–µ–Љ–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (7,5 –Љ–≥/—Б—Г—В., n=772) –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ (n=784) –≤ –њ–µ—А–≤—Л–µ 24 —З –Њ—В —А–∞–Ј–≤–Є—В–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Ф–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–∞—Б—М –Ї–∞–ґ–і—Л–µ 48 —З –і–Њ 15–30 –Љ–≥ –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є, —З—В–Њ —Г—А–Њ–≤–µ–љ—М —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –љ–µ –њ—А–µ–≤—Л—И–∞–ї 100 –Љ–Љ —А—В.—Б—В. –Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є. –Я–∞—Ж–Є–µ–љ—В—Л —Б –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –і–Њ–Ј—Л 7,5 –Љ–≥ –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ґ–µ—А–∞–њ–Є—П –і–ї–Є–ї–∞—Б—М 6 –љ–µ–і–µ–ї—М, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–µ–Ї—А–∞—Й–∞–ї–Є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, –љ–Њ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й—Г—О —В–µ—А–∞–њ–Є—О –≤ —Б—А–µ–і–љ–µ–Љ –µ—Й–µ 48±4 –љ–µ–і–µ–ї—М. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —Б–ї–µ–њ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –љ–∞–ї–Є—З–Є–µ –•–°–Э.
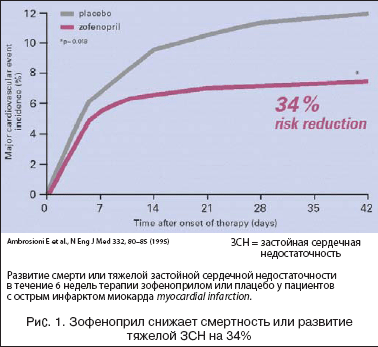
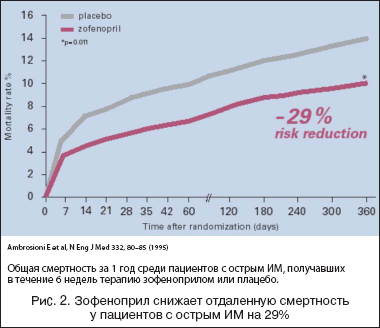
–Ю—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SMILE–I –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Є–µ 6––љ–µ–і–µ–ї—М–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —З–∞—Б—В–Њ—В—Г —Б–Љ–µ—А—В–Є –њ—А–Є —В—П–ґ–µ–ї–Њ–є –•–°–Э. –Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–Њ–є –≤—В–Њ—А–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –±—Л–ї–∞ –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —З–µ—А–µ–Ј 12 –Љ–µ—Б—П—Ж–µ–≤. –І–∞—Б—В–Њ—В–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є (—Б–Љ–µ—А—В—М –Є–ї–Є —В—П–ґ–µ–ї–∞—П –•–°–Э) —З–µ—А–µ–Ј 6 –љ–µ–і–µ–ї—М –њ–Њ—Б–ї–µ –Ш–Ь –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–∞—Е –њ–ї–∞—Ж–µ–±–Њ –Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (10,6% –њ—А–Њ—В–Є–≤ 7,1% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; —А=0,018), —З—В–Њ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (–°–Ю–†) –љ–∞ 34% –њ—А–Є –њ—А–Є–µ–Љ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (—А–Є—Б. 1). –≠—В–Њ –±—Л–ї–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л —В—П–ґ–µ–ї–Њ–є –•–°–Э (—Б–љ–Є–ґ–µ–љ–Є–µ –Ю–† 46%, —А=0,018). –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤ –њ–µ—А–≤—Г—О —Д–∞–Ј—Г –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є, –∞ –љ–µ —А–∞—Б–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –ї–µ—З–µ–љ–Є—П. –Т –њ–µ—А–≤—Л–µ 24 —З –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є —Г–Љ–µ—А –Њ–і–Є–љ –њ–∞—Ж–Є–µ–љ—В –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Є 8 –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ (—Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є –љ–∞ 90%). –І–µ—А–µ–Ј 48 —З –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є —Г–Љ–µ—А–ї–Є 9 –њ—А–Њ—В–Є–≤ 21 –њ–∞—Ж–Є–µ–љ—В–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є –љ–∞ 56%). –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤—В–Њ—А–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є, –≥–Њ–і–Є—З–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –њ–∞—Ж–Є–µ–љ—В—Л, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і–µ–ї—М, –≤—Л–ґ–Є–≤–∞–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ, —З–µ–Љ –±–Њ–ї—М–љ—Л–µ, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ –њ–ї–∞—Ж–µ–±–Њ. –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –і–Њ—Б—В–Є–≥–∞–ї–Є 14,1% –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ –Є 10,0% –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞: –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є –љ–∞ 29% (—А–Є—Б. 2).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В–µ—А–∞–њ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–Њ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–ї—Г—З—И–∞–ї–∞ –Ї–∞–Ї –Ї—А–∞—В–Ї–Њ–, —В–∞–Ї –Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л–µ –Є—Б—Е–Њ–і—Л –њ—А–Є –љ–∞—З–∞–ї–µ —В–µ—А–∞–њ–Є–Є –≤ –њ–µ—А–≤—Л–µ 24 —З –Њ—В —А–∞–Ј–≤–Є—В–Є—П –њ–µ—А–µ–і–љ–µ–≥–Њ –Ю–Ш–Ь –Є –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–Є –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і–µ–ї—М.
–Т –њ–Њ–і–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE–I –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –±—Л–ї–∞ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—П —З–∞—Б—В–Њ—В—Л –•–°–Э – –Њ—В —Б–ї–∞–±–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–Њ —В—П–ґ–µ–ї–Њ–є. –Т —Н—В–Њ –њ–Њ–і–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Є 1146 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ш–Ь, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ –≤—Л–њ–Њ–ї–љ—П–ї—Б—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б, —Б –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –ї–Є—Ж —Б –•–°–Э –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –•–°–Э –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є. –Я–∞—Ж–Є–µ–љ—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ 6––љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–Њ–Љ –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ, –Ї–∞–Ї –Њ–њ–Є—Б–∞–љ–Њ –≤—Л—И–µ. –І–µ—А–µ–Ј 6 –љ–µ–і–µ–ї—М –Є 1 –≥–Њ–і –Њ—В —А–∞–Ј–≤–Є—В–Є—П –Ю–Ш–Ь –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М —З–∞—Б—В–Њ—В–∞ –•–°–Э, –Њ—В —Б–ї–∞–±–Њ –Є —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–Њ —В—П–ґ–µ–ї–Њ–є. –Ю–±—Й–∞—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –•–°–Э –љ–µ —Б–љ–Є–ґ–∞–ї–∞—Б—М –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ–ї–∞—Ж–µ–±–Њ –Ї–∞–Ї —З–µ—А–µ–Ј 6 –љ–µ–і–µ–ї—М, —В–∞–Ї –Є —З–µ—А–µ–Ј 12 –Љ–µ—Б—П—Ж–µ–≤. –Э–∞–њ—А–Њ—В–Є–≤, —З–∞—Б—В–Њ—В–∞ —В—П–ґ–µ–ї–Њ–є –•–°–Э (1,6% –њ—А–Њ—В–Є–≤ 2,6%, –°–Ю–† 55,5%, —А=0,0325) –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —З–∞—Б—В–Њ—В—Л —Б–Љ–µ—А—В–Є –Є–ї–Є —В—П–ґ–µ–ї–Њ–є –•–°–Э (4,8% –њ—А–Њ—В–Є–≤ 8,2%, –°–Ю–† 59%, —А=0,024) —Г–Љ–µ–љ—М—И–∞–ї–Є—Б—М –њ—А–Є 6––љ–µ–і–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –і–Њ–ї—П –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –•–°–Э –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –і–Њ —В—П–ґ–µ–ї–Њ–є –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (11,0% –њ—А–Њ—В–Є–≤ 24,3%, —А=0,001).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ю–Ш–Ь –Њ—Б–ї–∞–±–ї—П–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –•–°–Э –Є –µ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є.
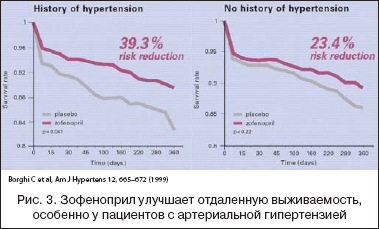
–Т—Л—И–µ—Г–њ–Њ–Љ—П–љ—Г—В—Л–µ —Н—Д—Д–µ–Ї—В—Л –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –≤ —А—П–і–µ –њ–Њ–і–≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ – –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Г –±–Њ–ї—М–љ—Л—Е —Б –Р–У, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ, –Ш–Ь –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є–ї–Є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–µ–є. –Ґ–∞–Ї, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В —В–µ—А–∞–њ–Є–Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–Њ–Љ –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї–Є—Ж–∞–Љ–Є —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ. –°—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ SMILE –Є –Ј–љ–∞–≤—И–Є—Е –Њ —Б–≤–Њ–µ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —Г 39,2% –Є–Љ–µ–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ. –Я–Њ—Б–ї–µ 6 –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –Є–ї–Є —В—П–ґ–µ–ї–Њ–є –•–°–Э —Б–љ–Є–ґ–∞–ї—Б—П –љ–∞ 40% (2—А<0,05) –≤ –≥—А—Г–њ–њ–µ –≥–Є–њ–µ—А—В–Њ–љ–Є–Ї–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї. –Т —В–Њ–є –ґ–µ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –≥–Њ–і–Є—З–љ—Л–є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є —Б–љ–Є–ґ–∞–ї—Б—П –љ–∞ 39% (2—А<0,05). –С–Њ–ї–µ–µ —В–Њ–≥–Њ, 6––љ–µ–і–µ–ї—М–љ–∞—П —З–∞—Б—В–Њ—В–∞ —Б–ї–∞–±–Њ –Є —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –•–°–Э —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –Р–У –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї–∞—Б—М –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (14,1% –њ—А–Њ—В–Є–≤ 9,4% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; 2—А<0,05) (—А–Є—Б. 3).
–≠—Д—Д–µ–Ї—В –ї–µ—З–µ–љ–Є—П –≤ –Ї–Њ–≥–Њ—А—В–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф (20%) —В–∞–Ї–ґ–µ –±—Л–ї –ї—Г—З—И–µ, —З–µ–Љ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–µ–Ј –і–Є–∞–±–µ—В–∞. –Р–±—Б–Њ–ї—О—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Б–Њ–±—Л—В–Є–є, –љ–∞–±–ї—О–і–∞–≤—И–µ–µ—Б—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE, –±—Л–ї–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ —Б —В–∞–Ї–Њ–≤—Л–Љ –≤ –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П GISSI–3, –≥–і–µ —А–∞–Ј–ї–Є—З–Є—П –і–Њ—Б—В–Є–≥–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї—М–Ј–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–∞—Б—М —Г –±–Њ–ї—М–љ—Л—Е —Б–Њ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–µ–є –Є–ї–Є —Б –Ш–Ь –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE–I —З–∞—Б—В–Њ—В–∞ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј––Ј–∞ —В—П–ґ–µ–ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є (–°–Р–Ф<90 –Љ–Љ —А—В.—Б—В.), –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ—В–∞ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–µ—А–≤–Њ–є –і–Њ–Ј—Л –±—Л–ї–Є —Б—Е–Њ–і–љ—Л–Љ–Є –≤ –≥—А—Г–њ–њ–∞—Е –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (3,8% –њ—А–Њ—В–Є–≤ 2,7%) –Є –њ–ї–∞—Ж–µ–±–Њ (0,6% –њ—А–Њ—В–Є–≤ 0,3%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –°—А–µ–і–Є –і—А—Г–≥–Є—Е —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —В—П–ґ–µ–ї–∞—П –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Г 1 –±–Њ–ї—М–љ–Њ–≥–Њ (–њ—А–Њ—В–Є–≤ 0), –Є —В—П–ґ–µ–ї—Л–є –Ї–∞—И–µ–ї—М —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—В–Є–≤ 1 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –•–Њ—А–Њ—И–Є–є –њ—А–Њ—Д–Є–ї—М –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–Њ–Љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE–I –±—Л–ї –±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ –Є–Ј—Г—З–µ–љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE–II. –Ю—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –±—Л–ї–Њ —Б—А–∞–≤–љ–µ–љ–Є–µ –і–≤—Г—Е –Є–Р–Я–§ (–Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–∞) –Є –Њ—Ж–µ–љ–Ї–∞ –Є—Е –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ш–Ь, –њ–µ—А–µ–љ–µ—Б—И–Є—Е —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SMILE–II –≤–Њ—И–ї–Є 1024 –њ–µ—А–µ–љ–µ—Б—И–Є—Е —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б (<12 —З –Њ—В —А–∞–Ј–≤–Є—В–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤) –±–Њ–ї—М–љ—Л—Е —Б –Ш–Ь. –Ю—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –±—Л–ї–Њ —Б—А–∞–≤–љ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є —В—П–ґ–µ–ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є (–°–Р–Ф<90 –Љ–Љ —А—В.—Б—В.) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–Є–Ј–∞–є–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ, –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ) –ї–Є–±–Њ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї (–љ–∞—З–Є–љ–∞—П —Б –і–Њ–Ј—Л 7,5 –Љ–≥ –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є), –ї–Є–±–Њ –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї (–љ–∞—З–Є–љ–∞—П —Б –і–Њ–Ј—Л 2,5 –Љ–≥, –њ–ї—О—Б –Њ–і–љ–∞ —В–∞–±–ї–µ—В–Ї–∞ –њ–ї–∞—Ж–µ–±–Њ) –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –≤ –њ–µ—А–≤—Л–µ 90 –Љ–Є–љ—Г—В – 12 —З –Њ—В –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б–∞. –І–µ—А–µ–Ј 2 –і–љ—П –і–Њ–Ј—Л —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Є—Б—М (–Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї – 15 –Љ–≥ –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є; –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї – 10 –Љ–≥, –њ–ї—О—Б –Њ–і–љ–∞ —В–∞–±–ї–µ—В–Ї–∞ –њ–ї–∞—Ж–µ–±–Њ). –° 5 –њ–Њ 42 –і–µ–љ—М –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ—Л–µ –і–Њ–Ј—Л (–Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї – 30 –Љ–≥ –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є, –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї – 10 –Љ–≥, –њ–ї—О—Б –Њ–і–љ–∞ —В–∞–±–ї–µ—В–Ї–∞ –њ–ї–∞—Ж–µ–±–Њ). –Я–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї 6 –љ–µ–і–µ–ї—М. –Я–Њ –Є—Б—В–µ—З–µ–љ–Є–Є —Н—В–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Њ–±—Й–∞—П —З–∞—Б—В–Њ—В–∞ —В—П–ґ–µ–ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–∞ (10,9% –њ—А–Њ—В–Є–≤ 11,7% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; —А=0,38), —В–∞–Ї–ґ–µ –Ї–∞–Ї –Є —З–∞—Б—В–Њ—В–∞ —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є —В—П–ґ–µ–ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є (–њ–µ—А–≤–Є—З–љ–∞—П –Ї–Њ–љ–µ—З–љ–∞—П —В–Њ—З–Ї–∞) (6,7% –њ—А–Њ—В–Є–≤ 9,8% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; 2—А=0,048). –Э–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –ї–µ—З–µ–љ–Є—П –њ–Њ –≤—В–Њ—А–Є—З–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є (—Б–Љ–µ—А—В—М, —З–∞—Б—В–Њ—В–∞ —В—П–ґ–µ–ї–Њ–є –•–°–Э, 6––љ–µ–і–µ–ї—М–љ–∞—П —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –Ы–Ц, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —Н–Ї—Б—В—А–µ–љ–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є, –і–Њ–ї—П –ї–Є—Ж —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї).
–°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї–∞–Ї –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї, —В–∞–Ї –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї –±—Л–ї–Є –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Љ–µ—А–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ–Є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ–Њ —Б—Е–µ–Љ–µ —В–Є—В—А–∞—Ж–Є–Є –і–Њ–Ј—Л –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ю–Ш–Ь, –њ–µ—А–µ–љ–µ—Б—И–Є–Љ —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б.
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMILE–II —Б–љ–Є–ґ–µ–љ–Є–µ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–і–µ–љ—М 1) –±—Л–ї–Њ –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ш–Ь, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–Њ–ї—Г—З–∞–≤—И–Є–Љ–Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї, 6––љ–µ–і–µ–ї—М–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–∞ (4,0% –њ—А–Њ—В–Є–≤ 3,2% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —А=0,38). –•–Њ—В—П —Н—В–Є —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –Є –Њ–±–ї–∞–і–∞–ї–Є –ї–Є—И—М –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М—О, —Н—В–Њ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В –≤–∞–ґ–љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –Њ–±–Њ–Є–Љ–Є –≤–Є–і–∞–Љ–Є —В–µ—А–∞–њ–Є–Є –Љ–Њ–≥—Г—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —Б–Ї–Њ—А–Њ—Б—В—М—О –љ–∞—З–∞–ї–∞ –і–µ–є—Б—В–≤–Є—П – –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–∞ –≤ –∞–Ї—В–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Њ—В—А–∞–ґ–∞–µ—В —А–∞–Ј–ї–Є—З–Є—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Д–Є–ї–µ–є –Њ–±–Њ–Є—Е –Є–Р–Я–§ (–ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї – –∞–Ї—В–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В, –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї – –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ, –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞—В). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї–∞–Ї –Њ–±—Б—Г–ґ–і–∞–ї–Њ—Б—М —А–∞–љ–µ–µ, –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї (—Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О) –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –і–µ–є—Б—В–≤—Г–µ—В –љ–∞ —Г—А–Њ–≤–љ–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —В–Ї–∞–љ–Є (—В.–µ. —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ—П–≥–Ї–Є–Љ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ), –∞ –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї (—Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≥–Є–і—А–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О) –±–Њ–ї—М—И–µ –≤–ї–Є—П–µ—В –љ–∞ –†–Р–° –љ–∞ —Г—А–Њ–≤–љ–µ —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤ —Ж–µ–ї–Њ–Љ —З–∞—Б—В–Њ—В–∞ —В—П–ґ–µ–ї–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–Є –њ–Њ—Б–ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Р–Я–§ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ь, –њ–µ—А–µ–љ–µ—Б—И–Є—Е —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б, –Њ—Б—В–∞–µ—В—Б—П –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–∞, —Б —Г—З–µ—В–Њ–Љ —А–Є—Б–Ї–∞ —А–µ–Њ–Ї–Ї–ї—О–Ј–Є–Є –∞—А—В–µ—А–Є–є –Є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –њ—А–Њ–і–Њ–ї–ґ–∞—О—В—Б—П. –Э–µ —В–∞–Ї –і–∞–≤–љ–Њ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б–њ—Л—В–∞–љ–Є—П SMILE–III, –Ї–Њ—В–Њ—А–Њ–µ –±—Л–ї–Њ –љ–∞—З–∞—В–Њ —Б —Ж–µ–ї—М—О –Є–Ј—Г—З–µ–љ–Є—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є —А–Њ–ї–Є –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Ї–∞–Ї –∞–љ—В–Є–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –≠—В–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б —Г—З–∞—Б—В–Є–µ–Љ 349 –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ш–Ь –Є —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –≤—Л—И–µ 40%. –Я–∞—Ж–Є–µ–љ—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ—А–Є–µ–Љ–∞ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ (30–60 –Љ–≥/—Б—Г—В., n=177) –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ (n=172), –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б—П—Ж–µ–≤ –Њ—В —А–∞–Ј–≤–Є—В–Є—П –Ю–Ш–Ь –Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б–∞, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–≤–Њ–є–љ—Л–Љ —Б–ї–µ–њ—Л–Љ –і–Є–Ј–∞–є–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –Є–Р–Я–§ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц. –Я–µ—А–≤–Є—З–љ—Л–Љ–Є –Ї–Њ–љ–µ—З–љ—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є –±—Л–ї–Є 6––Љ–µ—Б—П—З–љ–∞—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —З–∞—Б—В–Њ—В–∞ –≤–њ–µ—А–≤—Л–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–∞ –≠–Ъ–У, –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л ST–T –њ—А–Є 48–—З–∞—Б–Њ–≤–Њ–Љ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–Љ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–Є –≠–Ъ–У, –њ–Њ–≤—В–Њ—А–љ—Л–є –Ш–Ь, –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є. –Т—В–Њ—А–Є—З–љ—Л–Љ–Є –Ї–Њ–љ–µ—З–љ—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є –±—Л–ї–Є 6––Љ–µ—Б—П—З–љ–∞—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М, –њ–µ—А–≤–Є—З–љ–Њ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ–Њ–є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є –≠–Ъ–У––Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г —Б –љ–∞–≥—А—Г–Ј–Ї–Њ–є, —З–∞—Б—В–Њ—В–∞ –•–°–Э (–Ї–ї–∞—Б—Б II–IV –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є New York Heart Association). –Т —Ж–µ–ї–Њ–Љ 15 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є –Є—Б–Ї–ї—О—З–µ–љ—Л –Є–Ј––Ј–∞ –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ –ї–Є–±–Њ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т –∞–љ–∞–ї–Є–Ј –≤–Њ—И–ї–Є –і–∞–љ–љ—Л–µ 167 —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Є–Ј –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –ї–µ—З–µ–љ–Є—П. –Т –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –њ–µ—А–≤–Є—З–љ–∞—П –Ї–Њ–љ–µ—З–љ–∞—П —В–Њ—З–Ї–∞ —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є—Б—М –≤ 20,3% —Б–ї—Г—З–∞–µ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 35,9% –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ (2—А=0,001), –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є–є –≤ –Ї–Њ–љ—В—А–Њ–ї–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц –Є —В–µ—А–∞–њ–Є–Є. –Ф–µ–њ—А–µ—Б—Б–Є—П ST –њ—А–Є –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є –Ј–∞–њ–Є—Б–Є –≠–Ъ–У –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Г 10,7% –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–∞—Е –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –њ—А–Њ—В–Є–≤ 22,2% (2—А=0,027) –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ–Є–Ї–Њ–≤–Њ–є –і–µ–њ—А–µ—Б—Б–Є–Є ST –Є –µ–µ —Б—А–µ–і–љ–µ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –ґ–∞–ї–Њ–≤–∞–ї–Є—Б—М –љ–∞ –∞–љ–≥–Є–љ–Њ–Ј–љ—Г—О –±–Њ–ї—М –≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–µ (4,7% –њ—А–Њ—В–Є–≤ 14,3%, 2—А=0,024) –Є –∞—А–Є—В–Љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ (3,8% –њ—А–Њ—В–Є–≤ 10,5%, —А=0,048) –њ—А–Є –њ—А–Њ–±–µ —Б –љ–∞–≥—А—Г–Ј–Ї–Њ–є, —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤—А–µ–Љ–µ–љ–Є –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –і–µ–њ—А–µ—Б—Б–Є–Є ST –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ–Є–Ї–Њ–≤–Њ–є –і–µ–њ—А–µ—Б—Б–Є–Є ST. –Ю—Б–љ–Њ–≤–љ—Л–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П –±—Л–ї–Є —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –Љ–µ–ґ–і—Г –Њ–±–µ–Є–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є, —Б –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–Њ–є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э –≤ –≥—А—Г–њ–њ–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ—Л—В–∞–љ–Є—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—В –≥–Є–њ–Њ—В–µ–Ј—Г –Њ–± –∞–љ—В–Є–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ —Н—Д—Д–µ–Ї—В–µ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –њ–Њ—Б–ї–µ –Ю–Ш–Ь.
–Р–љ—В–Є–Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ —В–∞–Ї–ґ–µ –Є–Ј—Г—З–∞–µ—В—Б—П –≤ –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–Љ—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ZAAMIS. –≠—В–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –і–Є–Ј–∞–є–љ–∞ «2 —Е 2», –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ—Б–ї–µ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–≥–Њ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–І–Ъ–Т) –њ–Њ –њ–Њ–≤–Њ–і—Г –≤–њ–µ—А–≤—Л–µ —А–∞–Ј–≤–Є–≤—И–µ–≥–Њ—Б—П –њ–µ—А–µ–і–љ–µ–≥–Њ –Ш–Ь –њ–Њ–ї—Г—З–∞—О—В –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї –ї–Є–±–Њ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї, –љ–∞—З–Є–љ–∞—П –≤ –њ–µ—А–≤—Л–µ 6 —З –ї–Є–±–Њ —З–µ—А–µ–Ј 24–48 —З –њ–Њ—Б–ї–µ –І–Ъ–Т. –° —Г—З–µ—В–Њ–Љ –≤–∞–ґ–љ–Њ–є —А–Њ–ї–Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ –≤ —А–∞–Ј–≤–Є—В–Є–Є —А–µ–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ–Њ–≥–Њ –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ—А–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ш–Ь. –Я–µ—А–≤–Є—З–љ–Њ–є —Ж–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ZAAMIS —П–≤–ї—П–µ—В—Б—П —Б—А–∞–≤–љ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–∞ –љ–∞ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б —Г —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е. –Т—В–Њ—А–Є—З–љ—Л–Љ–Є —Ж–µ–ї—П–Љ–Є —П–≤–ї—П—О—В—Б—П —Б—А–∞–≤–љ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ —А–∞–љ–љ–µ–≥–Њ –Є –њ–Њ–Ј–і–љ–µ–≥–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –љ–∞ –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ—Л –Є –Љ–∞—А–Ї–µ—А—Л –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –∞ —В–∞–Ї–ґ–µ —Б—А–∞–≤–љ–µ–љ–Є–µ –≤–ї–Є—П–љ–Є—П –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞ –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Ы–Ц –Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, ZAAMIS —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–µ–Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–∞–њ—А—П–Љ—Г—О —Б—А–∞–≤–љ–Є–≤–∞—О—Й–Є—Е –і–≤–∞ –Є–Р–Я–§ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Д–Є–ї—П–Љ–Є. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–Њ–≥—Г—В –њ—А–µ–і–Њ—Б—В–∞–≤–Є—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ–Њ–і–і–µ—А–ґ–Ї—Г –≥–Є–њ–Њ—В–µ–Ј—Л –Њ —В–Њ–Љ, —З—В–Њ —А–∞–Ј–ї–Є—З–љ–∞—П —В–Ї–∞–љ–µ–≤–∞—П –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Г –Њ—В–і–µ–ї—М–љ—Л—Е –Є–Р–Я–§ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М —А–∞–Ј–ї–Є—З–љ—Г—О –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —В–µ—А–∞–њ–Є–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 30 –ї–µ—В –Ї—А—Г–њ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П –Є–Р–Я–§ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –Њ–±–ї–∞–і–∞—О—В –≤–∞–ґ–љ—Л–Љ–Є –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –Є–Ј–Љ–µ–љ–Є—В—М –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Р–Я–§. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —Н—В–∞–њ–∞—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞ –°–°–Ч, –≤–Ї–ї—О—З–∞—П –Ш–С–° –Є –Ю–Ш–Ь. –Т —Н—В–Њ–Љ —Б–њ–µ–Ї—В—А–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SMILE —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї–∞, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–Ї–∞–Ј–∞–ї–Є –Ї—А–∞—В–Ї–Њ– –Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —А–∞–љ–љ–µ–≥–Њ –љ–∞—З–∞–ї–∞ (<24 —З) —В–µ—А–∞–њ–Є–Є –Є–Р–Я–§ —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ш–Ь –Є —Е–Њ—А–Њ—И–Є–Љ –њ—А–Њ—Д–Є–ї–µ–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –≤ –њ–Њ–і–≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Г –ї–Є—Ж —Б –≥–Є–њ–µ—А—В–Њ–љ–Є–µ–є –Є–ї–Є —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Ј–Њ—Д–µ–љ–Њ–њ—А–Є–ї –і–ї—П —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –ї–Є—Ж —Б –Ш–С–° (–Ш–Ь).