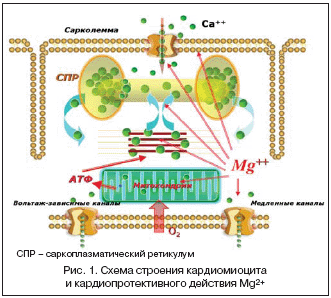
Среди катионов, присутствующих в организме человека, магний (Mg2+) по концентрации занимает четвертое место, а в клетке – второе среди других катионов (натрий, калий, кальций). Магний вместе с 11 основными структурными неорганическими химическими элементами (кальций, калий, натрий, хлор, фосфор, фтор, сера, углерод, кислород, водород, азот) определяет 99% элементарного состава человеческого организма [1]. В настоящее время установлено наличие не менее 290 генов и белковых соединений в последовательности генома человека, которые способны связывать Mg2+ как кофактор множества ферментов, участвующих более чем в 300 внутриклеточных биохимических реакциях. Mg2+ – естественный физиологический антагонист Са2+, универсальный регулятор биохимических и физиологических процессов в организме, обеспечивает гидролиз АТФ, уменьшая разобщение окисления и фосфолирование, регулирует гликолиз, уменьшает накопление лактата, способствует фиксации К+ в клетках, обеспечивая поляризацию клеточных мембран, контролирует спонтанную электрическую активность нервной ткани и проводящей системы сердца, контролирует нормальное функционирование кардиомиоцита на всех уровнях субклеточных структур – универсальный кардиопротектор (рис. 1).
Биодоступность магния в организме регулируется рядом генов, контролирующих «сборку» и функционирование белков на поверхности клеточных мембран, выполняющих роль рецепторов или ионных каналов, среди которых TRPM–6 (Transient Receptor Potential Cation Channel) и TRPМ–7 являются наиболее важными. Белок TRPM–6 является ионным каналом, регулирующим транспорт двухвалентных катионов. TRPM–6, специфически взаимодействуя с другим Mg2+–проницаемым каналом – TRPM–7, способствует формированию («сборке») функциональных TRPM–6/TRPM–7 комплексов на поверхности клеточных мембран. В свою очередь, дефицит магния на фоне эмоционального стресса может быть вызван изменениями функционального состояния TRPM–7 под действием катехоламинов [2].
Наиболее общий эффект воздействия Mg2+ на любую ткань заключается в том, что ионы Mg2+ стабилизируют структуру транспортной РНК, контролирующей общую скорость ресинтеза белков. При дефиците магния происходит дестабилизация транспортных – некодирующих РНК (увеличивается число дисфункциональных молекул РНК), что сопровождается замедлением скорости синтеза белковых структур клеток с относительным преобладанием процессов апоптоза.
Данные многочисленных исследований указывают на хронический дефицит ионов магния как причину возможных патогенетических механизмов неправильного формирования соединительнотканных структур с хаотическим расположением коллагеновых волокон, являющихся основным морфологическим признаком клинических проявлений дисплазии соединительной ткани [2,4].
Сведения о распространенности дефицита магния (нормальный уровень магния в плазме крови колеблется от 0,65 до 1,15 ммоль/л) варьируют в широких пределах в зависимости от исследованной группы населения, используемых методов определения содержания магния в различных средах и критериев диагностики [1]. Экспериментальные и клинические исследования указывают, что гипомагниемия (снижение уровня магния в плазме крови ниже 0,6 ммоль/л) – малочувствительный показатель, не коррелирующий с истинным дефицитом магния, т.к. отсутствует корреляционная связь между внутриклеточным содержанием магния и его концентрацией в плазме крови.
В настоящее время выделяют две формы дефицита магния.
1. Первичный (конституциональный, латентный) дефицит магния обусловлен дефектами в генах, ответственных за трансмембранный обмен магния в организме, клинически проявляется судорожным синдромом (спазмофилия), «конституционной тетанией» или «нормокальциевой тетанией» на фоне нормального содержания Mg2+ в сыворотке крови.
2. Вторичный дефицит магния обусловлен социальными условиями и образом жизни, экологической обстановкой и особенностями питания, различными стрессорными ситуациями и заболеваниями.
Метаболический синдром (МС) – кластер метаболических и гормональных нарушений, объединенных общим патофизиологическим механизмом – инсулинорезистентностью (ИР), включающих нарушение толерантности к глюкозе (НТГ), атерогенную дислипидемию (повышение триглициридов – ТГ, липопротеидов низкой плотности – ЛПНП, снижение липопротеидов высокой плотности – ЛПВП), артериальную гипертензию (АГ), сочетающихся с абдоминальным ожирением. МС имеет высокую распространенность среди населения. Около 24% населения экономически развитых стран страдают МС, а в возрастной группе старше 50 лет до 45% мужчин и женщин имеют клинические признаки МС [3,5,7,8,11].
Критерии МС неоднократно менялись. В 2005 году Международная диабетическая федерация предложила более жесткие критерии диагноза МС – абдоминальное ожирение (окружность талии для мужчин более 94 см, у женщин – более 80 см), сочетающееся с двумя из ниже перечисленных признаков: ТГ>1,7 ммоль/л, ХС ЛПВП<1,0 ммоль/л, уровень глюкозы в плазме >5,6 ммоль/л, АД≥130/85 мм рт.ст. [3].
Существуют два нарушения, которые наблюдаются при всех состояниях, связанных с дефицитом магния и МС, взаимно влияющие друг на друга. Недостаток магния способствует снижению чувствительности рецепторов к инсулину, а неполноценный ответ на инсулин влияет как на захват клетками глюкозы, так и на транспортировку магния в клетки. Кроме того, дефицит магния оказывает негативное влияние на секрецию и активность инсулина, что способствует формированию и прогрессированию ИР – основному этиологическому фактору МС. Оба фактора (ИР и недостаток магния) влияют на утилизацию жиров, способствуя развитию атерогенной дислипидемии. Назначение препаратов магния в качестве пищевой добавки людям всех возрастов с АГ и/или инсулин–независимой формой СД (СД 2 типа) помогает скорректировать у них резистентность к инсулину, снизить уровень инсулина в крови, нормализовать липидный спектр крови и артериальное давление. Другое нарушение, связываемое, но реже упоминаемое в отношении метаболических сдвигов – первичное нарушение окислительно–восстановительных процессов в организме, которое также обусловлено недостатком магния, участвующего в функционировании антиоксидантной системы (витамины Е, С, убихинон – коэнзим Q10) [3,10,11].
В многочисленных рандомизированных исследованиях показано, что гиперактивность симпатической нервной системы имеет место при МС и ассоциируется со снижением уровня внутриклеточного магния. [3,7,8,11]. Это сочетание регистрировалось у больных АГ с ожирением и без него, у больных СД независимо от уровня АД. Среди пациентов среднего возраста с лабильной гипертонией ответ в виде снижения АД на 3–месячный прием оротата магния (Магнерота) (6 таблеток в сутки) регистрировался только у больных с исходно сниженным уровнем магния в эритроцитах (<1,5 ммоль/л). У работников производства, связанного с высоким уровнем шума, а также у студентов, готовящихся к выпускным экзаменам, чей рацион исходно содержал Mg менее 5 мг на кг в сутки (около 350 мг в сутки для массы тела в 70 кг), отмечалось повышение уровня АД. Увеличение ежедневного потребления Mg до 6–7 мг на кг (до 3 грамм Mg в сутки) предотвращало повышение кровяного давления, вызванного стрессом [11].
В ряде клинических исследований была выявлена обратнопропорциональная зависимость между уровнем магния и ИР при СД 2 типа, которые сопровождаются атерогенной дислипидемией [3].
В США, на основании данных комиссии Американской ассоциации диабетологов о широкой рапространенности и последствиях недостатка магния у больных с нарушениями углеводного обмена, была проведена серия исследований среди пациентов с СД, 70% из которых имели сопутствующие ССЗ. Среди пациентов с СД и сопутствующей патологией со стороны ССС в 78% случаев имела место гипомагниемия (уровень Mg в плазме крови <0,6 ммол/л) и у одной трети этих пациентов к стандартной терапии эмпирически были добавлены препараты магния. В группе больных СД 2 типа, сочетающегося с дефицитом магния, в программу лечения которых был добавлен препарат магния – MgCl2 (1 г в сутки) на протяжении 1 года, было отмечено повышение чувствительности к инсулину, нормализация липидного спектра крови (снижение концентрации ТГ и повышение уровня ХС ЛПВП), снижение случаев сердечно–сосудистых осложнений по сравнению с контрольной группой аналогичных пациентов без добавления магния. Таким образом, устранение недостатка магния у пациентов с диабетом играет важную роль, т.к. низкий уровень магния – один из основных факторов в развитии осложнений, сопряженных с СД [11].
В другом двойном слепом плацебо–контролируемом исследовании у пациентов при назначении препаратов магния из расчета 500 мг Mg в сутки на протяжении 4 недель было статистически достоверно показано снижение экскреции норадреналина с мочой и уровня АД, по сравнению с группой плацебо. Аналогичные данные были прослежены в группе пациентов с неосложненной эссенциальной АГ (пограничная гипертензия), у которых после 4–недельного лечения оротатом магния из расчета 1 г в сутки отмечено увеличение внутриклеточного магния и снижение натрия с нормализацией уровней АД и триглицеридов. Еще более показательные результаты получены после 6–недельного курсового лечения Магнеротом в дозе 6 таблеток в сутки у больных ИБС в сочетании с метаболическим кардиоваскулярным синдромом: ТГ снизились на 55%, ХС ЛПВП увеличился вдвое, что сопровождалось уменьшением индекса атерогенности (ИА) на 57% [6,11].
Статистика показывает: 40% пациентов, находящихся в стационарах, имеют дефицит магния, в 70% случаев дефицит магния регистрируется у больных в блоках интенсивной терапии, в 90% дефицит магния имеет место у больных ОКС [1,6].
Один из факторов, способствующих развитию ИР – нарушение скорости перемещения глюкозных трансмиттеров (ГЛЮТ–4) из микросом низкой плотности к плазматическим мембранам глюкозозависимых клеток тканей (мышцы, печень, жировая ткань), регулируется скоростью окислительного фосфорилирования, находящейся под контролем Mg–зависмой АТФ–азы. Инсулин, через усиление выведения Mg из клетки (дефицит магния), тормозит фосфорилирование ГЛЮТ–4 примерно на 25–35%, что снижает захват глюкозы клеткой [3,9].
При МС регистрируются нарушения реологических параметров крови: повышение агрегационной активности тромбоцитов, снижение эластичности и подвижности эритроцитов, что способствует увеличению общего сосудистого сопротивления с повышением АД. Увеличение внутриклеточного Са2+ в тромбоците на фоне дефицита магния активирует фосфолипазу А2, которая, в свою очередь, стимулирует высвобождение арахидоновой кислоты. Арахидоновая кислота под действием циклооксигеназы–1 и 12–липооксигеназы конвертируется в тромбоксан А2 и лейкотриен–6. Тромбоксан А2 совместно с АДФ инициируют вазоспазм и процессы агрегации тромбоцитов, лежащие в основе образования атерогенных бляшек [10,11].
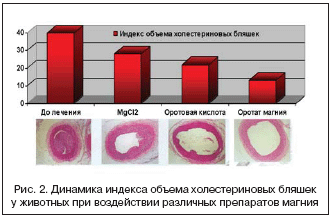
В экспериментах на животных было изучено влияние различных препаратов магния на индексы склеротических изменений сосудов. Под воздействием экспериментального «холестеринового стресса» у животных без лечения такие изменения быстро прогрессировали, и их нельзя было предотвратить. При назначении хлорида магния (MgCl2) было отмечено практически двукратное уменьшение индекса объема холестериновых бляшек. Оротовая кислота в аналогичных ситуациях оказывала более выраженный антисклеротический эффект по сравнению с MgCl2. Однако в качестве оптимальной защиты наиболее хорошо зарекомендовал себя оротат магния (Магнерот) (рис. 2) [9].
Таким образом, многочисленные экспериментальные исследования, клинические наблюдения конца XX – начала XXI века указывают на высокую частоту (до 70% и более) участия дефицита магния в патогенезе и прогрессировании ССЗ, что диктует необходимость включения препаратов магния в комплексное лечение различных заболеваний, сопряженных с метаболическими нарушениями углеводного и липидного обменов. Все вышеизложенное является предметом обсуждения в данной работе.
Материалы, методы исследования и лечение
Под нашим наблюдением находилось 87 пациентов с МС (мужчины/женщины – 33/54) в возрасте старше 45 лет (средний возраст по группе составил 52,7±4,2 года), с индексом массы тела, превышающим 25 кг/м2 (средняя величина в целом по группе составила – 31,1±2,2 кг/м2). Критериями постановки диагноза МС являлись данные физикального и лабораторного исследования крови: АД≥130/85 мм рт.ст., окружность талии для мужчин более 94 см, у женщин – более 80 см, уровень глюкозы в плазме >5,6 ммоль/л, ТГ>1,7 ммоль/л, ЛПВП<1,0 ммоль/л. Исходно, дополнительно к стандартному исследованию биохимических показателей крови (уровень гликемии, гликозилированный HbA1с, липидный спектр крови), всем больным проводилось исследование содержания Mg в волосах (N = 17,5 мкг/кг).
По данным исследования минерального состава волос у 42 пациентов (48,3%) с МС уровень магния был ≤15 мкг/кг и в среднем составил 11,4±2,1 мкг/кг, у 45 пациентов (51,7%) с МС уровень магния был ≥17 мкг/кг и в среднем составил 18,9±0,8 мкг/кг.
Тридцати пяти больным МС, включенным в программу исследования, с целью выявления частоты дефицита магния определяли концентрацию магния в эритроцитах (N=1,65–2,55 ммоль/л): в 16 случаях (45,7%) уровень магния в эритроцитах был ≤ 1,6 ммоль/л и в среднем составил 1,45±0,06 ммоль/л, в 19 наблюдениях (54,3%) уровень магния был ≥1,7 ммоль/л и в среднем по подгруппе составил 1,98±0,03 ммоль/л.
Исходно и после амбулаторного лечения всем пациентам, включенным в программу исследования (35 больных), проводился стандартный пероральный тест толерантности к глюкозе (ПТТГ) с одновременным определением уровней иммунореактивного инсулина (ИРИ), С–пептида – натощак, через 30 – 60 – 120 минут после ПТТГ. С–пептид является индикатором образования инсулина из проинсулина в b–клетках островков Лангерганса поджелудочной железы, выделяется в кровоток почти в равных с инсулином концентрациях. В норме, натощак, уровень С–пептида в сыворотке крови меньше 4 нг/мл, а после пероральной нагрузки глюкозой отмечается 5–6–кратное увеличение его концентрации.
В зависимости от уровня магния в эритроцитах больные МС были распределены на две подгруппы: подгруппа А (19 пациентов) – без дефицита магния, подгруппа Б (16 больных) – с дефицитом магния. Исследуемые подгруппы не различались по исходным клиническим и демографическим параметрам. Результаты межгруппового сравнения уровней глюкозы натощак, гликозилированного гемоглобина, липидного спектра крови (ТГ, ОХС ХС ЛПВП, ИА), гликемического профиля, концентрации ИРИ и С–пептида после ПТТГ до и после лечения представлены в таблице 1. Все пациенты получали стандартное лечение. У 16 больных МС в сочетании с дефицитом магния (Mg – 1,45±0,06 ммоль/л – эритроцит) к стандартной программе лечения были добавлены препараты магния. Стартовое лечение препаратами магния начинали с в/в инфузии сульфата магния со скоростью 0,5–0,6 г/ч из расчета 10–12 г в сутки (в течение 2–3 дней) с последующим переходом на пероральный прием Магнерота 3 г в сутки (6 таблеток).
Как видно из таблицы 1, средние уровни ИМТ, глюкозы натощак и показателей липидного спектра крови у всех пациентов по подгруппам соответствовали критериям МС.
В подгруппе Б концентрация Mg2+ в эритроцитах была статистически достоверно ниже нормативных уровней и на 26,8% (p<0,01) ниже по сравнению с аналогичным показателем подгруппы А. Исходные суммарные показатели гликемического, липидного профилей и ПТТГ по подгруппам (А и Б) практически (статистически недостоверно) не отличались друг от друга. В подгруппе Б (МС с дефицитом магния) имеют место статистически достоверные (p<0,001) исходные повышения концентрации иммунореактивного инсулина (ИРИ) и С–пептида, по сравнению с аналогичными показателями подгруппы А, соответственно пятикратное (на 422%) и двукратное (на 150%), что косвенно свидетельствует о более выраженной инсулинорезистентности и компенсаторной гиперфункции поджелудочной железы у пациентов с дефицитом магния.
После проведенного лечения (в конце исследования, через 8 недель) в подгруппе Б на фоне роста концентрации магния в эритроцитах на 35,9% (от 1,45±0,06 ммоль/л до 1,97±0,04 ммоль/л) отмечено значительное снижение ИР, что документируется практически двукратным уменьшением площади под кривой ИРИ (на 55%, p<0,001) при проведении ПТТГ по сравнению с подгруппой А, в которой аналогичный параметр уменьшился на 32% (p<0,01).
На фоне снижения инсулинорезистентности при приеме препаратов магния (сульфат магния, Магнерот), у больных МС, сочетающимся с дефицитом магния также отмечены положительные сдвиги в углеводном обмене, что документируется снижением уровня HbA1c в подгруппе Б на 6,9% (от 7,42±0,3 до 6,91±0,2%, p<0,05), в то время как в подгруппе А аналогичный показатель статистически недостоверно уменьшился только на 2,3% (от 6,87±0,3 до 6,71±0,21%, p>0,05).
В наших исследованиях при лечении больных МС, сочетающимся с атерогенной дислипидемией, в подгруппе Б после стартового лечения внутривенной инфузией сульфата магния в дозе 12 г/сут. в течение 2 дней с последующим пероральным приемом Магнерота (3 г/сут.) в течение 8 недель отмечены статистически достоверные снижения ОХС на 19,7%, ТГ – на 24,8%, с повышением ХС ЛПВП на 21%, что суммарно привело к снижению ИА на 39,5%. В подгруппе А на фоне снижения ИР также имела место нормализация липидного спектра крови в сторону антиатерогенности, документируемая снижением ИА на 15,5% (от 3,7±0,2 до 3,2±0,3, p<0,05).
При изучении реологических свойств крови у больных МС отмечено увеличение агрегационной активности тромбоцитов (ААТр) и снижение электрофоретической подвижности эритроцитов (ЭФПЭ). К концу контрольного срока лечения ААТр снизилась, а ЭФПЭ увеличилась в целом по группе больных МС (соответственно –23,4% и +13,5%). В подгруппе А скорость ЭФПЭ увеличилась на +12,1%, ААТр снизилась на –22,1%; в подгруппе Б скорость ЭФПЭ возросла на 15,2%, ААТр уменьшилась на –24,9% (межгрупповая разница статистически достоверна – p<0,05).
У мужчин и женщин повышение массы тела часто сопровождается повышением АД, сопряженного с активацией симпатического тонуса, вызванного развитием ИР, и атерогенной дислипидемии. Эти изменения имеют тенденцию к прогрессированию при дефиците внутриклеточного магния, являющегося кофактором более 300 ферментных реакций, контролирующих функционирование ионных каналов и рецепторов, расположенных на клеточных мембранах [1]. Повышению АД при МС способствуют изменения со стороны реологических свойств крови, характеризующиеся повышением ААТр с повышенным синтезом тромбоксана А2 (мощный вазоконстриктор), снижением эластичности и подвижности эритроцитов.
Магнерот в суточной дозе 3 г эффективен и хорошо переносится при коррекции нарушений ритма сердечной деятельности у пациентов с клиническими проявлениями недифференцированной дисплазии соединительной ткани [2,4]
Таким образом, данные литературы и наши наблюдения указывают на высокую частоту (от 40 до 50%) сочетания МС с дефицитом магния. Включение препаратов магния (Магнерот 3 г/сут.) в комплексную терапию МС оказывает антиаритмогенный эффект, способствует более эффективному снижению ИР, лежащей в основе метаболических нарушений, нормализации гликемического, липидного профилей и реологических свойств крови, что суммарно ведет к снижению АД, профилактике атеросклероза и сердечно–сосудистых осложнений.