–Ю—В–ї–Є—З–Є—В–µ–ї—М–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ —П–≤–ї—П–µ—В—Б—П —Б–≤—П–Ј—М —Б —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б—В—А–µ—Б—Б–Њ–Љ, –і–Є—Д—Д—Г–Ј–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є. –Ц–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Є–Љ–Є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б–Њ—Б—В–∞–≤–ї—П—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, 2–13% –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤. –Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –Њ—Б—В—А—Л—Е —П–Ј–≤–µ–љ–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П—Е —Г —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Њ–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 38 –і–Њ 77% [1–3]
–Т–µ–і—Г—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ –њ—А–Є–і–∞—О—В –Є—И–µ–Љ–Є–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є, –≥–Є–њ–Њ–≤–Њ–ї–µ–Љ–Є–Є, –њ–ї–∞–Ј–Љ–Њ–њ–Њ—В–µ—А–Є –Є –≥–Є–њ–Њ—В–Њ–љ–Є–Є; —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Р–Ъ–Ґ–У, –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤, –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, –≥–Є—Б—В–∞–Љ–Є–љ–∞, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ј–∞—Й–Є—В–љ—Л–є –±–∞—А—М–µ—А —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –Є —Г—Б–Є–ї–Є–≤–∞—О—Й–Є—Е –Ї–Є—Б–ї–Њ—В–љ–Њ––њ–µ–њ—В–Є—З–µ—Б–Ї—Г—О –∞–≥—А–µ—Б—Б–Є—О; –љ–∞—А—Г—И–µ–љ–Є—О –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є –Љ–Њ—В–Њ—А–Є–Ї–Є –Є —Н–≤–∞–Ї—Г–∞—Ж–Є–Є (–њ–∞—А–µ–Ј –ґ–µ–ї—Г–і–Ї–∞ –Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –і—Г–Њ–і–µ–љ–Њ–≥–∞—Б—В—А–∞–ї—М–љ—Л–є —А–µ—Д–ї—О–Ї—Б). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б—В—А–µ—Б—Б–Њ–≤—Л–µ —П–Ј–≤—Л –Њ–±—Л—З–љ–Њ –њ—А–Њ—П–≤–ї—П—О—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ [2]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ—О—В –Љ–µ—А—Л, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, –њ–Њ–Љ–Є–Љ–Њ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –і–µ–Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Є, –Њ–±–≤–Њ–ї–∞–Ї–Є–≤–∞—О—Й–Є—Е —Б—А–µ–і—Б—В–≤, –љ–∞–Є–±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Њ—В–≤–Њ–і–Є—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є. –°—А–µ–і–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е –љ–∞–Є–±–Њ–ї—М—И–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї–Є –±–ї–Њ–Ї–∞—В–Њ—А—Л –Э2––≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ (–Ш–Я–Э) [4,5]. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–µ—В –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –њ–Њ –њ–Њ–≤–Њ–і—Г –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Ї–Њ–љ–Ї—А–µ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ [6,7]. –Я–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –±—Л–ї —В—А–µ—В—М–Є–Љ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ–Њ—Б–ї–µ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї–∞ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞. –Ю—В —Б–≤–Њ–Є—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –Њ–љ –Њ—В–ї–Є—З–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ —Б—В—А—Г–Ї—В—Г—А–Њ–є —А–∞–і–Є–Ї–∞–ї–Њ–≤ –љ–∞ –њ–Є—А–Є–і–Є–љ–Њ–≤–Њ–Љ –Є –±–µ–љ–Ј–Є–Љ–Є–і–∞–Ј–Њ–ї—М–љ–Њ–Љ –Ї–Њ–ї—М—Ж–∞—Е. –Ґ–∞–Ї–Њ–µ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞, –Ї–Њ—В–Њ—А—Л–є –±–Њ–ї–µ–µ —Б—В–∞–±–Є–ї–µ–љ –њ—А–Є –Ј–љ–∞—З–µ–љ–Є—П—Е —А–Э, –±–ї–Є–Ј–Ї–Є—Е –Ї –љ–µ–є—В—А–∞–ї—М–љ—Л–Љ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Ј–љ–∞—З–µ–љ–Є–є —А–Э —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї–∞–љ–∞–ї—М—Ж–∞—Е –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П. –Р–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–є —Н—Д—Д–µ–Ї—В –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ 20–60 –Љ–≥/—Б—Г—В. —П–≤–ї—П–µ—В—Б—П –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ, –∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –і–Њ 80–120 –Љ–≥/—Б—Г—В. –ї–Є—И—М –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В –і–∞–ї—М–љ–µ–є—И–µ–µ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є. –£—З–Є—В—Л–≤–∞—П, —З—В–Њ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї – —Н—В–Њ –Њ–і–Є–љ –Є–Ј –љ–µ–Љ–љ–Њ–≥–Є—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –Ї–Њ—В–Њ—А—Л–є –њ–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ —Д–Њ—А–Љ–µ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П, –Љ—Л –њ—А–Є–≤–µ–ї–Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Д–Њ—А–Љ–Њ–є –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Э2––±–ї–Њ–Ї–∞—В–Њ—А–∞ —Д–∞–Љ–Њ—В–Є–і–Є–љ–∞.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–£—З–∞—Б—В–љ–Є–Ї–∞–Љ–Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Є 88 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—Е–Њ–і–Є–≤—И–Є—Е—Б—П –љ–∞ –ї–µ—З–µ–љ–Є–Є –≤ –¶–µ–љ—В—А–µ —Е–Є—А—Г—А–≥–Є–Є –Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–Њ–ї–Њ–≥–Є–Є –§–У–£ «–§–Ь–С–¶ –Є–Љ –Р.–Ш. –С—Г—А–љ–∞–Ј—П–љ–∞ –§–Ь–С–Р –†–Њ—Б—Б–Є–Є» —Б 2009 –њ–Њ 2010 –≥–Њ–і. –Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –Њ–±—И–Є—А–љ—Л–µ –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –≤ –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ —Н–Ј–Њ—Д–∞–≥–Њ–≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Њ—Б–Ї–Њ–њ–Є—О —Б –Њ—Ж–µ–љ–Ї–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –і–Є—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ –њ–Є—Й–µ–≤–Њ–і–∞, –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –љ–∞ –њ—А–µ–і–Љ–µ—В —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –Ї–∞–Ї —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б—В—А–µ—Б—Б–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤–ї–Є—П–љ–Є–µ Helicobacter pylori –љ–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [4,8]. –Т —Б–≤—П–Ј–Є –≤ —Н—В–Є–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –і–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П –љ–∞–ї–Є—З–Є—П –Є —Б—В–µ–њ–µ–љ–Є –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є Helicobacter pylori (–Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤).
–Т —Ж–µ–ї—П—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–µ—А–µ–і –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–Љ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–Љ–Є –ґ–µ–ї—Г–і–Њ—З–љ—Г—О —Б–µ–Ї—А–µ—Ж–Є—О. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —Б—В—А–∞—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –љ–∞ –≥—А—Г–њ–њ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б–њ–Њ—Б–Њ–±–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б—В—А–µ—Б—Б–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ, –Ї–Њ—В–Њ—А—Г—О —Б–Њ—Б—В–∞–≤–Є–ї–Є 48 –±–Њ–ї—М–љ—Л—Е, –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–∞–љ–љ–Є—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ –і–Њ–Ј–µ 40 –Љ–≥ –Њ–і–Є–љ —А–∞–Ј –≤ —Б—Г—В–Ї–Є. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г –≤–Њ—И–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Д–∞–Љ–Њ—В–Є–і–Є–љ–Њ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –±–Њ–ї—О—Б–љ–Њ –≤ –і–Њ–Ј–µ 20 –Љ–≥ –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є. –Я–µ—А–≤–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –≤–Ї–ї—О—З–∞–ї–Њ—Б—М –≤ –њ—А–µ–Љ–µ–і–Є–Ї–∞—Ж–Є—О. –Я–Њ–Љ–Є–Љ–Њ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є, –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –љ–∞–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–∞—П –і–µ–Ї–Њ–Љ–њ—А–µ—Б—Б–Є—П —Б –њ–Њ–Љ–Њ—Й—М—О –Ј–Њ–љ–і–∞, –Ї–Њ—В–Њ—А—Л–є —Г–і–∞–ї—П–ї—Б—П –њ–Њ—Б–ї–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є (–≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–∞–ї—М–љ–Њ–є) —Н–≤–∞–Ї—Г–∞—Ж–Є–Є. –†–∞–љ–љ–µ–≥–Њ —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М.
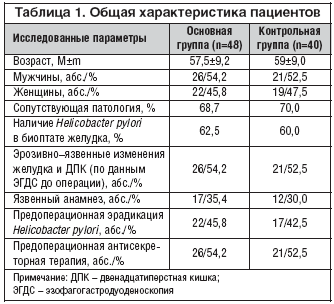
–Ю—Б–љ–Њ–≤–љ–∞—П –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤—Б–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ (—В–∞–±–ї. 1).
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –≤—Л—И–µ–њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, —Г —В—А–µ—В–Є –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ –Њ—В–Љ–µ—З–∞–ї—Б—П —П–Ј–≤–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј, –Є –±–Њ–ї–µ–µ —З–µ–Љ –≤ –њ–Њ–ї–Њ–≤–Є–љ—Л —Б–ї—Г—З–∞–µ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –±–Є–Њ–њ—В–∞—В–µ –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П Helicobacter pylori, —З—В–Њ —П–≤–ї—П–ї–Њ—Б—М –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Г—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Г—О –Є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Г—О —В–µ—А–∞–њ–Є—О.
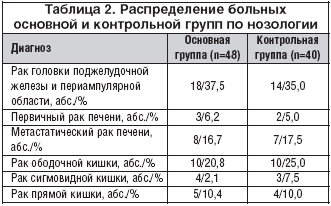
–Т –Њ—Б–љ–Њ–≤–љ—Г—О –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Л –≤–Њ—И–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б —А–∞–Ї–Њ–Љ –≥–Њ–ї–Њ–≤–Ї–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –њ–µ—А–Є–∞–Љ–њ—Г–ї—П—А–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, –њ–µ—А–≤–Є—З–љ—Л–Љ –Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ —А–∞–Ї–Њ–Љ –њ–µ—З–µ–љ–Є, —А–∞–Ї–Њ–Љ –Њ–±–Њ–і–Њ—З–љ–Њ–є, —Б–Є–≥–Љ–Њ–≤–Є–і–љ–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –њ—А–Є–Љ–µ—А–љ–Њ –≤ —А–∞–≤–љ–Њ–є —Б—В–µ–њ–µ–љ–Є (—В–∞–±–ї. 2).
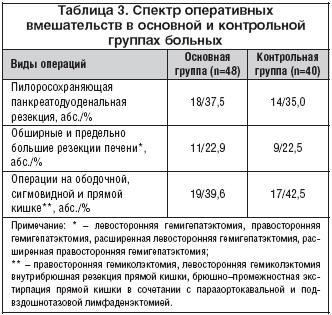
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Є–і–∞ –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ–∞—Ж–Є–µ–љ—В—Л –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ —В—А–Є –њ–Њ–і–≥—А—Г–њ–њ—Л: –±–Њ–ї—М–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –њ—А—П–Љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ (–њ–Є–ї–Њ—А–Њ—Б–Њ—Е—А–∞–љ—П—О—Й–∞—П –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П), –Њ–±—И–Є—А–љ—Л–µ –Є –њ—А–µ–і–µ–ї—М–љ–Њ –±–Њ–ї—М—И–Є–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ –њ—А–Є –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–Љ —А–∞–Ї–µ. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є —Б–њ–µ–Ї—В—А –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –љ–µ –Є–Љ–µ–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е (—В–∞–±–ї. 3).
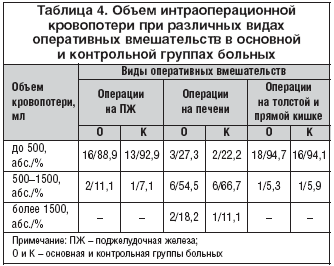
–Я—А–Є–љ–Є–Љ–∞—П –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —Б—В—А–µ—Б—Б–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Њ–±—К–µ–Љ–∞ –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї –Њ—Ж–µ–љ–µ–љ –Њ–±—К–µ–Љ –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–∞—Е –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ (—В–∞–±–ї. 4). –Я—А–Є —Н—В–Њ–Љ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–±—К–µ–Љ–µ –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ, –њ–µ—З–µ–љ–Є, —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ –Љ–µ–ґ–і—Г –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е.
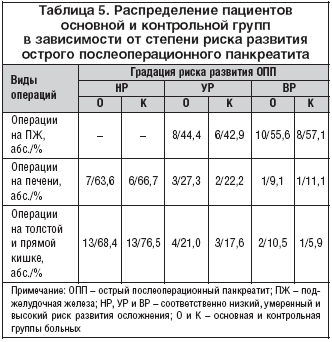
–£—З–Є—В—Л–≤–∞—П, —З—В–Њ –Њ–і–љ–Є–Љ –Є–Ј –≤–µ–і—Г—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б—В—А–µ—Б—Б–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ [9,10], —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–∞ —Б—В–µ–њ–µ–љ—М —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –і–∞–љ–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –Ї–Њ—В–Њ—А–∞—П –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–µ—А–Є–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ [11]. –°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М—Б—В–≤–µ –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ, —Г–Љ–µ—А–µ–љ–љ—Л–Љ –Є –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ (—В–∞–±–ї. 5).
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –і–µ–є—Б—В–≤–Є—П, –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є —А–Є—Б–Ї–∞ –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є –і—А—Г–≥–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ—А–Є–љ—Ж–Є–њ—Л –Ї–Њ—В–Њ—А–Њ–є –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е.
–Ю—Ж–µ–љ–Ї–∞ –љ–∞–ї–Є—З–Є—П –Є —Е–∞—А–∞–Ї—В–µ—А–∞ –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А–Њ–µ –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –љ–∞ 6––µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П–Љ –љ–∞ –њ–µ—З–µ–љ–Є, —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ –Є –љ–∞ 10––µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–Є–ї–Њ—А–Њ—Б–Њ—Е—А–∞–љ—П—О—Й—Г—О –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Г—О —А–µ–Ј–µ–Ї—Ж–Є—О. –Ч–љ–∞—З–Є–Љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ –Ї—А–Є—В–µ—А–Є—О χ2 —Б –њ–Њ–њ—А–∞–≤–Ї–Њ–є –Щ–µ—В—Б–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
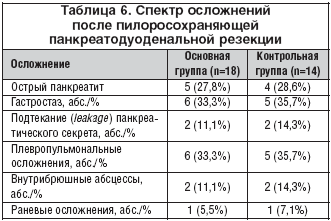
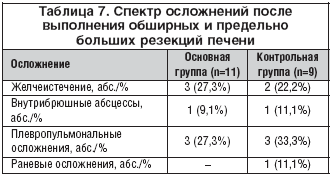
–І–∞—Б—В–Њ—В–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –Є–Љ–µ–ї–∞ –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є. –°–њ–µ–Ї—В—А –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Њ–њ–µ—А–∞—Ж–Є—О –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ, –њ–µ—З–µ–љ–Є, —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–∞—Е 6, 7 –Є 8.
–Ф–Њ–Љ–Є–љ–Є—А—Г—О—Й–Є–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –њ–Њ—Б–ї–µ –њ–Є–ї–Њ—А–Њ—Б–Њ—Е—А–∞–љ—П—О—Й–µ–є –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–∞–Ї –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є, —В–∞–Ї –Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Є –і–ї–Є—В–µ–ї—М–љ—Л–є –≥–∞—Б—В—А–Њ—Б—В–∞–Ј, –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –њ–ї–µ–≤—А–Є—В—Л, –∞ —В–∞–Ї–ґ–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–µ —В—А–∞–љ—Б–і—А–µ–љ–∞–ґ–љ–Њ–µ –њ–Њ–і—В–µ–Ї–∞–љ–Є–µ –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–µ–Ї—А–µ—В–∞ –Є –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л–µ –∞–±—Б—Ж–µ—Б—Б—Л (—В–∞–±–ї. 6).
–°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –Њ–±—И–Є—А–љ—Л–µ –Є –њ—А–µ–і–µ–ї—М–љ–Њ –±–Њ–ї—М—И–Є–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –њ–ї–µ–≤—А–Њ–њ—Г–ї—М–Љ–Њ–љ–∞–ї—М–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Є –ґ–µ–ї—З–µ–Є—Б—В–µ—З–µ–љ–Є–µ (—В–∞–±–ї. 7).
–Я–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ —Г –±–Њ–ї—М–љ—Л—Е, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ—В–Љ–µ—З–µ–љ—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ––≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л–µ –Є —А–∞–љ–µ–≤—Л–µ, –∞ —В–∞–Ї–ґ–µ –њ–ї–µ–≤—А–Њ–њ—Г–ї—М–Љ–Њ–љ–∞–ї—М–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П (—В–∞–±–ї. 8).
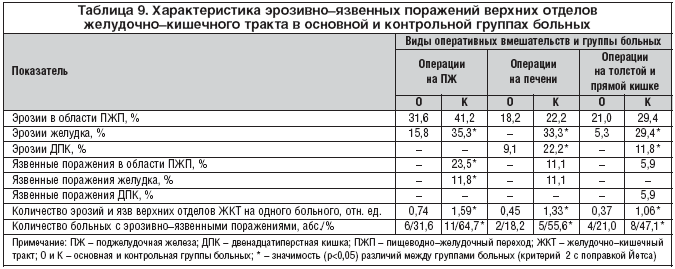
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ, –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е —Б —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, —З–∞—Б—В–Њ—В—Л —Н—А–Њ–Ј–Є–є –ґ–µ–ї—Г–і–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–∞ –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ (—В–∞–±–ї. 9). –ѓ–Ј–≤–µ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –ґ–µ–ї—Г–і–Ї–µ –Є –Њ–±–ї–∞—Б—В–Є –њ–Є—Й–µ–≤–Њ–і–љ–Њ––ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –≤–Њ–≤—Б–µ.
–Т –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –Њ–±—И–Є—А–љ—Л–µ –Є –њ—А–µ–і–µ–ї—М–љ–Њ –±–Њ–ї—М—И–Є–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є, –∞ —В–∞–Ї–ґ–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–∞ –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Н—А–Њ–Ј–Є–є –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є, –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е —Б —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є –Є—Е –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –љ–∞ –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–µ–≤–µ–љ—В–Є–≤–љ—Л–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Э2––≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –ѓ–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
–Э–µ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П —Н—А–Њ–Ј–Є–є –њ–Є—Й–µ–≤–Њ–і–љ–Њ––ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –Љ–µ–ґ–і—Г –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е. –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М—О –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–∞–ї–Є—З–Є—П –љ–∞–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–Њ–≥–Њ –Ј–Њ–љ–і–∞ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Н—А–Њ–Ј–Є–є –њ–Є—Й–µ–≤–Њ–і–љ–Њ––ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї–Њ —Г–≥–ї—Г–±–ї–µ–љ–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –њ–Є—Й–µ–≤–Њ–і–љ–Њ––ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞ –і–Њ —П–Ј–≤–µ–љ–љ—Л—Е, –Ї–Њ—В–Њ—А—Л—Е –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–≤—И–Є–µ—Б—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ, –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —Г –і–≤—Г—Е –±–Њ–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –њ—А–Њ–≤–Њ–і–Є–ї–Є —Д–∞–Љ–Њ—В–Є–і–Є–љ–Њ–Љ (–Њ–±–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –њ–µ—А–µ–љ–µ—Б–ї–Є –њ–Є–ї–Њ—А–Њ—Б–Њ—Е—А–∞–љ—П—О—Й—Г—О –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Г—О —А–µ–Ј–µ–Ї—Ж–Є—О). –Т –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –±—Л–ї –≤—Л–њ–Њ–ї–љ–µ–љ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–є –≥–µ–Љ–Њ—Б—В–∞–Ј, –≤ –і—А—Г–≥–Њ–Љ –Є–Ј––Ј–∞ —А–µ—Ж–Є–і–Є–≤–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л —А–µ–ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П –Є –Є—Б—Б–µ—З–µ–љ–Є–µ –Њ–±—И–Є—А–љ–Њ–є –Њ—Б—В—А–Њ–є —П–Ј–≤—Л –∞–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Ї–∞.
–£ –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Н—А–Њ–Ј–Є–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, —Г–і–∞–ї–Њ—Б—М –і–Њ–±–Є—В—М—Б—П —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ—Г—В–µ–Љ –њ—А–Њ–ї–Њ–љ–≥–∞—Ж–Є–Є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–Њ–Љ –≤ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–Њ 10 —Б—Г—В–Њ–Ї. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –±–Њ–ї–µ–µ —З–µ–Љ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (—Г 58,3%) —Б —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М —Б–Љ–µ–љ–∞ –Э2––≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –љ–∞ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л. –Я—А–Є —Н—В–Њ–Љ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В–∞–Ї–ґ–µ –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В —Н—Д—Д–µ–Ї—В –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞.
–У–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ.
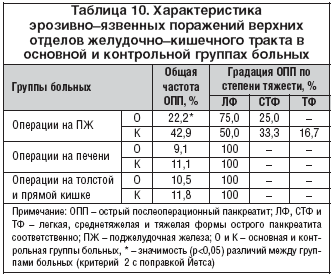
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–Є–ї–Њ—А–Њ—Б–Њ—Е—А–∞–љ—П—О—Й—Г—О –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Г—О —А–µ–Ј–µ–Ї—Ж–Є—О, –≤—Л—П–≤–ї–µ–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Њ–±—Й–µ–є —З–∞—Б—В–Њ—В—Л –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ (—В–∞–±–ї. 10). –Я—А–Є —Н—В–Њ–Љ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Њ—В–Љ–µ—З–µ–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –µ–≥–Њ —В—П–ґ–µ–ї–Њ–є —Д–Њ—А–Љ—Л, –љ–µ–Ї–Њ—В–Њ—А–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Б—А–µ–і–љ–µ–—В—П–ґ–µ–ї—Л—Е —Д–Њ—А–Љ –Є –і–Њ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–Є–µ –ї–µ–≥–Ї–Њ–є —Д–Њ—А–Љ—Л –Њ—Б—В—А–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞. –Я–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Є —В—П–ґ–µ—Б—В–Є –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –µ–≥–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –ґ–µ–ї—Г–і–Њ—З–љ—Г—О —Б–µ–Ї—А–µ—Ж–Є—О, –∞ —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Є –љ–∞ —Б–µ–Ї—А–µ—В–Є–љ––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є. –Т –і—А—Г–≥–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ —А–∞–Ј–ї–Є—З–Є–є –≤ —З–∞—Б—В–Њ—В–µ –Є —Б—В—А—Г–Ї—В—Г—А–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–∞ –Є —Д–∞–Љ–Њ—В–Є–і–Є–љ–∞ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ю—Б—В—А—Л–µ —Н—А–Њ–Ј–Є–Є –Є —Б—В—А–µ—Б—Б–Њ–≤—Л–µ —П–Ј–≤—Л –≤–Њ–Ј–љ–Є–Ї–∞—О—В –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –ї–Њ–Ї–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ, —П–≤–ї—П—О—В—Б—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–Љ–Є –Є –љ–µ –≤—Л–Ј—Л–≤–∞—О—В –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є —Б—В–µ–љ–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ [1,3,12]. –≠—А–Њ–Ј–Є–Є —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П—О—В —Г –±–Њ–ї—М–љ—Л—Е —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Я–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Н—А–Њ–Ј–Є–Є —Г–≥–ї—Г–±–ї—П—О—В—Б—П –Є, –і–Њ—Б—В–Є–≥–∞—П –Љ—Л—И–µ—З–љ–Њ–≥–Њ —Б–ї–Њ—П –ґ–µ–ї—Г–і–Ї–∞ –Є–ї–Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є, –њ—А–µ–≤—А–∞—Й–∞—О—В—Б—П –≤ —П–Ј–≤—Г. –І–∞—Й–µ –≤—Б–µ–≥–Њ —В–∞–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ —Б—В—А–µ—Б—Б–Њ–≤—Л–µ —П–Ј–≤—Л –Њ–±—А–∞–Ј—Г—О—В—Б—П –љ–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –і–љ–∞ –Є —В–µ–ї–∞ –ґ–µ–ї—Г–і–Ї–∞, —А–µ–ґ–µ – –≤ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–µ. –Ю—Б–љ–Њ–≤–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ —Г –Њ—Б–ї–∞–±–ї–µ–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –Љ–Њ–ґ–µ—В –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М —Г–≥—А–Њ–Ј—Г –ґ–Є–Ј–љ–Є. –Ш–љ–Њ–≥–і–∞ —В–∞–Ї–Њ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –±—Л–≤–∞–µ—В —Б–Ї—А—Л—В—Л–Љ –Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –ї–Є—И—М –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Ї–∞ –љ–∞ —Б–Ї—А—Л—В—Г—О –Ї—А–Њ–≤—М. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Њ—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є –ї–µ—З–µ–љ–Є—П —Б—В–∞–љ–Њ–≤–Є—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П.
–°—А–µ–і–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤ –љ–∞–Є–±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ—О—В –Љ–∞—Б—Б–Є–≤–љ–∞—П –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—П, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–њ–µ—А–∞—Ж–Є–Є –Є –∞–љ–µ—Б—В–µ–Ј–Є–Є, —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ–∞–≥—Г–ї–Њ–њ–∞—В–Є–Є –Є –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –і—Л—Е–∞—В–µ–ї—М–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —В—А–µ–±—Г—О—Й–∞—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Њ—Б—В—А—Л–µ —Н—А–Њ–Ј–Є–Є –Є —П–Ј–≤—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤—Л—П–≤–ї—П—О—В—Б—П –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –Є–љ—В—А–Њ–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П.
–Ю–њ–Є—Б–∞–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В—А—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–∞—Б—В–≤–Њ—А–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ —Б–ї—Г–ґ–Є—В —Е–Њ—А–Њ—И–µ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ—А–Њ–є, –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—О—Й–µ–є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤. –Ю–±—К—П—Б–љ–µ–љ–Є—П —Н—В–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Њ –Љ–љ–µ–љ–Є–µ, —З—В–Њ —Б—В—А–µ—Б—Б–Њ–≤–Њ–µ –Є–Ј—К—П–Ј–≤–ї–µ–љ–Є–µ –ґ–µ–ї—Г–і–Ї–∞ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –µ–≥–Њ —В–µ–ї–µ –≤ —Б–≤—П–Ј–Є —Б –љ–Є–Ј–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≥–ї–Є–Ї–Њ–≥–µ–љ–∞ –≤ –Ї–ї–µ—В–Ї–∞—Е —Н—В–Њ–є –Ј–Њ–љ—Л. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤. –І–∞—Б—В–Њ–µ —Н–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ–µ –Ј–∞–±—Г—Д–µ—А–Є—А–Њ–≤–∞–љ–Є–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ, –љ–µ —Г—Б—В—Г–њ–∞—О—Й–µ–µ –њ–Њ –њ—А–Њ—В–Є–≤–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–Љ—Г –і–µ–є—Б—В–≤–Є—О –љ–µ–Ї–Њ—В–Њ—А—Л–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б—А–µ–і—Б—В–≤–∞–Љ. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є —Н—В–Њ–Љ –Є–≥—А–∞–µ—В –њ—А–∞–≤–Є–ї—М–љ–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–Є—В–Љ–∞ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є: –і—А–Њ–±–љ–Њ –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –њ–Њ—А—Ж–Є—П–Љ–Є –Ї–∞–ґ–і—Л–µ 3 —З–∞—Б–∞.
–Т XX –≤–µ–Ї–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –∞–љ—В–∞—Ж–Є–і—Л – –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞–Є–Љ–µ–љ–µ–µ –њ–Њ–њ—Г–ї—П—А–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–Ј––Ј–∞ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ—А–Њ–±–ї–µ–Љ —Б –∞–і–µ–Ї–≤–∞—В–љ—Л–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ–Љ. –Ґ–∞–Ї–ґ–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л, –љ–∞–њ—А–Є–Љ–µ—А, —Б—Г–Ї—А–∞–ї—Д–∞—В, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–∞—Е–∞—А–Є–і–∞ —Б—Г–Ї—А–Њ–Ј—Л –Є –њ–Њ–ї–Є–∞–ї—О–Љ–Є–љ–Є–µ–≤–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞, –Ї–Њ—В–Њ—А—Л–µ, –њ–Њ–њ–∞–і–∞—П –≤ –Ї–Є—Б–ї—Г—О —Б—А–µ–і—Г –ґ–µ–ї—Г–і–Ї–∞, –њ–Њ–ї–Є–Љ–µ—А–Є–Ј—Г—О—В—Б—П; –њ—А–Є —Н—В–Њ–Љ –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Ї–ї–µ–є–Ї–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ, –њ–Њ–Ї—А—Л–≤–∞—О—Й–µ–µ —П–Ј–≤–µ–љ–љ—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л —Г–Ї—А–µ–њ–ї—П—О—В —Б–ї–Є–Ј–Є—Б—В—Л–є –±–∞—А—М–µ—А –ґ–µ–ї—Г–і–Ї–∞ –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–Э –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ, –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј —Б—В—А–µ—Б—Б–—П–Ј–≤ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —В–∞–Ї–Њ–≤–Њ–є —Г –∞–љ—В–∞—Ж–Є–і–Њ–≤ [13].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А—Л—Е –Є —Н—А–Њ–Ј–Є–є –Є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –∞–Ї—В–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л, —Б–љ–Є–ґ–∞—О—Й–Є–µ –ґ–µ–ї—Г–і–Њ—З–љ—Г—О —Б–µ–Ї—А–µ—Ж–Є—О: –Э2––±–ї–Њ–Ї–∞—В–Њ—А—Л –Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞. –Э2––±–ї–Њ–Ї–∞—В–Њ—А—Л –њ–Њ–і–∞–≤–ї—П—О—В –±–∞–Ј–∞–ї—М–љ—Г—О –Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤—Л—А–∞–±–Њ—В–Ї—Г –њ–µ–њ—Б–Є–љ–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–ї–Є–Ј–Є, –њ–Њ–≤—Л—И–∞—О—В —Б–Є–љ—В–µ–Ј –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —Б–µ–Ї—А–µ—Ж–Є—О –±–Є–Ї–∞—А–±–Њ–љ–∞—В–Њ–≤, —Г–ї—Г—З—И–∞—О—В –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ, –љ–Њ—А–Љ–∞–ї–Є–Ј—Г—О—В –Љ–Њ—В–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ —В–∞–Ї–ґ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –љ–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Г–ї—М—В—А–∞—Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П. –Ш–Ј–≤–µ—Б—В–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є–є –Э2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤: —Ж–Є–Љ–Є—В–Є–і–Є–љ, —А–∞–љ–Є—В–Є–і–Є–љ, —Д–∞–Љ–Њ—В–Є–і–Є–љ. –Я–Њ—Б–ї–µ–і–љ–Є–є –Њ–±–ї–∞–і–∞–µ—В —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (–љ–µ –≤–ї–Є—П–µ—В –љ–∞ —Б–Є—Б—В–µ–Љ—Г —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –†450, –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В —Г—А–Њ–≤–µ–љ—М –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ), –і–µ–є—Б—В–≤—Г—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–µ–µ, —З–µ–Љ —Ж–Є–Љ–µ—В–Є–і–Є–љ. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, –њ—А–Є–µ–Љ —Д–∞–Љ–Њ—В–Є–і–Є–љ–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Б–љ–Є–ґ–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 74–94%, –≤ —В–µ—З–µ–љ–Є–µ 9–12 —З–∞—Б–Њ–≤ [1,3,4].
–Ш–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ —П–≤–ї—П—О—В—Б—П –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Њ–і–љ–Є–Љ–Є –Є–Ј —Б–∞–Љ—Л—Е –Љ–Њ—Й–љ—Л—Е –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П: –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї, –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї, –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –Є —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї. –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Э2––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є —Г –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –≤ —Б–Ї–Њ—А–Њ—Б—В–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є —П–≤–ї–µ–љ–Є–є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –і–µ—Д–µ–Ї—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ–Є —Б—В—А–µ—Б—Б–Њ–≤—Л–Љ–Є —П–Ј–≤–∞–Љ–Є [14]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є –ї–µ—З–µ–љ–Є–Є –љ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –њ—А–µ–њ–∞—А–∞—В—Г, –Ї–∞–Ї —Н—В–Њ –±—Л–≤–∞–µ—В –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є H2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ —Г–≥–љ–µ—В–∞—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 100%. –Я—А–Є —Н—В–Њ–Љ –≤–≤–Є–і—Г –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ—Б—В–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є —Н—Д—Д–µ–Ї—В —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є. –Р–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Э+/–Ъ+––Р–Ґ–§–∞–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–∞, –љ–∞–Ї–Њ–њ–Є–≤—И–µ–≥–Њ—Б—П –≤ –Ї–∞–љ–∞–ї—М—Ж–∞—Е –њ–∞—А–Є–µ—В–∞–ї—М–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –Є –њ–µ—А–Є–Њ–і–Њ–Љ –њ–Њ–ї—Г–ґ–Є–Ј–љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞. –Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –Ї–ї–µ—В–Ї–∞ —Б–љ–Њ–≤–∞ –љ–∞—З–∞–ї–∞ –њ—А–Њ–і—Г—Ж–Є—А–Њ–≤–∞—В—М —Б–Њ–ї—П–љ—Г—О –Ї–Є—Б–ї–Њ—В—Г, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–љ–Њ–≤—М —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М –њ—А–Њ—В–Њ–љ–љ—Л–µ –њ–Њ–Љ–њ—Л, —Б–≤–Њ–±–Њ–і–љ—Л–µ –Њ—В —Б–≤—П–Ј–Є —Б –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н—Д—Д–µ–Ї—В–∞ –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—П –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М—О –Њ–±–љ–Њ–≤–ї–µ–љ–Є—П –њ—А–Њ—В–Њ–љ–љ—Л—Е –њ–Њ–Љ–њ. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –Њ–±–ї–∞–і–∞–µ—В —Б–∞–Љ—Л–Љ –і–ї–Є–љ–љ—Л–Љ –њ–Њ–ї—Г–њ–µ—А–Є–Њ–і–Њ–Љ —Г–≥–љ–µ—В–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л (<45,9 —З) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–Њ–Љ (<27,5 —З) –Є –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї–Њ–Љ (12,9 —З). –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –µ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ–Љ —Б —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ –≤ 822––Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є —Ж–Є—Б—В–µ–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–≥—А—Г–ґ–µ–љ –≤ —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л–є –і–Њ–Љ–µ–љ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞. –Ґ–∞–Ї–ґ–µ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–Є—Б—В–µ–Љ—Г —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –†450 –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –Њ–±–ї–∞–і–∞–µ—В –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ –Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О. –Ю–і–љ–Њ–Ї—А–∞—В–љ—Л–є —Б—Г—В–Њ—З–љ—Л–є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—А–Є–µ–Љ 40 –Љ–≥ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –њ—А–Є–≤–Њ–і–Є–ї –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–µ–Љ—Г —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є, —З–µ–Љ 20 –Љ–≥ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ [5], –∞ –ї–Є–љ–µ–є–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —А–Э –њ—А–Є –њ–µ—А–µ—Е–Њ–і–µ —Б –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –љ–∞ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Г—О —Д–Њ—А–Љ—Г. –Ґ–∞–Ї–ґ–µ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–Њ–Љ —Г–ї—Г—З—И–∞–µ—В—Б—П —Н—Д—Д–µ–Ї—В —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –Э–µlicobacter Pylori [2,4,12].
–Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤–Њ–Ј—А–∞c—В–∞–µ—В –њ–Њ –Љ–µ—А–µ –њ–Њ–љ–Є–ґ–µ–љ–Є—П —А–Э –ґ–µ–ї—Г–і–Ї–∞. –Т–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ—Л–є —А–Э –±–Њ–ї—М—И–µ 6 –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—Б—В–∞–љ–Њ–≤–Ї–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ —А–µ—Ж–Є–і–Є–≤–љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П [4]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ pH 6,3 –Љ–Њ–ґ–љ–Њ –і–Њ—Б—В–Є–≥–љ—Г—В—М –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ 80 –Љ–≥ –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї–∞. –Х—Б—В—М –Љ–љ–µ–љ–Є–µ, —З—В–Њ –њ–Њ—Б—В–Њ—П–љ–љ–∞—П –Є–љ—Д—Г–Ј–Є—П 8 –Љ–≥ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –≤ —З–∞—Б –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [5,14].
–Я–Њ –і–∞–љ–љ—Л–Љ —А—П–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –±—Л—Б—В—А–µ–µ –њ–Њ–≤—Л—И–∞—О—В p–Э –≤ –ґ–µ–ї—Г–і–Ї–µ –Є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л, —З–µ–Љ –±–ї–Њ–Ї–∞—В–Њ—А—Л –Э2––≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –љ–∞—И–Є –і–∞–љ–љ—Л–µ –Є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [2]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–Њ–≤–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Э2––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –≤ –ї–µ—З–µ–љ–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –Њ—Б—В—А—Л—Е —П–Ј–≤ –ґ–µ–ї—Г–і–Ї–∞ [15].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В—А—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –љ–Є—Е –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л —Н—А–Њ–Ј–Є–є –Є –Є—Б–Ї–ї—О—З–Є—В—М —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є H2––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –њ–Њ—Б–ї–µ–і–љ–Є—Е –Ї –њ–∞–љ—В–Њ–њ—А–Њ–Ј–Њ–ї—Г –љ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М, –Њ–љ –Њ–±–ї–∞–і–∞–µ—В –љ–Є–Ј–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Љ–Є–љ–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М –µ–≥–Њ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –Т—Б–µ —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї) –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А—Л—Е —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ –њ–Њ—Б–ї–µ –Њ–±—И–Є—А–љ—Л—Е –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г –Є —В—П–ґ–µ—Б—В—М –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –Њ–њ–µ—А–∞—Ж–Є—П—Е –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –У–µ–ї—М—Д–∞–љ–і –С.–†., –Ь–∞—А—В—Л–љ–Њ–≤ –Р.–Э., –У—Г—А—М—П–љ–Њ–≤ –Т.–Р., –®–Є–њ–Є–ї–Њ–≤–∞ –Ю.–°. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —Б—В—А–µ—Б—Б––њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤–µ—А—Е–љ–µ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е. –•–Є—А—Г—А–≥–Є—П. Consilium Medicum. 2003; –Я—А–Є–ї. 2: 16–20.
2.–Ъ—Г–±—Л—И–Ї–Є–љ –Т.–Р., –®–Є—И–Є–љ –Ъ.–Т. –≠—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ // Consilium medicum вДЦ2, 2002, —Б. 33–39.
3. Constantin VD, Paun S, Ciofoaia VV, Budu V, Socea B. Multimodal management of upper gastrointestinal bleeding caused by stress gastropathy. J Gastrointestin Liver Dis. 2009 Sep;18(3):279–84.
4. –Ш—Б–∞–Ї–Њ–≤ –Т.–Р. –Ґ–µ—А–∞–њ–Є—П –Ї–Є—Б–ї–Њ—В–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –≤ –≤–Њ–њ—А–Њ—Б–∞—Е –Є –Њ—В–≤–µ—В–∞—Е//Consilium medicum вДЦ7, 2006, —Б. 2–5.
5. Jeong HK, Park CH, Jun CH, Lee GH, et all. A prospective randomized trial of either famotidine or pantoprazole for the prevention of bleeding after endoscopic submucosal dissection. J Korean Med Sci. 2007 Dec;22(6):1055–9.
6. Ojiako K, Shingala H, Schorr C, Gerber DR. Famotidine versus pantoprazole for preventing bleeding in the upper gastrointestinal tract of critically ill patients receiving mechanical ventilation. Am J Crit Care. 2008 Mar;17(2):142–7.
7. Faisy C, Guerot E, Diehl JL, Iftimovici E, Fagon JY. Clinically significant gastrointestinal bleeding in critically ill patients with and without stress–ulcer prophylaxis. Intensive Care Med. 2003 Aug;29(8):1306–13. Epub 2003 Jun 26.
8. Robert R, Gissot V, Pierrot M, Laksiri L, Mercier E, Prat G, Villers D, Vincent JF, Hira M, Vignon P, Charlot P, Burucoa C. Helicobacter pylory infection is not associated with an increaseed hemorrhagic risk in patients in the intensive care unit. Crit Care. 2006;10(3):R77. Epub 2006 May 16.
9. Onopriev V., Manuilov A., Rogal M., Voskanyan S. Experience with end–to–loop pancreaticoenteroanastomosis in pancreaticoduodenectomy. Hepato–Gastroenterology, 2003, Vol. 50. p. 1650–1654
10. Onopriev V., Korot’ko G., Voskanyan S., Korsakov I. Meaninig and principles of pancreatoprotection in surgical gastroenterology. Asian journal of surgery, 2003, Vol. 26, вДЦ1. P. 120.
11. –Т–Њ—Б–Ї–∞–љ—П–љ –°.–≠. –Я—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Њ—Б—В—А–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ –≤ —Е–Є—А—Г—А–≥–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е —П–Ј–≤. –Т –Ї–љ.: «–ѓ–Ј–≤–µ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –ґ–µ–ї—Г–і–Ї–∞», –њ–Њ–і —А–µ–і. –Т.–Ш.–Ю–љ–Њ–њ—А–Є–µ–≤–∞, –У.–§.–Ъ–Њ—А–Њ—В—М–Ї–Њ, –Э.–Т.–Ъ–Њ—А–Њ—З–∞–љ—Б–Ї–Њ–є, –°.–Э.–°–µ—А–Є–Ї–Њ–≤–Њ–є, –Ъ—А–∞—Б–љ–Њ–і–∞—А, –Ю–Ю–Ю –С–Ъ «–У—А—Г–њ–њ–∞ –С», 2006, —Б. 325–350.
12. Gisbert JP, Khorrami S, Carballo F, Calvet X, Gene E, Dominguez–Munoz JE. H. Pylori eradication therapy vs. antisecretory non–eradication therapy (with or without long–term maintenance antisecretory therapy) for the prevention of recurrent bleeding from peptic ulcer. Cochrane Database Syst Rev 2004;(2):CD004062.
13. Szabo S, Hollander D. Pathways of gastrointestinai protection and repair: Mechanisms of action of sucralfate. Am J Med 1989; 86(Suppl A):23–31
14. van Rensburg CJ, Hartmann M, Thorpe A, Venter L, Theron I, Luhmann R, Wurst W. Intragastric pH during continuous infusion with pantoprazole in patients with bleeding peptic ulcer. Am J Gastroenterol. 2003 Dec;98(12):2635–41.
15. Lin PC, Chang CH, Hsu PI, Tseng PL, Huang YB. The efficacy and safety of proton pump inhibitors vs histamine–2 receptor antagonists for stress ulcer bleeding prophylaxis among critical care patients: a meta–analysis. Crit Care Med. 2010 Apr;38(4):1197–205.












