и безопасности послеоперационного обезболивания
Мультимодальный подход к обеспечению защиты пациента от боли в хирургии, основанный на достижениях фундаментальных наук в исследовании механизмов боли, в настоящее время занимает все более прочные позиции в практической анестезиологии. Необходимость торможения афферентного потока болевой импульсации на разных уровнях его распространения теоретически обоснована и понятна клиницистам, которые с этой целью используют и исследуют разные средства и методы. Усилия исследователей направлены на предотвращение сильного послеоперационного болевого синдрома, развивающегося по окончании защитного действия интраоперационной анестезии, и на последующее поддержание адекватного послеоперационного обезболивания.
Одним из направлений совершенствования антиноцицептивной защиты стала так называемая предупреждающая аналгезия, т.е. начало применения средств системной и/или регионарной анестезии и аналгезии перед нанесением хирургической травмы тканей с целью уменьшения ее активирующего воздействия на ноцицептивную систему. Большой поток публикаций в мировой литературе последнего десятилетия посвящен оценке разных компонентов мультимодальной защиты пациента: нестероидные противовоспалительные препараты (НПВП), метамизол, опиоидные анальгетики, регионарные блокады. В отношении каждого из этих компонентов установлен положительный вклад в антиноцицептивную защиту, причем неопиоидные анальгетики и регионарные блокады позволяют значительно повысить эффективность традиционной послеоперационной опиоидной аналгезии, уменьшить потребность в опиоиде и связанные с ним нежелательные побочные эффекты [2,3,4,5,6,7,13,16].
По мере увеличения мирового опыта использования разных средств и методов периоперационной антиноцицептивной защиты предпринимаются аналитические исследования не только их эффективности, но и безопасности. Заслуживает внимания выполненный в Швейцарии сравнительный анализ 50 рандомизированных плацебо–контролируемых исследований, включающих 4661 пациента, в которых оценивали эффективность НПВП, селективных ингибиторов ЦОГ–2 и парацетамола с использованием метода контролируемой пациентом аналгезии по их влиянию на суточную потребность в морфине у пациентов, перенесших большие хирургические операции. Установлено достоверное снижение суточной дозы морфина при сочетании с парацетамолом на 8 мг, с НПВП – на 19 мг, а с ингибитором ЦОГ–2 – на 12 мг, т.е. по этому критерию НПВП были наиболее эффективны. Однако НПВП повышали риск серьезных геморрагических осложнений, олигурии и почечной недостаточности [14].
Проблема эффективности послеоперационной аналгезии не может рассматриваться в отрыве от проблемы ее безопасности, особенно если речь идет о пациенте, перенесшем большое хирургическое вмешательство со всеми его последствиями (травма тканей, кровопотеря, длительная анестезия с ИВЛ, вынужденное голодание, полимодальная интенсивная терапия и др.). В этих условиях нередко возникают ограничения к применению для послеоперационного обезболивания разных аналгетических средств, способных отрицательно повлиять на состояние оперированного пациента. Опиоидная моноаналгезия в современных хирургических учреждениях фактически не применяется из–за ее многочисленных серьезных побочных эффектов (депрессия сознания, дыхания, гиповентиляция легких, тошнота, рвота, нарушение функции ЖКТ и др.), которые могут приводить к осложнениям. Тем не менее опиоидный анальгетик в безопасной дозе, не приводящей к тяжелым побочным эффектам, является обязательным компонентом всех современных методов системной и регионарной послеоперационной аналгезии [9].
Наш многолетний опыт использования разных НПВП и метамизола как неопиоидных компонентов послеоперационного обезболивания подтверждает их существенный вклад в аналгезию и снижение дозы опиоида, однако ограничения и противопоказания к их применению возникают довольно часто. Среди нашего контингента онкологических больных нередко встречаются имеющие нарушения функции почек, показателей форменных элементов белой и красной крови (нейтропения, тромбоцитопения, анемия), особенно после проведенной полихимиотерапии, анамнестические указания или реально выявленные эрозивно–язвенные процессы ЖКТ, бронхиальная астма. При обширных операциях, сопряженных с большой кровопотерей, применение НПВП считаем нецелесообразным из–за их дезагрегационных свойств, облегчающих кровотечение, что было показано у больных, перенесших онкологические операции с микрохирургической аутопластикой [1]. Метамизол не обладает таким свойством, а также ульцерогенным действием и может быть применен у пациентов с указанными ограничениями к НПВП, однако он также не показан при вышеуказанных гематологических проблемах и нарушении функции почек.
В нашей практике строго соблюдается правило отказа от применения НПВП и препаратов метамизола у пациентов с вышеуказанными ограничениями, но и в тех случаях, когда эти препараты назначаются интактным пациентам, после операции в ОРИТ наряду с мониторингом жизненно важных функций, состояния волемии, диуреза, потерь по дренажам ежедневно проводится контроль и выявление возможных изменений гемограммы и биохимических показателей крови. В случае появления отрицательной тенденции какого–либо показателя применение НПВП и метамизола приостанавливается или прекращается. Это позволяет избежать осложнений.
В последние годы большое количество публикаций посвящено важной роли регионарных блокад как компонента мультимодальной антиноцицептивной защиты пациента в большой хирургии. Следует, однако, учитывать инвазивность этих методов анестезии и связанные с ними потенциальные опасности.
Разные аспекты эффективности и безопасности продленной эпидуральной анестезии в большой хирургии в настоящее время активно обсуждаются в специальной литературе. Несмотря на высокую эффективность регионарной антиноцицептивной блокады, этот инвазивный метод с его возможными опасными влияниями на сердечно–сосудистую деятельность на фоне сопутствующего симпатического блока требует для его неосложненного проведения учета множества факторов, мониторинга и своевременной коррекции выявляемых нарушений. Например, попытки компенсировать путем активной инфузионной терапии предоперационную дегидратацию или гипотензию, вызванную симпатическим блоком, приводят к кардио–респираторным расстройствам, отеку стенок ЖКТ с нарушением его функции и могут отрицательно влиять на результаты лечения оперированного пациента. Это подчеркивают исследователи, имеющие большой опыт применения и научного анализа центральных регионарных блокад, призывающие к осторожности и необходимости оптимизации продленной эпидуральной блокады путем ее интеграции с общей системой мультимодальной послеоперационной реабилитации пациентов в большой хирургии с мониторингом и поддержанием адекватного функционирования всех звеньев гомеостаза [15,16] для своевременной диагностики и коррекции потенциально опасных побочных эффектов эпидуральной анестезии.
В нашей практике приходится работать в основном с больными значительного и высокого риска, имеющими распространенный онкологический процесс, исходные гиповолемию, анемию, нутритивную недостаточность, нередко перенесших лучевую и полихимиотерапию и большую интраоперационную кровопотерю. В связи с этим мы осторожно относимся к применению продленной эпидуральной анестезии в абдоминальной и торакальной хирургии [6] и солидарны с мнением приведенных выше авторов о возможных опасностях, хотя широко используем регионарные блокады в хирургии органов малого таза и в онкоортопедии. Нельзя не принимать во внимание также возможность потенциально фатальных осложнений, связанных с применением центральных блокад (гематома, инфицирование, неврологические расстройства), на что указывают некоторые известные исследователи [13].
Таким образом, проблема послеоперационного обезболивания должна рассматриваться с позиции не только качества аналгезии, но и безопасности для пациента обеспечивающих ее компонентов. Многие годы требуются для объективной оценки с точки зрения «польза/вред» разных средств и методов, применяемых для послеоперационного обезболивания у разных контингентов больных. Большой мировой опыт использования НПВП, метамизола, регионарных блокад высветил не только их преимущества, но и серьезные недостатки, которые у многих пациентов могут превышать преимущества, что требует взвешенного подхода к индивидуальному выбору компонентов послеоперационного обезболивания.
С учетом всего изложенного специальный интерес для анестезиологии представляет недавно вошедший в клиническую практику новый неопиоидный препарат – парацетамол для внутривенного введения (Перфалган).
Среди всех существующих неопиоидных анальгетиков системного действия для применения в хирургии парацетамол отличается наибольшей безопасностью. Появление готовой формы парацетамола для внутривенного введения сделало возможным применение этого неопиоидного аналгетика в качестве компонента послеоперационного обезболивания.
Перфалган представляет собой готовую форму парацетамола для внутривенного введения во флаконах, содержащих 1 г парацетамола в 100 мл биологически совместимого раствора, имеющего рН 5,5, осмолярность 290 мОсм/л [18].
Наличие формы парацетамола для парентерального введения позволяет использовать в системе мультимодальной анестезиологической защиты пациента дополнительные центральные неопиоидные механизмы, присущие только этому анальгетику. Центральное аналгетическое действие парацетамола обусловлено по крайней мере двумя основными механизмами, уточненными экспериментальным путем в последние годы: а) избирательным ингибированием ЦОГ–3, приводящим к торможению продукции в структурах спинного мозга простаноидов – одного из факторов центральной сенситизации, б) активацией серотонинергического торможения боли на спинальном уровне. Наряду с этим в отношении парацетамола, как и в отношении НПВП, в эксперименте установлена способность снижать продукцию болевого трансмиттера – оксида азота в ЦНС [10], а также уменьшать спинальную гипералгезию, индуцированную NMDA и субстанцией «Р» [12]. Эти экспериментальные данные подтверждены у человека [17], т.е. парацетамолу присущи важные свойства, связанные с торможением нескольких звеньев процесса спинальной сенситизации и гипералгезии, лежащего в основе развития сильного послеоперационного болевого синдрома в случае недостаточной антиноцицептивной защиты.
Перфалган как компонент периоперационной аналгезии при онкологических операциях
Цель исследования: оценить эффективность, переносимость и безопасность Перфалгана как компонента периоперационной аналгезии при онкологических операциях разной травматичности.
Материалы и методы исследования
Исследования выполнены у 102 онкологических больных 33–77 лет (57,4±10,8), перенесших радикальные оперативные вмешательства. Масса тела пациентов – 75,9±11,2 кг (54–103 кг). По физическому статусу все больные соответствовали II–III классам ASA. Среди них не было пациентов с анамнезом и клиническими симптомами язвенной болезни, бронхиальной астмы, нарушения функции печени и почек.
Выполненные больным операции разделены на 3 группы (в зависимости от степени травматичности):
Группа 1 – большие травматичные абдоминальные – 47, продолжительностью в среднем 4,6±2,3 ч;
Группа 2 – радикальные онко–гинекологические средней травматичности – 20 (3,9±1,8 ч);
Группа 3 – радикальные неполостные операции средней травматичности по поводу рака гортани, щитовидной железы и молочной железы – 35 (2,1±1,5 ч).
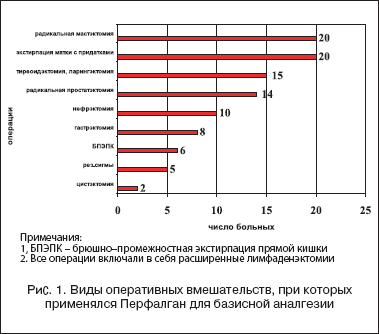
Распределение больных по виду оперативного вмешательства представлено на рисунке 1. Во всех случаях применена тактика профилактического введения Перфалгана во время вводной анестезии (1 г внутривенно капельно в течение 15 мин.). Всем больным проводили мультимодальную общую анестезию на основе мидазолама, пропофола, фентанила и кетамина по принятой в институте методике [5,10].
Обезболивание Перфалганом продолжали в послеоперационном периоде в условиях ОРИТ, при необходимости сочетая его с опиоидом средней потенции трамадолом или более мощным опиоидом бупренорфином в зависимости от травматичности операции. По окончании операций после перевода пациентов в ОРИТ при появлении первых признаков послеоперационной боли осуществляли внутривенную инфузию Перфалгана в дозе 1 г. В дальнейшем на фоне базисной аналгезии Перфалганом по показаниям применяли опиоидный анальгетик. Плановая суточная доза Перфалгана составляла 4 г. Длительность терапии Перфалганом в подавляющем числе наблюдений не превышала трех дней.
Интенсивность послеоперационной боли оценивали по шкале вербальных оценок – ШВО (0 – боли нет, 1 балл – слабая боль при движении, 2 балла – слабая боль в покое и умеренная при движении, 3 балла – умеренная боль в покое и сильная при движении, 4 балла – сильная боль в покое и очень сильная боль при движении). Учитывали суточную дозу опиоида, необходимую для полноценной аналгезии на фоне плановой терапии Перфалганом. Для объективной оценки качества аналгезии определяли в динамике концентрацию кортизола в плазме крови как показатель стресса. Возможные побочные эффекты аналгетической терапии выявляли путем опроса, клинического исследования пациентов, проведения непрерывного мониторинга АД, ЧСС, SaO2, ЭКГ, динамического наблюдения за показателями КОС, билирубина, трансаминаз.
Результаты и их обсуждение
В ОРИТ первые болевые ощущения появлялись у больных не ранее 2 ч от момента окончания операции, т.е. после окончания общей анестезии сохранялась следовая аналгезия. На этом этапе, не дожидаясь развития сильной боли, пациентам вводили первую послеоперационную, т.е. вторую по счету дозу Перфалгана (1 г).
Интенсивность боли колебалась перед введением Перфалгана в разных группах больных составляла от 1,1 до 1,7 балла и после полостных операций соответствовала умеренной, а после неполостных – от слабой до умеренной. Спустя 1 ч после инфузии Перфалгана (1 г) снова оценивали интенсивность боли по ШВО и наблюдали за дальнейшей динамикой болевых ощущений. Результаты представлены в таблице 1.
Установлено, что через 1 ч после введения первой послеоперационной дозы Перфалгана интенсивность боли снижалась до слабой или незначительной у всех пациентов, и применение опиоидного аналгетика не требовалось. Продолжительность аналгетического действия первой послеоперационной дозы Перфалгана зависела от масштабов выполненной операции и была наибольшей (14,5±3,4 ч) после неполостных операций и наименьшей (10,2±1,7 ч) после больших абдоминальных операций, т.е. плановая терапия Перфалганом позволяет отсрочить введение опиоидного аналгетика в раннем послеоперационном периоде, что важно для полной посленаркозной реабилитации пациента и предотвращения продленной центральной депрессии, неизбежной при рутинной опиоидной послеоперационной аналгезии.
Последующие 2 из 4 разрешенных в течение суток стандартных разовых доз (1 г) Перфалгана распределяли по времени до конца первых суток, считая от введения первой предоперационной дозы. Пациенты находились в полном сознании, выполняли все инструкции и рекомендации врача, и при тенденции даже к незначительному усилению боли им вводили опиоидный анальгетик трамадол после гинекологических (группа 2) и неполостных (группа 3) операций или бупренорфин после абдоминальных операций (группа 1).
Оценка качества послеоперационного обезболивания наиболее важна на 2–е сутки после операции, когда исключается остаточное действие общей анестезии, и послеоперационная боль бывает максимальной. Оценка качества аналгезии, выполненная на 2–е сутки послеоперационного периода, представлена в таблицах 2 и 3.
Поскольку показатели послеоперационной аналгезии Перфалганом в сочетании с трамадолом были сходными у больных групп 2 и 3, полученные в обеих группах результаты представлены совместно в таблице 2, из которой следует, что на фоне базисной терапии Перфалганом полное или почти полное послеоперационное обезболивание (0,4±0,6 балла по ШВО) достигалось при минимальной суточной дозе «малого опиоида» трамадола (180±77 мг/сут.), т.е. для большинства пациентов было достаточно 2 инъекций по 100 мг и для отдельных пациентов – 1 или 3 инъекций по 100 мг. При этом не выявлялось каких–либо побочных эффектов, которые можно было связать с Перфалганом или трамадолом.
Показатели послеоперационного обезболивания Перфалганом в сочетании с бупренорфином у больных, перенесших большие абдоминальные операции, приведены в таблице 3.
В этой группе суточная доза бупренорфина у всех больных составила 0,6 мг, т.е. 2 внутримышечные инъекции по 0,3 мг. Эта доза опиоида в 1,5–2 раза ниже необходимой после подобных операций при монотерапии бупренорфином, которая, по данным литературы и собственных исследований (табл. 4 – контроль), составляет от 0,9 до 1,2 мг/сут. и приводит к выраженной седации и депрессии дыхания [3,8]. В исследованной группе хорошая аналгезия в течение суток (0,6±0,8 балла ШВО, т.е. отсутствие боли в покое и незначительная боль при движениях и кашле) поддерживалась без каких–либо побочных симптомов аналгетической терапии. Пациенты были контактны, способны глубоко дышать и кашлять, удовлетворены обезболиванием.
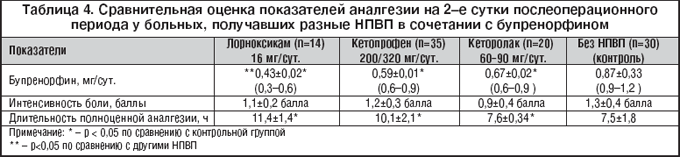
Потребность в бупренорфине на фоне базисной аналгезии Перфалганом достоверно не отличается от таковой в ранее проведенном нами исследовании с использованием по аналогичной схеме разных НПВП (табл. 4) [8].
Cамое низкое среднее значение суточной дозы бупренорфина (0,43±0,02 мг/сут.) было получено в группе с лорноксикамом. При этом средний уровень боли по ШВО был самым низким в группе с Перфалганом, а продолжительность аналгезии после введения разовой дозы бупренорфина 0,3 мг была наибольшей на фоне базисной неопиоидной аналгезии Перфалганом (10,2±1,7 ч) и лорноксикамом (11,4±1,4 ч).
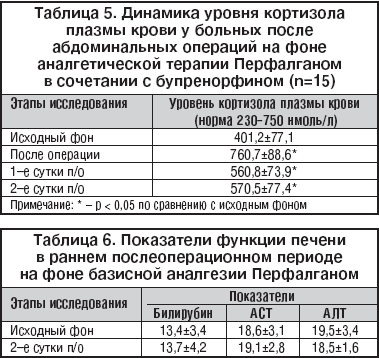
Объективное уточнение благоприятного клинического впечатления от послеоперационного обезболивания Перфалганом в сочетании с бупренорфином в абдоминальной онкохирургии было проведено у 15 пациентов путем исследования динамики концентрации в плазме крови гормона стресса кортизола (табл. 5).
Установлено, что исходные уровни гормона были в пределах нормы, составляя в среднем 401,2±77,1 нмоль/л. В пробах крови, взятых у пациентов сразу по окончании операции, выявлено достоверное увеличение уровня гормона до верхней границы нормы или чуть выше ее (760,7±88,6 нмоль/л), что находится в пределах физиологической реакции на внешнее воздействие. В течение 2 суток послеоперационного периода содержание кортизола в крови на фоне проводимого обезболивания соответствовало норме, хотя и превышало исходный уровень, что следует расценивать как адекватную естественную адаптационную реакцию организма оперированных больных.
При установленной в ходе работы хорошей общей и местной переносимости Перфалгана и отсутствии клинически выраженных побочных эффектов важным аспектом считали оценку функционального состояния печени на фоне терапии Перфалганом, поэтому у всех пациентов ежедневно выполняли биохимическое исследование показателей билирубина и печеночных трансаминаз – АЛТ и АСТ. Не установлено достоверных изменений этих показателей по сравнению с исходной нормой (табл. 6).
Заключение
Проведенное исследование и новейшие данные специальной литературы указывают на важную роль неопиоидного аналгетика парацетамола в системе мультимодальной защиты пациента от боли в хирургии. Готовая форма парацетамола Перфалган расширяет возможности обеспечения эффективного и безопасного послеоперационного обезболивания в хирургии при значительном сокращении потребности в опиоидном аналгетике и снижении связанных с ним побочных эффектов, способных осложнить состояние оперированного пациента.
В отличие от традиционного неопиоидного компонента послеоперационного обезболивания – НПВП, Перфалган при аналогичной эффективности не имеет присущего НПВП комплекса побочных свойств, нередко создающих противопоказания к их использованию для периоперационной неопиоидной базисной аналгезии. Для парацетамола/Перфалгана существует фактически единственное ограничение – нарушение функции печени, поэтому показания к его назначению оперированным больным с целью обезболивания более широки, чем у НПВП. Оба неопиоидных компонента – парацетамол и НПВП – заслуживают применения для послеоперационного обезболивания, а выбор в каждом конкретном случае следует осуществлять индивидуально в целях безопасности пациента. Такой подход позволяет получить оптимальный результат без побочных эффектов и осложнений.


Литература
1. Ермолаев П.М. Анестезиологическое пособие и интенсивная терапия при операциях с микрохирургической аутопластикой в онкологии. Автореф. Дисс. канд. мед.наук, М., 2005 г.
2. Карпов И.А., Овечкин А.М. Современные возможности оптимизации послеоперационного обезболивания в абдоминальной хирургии. «Боль», 2005, №1, с.15–20.
3. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. М. Аир–Арт., 1998
4. Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеоперационной анальгезии. «Анестезиол. и реаниматол.», 1998, №5, с.11–15.
5. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Средства периферического и сегментарного уровней защиты пациента в системе общей анестезии и послеоперационного обезболивания. «Анестезиол. и реаниматол.», 2002, №4, с.14–19
6. Осипова Н.А., Петрова В.В., Митрофанов С.В., Береснев В.А. и др. Системная и регионарная антиноцицептивная защита пациента в хирургии. Проблема выбора. «Анестезиол. и реаниматол.», 2006, №4, с.12–16.
7. Осипова Н.А., Свиридов С.В. Обоснование применения ингибиторов простагландино– и кининогенеза в комплексе общей анестезии и послеоперационного обезболивания. «Анестезиол. и реаниматол.», 1993, №2, с.3–9.
8. Петрова В.В., Осипова Н.А., Береснев В.А., Долгополова Т.В. Лорноксикам (ксефокам) как средство профилактики и лечения послеоперационного болевого синдрома среди других НПВП. «Анестезиол. и реаниматол.», № 5, с.39–44.
9. Светлов В.А., Зайцев А.Ю., Козлов С.П. Сбалансированная анестезия на основе регионарных блокад: стратегия и тактика. «Анестезиол. и реаниматол.», 2006, №4, с.4–12.
10. Хороненко В.Э., Осипова Н.А., Петрова В.В. и др. Внутривенная общая анестезия с самостоятельным дыханием пациентов при неполостных онкологических операциях. «Анестезиол. и реаниматол.», 2001 №5, с.36–40
11. Bj?rkman R. Antinociceptive effects of non–steroidal anti–inflammatory drugs and paracetamol. Acta Anaesthesiol. Scand., 1995, 39, 1039.
12. Bj?rkman R., Hallman K.M., Hedner T., Henning M. Acetaminophen blocks spinal hyperalgesia induced by NMDA and substance P. Pain, 1994, 57, 259–264.
13. Breivik H. Postoperative pain: toward optimal pharmacological and epidural analgesia. Pain 2002– an Updated Review. IASP. Press. Seattle, 2002, p.337–349.
14. Elia N., Lysakowski C., Tramer M. Concomitant use of non–opioid analgesics and morphine after maior surgery – is there a clinically relevant morphine sparing effect? A meta–analysis of randomized trials. Europ. J. of Anasthesiology, 2005, v.22 Suppl.34, p.187, A–726.
15. Holte K., Kehlet H. Compensatory fluid administration for preoperative dehydratation –does it improve outcome? Acta Anaesthesiol. Scand. 2002.
16. Kehlet H. Effects postoperative pain relief on Outcome. Pain 2005– an Updated Review. IASP. Press. Seattle, 2005, p.277–281.
17. Koppert W., Webertritz A., Korber N. The cyclooxygenase isoenzime inhibitors parecocsib and paracetamol induce central hyperalgesia in humans. Pain, 2004, 108, 148–153.
18. Schmitt E., Vainchtock A., Nicoloyannis N., Locher F., Meszobian X. Readdy to use injectable paracetamol: easier, safer, lovering workload and costs. Europ. J. of Hospital Pharmacy (E.J.H.P.), 2003, v.9. Iss 6, p.96–102.












