–Т–≤–µ–і–µ–љ–Є–µ
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —Б–∞–Љ –Љ–µ—В–Њ–і –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Ъ–Ґ) –њ–Њ—П–≤–Є–ї—Б—П –≥–Њ—А–∞–Ј–і–Њ —А–∞–љ—М—И–µ –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –µ—Й–µ –і–Њ–ї–≥–Њ —Б–і–µ—А–ґ–Є–≤–∞–ї–Њ—Б—М –Љ–љ–Њ–≥–Є–Љ–Є –љ–µ—А–µ—И–µ–љ–љ—Л–Љ–Є —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–і–∞—З–∞–Љ–Є. –Я–µ—А–≤—Л–µ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Л–µ —В–Њ–Љ–Њ–≥—А–∞—Д—Л, –њ–Њ—П–≤–Є–≤—И–Є–µ—Б—П –≤ 1973 –≥., –Є–Љ–µ–ї–Є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї—Г—О —В—А—Г–±–Ї—Г, –њ—Г—З–Њ–Ї –ї—Г—З–µ–є, –Ї–Њ—В–Њ—А–Њ–є –±—Л–ї –љ–∞–њ—А–∞–≤–ї–µ–љ —В–Њ–ї—М–Ї–Њ –љ–∞ –Њ–і–Є–љ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є–є –і–µ—В–µ–Ї—В–Њ—А. –Я—А–Є —Н—В–Њ–Љ –Њ–і–Є–љ –Њ–±–Њ—А–Њ—В —В—А—Г–±–Ї–Є –≤–Њ–Ї—А—Г–≥ –Њ–±—К–µ–Ї—В–∞ –њ–Њ–Ј–≤–Њ–ї—П–ї –њ–Њ–ї—Г—З–Є—В—М –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ –Њ–і–љ–Њ–≥–Њ —Б–ї–Њ—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —В–∞–Ї–Њ–µ –њ–Њ—И–∞–≥–Њ–≤–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –і–Њ–≤–Њ–ї—М–љ–Њ –љ–Є–Ј–Ї–Њ–є —Б–Ї–Њ—А–Њ—Б—В—М—О, —З—В–Њ, –љ–∞—А—П–і—Г —Б –њ—А–Њ—З–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–ї–Њ –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Т–Њ –≤—В–Њ—А–Њ–Љ –њ–Њ–Ї–Њ–ї–µ–љ–Є–Є —В–Њ–Љ–Њ–≥—А–∞—Д–Њ–≤ –Ј–∞ –Њ—Б–љ–Њ–≤—Г –±—Л–ї –≤–Ј—П—В –≤–µ–µ—А–љ—Л–є —В–Є–њ –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–∞–њ—А–Њ—В–Є–≤ —В—А—Г–±–Ї–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Њ—Б—М —Г–ґ–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–µ—В–µ–Ї—В–Њ—А–Њ–≤, –њ—А–Є —Н—В–Њ–Љ –≤—А–µ–Љ—П –Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –≤ —А–∞–Ј—Л —Б–Њ–Ї—А–∞—Й–∞–ї–Њ—Б—М, –і–∞–≤–∞—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М –±–Њ–ї–µ–µ –њ—А–Њ—В—П–ґ–µ–љ–љ—Г—О –Њ–±–ї–∞—Б—В—М –Ј–∞ –Њ–і–Є–љ –Њ–±–Њ—А–Њ—В —В—А—Г–±–Ї–Є. –° –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –∞–њ–њ–∞—А–∞—В–Њ–≤ —В—А–µ—В—М–µ–≥–Њ, –∞ –Ј–∞—В–µ–Љ –Є —З–µ—В–≤–µ—А—В–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є–є, —А–∞–±–Њ—В–∞—О—Й–Є—Е –њ–Њ –њ—А–Є–љ—Ж–Є–њ—Г —Б–њ–Є—А–∞–ї—М–љ–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ—Л–Љ –і–≤–Є–ґ–µ–љ–Є–µ–Љ —Б—В–Њ–ї–∞ –Є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є —В—А—Г–±–Ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і—А—Г–≥ –і—А—Г–≥–∞, —Б—В–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –µ—Й–µ –±–Њ–ї—М—И–µ —Б–Њ–Ї—А–∞—В–Є—В—М –≤—А–µ–Љ—П —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П, —Б–љ–Є–Ј–Є–≤ –њ—А–Є —Н—В–Њ–Љ –ї—Г—З–µ–≤—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞.
–Я–µ—А–≤—Л–µ –њ–Њ–њ—Л—В–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –ЪT –±—Л–ї–Є –њ—А–µ–і–њ—А–Є–љ—П—В—Л –≤ –Ї–Њ–љ—Ж–µ 1990-—Е –≥–Њ–і–Њ–≤. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –±—Л–ї–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ—Л –љ–∞ –њ—А–Є–Љ–µ—А–∞—Е –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –∞—А—В–µ—А–Є–є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є [1вАУ4]. –° —Г—З–µ—В–Њ–Љ –Є–Љ–µ—О—Й–Є—Е—Б—П —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є –Њ—Е–≤–∞—В–Є—В—М –±–Њ–ї—М—И–Є–µ –њ–Њ –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є —Г—З–∞—Б—В–Ї–Є —В–µ–ї–∞, –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –њ—А–Њ—Е–Њ–і–Є–ї–∞ –љ–∞ –Ї–∞–Ї–Њ–Љ-—В–Њ –Њ–і–љ–Њ–Љ –≤—Л–±—А–∞–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ: –≥—А—Г–і–љ–Њ–є –Є–ї–Є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ-–±–µ–і—А–µ–љ–љ–Њ–≥–Њ –Є–ї–Є –њ–Њ–і–Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–Њ–≤ –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є [5вАУ7]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤ 3D-—А–µ–ґ–Є–Љ–µ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –і–Њ–±–Є—В—М—Б—П –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Љ–∞–≥–Є—Б—В—А–∞–ї–µ–є –Є–ї–Є –±–Њ–ї–µ–µ –Љ–µ–ї–Ї–Є—Е –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї–µ–є.
–Я–Њ—П–≤–ї–µ–љ–Є–µ 8-–і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–Ї–∞–љ–µ—А–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ—А–Њ–≤–Њ–і–Є—В—М —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ –≤—Б–µ–Љ —В—А–µ–Љ –Њ—Б—П–Љ (X, Y –Є Z), —З—В–Њ –±—Л–ї–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –і–ї—П –њ–Њ—Б—В—А–Њ–µ–љ–Є—П –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤ 3D-—Д–Њ—А–Љ–∞—В–µ. –Я—А–Є —Н—В–Њ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—В–Є–ї–Њ—Б—М –Є –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [8вАУ10]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–∞–љ–љ—Л–µ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ —А–µ—И–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–µ–≥–Љ–µ–љ—В–Њ–≤ —В–µ–ї–∞ –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О –і–Њ 1,5 –Љ, —З—В–Њ –і–∞–≤–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–Є—В—М –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤—Б–µ–є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Є —В–∞–Ј–∞ –Ј–∞ –Њ–і–Є–љ –Ј–∞—Е–≤–∞—В —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є –њ–Њ—Б—В—А–Њ–µ–љ–Є–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤ 3D-—А–µ–ґ–Є–Љ–µ [11вАУ13].
–Я—А–Њ–≤–µ–і–µ–љ–Є–µ –±—Л—Б—В—А–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є 8 –і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–Ї–∞–љ–µ—А–Њ–≤ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —В–Њ–љ–Ї–Є—Е —Б—А–µ–Ј–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ–Њ–ї—Г—З–Є—В—М –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –∞—А—В–µ—А–Є–є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞, —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞—А—В–µ—Д–∞–Ї—В–Њ–≤, –±–µ–Ј –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ [14, 15].
–Ю–і–љ–Є–Љ–Є –Є–Ј –њ–µ—А–≤—Л—Е –Њ —П–≤–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞—Е –Љ–љ–Њ–≥–Њ–і–µ—В–µ–Ї—В–Њ—А–љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (Multi-Detector CT, MDCT) –≤ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –±—А—О—И–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є —Б–Њ–Њ–±—Й–Є–ї–Є M.L. Martin et al. [16]. –Т –і–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –∞–≤—В–Њ—А—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М MDCT-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Ж–Є—Д—А–Њ–≤–Њ–є —Б—Г–±—В—А–∞–Ї—Ж–Є–Њ–љ–љ–Њ–є –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–µ–є (Digital Subtraction Angiography, DSA). –Ґ–∞–Ї, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–∞ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е –Њ–Ї–Ї–ї—О–Ј–Є–є —Б–Њ—Б—В–∞–≤–Є–ї–Є 88,6% –Є 97,7% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –∞ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е —Б—В–µ–љ–Њ–Ј–Њ–≤ вАУ 92,2% –Є 96,8% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ –Љ–љ–µ–љ–Є—О –∞–≤—В–Њ—А–Њ–≤, MDCT-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б DSA –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є—В—М –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –љ–∞ —Г—А–Њ–≤–љ–µ –≥–Њ–ї–µ–љ–Є, –≥–і–µ DSA –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≥–Њ—А–∞–Ј–і–Њ —Е—Г–ґ–µ –Є–Ј-–Ј–∞ –±–Њ–ї—М—И–Є—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Б–Ї–Њ—А–Њ—Б—В–Є –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –∞—А—В–µ—А–Є–є [17]. –≠—В–Њ –і–µ–ї–∞–ї–Њ –Љ–µ—В–Њ–і MDCT-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –Њ—Б–Њ–±–Њ —Ж–µ–љ–љ—Л–Љ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –∞—А—В–µ—А–Є–є –љ–Є–ґ–µ –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Є–љ—П—В–Є—П —А–µ—И–µ–љ–Є—П –Њ —Е–∞—А–∞–Ї—В–µ—А–µ –Є –Њ–±—К–µ–Љ–µ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ [16]. –Я—А–Є —Н—В–Њ–Љ —А–∞—Б—З–µ—В–љ—Л–Љ –њ—Г—В–µ–Љ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–Њ–Ј–∞ –Њ–±–ї—Г—З–µ–љ–Є—П –њ—А–Є MDCT-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –±—Л–ї–∞ –≤ 3,9 —А–∞–Ј–∞ –љ–Є–ґ–µ, —З–µ–Љ –њ—А–Є DSA [15].
–Я–µ—А–≤—Л–µ 16-–і–µ—В–µ–Ї—В–Њ—А–љ—Л–µ —Б–Ї–∞–љ–µ—А—Л –њ–Њ—П–≤–Є–ї–Є—Б—М –≤ 2004вАУ2005 –≥–≥. –Т –љ–Є—Е, –њ–Њ–Љ–Є–Љ–Њ –µ—Й–µ –±–Њ–ї—М—И–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –і–µ—В–µ–Ї—В–Њ—А–Њ–≤, –±—Л–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ —Б–њ–Є—А–∞–ї—М–љ—Л–є –њ—А–Є–љ—Ж–Є–њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–є –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –Є–Љ–µ–ї –љ–∞–Ј–≤–∞–љ–Є–µ –≤–Є–љ—В–Њ–≤–Њ–≥–Њ [8]. –Я–Њ—Б—В—А–Њ–µ–љ–Є–µ –±–Њ–ї–µ–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є —Ж–≤–µ—В–љ–Њ–≥–Њ 3D-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б—В–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ c –≤–љ–µ–і—А–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –љ–Њ–≤—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П: –Љ–љ–Њ–≥–Њ–њ–ї–Њ—Б–Ї–Њ—Б—В–љ–Њ–≥–Њ –њ—А–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П (Multi-Planer Reformation, MPR) –Є –Њ–±—К–µ–Љ–љ–Њ–≥–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П (Volume-Rendering, VR) [18].
–С–ї–∞–≥–Њ–і–∞—А—П –≤–љ–µ–і—А–µ–љ–Є—О MDCT –њ—А–Њ—Ж–µ—Б—Б –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —Б—В–∞–ї –љ–∞–Љ–љ–Њ–≥–Њ –±—Л—Б—В—А–µ–µ, –∞ –њ–Њ–ї—Г—З–µ–љ–љ–Њ–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ –Є–Љ–µ–ї–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–µ —А–∞–Ј—А–µ—И–µ–љ–Є–µ. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–њ–Є—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–љ—Ж–Є–њ–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П —А–µ—И–∞–ї–∞—Б—М –Њ–і–љ–∞ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Ј–∞–і–∞—З вАФ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л –њ—Г—З–Ї–∞ —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П (–Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є). –Т –Њ–і–љ–Њ–і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–Є—Б—В–µ–Љ–∞—Е —А–∞–Ј–Љ–µ—А –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є —А–∞–≤–љ—П–ї—Б—П —В–Њ–ї—Й–Є–љ–µ —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—А–µ–Ј–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–ї 5вАУ8 –Є–ї–Є 10 –Љ–Љ. –І–µ—В—Л—А–µ –і–µ—В–µ–Ї—В–Њ—А–љ—Л–µ —Б–Є—Б—В–µ–Љ—Л –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Г–Љ–µ–љ—М—И–Є—В—М —А–∞–Ј–Љ–µ—А –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ 4 –і–µ—В–µ–Ї—В–Њ—А–∞ –њ—А–Є –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є 1 –Љ–Љ –њ–Њ–Ј–≤–Њ–ї—П–ї–Є –њ–Њ–ї—Г—З–Є—В—М 4 –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б —В–Њ–ї—Й–Є–љ–Њ–є —Б—А–µ–Ј–∞ –≤ 1 –Љ–Љ, 2 –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –њ–Њ 2 –Љ–Љ –Є–ї–Є 1 –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ —Б —В–Њ–ї—Й–Є–љ–Њ–є —Б—А–µ–Ј–∞ (—А–∞–Ј–Љ–µ—А–Њ–Љ –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є) –≤ 4 –Љ–Љ —Б –њ—А–Њ–і–Њ–ї—М–љ–Њ–є –Є–љ—В–µ—А–њ–Њ–ї—П—Ж–Є–µ–є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –њ—А–Є –Њ–і–љ–Њ–Љ –Њ–±–Њ—А–Њ—В–µ –і–µ—В–µ–Ї—В–Њ—А–Њ–≤ –љ–∞ 360¬∞ –Є–ї–Є 180¬∞. –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –њ—А–Њ–і–Њ–ї—М–љ–∞—П –Є–љ—В–µ—А–њ–Њ–ї—П—Ж–Є—П –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–∞ —Б–Њ–±–Њ–є —Б–њ–Њ—Б–Њ–± —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–Є–Ї—Б–µ–ї–µ–є –≤ —А–∞—Б—В—А–Њ–≤–Њ–Љ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–Є [19]. –Я–Њ–љ—П—В–љ–Њ, —З—В–Њ –њ—А–Є —Б–њ–Є—А–∞–ї—М–љ–Њ–Љ —Б–њ–Њ—Б–Њ–±–µ –Њ–±—А–∞–±–Њ—В–Ї–Є —Б–Є–≥–љ–∞–ї–∞ –≤ —Г—Б–ї–Њ–≤–Є—П—Е 16 –і–µ—В–µ–Ї—В–Њ—А–Њ–≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Є–Ї—Б–µ–ї–µ–є –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –њ–ї–Њ—Й–∞–і–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Њ—Б—М. –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –≤—Б–µ –Ј–∞–≤–Є—Б–µ–ї–Њ –Њ—В —И–∞–≥–∞ —Б–њ–Є—А–∞–ї–Є. –Т—В–Њ—А–Њ–є –≤–µ–ї–Є—З–Є–љ–Њ–є, –≤–ї–Є—П—О—Й–µ–є –љ–∞ –±—Л—Б—В—А–Њ—В—Г –њ–Њ–ї—Г—З–µ–љ–Є—П –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є, —П–≤–ї—П–ї–∞—Б—М —Б–Ї–Њ—А–Њ—Б—В—М —Б–Љ–µ—Й–µ–љ–Є—П —Б—В–Њ–ї–∞, –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–є, –љ–∞–њ—А–Є–Љ–µ—А, –≤ 2 —А–∞–Ј–∞ –Ј–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ–±–Њ—А–Њ—В–Њ–≤ —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є —В—А—Г–±–Ї–Є –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М –Ј–Њ–љ—Л —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –≤—Л—А–∞—Б—В–∞–ї–∞ –≤–і–≤–Њ–µ –њ—А–Є —А–∞–≤–љ–Њ–Љ –≤—А–µ–Љ–µ–љ–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П [20]. –Ф—А—Г–≥–Є–Љ —Б–ї–µ–і—Б—В–≤–Є–µ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б–Ї–Њ—А–Њ—Б—В–Є –і–≤–Є–ґ–µ–љ–Є—П —Б—В–Њ–ї–∞ —П–≤–ї—П–ї–∞—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤–µ–ї–Є—З–Є–љ—Л –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –Њ–±—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є –Ј–Њ–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [18].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ–љ–µ—З–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —В–Њ–ї—Й–Є–љ–Њ–є –њ—Г—З–Ї–∞ —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П (—А–∞–Ј–Љ–µ—А–Њ–Љ –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є), –љ–Њ –Є —Д–Њ—А–Љ–Њ–є —Б–њ–Є—А–∞–ї–Є, –µ–µ ¬Ђ—А–∞—Б—В—П–ґ–µ–љ–Є–µ–Љ¬ї –≤–і–Њ–ї—М –њ—А–Њ–і–Њ–ї—М–љ–Њ–є –Њ—Б–Є. –С–Њ–ї–µ–µ —В–Њ—З–љ–Њ–є –Є –њ–Њ–ї–љ–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є —Б–њ–Є—А–∞–ї—М–љ–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П —П–≤–ї—П–µ—В—Б—П –њ–Њ–љ—П—В–Є–µ ¬Ђ—И–∞–≥ —Б–њ–Є—А–∞–ї–Є¬ї вАФ –њ–Є—В—З (pitch), –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Њ—В–љ–Њ—И–µ–љ–Є–µ —Б–Љ–µ—Й–µ–љ–Є—П —Б—В–Њ–ї–∞ –Ј–∞ –Њ–і–Є–љ –Њ–±–Њ—А–Њ—В —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є —В—А—Г–±–Ї–Є (table feed per rotation) –Ї —В–Њ–ї—Й–Є–љ–µ –њ—Г—З–Ї–∞ —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П (slice collimation). –Т —Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ъ–Ґ —И–∞–≥ —Б–њ–Є—А–∞–ї–Є –Љ–Њ–ґ–µ—В –Є–Ј–Љ–µ–љ—П—В—М—Б—П –Њ—В 0,1 –і–Њ 2. –І–µ–Љ –±–Њ–ї—М—И–µ –≤–µ–ї–Є—З–Є–љ–∞ —И–∞–≥–∞ —Б–њ–Є—А–∞–ї–Є, —В–µ–Љ –±—Л—Б—В—А–µ–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Є —А–∞–≤–љ–Њ–є —В–Њ–ї—Й–Є–љ–µ —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–ї–Њ—П –Є –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є –Ј–Њ–љ—Л —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П [21]. –Ф—А—Г–≥–Є–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –≤ –Љ–љ–Њ–≥–Њ–і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞–њ–њ–∞—А–∞—В–∞—Е —В–Њ–ї—Й–Є–љ–∞ —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–ї–Њ—П –њ—А–µ–≤—Л—И–∞–ї–∞ –≤–µ–ї–Є—З–Є–љ—Г –Ї–Њ–ї–ї–Є–Љ–∞—Ж–Є–Є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П, –Є–Ј-–Ј–∞ —З–µ–≥–Њ –њ—А–Є –њ–Њ–ї—Г—З–µ–љ–Є–Є –±–Њ–ї–µ–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б–љ–Є–ґ–∞–ї–∞—Б—М –і–Њ–Ј–∞ –Њ–±–ї—Г—З–µ–љ–Є—П [20]. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–љ–Њ–≥–Њ–і–µ—В–µ–Ї—В–Њ—А–љ–Њ–є —Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ъ–Ґ —В–Њ–ї—Й–Є–љ–∞ —Б–ї–Њ—П —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –і–Њ 1 –Љ–Љ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Г–≤–µ–ї–Є—З–Є—В—М —Б–Ї–Њ—А–Њ—Б—В—М —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–µ —А–∞–Ј—А–µ—И–µ–љ–Є–µ –≤–і–Њ–ї—М –њ—А–Њ–і–Њ–ї—М–љ–Њ–є –Њ—Б–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –≤ 8вАУ10 —А–∞–Ј –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–±—Л—З–љ—Л–Љ–Є ¬Ђ—В–Њ–ї—Б—В—Л–Љ–Є¬ї —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Б–ї–Њ—П–Љ–Є [21]. –Я–Њ—Б–ї–µ —В–∞–Ї–Њ–≥–Њ –Ї—А–∞—В–Ї–Њ–≥–Њ, –љ–Њ —Б—В–Њ–ї—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –њ–Њ–≥—А—Г–ґ–µ–љ–Є—П –≤ —Б—Г—В—М —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ —Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ъ–Ґ, —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ—Л–Љ, –Ї–∞–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤ –њ–Њ–ї—Г—З–µ–љ–Є–Є –Њ–±—К–µ–Љ–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –Љ–Њ–≥–ї–Є –Њ–ґ–Є–і–∞—В—М —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ 32-, 64- –Є 128-—Б—А–µ–Ј–Њ–≤—Л—Е —В–Њ–Љ–Њ–≥—А–∞—Д–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ 2004вАУ2005 –≥–≥. [21].
–Ю—З–µ—А–µ–і–љ—Л–Љ —И–∞–≥–Њ–Љ –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –њ–Њ–ї—Г—З–∞–µ–Љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –Љ–µ–ї–Ї–Є—Е –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е –≤–µ—В–≤–µ–є —Б—В–∞–ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Є–љ—Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П —Б —А–∞–±–Њ—В–Њ–є —Б–µ—А–і—Ж–∞. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –Ї–∞—Б–∞–ї–Њ—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –Ї–∞—А–і–Є–Њ—В–Њ—А–∞–Ї–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≥–і–µ –љ–∞–ї–Є—З–Є–µ –≤–ї–Є—П–љ–Є—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є—Е –∞—А—В–µ—Д–∞–Ї—В–Њ–≤ –і–≤–Є–ґ–µ–љ–Є—П –љ–∞ –њ–Њ–ї—Г—З–µ–љ–Є–µ –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –Є–Љ–µ–ї–Њ –Њ—Б–Њ–±–Њ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –≤ –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–і—Е–Њ–і—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ (–і–Є–∞—Б—В–Њ–ї–∞) –µ–≥–Њ —А–Є—В–Љ –±—Л–ї —Б–Є–љ—Е—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ —Б –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Л–Љ —В–Њ–Љ–Њ–≥—А–∞—Д–Њ–Љ c –њ–Њ–Љ–Њ—Й—М—О –≠–Ъ–У. –° —Н—В–Њ–є —Ж–µ–ї—М—О –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Љ–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Љ–Њ–і–µ–ї–Є electrocardiography (ECG)-triggered sequential scanning –Є ECG-gated [22вАУ24].
–°–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ ECG-trigger –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б –Ј–∞—А–∞–љ–µ–µ –Ј–∞–і–∞–љ–љ–Њ–є –Ј–∞–і–µ—А–ґ–Ї–Њ–є, –Ї–Њ—В–Њ—А–∞—П –Њ—В—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М –Њ—В –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П. –Я–Њ—Б–ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б—В–Њ–ї, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б–µ—А–і–µ—З–љ—Л–Љ —А–Є—В–Љ–Њ–Љ, –≤ –Њ—Б–љ–Њ–≤–љ—Г—О —Д–∞–Ј—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–µ—А–µ–Љ–µ—Й–∞–ї—Б—П —Б –Ј–∞–і–∞–љ–љ–Њ–є —Б–Ї–Њ—А–Њ—Б—В—М—О –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П –≤—Б–µ–≥–Њ —Ж–Є–Ї–ї–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П. –Я–Њ—Б–ї–µ–і—Г—О—Й–∞—П —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ—Г—В–µ–Љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –і–∞–љ–љ—Л—Е –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —Д–∞–Ј—Г —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П —Б–µ—А–і—Ж–∞ –Є–Ј –Є–Љ–µ—О—Й–µ–≥–Њ—Б—П –њ–Њ–ї–љ–Њ–≥–Њ –љ–∞–±–Њ—А–∞ –і–∞–љ–љ—Л—Е –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ј–∞–њ–Є—Б–∞–љ–љ–Њ–є –≠–Ъ–У. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞–Ј–∞—Е —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П (–Њ–±—Л—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–Є–∞—Б—В–Њ–ї–∞), —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–Љ—Г —А–Є—В–Љ—Г, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–µ–і–∞–Ї—Ж–Є–Є –і–∞–љ–љ—Л—Е –≠–Ъ–У –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є —Б –њ–µ—А–µ–Ї—А—Л—В–Є–µ–Љ –њ–Њ —В–Њ–ї—Й–Є–љ–µ –і–µ–ї–∞—О—В –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Б–њ–Є—А–∞–ї—М–љ—Г—О –Ъ–Ґ —Б –≠–Ъ–У-—Б–Є–љ—Е—А–Њ–љ–Є–Ј–∞—Ж–Є–µ–є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є –Ї–Њ—А–Њ–љ–∞—А–Њ–≥—А–∞—Д–Є–Є [21, 25, 26]. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Н—В–Њ—В –ґ–µ –њ—А–Є–љ—Ж–Є–њ –±—Л–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ—Л—Е (–Ь–†) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є [27, 28]. –Т 2007вАУ2010 –≥–≥. –±—Л–ї–Є —Б–Ї–Њ–љ—Б—В—А—Г–Є—А–Њ–≤–∞–љ—Л 256-—Б—А–µ–Ј–Њ–≤—Л–µ, –∞ –њ–Њ–Ј–ґ–µ –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Њ–±—А–∞–Ј—Ж—Л 320-—Б—А–µ–Ј–Њ–≤—Л—Е –Ъ–Ґ-—В–Њ–Љ–Њ–≥—А–∞—Д–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б—В–∞–ї–Є –љ–Њ–≤—Л–Љ —Н—В–∞–њ–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Љ–µ—В–Њ–і–∞. –Ґ–∞–Ї–Њ–µ –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є–µ —Б–µ–≥–Њ–і–љ—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–ї—Г—З–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –≤—Л—Б–Њ–Ї–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П, –љ–Њ –Є –±—Г–Ї–≤–∞–ї—М–љ–Њ –≤ —А–µ–∞–ї—М–љ–Њ–Љ –≤—А–µ–Љ–µ–љ–Є –љ–∞–±–ї—О–і–∞—В—М –Ј–∞ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–Љ–Є –≤ —Б–µ—А–і—Ж–µ –Є —Б–Њ—Б—Г–і–∞—Е [29].
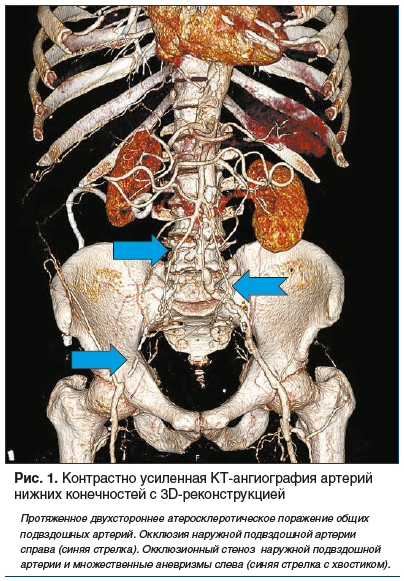
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±–ї–∞–≥–Њ–і–∞—А—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–µ—И–µ–љ–Є—П –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–і–∞—З –Љ–µ—В–Њ–і –Ъ–Ґ-–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Є–Љ–µ–µ—В —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ (—А–Є—Б. 1) [21, 30, 31].
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —В—А–Њ–Љ–±–Њ–Ј–∞ –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Ј–Љ–∞
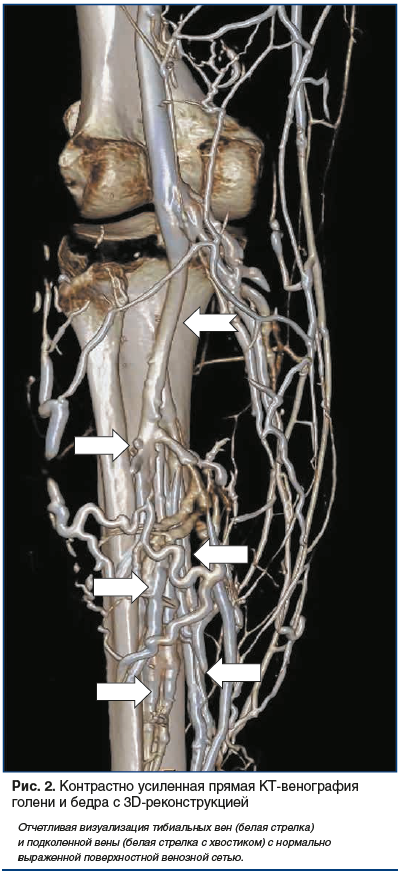
–С–µ—Б—Б–њ–Њ—А–љ–Њ, –∞–љ–≥–Є–Њ–ї–Њ–≥–Є –Є —Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Е–Є—А—Г—А–≥–Є –њ–Њ—З—В–Є —Б—А–∞–Ј—Г –Њ–±—А–∞—В–Є–ї–Є –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –Љ–µ—В–Њ–і –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –љ–∞—А—П–і—Г —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Є –≤–µ–љ–Њ–Ј–љ–Њ–µ —А—Г—Б–ї–Њ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є (—А–Є—Б. 2, 3).

–° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ —В—А–Њ–Љ–±–Њ–Ј –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є (–Ґ–У–Т) –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—П –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є (–Ґ–≠–Ы–Р) —П–≤–ї—П—О—В—Б—П, –њ–Њ —Б—Г—Й–µ—Б—В–≤—Г, –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Њ–і–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –Є–Љ–µ–љ–љ–Њ –≤–µ–љ–Њ–Ј–љ–Њ–є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є (–Т–Ґ–≠), –ї–Њ–≥–Є—З–љ–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–∞—Б—М –њ–Њ–њ—Л—В–Ї–∞ –Њ–±—К–µ–і–Є–љ–µ–љ–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Н—В–Є—Е –і–≤—Г—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –≤ –Њ–і–Є–љ –Љ–µ—В–Њ–і. –Я–Њ—Н—В–Њ–Љ—Г —Б—В—А–µ–Љ–ї–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Е–Є—А—Г—А–≥–Њ–≤ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –≤—А–∞—З–∞–Љ–Є-—А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–∞–Љ–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –Т–Ґ–≠ –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ–Њ–ї—Г—З–Є—В—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Г—О –Є –њ–Њ–і—А–Њ–±–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –µ–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Є–Љ–µ–ї–Њ –≤—Б–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е –њ–Њ–њ—Л—В–Њ–Ї –±—Л–ї–∞ –њ—А–Њ–і–Є–Ї—В–Њ–≤–∞–љ–∞ —Б–ї–µ–і—Г—О—Й–Є–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є: –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ—Б—В—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ [32], —Б–Ї–Њ—А–Њ—Б—В—М—О –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П, –љ–∞–њ—А–Є–Љ–µ—А, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–µ–є (–Ь–†–Ґ) [33], –њ–Њ–ї—Г—З–µ–љ–Є–µ–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ —Б–Њ—Б—В–Њ—П–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ґ–≠–Ы–Р [34, 35]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –њ—А–Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є —Г–ґ–µ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ–µ—А–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–Љ–Є —Б –і–∞–љ–љ—Л–Љ–Є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –і—Г–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П (duplex Ultra-Sound, US) [34]. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Є –њ–Њ–Ї–∞–Ј–∞–љ—Л –љ–µ–Њ—Б–њ–Њ—А–Є–Љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –њ–µ—А–µ–і US –≤ —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є–Є —В—А–Њ–Љ–±–Њ–Ј–∞ –≤–µ–љ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є —В–∞–Ј–∞ [36].
–Ш–Ј–љ–∞—З–∞–ї—М–љ–Њ –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є —Б —Ж–µ–ї—М—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –њ—А–Њ–±–Њ–≤–∞–ї–Є –≤–≤–Њ–і–Є—В—М –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ —З–µ—А–µ–Ј –Ї—Г–±–Є—В–∞–ї—М–љ—Г—О –≤–µ–љ—Г. –Ґ–∞–Ї –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –±—Л–ї–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ, –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –њ–Њ–ї—Г—З–Є–ї –љ–∞–Ј–≤–∞–љ–Є–µ –љ–µ–њ—А—П–Љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ-—В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–≥—А–∞—Д–Є–Є (Indirect CT-Venography, ICTV). –Т –Њ—Б–љ–Њ–≤–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ–њ—А—П–Љ–Њ–є (–≤–µ—А—Е–љ–µ–є) ICTV –ї–µ–ґ–∞–ї–∞ –Њ—В—Б—А–Њ—З–Ї–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Њ—В 2,5 –і–Њ 4 –Љ–Є–љ –њ–Њ—Б–ї–µ –±–Њ–ї—О—Б–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≤ –Ї—Г–±–Є—В–∞–ї—М–љ—Г—О –≤–µ–љ—Г 80вАУ100 –Љ–ї –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О –Њ—В 2,5 –і–Њ 4,5 –Љ–ї/—Б [37]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є –≤ —Б–≤–Њ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Д–ї–µ–±–Њ–≥—А–∞–Љ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є —В–∞–Ј–∞ —Е–Њ—А–Њ—И–µ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л —Б—В–Њ–ї–Ї–љ—Г–ї–Є—Б—М —Б –њ—А–Њ–±–ї–µ–Љ–∞–Љ–Є. –Ю—Б–љ–Њ–≤–љ–Њ–є —Б–ї–Њ–ґ–љ–Њ—Б—В—М—О –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –њ—А–Є —В–∞–Ї–Њ–Љ –Љ–µ—В–Њ–і–µ –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–∞ –±—Л–ї–∞ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —З–µ—В–Ї–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–є —Д–∞–Ј—Л –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ–і–≤–µ—А–≥–∞–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О —Б–µ–≥–Љ–µ–љ—В–∞ —В–µ–ї–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ [38]. –Ґ–∞–Ї, J.F. Uhl et al. [39] –њ—А–Є –∞–Ї—В–Є–≤–љ–Њ–Љ –≤–љ–µ–і—А–µ–љ–Є–Є –Љ–µ—В–Њ–і–∞ –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Б—В–Њ–ї–Ї–љ—Г–ї–Є—Б—М —Б –њ—А–Њ–±–ї–µ–Љ–Њ–є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —З–µ—В–Ї–Њ–≥–Њ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤—А–µ–Љ–µ–љ–Є –љ–∞—З–∞–ї–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П, —З—В–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ—В—З–µ—В–ї–Є–≤–Њ –Є –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ–Њ –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –≤–µ–љ–Њ–Ј–љ—Г—О –Љ–∞–≥–Є—Б—В—А–∞–ї—М –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Є —В–∞–Ј–∞, –∞ —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ–Њ–і—В–≤–µ—А–і–Є—В—М –Є–ї–Є –Є—Б–Ї–ї—О—З–Є—В—М –љ–∞–ї–Є—З–Є–µ –Ґ–У–Т –≤ –±–Њ–ї–µ–µ —З–µ–Љ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –Ї–∞–ґ–і—Л–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М –≤—Л–љ—Г–ґ–і–µ–љ –±—Л–ї —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞—В—М —Б–≤–Њ–є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –Є–ї–Є —Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞—В—М —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –Љ–µ—В–Њ–і–Є–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Ј–∞–і–∞—З, —З–µ–≥–Њ –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –і–ї—П –∞—А—В–µ—А–Є–є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –≥–і–µ –Љ–µ—В–Њ–і–Є–Ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –і–Њ–≤–Њ–ї—М–љ–Њ –±—Л—Б—В—А–Њ –±—Л–ї–∞ –Њ—В—А–∞–±–Њ—В–∞–љ–∞ –Є –њ–Њ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Њ—Б—В–∞–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –њ—А–Є –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ–Њ–Љ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Љ —А—Г—Б–ї–µ.
S.P. Kalva et al. [32] –Є A.M. Kelly et al. [33] –њ—А–Є—И–ї–Є –Ї –≤—Л–≤–Њ–і—Г –љ–µ —В–Њ–ї—М–Ї–Њ –Њ –±–Њ–ї—М—И–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–µ–љ–Є—П —Б–Њ–Љ–љ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є ICTV, –љ–Њ –Є –Њ –њ–Њ–ї–љ–Њ–є –±–µ—Б–њ–Њ–ї–µ–Ј–љ–Њ—Б—В–Є –µ–µ –≤ 15,2% —Б–ї—Г—З–∞–µ–≤ вАФ –њ–Њ –њ—А–Є—З–Є–љ–µ –±–∞–љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є–Ј-–Ј–∞ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Г–ї–Њ–≤–Є—В—М –≤–µ–љ–Њ–Ј–љ—Г—О —Д–∞–Ј—Г, –Ї–Њ—В–Њ—А–∞—П –њ–Њ –Љ–љ–Њ–≥–Є–Љ –њ—А–Є—З–Є–љ–∞–Љ –±—Л–ї–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–∞, —З–∞—Б—В–Њ –≤—А–µ–Љ—П –µ–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Њ—Б—М –њ—А–Њ—Б—В–Њ –Є–љ—В—Г–Є—В–Є–≤–љ–Њ. –Я–Њ —Н—В–Њ–є –ґ–µ –њ—А–Є—З–Є–љ–µ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л —З–∞—Б—В–Њ —Б—В–∞–ї–Ї–Є–≤–∞–ї–Є—Б—М —Б –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ–Њ—Б—В—А–Њ–µ–љ–Є—П 3D-–Љ–Њ–і–µ–ї–Є, –Ї–Њ—В–Њ—А–∞—П –і–Њ–ї–ґ–љ–∞ –±—Л–ї–∞ —Б—В–∞—В—М –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –°TV –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б DSV [40].
–Я–Њ—Б–ї–µ–і–љ–µ–µ –Ї—А—Г–њ–љ–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є –Ъ–Ґ-–∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є –Є –љ–µ–њ—А—П–Љ–Њ–є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ 2012 –≥. —Б –њ—А–Є–≤–ї–µ—З–µ–љ–Є–µ–Љ –≤—Б–µ—Е –≤–µ–і—Г—Й–Є—Е —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Њ–≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є [41]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Њ –±–Њ–ї–µ–µ 800 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–≥–ї—Г–±–ї–µ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≥–ї–∞—Б–Є–ї–Є—Б—М —Б –≤—Л–≤–Њ–і–∞–Љ–Є, —Б–і–µ–ї–∞–љ–љ—Л–Љ–Є J.F. Uhl et al. [39] —А–∞–љ–µ–µ, –Є –±—Л–ї–Є –≤—Л–љ—Г–ґ–і–µ–љ—Л —Б–і–µ–ї–∞—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ –Љ–∞–ї–Њ–є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –љ–µ–њ—А—П–Љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є —Б —Ж–µ–ї—М—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–У–Т –њ—А–Є –µ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Г —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ґ–≠–Ы–Р –Є–ї–Є –≤ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –≤–Є–і–µ —Б —Ж–µ–ї—М—О –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Ґ–У–Т. –Ю—Б–Њ–±–µ–љ–љ–Њ —З–∞—Б—В—Л–Љ–Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М —Б–Њ–Љ–љ–µ–љ–Є—П –≤ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –Є –ї–Њ–Ї–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ —В—А–Њ–Љ–±–∞ [41].
–Ґ–∞–Ї–ґ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Љ–µ—В–Њ–і–Є–Ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П ICTV —В—А–µ–±–Њ–≤–∞–ї–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї—М—И–µ–≥–Њ –Њ–±—К–µ–Љ–∞ –Ї—Г–±–Є—В–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ (–і–Њ 150 –Љ–ї), —З–µ–Љ —Н—В–Њ–≥–Њ —В—А–µ–±–Њ–≤–∞–ї–∞ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–∞—П –Ъ–Ґ-–∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є—П. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±—Л–ї–Њ —Г—З–Є—В—Л–≤–∞—В—М –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –ї—Г—З–µ–≤—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –°TA –Є ICTV —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ —Б–µ–≥–Њ–і–љ—П —П–≤–ї—П–µ—В—Б—П —Б–њ–Њ—А–љ–Њ–є, –Њ–љ–Њ –љ–µ –≤–Ї–ї—О—З–µ–љ–Њ –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–µ –њ—А–Њ—В–Њ–Ї–Њ–ї—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –Ґ–≠–Ы–Р –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —Б—В—А–∞–љ [38].
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї—А–∞–є–љ–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –Њ—В–љ–Њ—И–µ–љ–Є—П –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О ICTV —Б —Ж–µ–ї—М—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ J.F. Uhl –Є C. Gillot –≤ 2012 –≥. –≤ –Њ—З–µ—А–µ–і–љ–Њ–є —А–∞–Ј –њ—А–Є–Ј–≤–∞–ї–Є –Љ–Є—А–Њ–≤–Њ–µ —Д–ї–µ–±–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ –Њ—В–Ї–∞–Ј–∞—В—М—Б—П –Њ—В –њ–Њ–њ—Л—В–Њ–Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤–µ–љ –Є –≤–µ—А–љ—Г—В—М—Б—П –Ї –њ—А–Њ–≤–µ—А–µ–љ–љ–Њ–є –і–µ—Б—П—В–Є–ї–µ—В–Є—П–Љ–Є –і–Є—Б—В–∞–ї—М–љ–Њ–є —Д–ї–µ–±–Њ–≥—А–∞—Д–Є–Є, –љ–Њ —В–µ–њ–µ—А—М –Є—Б–њ—Л—В–∞—В—М —Н—В–Њ—В –Љ–µ—В–Њ–і –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ-—В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є—П), —В. –µ., –њ–Њ —Б—Г—В–Є, –Ї –Љ–µ—В–Њ–і—Г –њ—А—П–Љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ-—В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–≥—А–∞—Д–Є–Є (Direct CT-Venography, DCTV) .
–Я–µ—А–≤—Л–µ –њ–Њ–њ—Л—В–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П DCTV –њ—А–Є –і–Є—Б—В–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—Г—В–µ–Љ –њ—Г–љ–Ї—Ж–Є–Є –Њ–і–љ–Њ–є –Є–Ј –≤–µ–љ –љ–∞ —В—Л–ї–µ —Б—В–Њ–њ—Л –±—Л–ї–Є –њ—А–µ–і–њ—А–Є–љ—П—В—Л –≤ 1994 –≥. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Н—В–∞–њ–∞–Љ–Є –Љ–µ—В–Њ–і–∞, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ M.K. Stehling et al. [42], —П–≤–ї—П–ї–Є—Б—М: –Ї–∞—В–µ—В–µ—А–Є–Ј–∞—Ж–Є—П –≤–µ–љ—Л —Б—В–Њ–њ—Л, –љ–∞–ї–Њ–ґ–µ–љ–Є–µ –і–≤—Г—Е —В—Г—А–љ–Є–Ї–µ—В–Њ–≤ –љ–∞ —Б—А–µ–і–љ—О—О —В—А–µ—В—М –±–µ–і—А–∞ –Є –љ–Є–ґ–љ—О—О —В—А–µ—В—М –≥–Њ–ї–µ–љ–Є, –њ—А–Є–њ–Њ–і–љ–Є–Љ–∞–љ–Є–µ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –љ–∞–і —Г—А–Њ–≤–љ–µ–Љ —Б—В–Њ–ї–∞ –Ј–∞ —Б—З–µ—В –і–≤—Г—Е –і–µ—А–ґ–∞—В–µ–ї–µ–є, –≤–≤–µ–і–µ–љ–Є–µ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –≤ –Њ–і–Є–љ —Н—В–∞–њ –≤ —В–µ—З–µ–љ–Є–µ 60 —Б. –Ю—Б–љ–Њ–≤–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –і–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П DCTV-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ —З–∞—Б—В–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —З–µ—В–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤—Б–µ—Е –≤–µ–љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ —Б–Ї–∞–љ–Є—А—Г–µ–Љ–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞. –Я—А–Є—З–Є–љ–Њ–є —Н—В–Њ–≥–Њ –Љ–Њ–≥–ї–∞ –±—Л—В—М –Њ—И–Є–±–Ї–∞ –≤ –њ—А–∞–≤–Є–ї—М–љ–Њ—Б—В–Є –≤—Л–±–Њ—А–∞ –≤—А–µ–Љ–µ–љ–Є –Ј–∞–і–µ—А–ґ–Ї–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –Њ–±—К–µ–Љ –≤–≤–Њ–і–Є–Љ–Њ–≥–Њ —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –љ–µ —Г–і–∞–≤–∞–ї–Њ—Б—М –њ–Њ–ї—Г—З–Є—В—М –≤—Б–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ —Ж–µ–ї–Є–Ї–Њ–Љ, —В–∞–Ї –Ї–∞–Ї –≤ –Њ–і–љ–Є—Е (–і–Є—Б—В–∞–ї—М–љ—Л—Е) —Б–µ–≥–Љ–µ–љ—В–∞—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Ї–Њ–љ—В—А–∞—Б—В –Ј–∞–і–µ—А–ґ–Є–≤–∞–ї—Б—П, –∞ –≤ –і—А—Г–≥–Є—Е (–њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л–µ –Њ—В–і–µ–ї—Л –Є —В–∞–Ј) –Ї –Љ–Њ–Љ–µ–љ—В—Г –љ–∞—З–∞–ї–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–Є–і–∞–ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–µ —А—Г—Б–ї–Њ –µ—Й–µ –і–Њ —Н—В–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞.
–£–Ї–∞–Ј–∞–љ–љ—Л–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–Є –Љ–Њ–≥–ї–Є –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л –Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≤ —В–Њ –≤—А–µ–Љ—П –Љ–љ–Њ–≥–Њ–і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–Є—Б—В–µ–Љ, —Б–Ї–∞–љ–Є—А—Г—О—Й–Є—Е –≤ —Б–њ–Є—А–∞–ї—М–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Ъ —В–Њ–Љ—Г –ґ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ —Б–µ–≥–Њ–і–љ—П –Љ–µ—В–Њ–і–Є–Ї–Є –њ–Њ—Б—В–Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤–µ–љ –≤ 3D-—А–µ–ґ–Є–Љ–µ –љ–∞ —В–Њ—В –њ–µ—А–Є–Њ–і –≤—А–µ–Љ–µ–љ–Є –µ—Й–µ –љ–µ –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л. –≠—В–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –∞–≤—В–Њ—А–∞–Љ –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ –≤–≤–µ—Б—В–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є. –Ю–і–љ–∞–Ї–Њ –Є —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Љ–љ–Њ–≥–Њ–і–µ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–Є—Б—В–µ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ї–∞–ґ—Г—Й—Г—О—Б—П –њ—А–Њ—Б—В–Њ—В—Г –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Њ—Б—В–∞–≤–ї—П–ї–∞ –ґ–µ–ї–∞—В—М –ї—Г—З—И–µ–≥–Њ [40].
–Я—А–Њ–±–ї–µ–Љ—Л –±—Л–ї–Є —Б–≤—П–Ј–∞–љ—Л —Б –≤—Л–±–Њ—А–Њ–Љ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Ј–∞–і–µ—А–ґ–Ї–Є —Б—В–∞—А—В–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ–Њ–≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –±–Њ–ї—О—Б–Њ–Љ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, –њ–Њ–Є—Б–Ї–Њ–Љ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–є –Є –µ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —Е–∞—А–∞–Ї—В–µ—А–∞ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Њ–±.
–° —Ж–µ–ї—М—О –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –†.–У. –Р—Б–Ї–µ—А—Е–∞–љ–Њ–≤—Л–Љ –Є —Б–Њ–∞–≤—В. –≤ 2013 –≥. [43] –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ —Б–њ–Њ—Б–Њ–± –Љ—Г–ї—М—В–Є—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є-—Д–ї–µ–±–Њ–≥—А–∞—Д–Є–Є –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –∞–≤—В–Њ—А—Л –њ–Њ–њ—Л—В–∞–ї–Є—Б—М —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞—В—М –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–∞–љ–љ—Л—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–µ–є —Г–і–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –ї—Г—З—И–µ –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л–µ –≤–µ–љ—Л –Њ–±—Б–ї–µ–і—Г–µ–Љ–Њ–є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –≤ —Ж–µ–ї–Њ–Љ, –Њ–і–љ–∞–Ї–Њ –љ–µ –њ–Њ–ї—Г—З–Є–ї–Њ—Б—М –і–Њ—Б—В–Є—З—М –Є–і–µ–∞–ї—М–љ–Њ–є –Ї–∞—А—В–Є–љ—Л –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –≥–Њ–ї–µ–љ–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –њ—А–Њ–±—Л —Б –Ј–∞–і–µ—А–ґ–Ї–Њ–є –і—Л—Е–∞–љ–Є—П (–њ—А–Њ–±—Л –Т–∞–ї—М—Б–∞–ї—М–≤—Л) –њ—А–µ–≤—А–∞—В–Є–ї–∞—Б—М –≤ –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї, —В–∞–Ї –Ї–∞–Ї –±–Њ–ї—М—И–µ –њ–Њ–ї–Њ–≤–Є–љ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л–њ–Њ–ї–љ—П–ї–Є –µ–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ, —З—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤–ї–Є—П–ї–Њ –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М –њ—А–Њ–і–≤–Є–ґ–µ–љ–Є—П —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є –њ–Њ–ї–љ–Њ—В—Г –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –≤–µ–љ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –Њ–і–љ–Њ–є —В–Њ–ї—М–Ї–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –њ—А–Њ–±—Л —Б –Ј–∞–і–µ—А–ґ–Ї–Њ–є –і—Л—Е–∞–љ–Є—П –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М –Ј–∞–і–µ—А–ґ–Ї—Г —Н–≤–∞–Ї—Г–∞—Ж–Є–Є –Ї–Њ–љ—В—А–∞—Б—В–∞ –Є –і–Њ–±–Є—В—М—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤—Б–µ—Е –≤–µ–љ–Њ–Ј–љ—Л—Е –Ї–Њ–ї–ї–µ–Ї—В–Њ—А–Њ–≤ –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є.
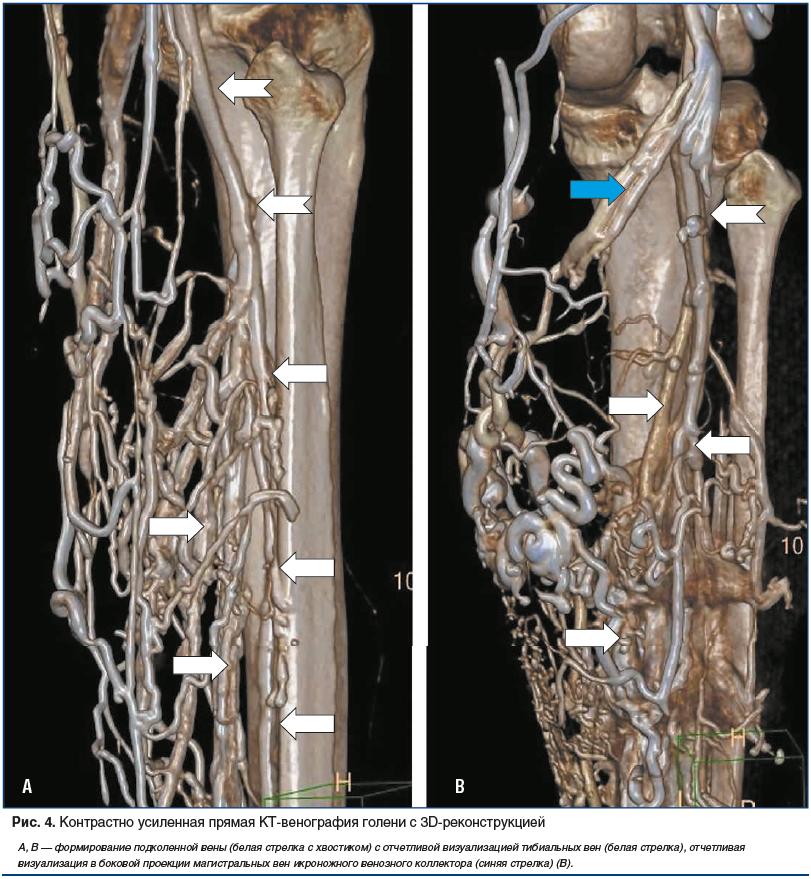
–Ъ –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г –њ–Њ–Є—Б–Ї—Г —А–µ—И–µ–љ–Є–є –Є–Љ–µ—О—Й–Є—Е—Б—П –Ј–∞–і–∞—З –њ–Њ —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П DCTV –≤ 2016 –≥. –њ—А–Є—Б–Њ–µ–і–Є–љ–Є–ї—Б—П –љ–∞—И –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є –Ї–Њ–ї–ї–µ–Ї—В–Є–≤ (–њ–∞—В–µ–љ—В –љ–∞ –Є–Ј–Њ–±—А–µ—В–µ–љ–Є–µ RU вДЦ 2638920 –Њ—В 03.08.2016). –Т –Њ—Б–љ–Њ–≤–µ –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –љ–∞–Љ–Є –Љ–µ—В–Њ–і–∞ –±—Л–ї–Њ –њ–Њ—Н—В–∞–њ–љ–Њ–µ –і–≤—Г—Е–Ї–Њ–ї–±–Њ–≤–Њ–µ –±–Њ–ї—О—Б–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –≤ –Њ–і–љ—Г –Є–Ј –≤–µ–љ –љ–∞ —В—Л–ї–µ —Б—В–Њ–њ—Л —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 50 –Љ–ї –љ–µ–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П (–Є–Ј —А–∞—Б—З–µ—В–∞ 1 –Љ–ї 0,9% —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –љ–∞ 1 —Б–Љ —А–Њ—Б—В–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ), —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О 4 –Љ–ї/—Б. –Я–Њ—Б–ї–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–і–∞–≤–∞–ї–∞—Б—М –Њ–±–ї–∞—Б—В—М —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П (–≤—Б—П –љ–Є–ґ–љ—П—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В—М –Є –Њ–±–ї–∞—Б—В—М —В–∞–Ј–∞) —Б –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М—О –Њ—В —В–∞–Ј–∞ –Ї —Б—В–Њ–њ–µ. –Т –њ—А–Њ–≥—А–∞–Љ–Љ—Г —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –≤–≤–Њ–і–Є–ї–Є—Б—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є –≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–є –љ–∞–Љ–Є —Б—Е–µ–Љ–Њ–є –њ—А–Њ–≤–µ–і–µ–љ–Є—П DCTV –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є —В–∞–Ј–∞. –Э–∞–і –ї–Њ–і—Л–ґ–Ї–∞–Љ–Є –љ–∞–Ї–ї–∞–і—Л–≤–∞–ї–∞—Б—М –њ–љ–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–∞—П –Љ–∞–љ–ґ–µ—В–∞, –і–∞–≤–ї–µ–љ–Є–µ –≤ –Ї–Њ—В–Њ—А–Њ–є –њ–Њ–і–љ–Є–Љ–∞–ї–Њ—Б—М –і–Њ 60 –Љ–Љ —А—В. —Б—В., –њ–Њ—Б–ї–µ —З–µ–≥–Њ –љ–∞—З–Є–љ–∞–ї–Њ—Б—М –≤–≤–µ–і–µ–љ–Є–µ —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є —Б–Љ–µ—Б–Є, –Ї–Њ—В–Њ—А–Њ–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–∞—Б—З–µ—В–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –і–ї–Є–ї–Њ—Б—М –Њ–Ї–Њ–ї–Њ 40 —Б. –Я–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –≤–≤–µ–і–µ–љ–Є—П –≤—Б–µ–≥–Њ –Њ–±—К–µ–Љ–∞ –Ї–Њ–љ—В—А–∞—Б—В–∞ –Є –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –і–∞–≤–ї–µ–љ–Є–µ –≤–Њ –≤—В–Њ—А–Њ–є –Љ–∞–љ–ґ–µ—В–µ, –љ–∞–ї–Њ–ґ–µ–љ–љ–Њ–є –љ–∞ —Б–µ—А–µ–і–Є–љ–µ –±–µ–і—А–∞, –њ–Њ–і–љ–Є–Љ–∞–ї–Є –і–Њ 60 –Љ–Љ —А—В. —Б—В., –њ–∞—Ж–Є–µ–љ—В –і–µ–ї–∞–ї –≥–ї—Г–±–Њ–Ї–Є–є –≤–і–Њ—Е, –Ј–∞–і–µ—А–ґ–Є–≤–∞–ї –і—Л—Е–∞–љ–Є–µ –Є –љ–∞—В—Г–ґ–Є–≤–∞–ї –Љ—Л—И—Ж—Л –њ–µ—А–µ–і–љ–µ–є –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Є. –° —Н—В–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ –љ–∞—З–Є–љ–∞–ї–Є 1-–µ –Њ—Б–љ–Њ–≤–љ–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ, –Њ–±—Й–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 12вАУ15 —Б. –Я–Њ—Б–ї–µ –µ–≥–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В –і–µ–ї–∞–ї –≤—Л–і–Њ—Е –Є –≤—Л–њ–Њ–ї–љ—П–ї –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —В—Л–ї—М–љ—Л—Е —Б–≥–Є–±–∞—В–µ–ї—М–љ—Л—Е –і–≤–Є–ґ–µ–љ–Є–є —Б—В–Њ–њ–Њ–є, –Ј–∞—В–µ–Љ –њ—А–Є–љ–Є–Љ–∞–ї –Є—Б—Е–Њ–і–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ. –Т —Б—А–µ–і–љ–µ–Љ –њ–Њ –Є—Б—В–µ—З–µ–љ–Є–Є 40 —Б –љ–∞—З–Є–љ–∞–ї–Є 2-–µ –Њ—Б–љ–Њ–≤–љ–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ —В–∞–Ї–ґ–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Њ—В —В–∞–Ј–∞ –Ї —Б—В–Њ–њ–∞–Љ. –Я–Њ—Б–ї–µ –µ–≥–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ј–∞–Ї–∞–љ—З–Є–≤–∞–ї–Є –Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—О —В—А–µ—Е–Љ–µ—А–љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤–µ–љ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Є —В–∞–Ј–∞ —Б –њ–Њ–Љ–Њ—Й—М—О –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –Њ–±—А–∞–±–Њ—В–Ї–Є –і–∞–љ–љ—Л—Е Intelli Space Portal, –Ј–∞–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ –Ї–Њ–Љ–њ—М—О—В–µ—А–µ. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –і–Њ–±–Є—В—М—Б—П –Њ—В—З–µ—В–ї–Є–≤–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ –≤–µ–љ –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є (—Б–Љ. —А–Є—Б. 3–Р), –љ–Њ –Є –≤–µ–љ –≥–Њ–ї–µ–љ–Є, —З—В–Њ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–У–Т –Є–Љ–µ–ї–Њ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ (—А–Є—Б. 4, 5).

–Ю–і–љ–Њ –Є–Ј –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Ј–∞ —А—Г–±–µ–ґ–Њ–Љ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ W.-Y. Shi et al. [44]. C —Ж–µ–ї—М—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–У–Т –±—Л–ї–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –Љ–µ—В–Њ–і–Є–Ї–∞ DCTV, —Б—Г—В—М –Ї–Њ—В–Њ—А–Њ–є –Ј–∞–Ї–ї—О—З–∞–ї–∞—Б—М –≤ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–Є–Є –љ–µ–њ—А—П–Љ–Њ–є –Є –њ—А—П–Љ–Њ–є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–Њ—Б—В–Њ—П–ї–Њ –Є–Ј —В—А–µ—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —Н—В–∞–њ–Њ–≤. –Ш–Ј–љ–∞—З–∞–ї—М–љ–Њ –≤ –Ї—Г–±–Є—В–∞–ї—М–љ—Г—О –≤–µ–љ—Г –≤–≤–Њ–і–Є–ї–Є 80 –Љ–ї –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О 4 –Љ–ї/—Б. –Ч–∞—В–µ–Љ —З–µ—А–µ–Ј 1,5 –Љ–Є–љ –≤ –Ї–∞—В–µ—В–µ—А–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–µ–љ—Г —Б—В–Њ–њ—Л –≤–≤–Њ–і–Є–ї–Є —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О 1,5 –Љ–ї/—Б 60 –Љ–ї —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 12 –Љ–ї –Ї–Њ–љ—В—А–∞—Б—В–∞ –Є 48 –Љ–ї —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, —Б –љ–∞–ї–Њ–ґ–µ–љ–љ—Л–Љ –≤—Л—И–µ –ї–Њ–і—Л–ґ–Ї–Є –ґ–≥—Г—В–Њ–Љ. –°–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞—З–Є–љ–∞–ї–Њ—Б—М —З–µ—А–µ–Ј 60 —Б –њ–Њ—Б–ї–µ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —А–µ–љ—В–≥–µ–љ–Њ–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є —Б–Љ–µ—Б–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л —Б —Г—З–∞—Б—В–Є–µ–Љ 96 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л –Ї–Њ–љ—В—А–Њ–ї—О –Љ–µ—В–Њ–і–Њ–Љ DSV –Є US. –Ґ–Њ—З–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–Є–Ї–Є –≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В–Є –Ґ–У–Т —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Њ—В 96,9% –і–Њ 97,9%, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М вАФ –Њ—В 95,2% –і–Њ 96,8%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 100%, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М вАФ 100%, –∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М –Є–Љ–µ–ї–∞ –і–Є–∞–њ–∞–Ј–Њ–љ –Њ—В 91,7% –і–Њ 94,3%. –Ш—Б—Е–Њ–і—П –Є–Ј —Н—В–Є—Е –і–∞–љ–љ—Л—Е, –∞–≤—В–Њ—А—Л —Б–і–µ–ї–∞–ї–Є –≤—Л–≤–Њ–і –Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–љ–Њ—Б—В–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–є –Є–Љ–Є –Љ–µ—В–Њ–і–Є–Ї–Є –Є —П–≤–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –њ–µ—А–µ–і –њ—А—П–Љ–Њ–є –Є –љ–µ–њ—А—П–Љ–Њ–є, –≤—Л–њ–Њ–ї–љ—П–µ–Љ–Њ–є –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є [44]. –Ш —Е–Њ—В—П –∞–≤—В–Њ—А—Л –±—Л–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є, –≤ –і–∞–ї—М–љ–µ–є—И–µ–є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ –љ–∞–Љ –љ–µ —Г–і–∞–ї–Њ—Б—М –љ–∞–є—В–Є —Б—Б—Л–ї–Ї–Є –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є –і—А—Г–≥–Є–Љ–Є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ–Є.
–° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ґ–У–Т –і–Њ 40% –Є–Љ–µ—О—В –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Г—О –Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Г—О –Ґ–≠–Ы–Р, –∞ –≤ —Б–ї—Г—З–∞—П—Е –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј–∞ –Ґ–≠–Ы–Р –њ–Њ—З—В–Є –≤ 90% –љ–∞–±–ї—О–і–µ–љ–Є–є –µ–µ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —П–≤–ї—П—О—В—Б—П –≤–µ–љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –Є —В–Њ—З–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Т–Ґ–≠ –≤—Б–µ–≥–і–∞ –Є–Љ–µ–ї–∞ –њ–µ—А–≤–Њ–Њ—З–µ—А–µ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ [45, 46]. –° –≤–љ–µ–і—А–µ–љ–Є–µ–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–≠–Ы–Р –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є–Є –Њ–љ–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Б—А–∞–Ј—Г –Ј–∞–љ—П–ї–∞ –ї–Є–і–Є—А—Г—О—Й—Г—О –њ–Њ–Ј–Є—Ж–Є—О, —В–∞–Ї –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–∞ —Б–≤–Њ—О –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М (94вАУ96% –Є 94вАУ100% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–Є–Љ–Є—Б—П —А–∞–љ–µ–µ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–≠–Ы–Р –≤–µ–љ—В–Є–ї—П—Ж–Є–Њ–љ–љ–Њ-–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ—Л–Љ —А–∞–і–Є–Њ–љ—Г–Ї–ї–Є–і–љ—Л–Љ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ (V/Q) –Є —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є–µ–є –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –љ–µ —Г—Б—В—Г–њ–∞—П –њ—А–Є —Н—В–Њ–Љ –њ–Њ —Б–≤–Њ–µ–є –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є –∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є, –Ї–Њ—В–Њ—А–∞—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е –ї–µ—В –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Ґ–≠–Ы–Р —Б—З–Є—В–∞–ї–∞—Б—М ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї [47, 48].
–Э–∞ —Б–µ–≥–Њ–і–љ—П –≤—Б–µ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –і–µ—В–∞–ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ъ–Ґ-–∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є –њ–Њ–ї–љ–Њ—Б—В—М—О —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ—Л. –Я—А–Њ–≤–Њ–і–Є—В—Б—П –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –µ–і–Є–љ–Њ–Љ—Г –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –њ—А–Њ—В–Њ–Ї–Њ–ї—Г. –°–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ –Ї–∞—Г–і–Њ-–Ї—А–∞–љ–Є–∞–ї—М–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Њ—В –≤–µ—А—Е–љ–µ–є –∞–њ–µ—А—В—Г—А—Л –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є –і–Њ –Ї—Г–њ–Њ–ї–∞ –і–Є–∞—Д—А–∞–≥–Љ—Л. –Ш–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –∞—А—В–µ—Д–∞–Ї—В–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–Є–ґ–µ –≤ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –ї–µ–≥–Ї–Є—Е –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–Є–ґ–љ–Є–Љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –∞—А—В–µ—Д–∞–Ї—В—Л –≤ –Ї–Њ–љ—Ж–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Љ–µ—О—В –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Љ–µ–љ—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Ъ–Њ–ї–ї–Є–Љ–∞—Ж–Є—П –Є —Б–Ї–Њ—А–Њ—Б—В—М –і–≤–Є–ґ–µ–љ–Є—П —Б—В–Њ–ї–∞ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ –Љ–Њ–≥—Г—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П. –Ю—В—Б—А–Њ—З–Ї–∞ –≤—А–µ–Љ–µ–љ–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В—Б—А–Њ—З–Ї–∞ 15 —Б –і–Њ—Б—В–∞—В–Њ—З–љ–∞ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–≥–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є –Є –њ—А–∞–≤–Њ–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –≤—А–µ–Љ—П –Њ—В—Б—А–Њ—З–Ї–Є –Љ–Њ–ґ–µ—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –Љ–µ–ґ–і—Г 15 –Є 30 —Б –Є –і–Њ–ї–ґ–љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ї–∞—В–µ—В–µ—А–∞ –Њ—В—Б—А–Њ—З–Ї–∞ –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М 5 —Б. –Т–≤–µ–і–µ–љ–Є–µ –љ–µ–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ —В—А–µ–±—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–ґ–µ–Ї—В–Њ—А–∞. –° —Г—Б–њ–µ—Е–Њ–Љ –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞ –Ї–∞–Ї –љ–Є–Ј–Ї–Њ–є, —В–∞–Ї –Є –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є. –Я—А–Є –љ–Є–Ј–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–≤–Њ–і–Є—В—Б—П 120вАУ150 –Љ–ї –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ (—Б —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ 120вАУ 200 –Љ–≥ –є–Њ–і–∞) —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О –Њ—В 4 –і–Њ 5 –Љ–ї/—Б. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–љ—В—А–∞—Б—В–∞ –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–≤–Њ–і–Є—В—Б—П 100вАУ120 –Љ–ї –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ —Б —Г—А–Њ–≤–љ–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П 270вАУ320 –Љ–≥ –є–Њ–і–∞ –Є —Б–Ї–Њ—А–Њ—Б—В—М—О –≤–≤–µ–і–µ–љ–Є—П 2вАУ3 –Љ–ї/—Б [11]. –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П, –њ—А–Њ–≤–Њ–і–Є–Љ–∞—П –≤ —А–µ–ґ–Є–Љ–µ –∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ—А—П–Љ—Г—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Њ–≤ –≤–љ—Г—В—А–Є –ї–µ–≥–Њ—З–љ—Л—Е –∞—А—В–µ—А–Є–є –≤ –≤–Є–і–µ –і–µ—Д–µ–Ї—В–Њ–≤ –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –≤–љ—Г—В—А–Є —Б–Њ—Б—Г–і–Њ–≤, —З–∞—Б—В–Є—З–љ–Њ –Є–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ–Ї—А—Г–ґ–µ–љ–љ—Л—Е –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї—А–Њ–≤—М—О, –Є–ї–Є –Ї–∞–Ї –њ–Њ–ї–љ—Л–є –і–µ—Д–µ–Ї—В –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–є –і–µ–ї–∞–µ—В –і–Є—Б—В–∞–ї—М–љ—Л–µ —Б–Њ—Б—Г–і—Л –њ–Њ–ї–љ–Њ—Б—В—М—О –љ–µ–Ї–Њ–љ—В—А–∞—Б—В–Є—А—Г–µ–Љ—Л–Љ–Є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ—Г–ї—М—В–Є–і–µ—В–µ–Ї—В–Њ—А–љ–Њ–є –Ъ–Ґ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –∞–њ–њ–∞—А–∞—В–∞—Е –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —Б–Њ—Б—Г–і—Л –ї–µ–≥–Ї–Њ–≥–Њ –і–Њ –≤–µ—В–≤–µ–є —И–µ—Б—В–Њ–≥–Њ –њ–Њ—А—П–і–Ї–∞ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —А–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–ї–Њ—Б–Ї–Њ—Б—В—П—Е, —Н–Љ–±–Њ–ї—Л –≤ –Ї–Њ—В–Њ—А—Л—Е —А–∞—Б–њ–Њ–Ј–љ–∞—О—В—Б—П –Ї–∞–Ї –і–µ—Д–µ–Ї—В—Л –≤–љ—Г—В—А–Є–њ—А–Њ—Б–≤–µ—В–љ–Њ–≥–Њ –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ —З–∞—Б—В–Є—З–љ–Њ –Є–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–Ї—Г–њ–Њ—А–Є–≤–∞—О—В —Б–Њ—Б—Г–і. –Я—А–Є —Н—В–Њ–Љ –і–µ—В–∞–ї—М–љ–Њ–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ –њ–∞—А–µ–љ—Е–Є–Љ—Л –ї–µ–≥–Ї–Є—Е –і–∞–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О. –Ґ—А—Г–і–љ–Њ—Б—В–Є –≤ –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —Б–њ–Є—А–∞–ї—М–љ—Л—Е –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞–Љ–Љ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –і—Л—Е–∞—В–µ–ї—М–љ—Л–Љ–Є –∞—А—В–µ—Д–∞–Ї—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±–љ—Л –і–∞–≤–∞—В—М –њ—Б–µ–≤–і–Њ–≥–Є–њ–Њ–і–µ–љ—Б–љ—Л–µ –Њ–±–ї–∞—Б—В–Є, –Љ–Є–Љ–Є–Ї—А–Є—А—Г—О—Й–Є–µ —Б–≥—Г—Б—В–Њ–Ї –Є–ї–Є –љ–µ–Ї–Њ–љ—В—А–∞—Б—В–Є—А—Г—О—Й—Г—О—Б—П –Њ–±–ї–∞—Б—В—М –≤ —Б–Њ—Б—Г–і–µ [38].
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ъ–∞—Б–∞—П—Б—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–∞—А—Г—И–µ–љ–Є–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –µ—Й–µ —А–∞–Ј –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–≤–µ—В–Є—В—М, —З—В–Њ US –Њ—Б—В–∞–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї —Д–ї–µ–±–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є [49, 50]. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —А–µ—З—М –Є–і–µ—В —В–Њ–ї—М–Ї–Њ –Њ —Б–ї—Г—З–∞—П—Е, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є –Љ—Л –Љ–Њ–ґ–µ–Љ —Б—В–Њ–ї–Ї–љ—Г—В—М—Б—П –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –≤–µ–љ–Њ–Ј–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–Њ–≤ [51]. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Њ—Ж–µ–љ–Ї–Є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–Њ–і–≤–Ј–і–Њ—И–љ—Л—Е –≤–µ–љ –Є –љ–Є–ґ–љ–µ–є –њ–Њ–ї–Њ–є –≤–µ–љ—Л [52]. –Ю—З–µ–љ—М —З–∞—Б—В–Њ –≤ —В–∞–Ї–Є—Е —Б–ї–Њ–ґ–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ —Б—В—А–Њ–Є—В—Б—П –љ–µ –љ–∞ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, –∞ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ—А–Њ–± —Б –і–Є—Б—В–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–µ–є –Є–ї–Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –і–µ–Ї–Њ–Љ–њ—А–µ—Б—Б–Є–µ–є. –Ю—И–Є–±–Ї–Є —В–∞–Ї–ґ–µ –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –Љ–Њ–≥—Г—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –≤ –Љ–µ—Б—В–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –њ–Њ–і–Ї–Њ–ї–µ–љ–љ–Њ–є –Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є –±–µ–і—А–µ–љ–љ–Њ–є –≤–µ–љ—Л –≤ –љ–∞—З–∞–ї–µ –∞–і–і—Г–Ї—В–Њ—А–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞. –Т –і–∞–љ–љ–Њ–є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–∞—П –±–µ–і—А–µ–љ–љ–∞—П –≤–µ–љ–∞ –≤ 20% —Б–ї—Г—З–∞–µ–≤ –Љ–Њ–ґ–µ—В –њ—А–Њ—Е–Њ–і–Є—В—М –і–≤—Г–Љ—П —Б—В–≤–Њ–ї–∞–Љ–Є, —З—В–Њ –Є –њ—А–Є–≤–Њ–і–Є—В –Ї –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—И–Є–±–Ї–µ, –Ї–Њ–≥–і–∞ –Њ–њ–µ—А–∞—В–Њ—А –≤–Є–і–Є—В —Е–Њ—А–Њ—И—Г—О –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ–і–љ–Њ–≥–Њ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —Б—В–≤–Њ–ї–∞ –Є –љ–µ –Њ–±—А–∞—Й–∞–µ—В –≤–љ–Є–Љ–∞–љ–Є—П –љ–∞ —В—А–Њ–Љ–±–Њ–Ј –і—Г–±–ї–Є—А—Г—О—Й–µ–є –≤–µ–љ–Њ–Ј–љ–Њ–є –Љ–∞–≥–Є—Б—В—А–∞–ї–Є [38].
–Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е —Е–Њ—В–µ–ї–Њ—Б—М –±—Л –њ–Њ–ї—Г—З–Є—В—М –±–Њ–ї—М—И—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –і—Г–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–Є—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞ –Є–Љ–µ–љ–љ–Њ –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л—Е –≤–µ–љ –≥–Њ–ї–µ–љ–Є, –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –љ–µ—А–∞—Б–њ–Њ–Ј–љ–∞–љ–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –љ–∞—Б—В–Њ—А–∞–ґ–Є–≤–∞–µ—В, –љ–∞–њ—А–Є–Љ–µ—А, —Г –ґ–µ–љ—Й–Є–љ –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [53, 54]. –Я—А–Њ–±–ї–µ–Љ—Л —Б –Њ—В—З–µ—В–ї–Є–≤–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Б—Г—А–∞–ї—М–љ—Л—Е –≤–µ–љ –Љ–Њ–≥—Г—В –≤–Њ–Ј–љ–Є–Ї–љ—Г—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є–ї–Є –Њ—В–µ–Ї–Њ–Љ [53]. –Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М US –Є–Ј-–Ј–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–µ–љ–Є—П –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–µ —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ [55]. –Ґ–∞–Ї–ґ–µ –≤—Л—Б–Њ–Ї–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–Є—П –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є US —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –ї–Є–њ–Њ–і–µ—А–Љ–∞—В–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ –Њ—В–µ–Ї–Њ–Љ, –њ—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–µ—Б—В–∞ –љ–∞ —Б–ґ–Є–Љ–∞–µ–Љ–Њ—Б—В—М [51].
–Я–Њ –Љ–љ–µ–љ–Є—О –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ–Ј–∞ –Ґ–У–Т –≤–Њ –≤—Б–µ—Е –Њ–њ–Є—Б–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е —В—А–µ–±–Њ–≤–∞–ї–Њ —Г—В–Њ—З–љ—П—О—Й–µ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —В–∞–Ї –Ї–∞–Ї —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –і–∞–ґ–µ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –Ґ–≠–Ы–Р –Њ—Б—В–∞–≤–∞–ї—Б—П –≤—Л—Б–Њ–Ї–Є–Љ, –∞ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–≤–µ–і–µ–љ–Є–є –Њ –≤–µ—А–Њ—П—В–љ–Њ–Љ –Є—Б—В–Њ—З–љ–Є–Ї–µ –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й—Г—О –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Г—О —В–µ—А–∞–њ–Є—О –Є–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М –µ–µ –Ї–Њ—А—А–µ–Ї—Ж–Є—О, –Њ—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ–Њ–≤—В–Њ—А–љ—Л—Е —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е US [55].
–Ю–і–љ–Є–Љ –Є–Ј —В–∞–Ї–Є—Е —Г—В–Њ—З–љ—П—О—Й–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –≤ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–µ–љ —В–∞–Ј–∞ –Є –љ–Є–ґ–љ–µ–є –њ–Њ–ї–Њ–є –≤–µ–љ—Л –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –Ь–†–Ґ, –Ї–Њ—В–Њ—А–∞—П –±–ї–∞–≥–Њ–і–∞—А—П –≤–љ–µ–і—А–µ–љ–Є—О —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –≤–µ–љ–Њ–Ј–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –≤ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–Љ —А–∞–Ј—А–µ—И–µ–љ–Є–Є, –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –Ь–†–Ґ –њ–µ—А–µ–і –Ъ–Ґ, –±–µ—Б—Б–њ–Њ—А–љ–Њ, —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –ї—Г—З–µ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞.
–Р–љ–∞–ї–Є–Ј –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –Љ–Є—А–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї –≤—Л—Б–Њ–Ї—Г—О –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–†-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Њ –≤—Б–µ—Е —Б–ї–Њ–ґ–љ—Л—Е –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±–µ—Б–Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ь–†-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ —Н—В–Њ–≥–Њ —П–≤–ї—П—О—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –≤ 2017 –≥. –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –і–∞–ї—М–љ–µ–є—И–µ–є —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –≤ –Ь–†–Ґ-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –±–µ—Б–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є –њ—А—П–Љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–∞ [56], –∞ —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –±–µ—Б–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–є –њ—А—П–Љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–∞ [57]. –Ш—Б–њ–Њ–ї—М–Ј—Г—П —Н—В–Є –љ–Њ–≤—Л–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є–Љ–њ—Г–ї—М—Б–љ—Л–µ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П, –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—Г—З–∞—В—М –≤—Л—Б–Њ–Ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Г—О –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—О –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –≤–µ–љ –Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –≤ –њ—А–∞–Ї—В–Є–Ї–µ –љ–∞ —Б–µ–≥–Њ–і–љ—П —Б–Ї–∞–љ–Є—А—Г—О—Й–Є—Е —Б–Є—Б—В–µ–Љ —Б –Љ–∞–≥–љ–Є—В–љ—Л–Љ –њ–Њ–ї–µ–Љ 1,5 –Ґ–µ—Б–ї–∞ [58]. –Э–µ –њ–Њ—В–µ—А—П–ї–Є —Б–≤–Њ–µ–є –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В–Є –Є –Љ–µ—В–Њ–і—Л –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ —Г—Б–Є–ї–µ–љ–љ–Њ–є –Ь–†-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є. –Ь–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≤ –±–ї–Є–ґ–∞–є—И–µ–Љ –±—Г–і—Г—Й–µ–Љ, —Б –і–∞–ї—М–љ–µ–є—И–µ–є —А–∞–Ј—А–∞–±–Њ—В–Ї–Њ–є –љ–Њ–≤—Л—Е –Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ ¬Ђ–њ—Г–ї–∞ –Ї—А–Њ–≤–Є¬ї, –Ь–†-–≤–µ–љ–Њ–≥—А–∞—Д–Є—П —Б–Љ–Њ–ґ–µ—В –њ–Њ–Ї–∞–Ј–∞—В—М –≤—Л—Б–Њ–Ї—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —Ж–µ–љ–љ–Њ—Б—В—М –Є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–Є—Б—В–∞–ї—М–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–Њ–≤ –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є. –Ю—Б–Њ–±–Њ–є –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ —Г—Б–Є–ї–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ь–†–Ґ-—Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –ї–µ–≥–Ї–Є—Е –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л [38]. –Э–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В —В–∞–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і—П—В—Б—П, –Њ–і–љ–∞–Ї–Њ –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П —Н—В–Њ–є –Ј–∞–і–∞—З–Є –Љ–Њ–ґ–љ–Њ –±—Г–і–µ—В –Њ–ґ–Є–і–∞—В—М –ї–Є—И—М –≤ –±—Г–і—Г—Й–µ–Љ. –Х—Й–µ –Њ–і–љ–Є–Љ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ь–†-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є, –њ–Њ –Љ–љ–µ–љ–Є—О –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, —П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Ґ–У–Т –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Т —Н—В–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л US —З–∞—Б—В–Њ –і–≤—Г—Б–Љ—Л—Б–ї–µ–љ–љ—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ –њ–Њ—Б–ї–µ–і–љ–Є—Е —Б—А–Њ–Ї–∞—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –У—А–Њ–Ј–љ—Л–Љ –≤–µ–љ–Њ–Ј–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —Г –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Љ–Њ–ґ–µ—В —Б—В–∞—В—М —В—А–Њ–Љ–±–Њ–Ј —П–Є—З–љ–Є–Ї–Њ–≤—Л—Е –≤–µ–љ –Є–ї–Є –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–є —В—А–Њ–Љ–±–Њ—Д–ї–µ–±–Є—В —Н—В–Є—Е –≤–µ–љ, –Ї–Њ—В–Њ—А—Л–є, –њ–Њ –і–∞–љ–љ—Л–Љ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е –∞–≤—В–Њ—А–Њ–≤, –≤ 25% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–µ–њ—Б–Є—Б–∞ –Є –Т–Ґ–≠ [59].
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Ъ–Ґ, —В–Њ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ–њ—А—П–Љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Њ—Б—В–∞–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–≠–Ы–Р [32, 33, 49, 50]. –Ь–љ–Њ–≥–Њ–Ї—А–∞—В–љ—Л–µ –њ–Њ–њ—Л—В–Ї–Є –і–Њ–±–Є—В—М—Б—П –Њ—В—З–µ—В–ї–Є–≤–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–Њ–≤ –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—Г—В–µ–Љ ICTV –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ –Є–ї–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –њ—А–Њ–≤–µ–і–µ–љ–Є–µ–Љ –Ъ–Ґ-–∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є –љ–µ –њ—А–Є–≤–µ–ї–Є –Ї —Г—Б—В–Њ–є—З–Є–≤–Њ–Љ—Г –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–Љ—Г —А–µ–Ј—Г–ї—М—В–∞—В—Г [34, 35, 60], —В–∞–Ї –Ї–∞–Ї –≤ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–Ј-–Ј–∞ —А–∞–Ј–Љ—Л—В–Њ—Б—В–Є –Ї–Њ–љ—В—А–∞—Б—В–∞ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –≤–µ–љ–∞—Е –њ–Њ—Б—В—А–Њ–µ–љ–Є–µ 3D-–Љ–Њ–і–µ–ї–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –љ–µ–≤—Л–њ–Њ–ї–љ–Є–Љ—Л–Љ [40].
–Ш–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Њ—В–Ї—А—Л–ї–Є—Б—М –њ–Њ—Б–ї–µ –≤–љ–µ–і—А–µ–љ–Є—П –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г DCTV —Б –њ–Њ–Љ–Њ—Й—М—О –±–Њ–ї—О—Б–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–∞ –њ—Г—В–µ–Љ –њ—Г–љ–Ї—Ж–Є–Є –Њ–і–љ–Њ–є –Є–Ј –≤–µ–љ —В—Л–ї–∞ —Б—В–Њ–њ—Л [39, 40, 61]. –Ю–і–љ–∞–Ї–Њ –Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ—И–Є–±–Њ–Ї –Њ—Б—В–∞–µ—В—Б—П. –Ю—Б–љ–Њ–≤–љ–∞—П –њ—А–Є—З–Є–љ–∞ –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є –Є —З–µ—В–Ї–Њ–є –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ш–Љ–µ–љ–љ–Њ –њ–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М DCTV –Є–Љ–µ—О—В –і–Є–∞–њ–∞–Ј–Њ–љ –Њ—В 89% –і–Њ 100% –Є –Њ—В 94% –і–Њ 100% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [62]. –Я—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї—М—И—Г—О —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є—П –Є–Љ–µ–µ—В –њ—А–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –±–µ–і—А–µ–љ–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞, –∞ –љ–∞–Є–Љ–µ–љ—М—И—Г—О вАФ –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–µ–љ –≥–Њ–ї–µ–љ–Є [63].
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ъ–Ґ-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ –њ—А–∞–Ї—В–Є–Ї–µ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Д–ї–µ–±–Њ–ї–Њ–≥–Њ–≤ –°–®–Р, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —Д–Њ—А—Г–Љ–∞, –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Љ–Є–Љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ґ–≠–Ы–Р —П–≤–ї—П–µ—В—Б—П –Є–Ј—Г—З–µ–љ–Є–µ –Њ–±—Б—В—А—Г–Ї—Ж–Є–є –Ї—А—Г–њ–љ—Л—Е –≤–µ–љ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –ґ–Є–≤–Њ—В–∞, –љ–Є–ґ–љ–µ–є –њ–Њ–ї–Њ–є –Є –њ–Њ–і–≤–Ј–і–Њ—И–љ—Л—Е –≤–µ–љ [64]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —Б–µ–≥–Њ–і–љ—П –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Ъ–Ґ-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ–љ –Є –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е [49, 50].
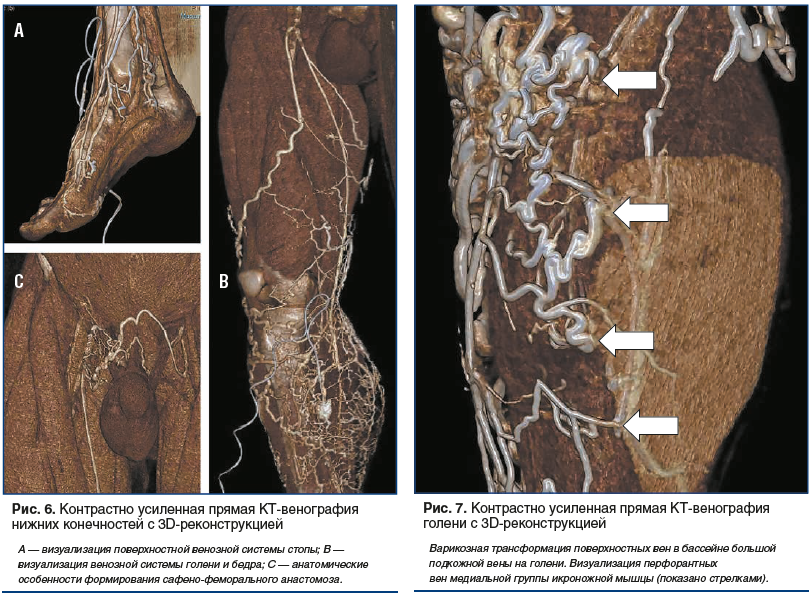
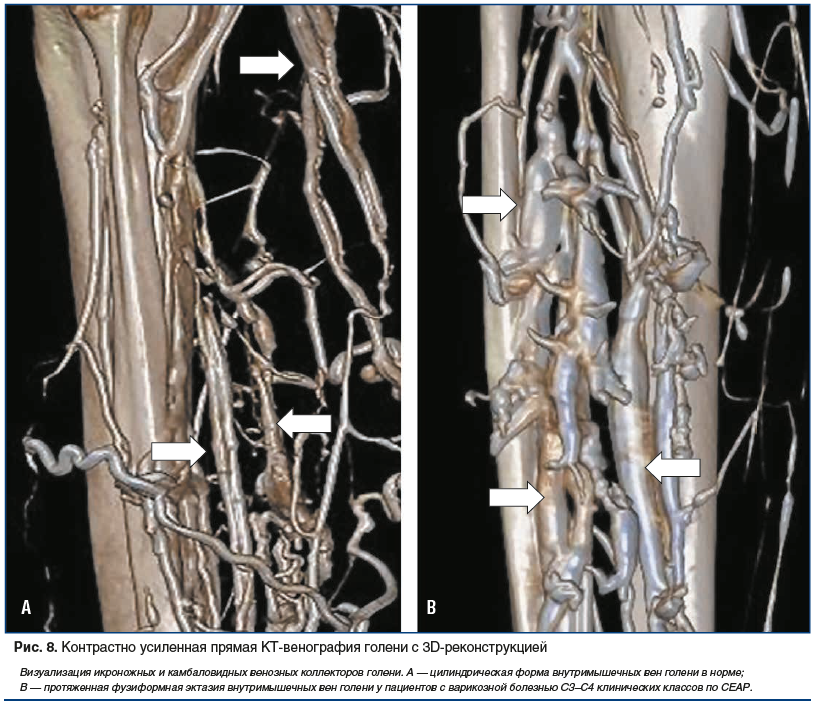
–Х—Й–µ –Њ–і–љ–Є–Љ –Є –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–Љ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–Љ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ —Г—Б–Є–ї–µ–љ–љ–∞—П –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є—П –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –≤ –Є–Ј—Г—З–µ–љ–Є–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —В–Њ–њ–Њ–≥—А–∞—Д–Њ-–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–Њ–µ–љ–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —А—Г—Б–ї–∞ (—А–Є—Б. 6вАУ8). –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ—А–Є–ґ–Є–Ј–љ–µ–љ–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ—Л—Е –Ї–Њ–ї–ї–µ–Ї—В–Њ—А–Њ–≤ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –љ–µ —В–Њ–ї—М–Ї–Њ –Є–љ–∞—З–µ –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –њ—А–Є–Ї–ї–∞–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–∞—А–Є–Ї–Њ–Ј–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [65, 66], –љ–Њ –Є —Г—В–Њ—З–љ–Є—В—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –≤–µ–љ–Њ–Ј–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є [67]. –Я—А–Њ–≤–µ–і–µ–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ —Г—Б–Є–ї–µ–љ–љ–Њ–є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–љ–∞—В–Њ–Љ–Є–Є –≥–Њ–ї–µ–љ–Њ—Б—В–Њ–њ–љ–Њ–є –Љ—Л—И–µ—З–љ–Њ-–≤–µ–љ–Њ–Ј–љ–Њ–є –њ–Њ–Љ–њ—Л —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Г—З–∞—Б—В–Є—П –≤ –≤–µ–љ–Њ–Ј–љ–Њ–Љ –Њ—В—В–Њ–Ї–µ –Є–Ј –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–µ–љ–Њ–Ј–љ—Л—Е –Ї–Њ–ї–ї–µ–Ї—В–Њ—А–Њ–≤, –љ–Њ –Є –њ–µ—А—Д–Њ—А–∞–љ—В–љ—Л—Е –≤–µ–љ [68вАУ70].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ –Є –∞–љ–∞–ї–Є–Ј–∞ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ –Є–љ—В–µ—А–µ—Б –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Ь–†–Ґ- –Є –Ъ–Ґ-–≤–µ–љ–Њ–≥—А–∞—Д–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ–љ –±—Г–і–µ—В —В–Њ–ї—М–Ї–Њ –≤–Њ–Ј—А–∞—Б—В–∞—В—М. –Т–Њ-–њ–µ—А–≤—Л—Е, —Н—В–Њ –њ—А–Њ–і–Є–Ї—В–Њ–≤–∞–љ–Њ —В–µ—Б–љ–Њ–є –≤–Ј–∞–Є–Љ–Њ-—Б–≤—П–Ј—М—О —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б –Ґ–У–Т –Є –Ґ–≠–Ы–Р, —П–≤–ї—П—О—Й–Є—Е—Б—П, –њ–Њ —Б—Г—В–Є, –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Њ–і–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –Є–Љ–µ–љ–љ–Њ –Т–Ґ–≠, —З—В–Њ —В—А–µ–±—Г–µ—В —Б–≤–Њ–µ-–≤—А–µ–Љ–µ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ–±–Њ–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є. –Т–Њ-–≤—В–Њ—А—Л—Е, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –±–Њ–ї–µ–µ —В–Њ—З–љ–Њ–є —В–Њ–њ–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б 3D-–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–µ–є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є —В–∞–Ј–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–∞—А–∞—Б—В–∞—О—Й–Є–Љ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Є–љ—В–µ—А–µ—Б–Њ–Љ —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є –Є–љ—В–µ—А–≤–µ–љ—Ж–Є–Њ–љ–љ—Л—Е —Е–Є—А—Г—А–≥–Њ–≤ –Ї –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –≤–љ–µ–і—А–µ–љ–Є—О –≤–Њ —Д–ї–µ–±–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г —Н–љ–і–Њ–≤–∞–Ј–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Ю—З–µ–≤–Є–і–љ–Њ –Є —В–Њ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–µ—В–Њ–і–Њ–≤ –Ь–†- –Є –Ъ–Ґ-–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є —А–∞–±–Њ—В–µ –њ–Њ–Ј–≤–Њ–ї–Є—В —Г—В–Њ—З–љ–Є—В—М –і–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –∞–љ–∞—В–Њ–Љ–Є–Є, –∞ —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Є–љ–∞—З–µ –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–∞—В–Њ–≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Ј–≤–µ–љ—М—П —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л.












