Сегодня во всем мире отмечается тенденция к росту инфекционной патологии в структуре причин смерти новорожденных, причем среди недоношенных детей доля инфекции в структуре причин смерти в 15–20 раз выше, чем среди доношенных. В структуре инфекционной патологии, приводящей к неблагоприятным исходам, ведущее место занимает сепсис. Высокая смертность новорожденных детей с инфекционно–септическим процессом, отсутствие четких критериев самого диагноза, а также естественные трудности постановки данного диагноза и терапии, связанные с особенностями неонатального периода жизни, ставят перед клиницистами задачу поиска новых объективных критериев для диагностики и мониторинга в ОРИТ.
Появление информации о новых перспективных маркерах бактериальной инфекции в медицинской литературе вовсе не означает, что эти методы или технологии сразу найдут широкое практическое применение. Как правило, проходят многие годы, прежде чем тот или иной тест «приживется» и станет востребованным клиницистами. Особенно, если речь идет о таком разделе медицины, как неонатология, и о таких специалистах, как детские реаниматологи.
У нас в стране достаточно долгий путь признания проходил количественный тест на С–реактивный белок (СРБ). В настоящее время большинство детских клинических учреждений использует этот тест, с помощью которого можно получить объективную информацию о наличии воспаления в организме, а в динамике – об эффективности проводимого лечения. К сожалению, серьезными недостатками теста на СРБ является то, что повышение С–реактивного белка носит неспецифический характер и может отмечаться не только при бактериальном воспалении и сепсисе, но и при воспалении любого другого генеза, например, пищевой аллергии, ревматоидной реакции, сенсибилизации к компонентам лекарственной терапии, инфузионным препаратам, кровезаменителям, а также при вирусных, грибковых, аутоиммунных заболеваниях и др.
Именно поэтому с большим энтузиазмом в медицинской среде было воспринято появление нового маркера сепсиса и бактериальных инфекций – прокальцитонина (РСТ), который является не только более чувствительным и специфичным, но и лишен всех перечисленных выше недостатков, свойственных СРБ.
В данной публикации нет возможности подробно остановиться на характеристике биомаркера РСТ. Чтобы получить представление о значении этого маркера и масштабности его применения в современной медицине, достаточно ознакомиться с кратким перечнем рекомендуемой литературы, приведенной в конце данной статьи. Даже по названиям зарубежных и отечественных журналов, ориентированных преимущественно на анестезиологов и реаниматологов, легко понять, что востребованность в этом тесте чрезвычайно высока именно в медицине критических состояний [1–8]. Предлагаем коллегам ознакомиться с подробным аналитическим обзором на русском языке, направленным на поиск «идеального» биомаркера бактериальных инфекций, где дан подробный анализ диагностических возможностей теста на прокальцитонин и проведено его сравнение с другими современными маркерами [8].
Несмотря на растущее число работ о практическом применении теста на РСТ, в том числе – в периоде новорожденности, российские клиницисты, несомненно, нуждаются в новых исследованиях, проведенных в наших условиях, для решения наших насущных проблем в интенсивной неонатологии.
С учетом существующих в литературе рекомендаций сформулированы рабочие диапазоны уровней РСТ для новорожденных изученного контингента:
n < 0,5 нг/мл – нормальный уровень
n 0,5–2 нг/мл – системная воспалительная реакция неясной этиологии, при которой возможна локальная инфекция
n 2–10 нг/мл – достоверная системная воспалительная реакция, вероятней всего развившаяся вследствие инфекции, если неизвестны никакие другие причины
n >10 нг/мл – выраженная системная воспалительная реакция, развившаяся вследствия тяжелого бактериального сепсиса или септического шока, преимущественно грамотрицательной этиологии.
Среди самых актуальных вопросов, на которые хотелось бы получить ответ при организации таких исследований, можно назвать следующие:
1. Может ли тест на РСТ помочь в поиске причин исходной тяжести, то есть в проведении дифференциальной диагностики у новорожденного ребенка, поступившего на ИВЛ в ОРИТ?
2. Можно ли по уровню РСТ судить о наличии или отсутствии бактериальной инфекции у новорожденного, то есть решать вопрос о показаниях к антибиотикотерапии?
3. Можно ли по динамике уровня РСТ оценить правильность начатого лечения и его прогноз?
На самом деле перечень вопросов можно продолжить, однако значительно важнее найти ответ хотя бы на некоторые из них. Это и послужило поводом для проведения настоящего исследования по оценке диагностической значимости РСТ (общепризнанного маркера сепсиса) у новорожденных на ИВЛ в ОРИТ. Необходимо выяснить, насколько полезен этот новый тест для принятия решения о лечебной тактике у постели критически больного новорожденного.
При планировании исследования выделены 2 этапа:
• первый этап – с ретроспективным анализом лабораторных показателей уровня РСТ. Соответственно, его результаты, опубликованные в данной статье, расценены нами как предварительные. Задачей первого этапа было выяснить, может ли тест на РСТ помочь в ответе на вопрос, нужен ли данному больному максимально мощный антибиотик (карбапенем) и насколько назначение такого антибиотика может повлиять на течение и исход у данного больного
• при получении обнадеживающих результатов запланирован второй этап – проспективное исследование, когда врачи в процессе лечения больного будут учитывать показатели теста на РСТ.
Конечной целью исследования является создание на основании полученных данных алгоритма, в котором так нуждаются детские реаниматологи при лечении новорожденных и недоношенных высокого риска.
Материалы и методы
В 2005 году в первый этап исследования последовательно включены 45 новорожденных, госпитализированных в отделение реанимации и интенсивной терапии ДГКБ № 13 им. Филатова (неонатальный центр). Все дети поступали в отделение из родильных домов и детских стационаров города Москвы, в тяжелом состоянии, на ИВЛ. Большинство новорожденных при поступлении были в возрасте первой недели жизни (39 детей, 86,5%), а именно:
– в возрасте 1–2 дня в исследование включено 27 детей (60%);
– от 3 до 7 дней – 12 детей (26,5%);
– от 8 до 14 дней – 2 ребенка (4,7%).
С поздним поступлением (после 14 сут.) в исследование включено всего 4 ребенка (8,8%). Таким образом, средний возраст при поступлении составил 4,5 сут.
По гестационному возрасту дети распределились следующим образом:
– недоношенных – 30 детей (67%), в т.ч. 2 (4,4%) с гестационным возрастом менее 28 недель;
– доношенных – 15 детей (33%).
Мальчиков было 27, девочек – 18, что составило 40 и 60% соответственно.
Все дети поступали в тяжелом состоянии, однако роль бактериальной инфекции не всегда была ясна. Как правило, сразу после поступления в отделение по тяжести состояния этим больным назначались антибиотики – один из вариантов эмпирического стартового режима, например:
а) цефалоспорин 2–го поколения (цефуроксим) плюс/минус аминогликозид нетилмицин либо
б) цефалоспорин 3–го поколения (цефтазидим, цефтриаксон, цефотаксим) плюс/минус ванкомицин.
Выбор антибиотика определялся наличием признаков инфекции, тяжестью состояния, данными об антибиотикотерапии на этапе лечения в родильном доме, с учетом анамнеза матери и др.
Всем пациентом проводилось традиционное обследование (клинические анализы крови и мочи, микробиологические посевы, биохимический анализ крови с определением СРБ и др.) и лечение по принятым стандартам.
Согласно протоколу исследования пробу крови для последующего определения уровня РСТ брали в том случае, когда возникала необходимость подтвердить или опровергнуть ведущую роль бактериального воспаления. Однако исследование не выполнялось сразу, а образец центрифугировали, сыворотку замораживали и помещали в морозильную камеру для хранения. В зависимости от того, когда теоретически возникал вопрос о выраженности бактериальной нагрузки (то есть о РСТ), тогда и производился забор образца крови. В некоторых случаях это происходило сразу при поступлении ребенка в отделение, но чаще – когда появлялась необходимость смены антибиотиков.
Коррекция антибиотикотерапии (или смена антибиотиков) проводилась по разным причинам, наиболее частыми из которых были следующие:
– клиническое ухудшение состояния ребенка;
– отрицательная динамика лабораторных показателей (повышение лейкоцитоза и др.);
– данные дополнительных обследований (рентгенография и др.);
– окончание предыдущего курса.
В большинстве случаев пробы крови для РСТ у детей брали в день смены антибиотика, то есть после отмены стартового режима – перед назначением нового. Теоретически врачу было важно знать показатель РСТ сразу после забора крови, но на этом этапе работы, чтобы объективно оценить диагностическую значимость теста у данного контингента больных, образец крови замораживался. Врач по–прежнему ориентировался на традиционные клинико–лабораторные показатели, а затем ретроспективно мог сопоставить их с уровнем РСТ и сделать выводы – является ли этот тест полезным и дает ли он новую информацию для оптимизации антибитикотерапии. Тест на РСТ, выполненный отсроченно, доводился до сведения врача лишь по прошествии какого–то времени, и потенциальная роль этого показателя обсуждалась ретроспективно.
На каждого ребенка велась карта наблюдения. В соответствии с протоколом у всех детей, включенных в исследование, регистрировались осложнения, развитие очагов инфекции и исход. В качестве независимых показателей лечения подсчитывались длительность ИВЛ, койко–день в реанимации, общая продолжительность пребывания в стационаре.
Тест на РСТ
Для количественного определения РСТ сыворотка, полученная из 1 мл венозной крови, исследовалась иммунолюминометрическим методом, принцип которого подробно описан в предыдущих публикациях [7,8]. По условиям данного исследования, практически все образцы исследовались одномоментно – по окончании исследования (то есть ретроспективно) однако трем детям с явной клиникой септического состояния по настоянию лечащих врачей анализ был произведен в день забора крови, причем в двух случаях повторно при зафиксированных высоких значениях у детей с течением тяжелой инфекции с целью оценки эффективности терапии и еще в одном случае – при ухудшении состояния ребенка. Таким образом, на данном этапе исследования всего было выполнено 48 тестов на РСТ у 45 новорожденных.
Результаты исследования
и обсуждение
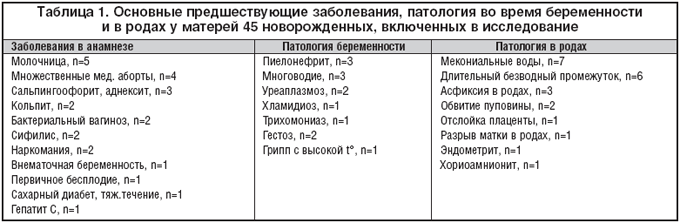
Новорожденные, поступившие в неонатальный центр для интенсивной терапии, находились в тяжелом состоянии и, как правило, нуждались в ИВЛ. В анамнезе у 36 из 45 (%) матерей этих детей имелись сведения о серьезной патологии во время беременности, в родах и/или о предшествующих заболеваниях, что отражено в таблице 1.
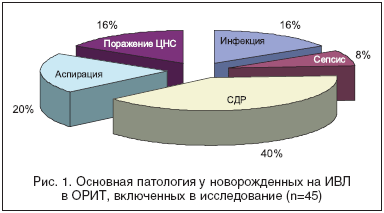
Основными причинами для экстренной госпитализации в ОРИТ были дыхательная недостаточность, чаще всего связанная с РДС или аспирационным синдромом, инфекция, поражение ЦНС (НМК, ВЖК, судорожный синдром), в различных сочетаниях, включая гемолитическую болезнь, пороки развития (ВПС) и др. сопутствующую патологию периода новорожденности (рис. 1).
При микробиологическом исследовании в ОРИТ у 13 из 45 новорожденных документирована бактериемия: в 7 случаях – грамотрицательная (Klebsiella pneumoniae – 5, E. cоli – 1, Pseudomonas aeruginosa – 1), в 4 случаях – стафилококковая, в 2 случаях – кандидемия. При посеве отделяемого из трахеи практически у всех детей получали положительный рост различных грам(+) и грам(–) бактерий, часто меняющихся в процессе терапии, редко – рост грибов. При посеве мочи рост получен у 21 из 45 детей (46,67%), причем в этом биологическом материале преобладали грибы рода Кандида (16 случаев), а кишечные палочки, стафилококки или энтерококки встречались в единичных случаях.
По окончании исследования на основании клинических симптомов и лабораторных данных пациенты были разделены на 5 групп:
• 1 группа, n=7 – новорожденные с течением вирусной или грибковой инфекции;
• 2 группа, n=15 – новорожденные с локальным воспалительным процессом (пневмония, энтероколит, омфалит, конъюнктивит);
• 3 группа, n=6 – дети, воспалительный процесс у которых отсутствовал;
• 4 группа, n=4 – новорожденные, находящиеся в критических состояниях неинфекционного генеза;
• 5 группа, n=13 – новорожденные с системным воспалительным процессом инфекционного генеза (сепсисом).
У детей 1 группы с документированной инфекцией вирусного или грибкового генеза не было зафиксировано высоких значений РСТ, в том числе – в случаях системного кандидоза и виремии. Один ребенок из этой группы, имевший генерализованную грибковую инфекцию, умер; причина смерти по данным патологоанатомического вскрытия – множественные пороки развития, синдромальная форма.
Среди детей 2 группы с локальным воспалительным процессом, независимо от его локализации (пневмония, энтероколит, омфалит, конъюнктивит) значения РСТ оказались умеренно повышенными (от 0,5 до 2 нг/мл) у 5 детей; лишь у одного ребенка с тяжелым течением внутриутробной пневмонии уровень РСТ был 5 нг/мл. Все дети были благополучно излечены или переведены на следующие этапы выхаживания, летальных исходов в этой группе не было.
В 3 группу отнесены дети, которые не имели воспалительных процессов при поступлении и у которых в дальнейшем, в процессе лечения признаков инфекции не отмечалось. У 5 из 6 новорожденных этой группы повышенных уровней РСТ не было отмечено, исключение составил один ребенок, перенесший тяжелую асфиксию в родах, анализ на РСТ был взят у него при поступлении в возрасте 12 часов жизни и оказался повышенным.
У детей 4 группы, находящихся в критических состояниях, во всех случаях зафиксированы высокие значения РСТ, трое из них умерли. Среди причин смерти нет указаний на инфекцию: у двух детей имели место несовместимые с жизнью кровоизлияния в головной мозг, 1 ребенок со сложным ВПС, тяжелой сердечной недостаточностью умер в связи с развитием кардиогенного шока. Один ребенок – с врожденным заворотом кишечника, некрозом части кишки, развитием перитонита.
Особого внимания заслуживает анализ 5 группы, куда вошли 13 детей с признаками системной реакции на воспалительный процесс. Диагноз сепсиса у новорожденных устанавливался при наличии системного воспалительного ответа в сочетании с инфекционным очагом и/или полиорганной недостаточностью, положительная гемокультура рассматривалась как дополнительный критерий. Важно отметить, что в этой группе гемокультура зарегистрирована в 93% случаев. В зависимости от срока манифестации воспалительного процесса были выделены группы с ранним (внутриутробным, n=5) и поздним (постнатальным, n=9) сепсисом.
По этиологическому признаку дети с бактериальным септическим процессом распределились следующим образом: у 4 детей (29%) верифицирован грамположительный и у 9 (66%) – грамотрицательный сепсис.
При сопоставлении лабораторных показателей в группе детей с клиническим диагнозом «сепсис», важно отметить следующее:
• положительная гемокультура зарегистрирована у 12 из 13 детей (93%);
• значения РСТ были повышенными у 11 детей этой группы, что составило 84%. Наиболее высокие значения наблюдались при грам(–) сепсисе;
• уровень СРБ был повышен у 7 (51%) детей данной группы;
• лейкоцитоз отмечался у 6 детей, у 3 была лейкопения, т.е. отклонение уровня лейкоцитов от нормы наблюдалось у 69% детей.
Из этой группы умерли двое детей, при этом у одного ребенка сепсис отмечен в протоколе вскрытия как основная причина смерти.
Результаты теста на РСТ сравнивались с СРБ, уровнем лейкоцитов крови, и данными гемокультур. РСТ оказался более чувствительным и специфичным маркером септического процесса. Чувствительность и специфичность метода по результатам данного исследования составила 89 и 63% соответственно.
Анализ антибактериальной терапии
Антибиотикотерапия имеет решающее значение в определении тяжести течения и исхода не только у детей, поступивших с локальной или генерализованной инфекцией, но и у новорожденных с аспирационным синдромом, особенно в случае аспирации мекониальных вод. Наиболее ответственным является момент коррекции антибактериальной терапии у ребенка, находящегося на ИВЛ, так как недооценка уровня микробной нагрузки и выбор неадекватного антибактериального препарата могут привести к быстрой активации воспалительного процесса с неблагоприятными последствиями. С другой стороны, тяжесть состояния ребенка на ИВЛ может быть обусловлена другими причинами, не связанными с инфекцией, и в таких случаях рассчитывать на максимально широкий спектр антибактериальной активности карбапенемов не имеет смысла, так как не антибиотики решают проблему.
Коррекция антибиотикотерапии в неонатальном центре потребовалась у 23 детей, при смене препаратов врачи ориентировались, как указано выше, на совокупность традиционных клинико–лабораторных показателей и опыт.
После «расшифровки» данных об уровне РСТ оказалось, что детей с высоким показателем РСТ>2 нг/мл было 23. Ретроспективный анализ показал, что среди них в 13 случаях (60%) назначались антибиотики из группы карбапенемов (Меронем), в 10 (40%) – антибиотики других групп (цефалоспорины 2–3–4 поколений, аминогликозиды, ципрофлоксацин). При сравнении основных показателей лечения в этих двух группах получены следующие данные: длительность ИВЛ и койко–день в реанимации значительно меньше у детей, которым были назначены карбапенемы. В таком показателе, как общая продолжительность пребывания в стационаре, существенной разницы между группами не выявлено. Из 13 детей, рано пролеченных карбапенемами, умер 1 ребенок (7,7%), а во второй группе из 10 детей умерли 2 (20%) (табл. 2).
Важно отметить еще одно наблюдение: анализ показал, что детям из группы В на последующих этапах также применялись карбапенемы, так как септический процесс прогрессировал и требовал интенсификации лечения, однако применение мощных антибиотиков в более поздние сроки менее эффективно, что отразилось на показателях лечения (рис. 2).
При анализе полученных данных выделены случаи, когда у новорожденных (n=22) отмечались низкие или нормальные показатели РСТ, что свидетельствовало об отсутствии выраженной бактериальной нагрузки. Однако дифференцировать причины тяжести состояния удается далеко не всегда, поэтому у части таких детей (n=13) также применялись карбапенемы в расчете на их жизнеспасающий эффект (табл. 3).
Однако, как и следовало ожидать, у тех детей, тяжесть состояния которых была обусловлена другими причинами, не связанными с бактериальной инфекцией (РСТ ниже 2 нг/мл), применение карбапенемов не дало эффекта. Более того, у этой группы детей (группа А) основные показатели лечения оказались хуже, чем в группе В, где применялись менее мощные антибиотики. И это не парадокс, а закономерное следствие неадекватной оценки роли инфекции в тяжести состояния больного: по–видимому, в группе В новорожденным не назначены карбапенемы, так как тяжесть состояния справедливо оценивалась с учетом всех возможных причин, на которые, соответственно, и была сконцентрирована последующая терапия. А детям в группе А, по–видимому, ошибочно предположили ведущую роль грамотрицательной инфекции (не зная, что уровень РСТ низкий!), поэтому были назначены карбапенемы, но в ожидании эффекта от мощных антибиотиков напрасно ушло время, не устраняя истинные причины тяжести состояния, вследствие чего длительность ИВЛ и койко–дня в реанимации оказалась более продолжительной, а показатель летальности был более высоким в этой группе.
Клинический пример
Недоношенная девочка, Наташа Л., поступила в неонатальный центр ДГКБ №13 на 2–е сутки жизни из роддома
№ 25. Из анамнеза: ребенок от женщины 37 лет, от 2–й беременности, протекавшей в I–м триместре с грибковым кольпитом, анемией; во II–м – с декомпенсированной формой фетоплацентарной недостаточности, нефропатией, внутриутробной задержкой развития плода. Роды 2–е, преждевременные, на 33–й неделе беременности, путем операции кесарева сечения на фоне обострения гестоза, протекали с преэклампсией. Апгар 5–6 баллов, вес 1150 г, рост 37 см. Состояние при рождении тяжелое, ИВЛ с 5–й минуты жизни. Диагноз при поступлении – СДР, церебральная ишемия, недоношенность. Тяжесть состояния при поступлении обусловлена выраженной дыхательной недостаточностью, неврологической симптоматикой. К 6–м сут. наметилась положительная динамика, ребенок экстубирован, начал усваивать питание. В ан. крови без воспалительных изменений, в посевах роста нет, РСТ–0, СРБ–0. На 13–е сут. ухудшение состояния в виде нарастания инфекционного токсикоза, дыхательной недостаточности за счет развития пневмонии, повторная интубация, ИВЛ, субфебрильная температура, явления энтероколита. К 15–м сут. ухудшение состояния прогрессирует, с присоединением сердечной недостаточности, потребовавшей кардиотонической поддержки, ДВС–синдрома, развитие ВЖК II. В ан. крови – лейкопения, умеренный палочкоядерный сдвиг, тромбоцитопения, СРБ–16,6, РСТ–13,4. Не дожидаясь результатов посевов, произведена смена антибиотиков с назначением карбапенема (Меронем) и курса пентоглобина (3 дня). Результаты посевов получены через 3 дня: гемокультура – Enterobacter cloacae; трахея – Enterobacter cloacae, Klebsiela pneumoniae, моча – Enterobacter cloacae, Саndida albicans. Поставлен диагноз: поздний неонатальный грамотрицательный сепсис (бактериемия, пневмония, инфекция МВП). Состояние ребенка удалось стабилизировать, на 22 сутки девочка экстубирована, дышит самостоятельно, на 24 сут. переведена в детское отделение, в возрасте 2 месяца 10 дней ребенок выписан домой.
Комментарии. Описан клинический случай успешного лечения позднего грамотрицательного сепсиса у недоношенного ребенка. У врачей имелась информация об уровне РСТ дважды: нулевой уровень – при поступлении и «вираж» до 13,4 нг/мл в момент ухудшения состояния, что, бесспорно, свидетельствовало о манифестации сепсиса. Уверенность в эффективности эмпирической терапии карбапенемами позволила назначить Меронем, не дожидаясь микробиологического подтверждения диагноза. Положительная динамика и выздоровление.
Заключение
Таким образом, предварительные результаты первого этапа исследования у новорожденных из–за немногочисленности групп наблюдения еще не дают основания для конкретных выводов и рекомендаций. Однако полученные в ходе исследования данные, во–первых, еще раз подтвердили роль прокальцитонина как диагностически значимого маркера системной инфекции у новорожденных в условиях ОИТ. Показано, что повышение уровня РСТ происходит в основном в случаях системного бактериального воспаления, а при грибковых и вирусных инфекциях РСТ если и повышается, то незначительно.
Как показал опыт, измерение уровня прокальцитонина должно производиться, когда речь идет об определении роли инфекции в тяжести состояния ребенка для решения вопроса о показаниях к эскалации антибиотикотерапии.
Во–вторых, проведенное исследование продемонстрировало значительные преимущества карбапенемов перед любыми другими антибиотиками у новорожденных, находящихся в критическом состоянии, на ИВЛ в условиях ОРИТ, то есть подтвердило жизнеспасающий эффект терапии карбапенемами, в том числе у такого тяжелого контингента больных. В то же время сомнительно рассчитывать на эффективность самых современных антибиотиков, если причины тяжести состояния не связаны с бактериальной инфекцией, что и было показано в работе.
Таким образом, оптимизация антибиотикотерапии у новорожденных реальна и состоит в своевременном назначении карбапенемов по прямым показаниям, что становится возможным в связи с внедрением в практику современных биомаркеров сепсиса.
На другие вопросы, поставленные неонатологами, в частности – можно ли по динамике РСТ оценить эффективность назначенного антибиотика? – ответы будут получены и отражены в наших следующих публикациях.



Литература
1. Ugarte H., Silva E., Mercan D., De Mendonca A., Vincent JF. Procalcitonin used as a marker of infection in the medical intensive care unit. Crit Care Med 2000; 28: 977–83
2. HB Reith, U Mittelkotter, R. Wagner, A. Thiede. Procalcitonin (PCT) in patients with abdominal sepsis. Intensive Care Med (2000); 26: 165–69
3. Mimoz O., Benoist JF., Edouard AR., Assicot M., Bohuon C., Samii K. Procalcitonin and C–reactive protein during the early posttraumatic systemic inflamatory responce syndrome., Intensive Care Med 1998; 24: 185–8.
4. Meisner M., Tschaikowsky K., Palmaers T., and Schmidt J. Comparison of procalcitonin and C–reactive protein plasma concentrations at different SOFA scores during the course of sepsis and MODS Crit Care 1999 3: 45–50 This article is available from: http://ccforum.com
5. Brunkhorst FM., Wegscheider K., Forycky ZE., Brunkhorst R. Procalcitonin for early diagnosis and differentiation of SIRS, sepsis, severe sepsis, and septic shock. Intensive Care Med (2000); 26: 148–52
6. Christ–Crain M, Jaccard–Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, Muller B. Effect of procalcitonin–guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster–randomised, single–blinded intervention trial. Lancet. 2004 Feb 21;363(9409):600–
7. Белобородова Н.В., Попов Д.А. Диагностическая ценность некоторых маркеров инфекции в раннем послеоперационном периоде у кардиохирургических больных «Анестезиология и реаниматология», 2005, № 3,, стр.45–49
8. Белобородова Н.В., Попов Д.А. Поиск идеального биомаркера бактериальных инфекций. «Клиническая анестезиология и реаниматология», № 3, 2006, стр. 30–39












