–•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ–Є—Й–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –ґ–Є–Ј–љ–Є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —Б–љ–∞–±–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є —Н–љ–µ—А–≥–Є–µ–є, –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –±–µ–ї–Ї–Њ–≤, –ґ–Є—А–Њ–≤, —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Є, –Ї–∞–Ї –і–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. –Ю–і–љ–∞–Ї–Њ –і–ї—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –≤—Л—Б–Њ–Ї–∞—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П —Б—А–µ–і–Є –Ї–∞–Ї –і–µ—В–µ–є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤, —В–∞–Ї –Є –Ј—А–µ–ї—Л—Е –Є –њ–Њ–ґ–Є–ї—Л—Е –≥—А–∞–ґ–і–∞–љ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ —Б –њ–Є—Й–µ–є –Ї–∞–ї—М—Ж–Є—П (–°–∞), –≤–Є—В–∞–Љ–Є–љ–∞ D, –Љ–∞–≥–љ–Є—П, —З—В–Њ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г —А–Њ—Б—В—Г –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –Є —А–∞–Ј–≤–Є—В–Є—О —А—П–і–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є [1, 2]. –Ф–µ—Д–Є—Ж–Є—В —Н—В–Є—Е –≤–µ—Й–µ—Б—В–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Ї–ї—О—З–µ–≤–Њ–є —Д–∞–Ї—В–Њ—А –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (–Ю–Я) —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Њ—З–µ–љ—М –Љ–љ–Њ–≥–Є—Е –њ—А–Њ–±–ї–µ–Љ –≤ –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ [3вАУ7]. –І–∞—Б—В—М —Н—В–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Б–њ–Њ—Б–Њ–±–µ–љ –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞—В—М –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б.
–Т –њ—А–µ–і–њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –°–∞ –≤ –Ї–Њ—Б—В—П—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 140вАУ165 –Љ–≥ –Є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –і–Њ 400вАУ500 –Љ–≥ –≤ –њ—Г–±–µ—А—В–∞—В–љ—Л–є –њ–µ—А–Є–Њ–і, –њ—А–Є —Н—В–Њ–Љ —Д—А–∞–Ї—Ж–Є–Њ–љ–љ–∞—П –Ї–Є—И–µ—З–љ–∞—П –∞–±—Б–Њ—А–±—Ж–Є—П –°–∞ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–∞ –Є –і–Њ—Б—В–Є–≥–∞–µ—В 40%, –љ–Њ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 30вАУ10%. –Я–Є–Ї –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є —Г –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –Ї 20 –≥–Њ–і–∞–Љ, —Е–Њ—В—П –Є –і–∞–ї—М—И–µ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 3-–≥–Њ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –ґ–Є–Ј–љ–Є –Є–і–µ—В –љ–µ–±–Њ–ї—М—И–Њ–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є [8, 9]. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –њ–Є—Й–µ–≤–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –°–∞ —П–≤–ї—П–µ—В—Б—П –≥–ї–∞–≤–љ–Њ–є –і–µ—В–µ—А–Љ–Є–љ–∞–љ—В–Њ–є –µ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Ї–Њ—А–Њ—Б—В–Є –Њ—В–ї–Њ–ґ–µ–љ–Є—П –≤ –Ї–Њ—Б—В—П—Е [10, 11]. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б—З–Є—В–∞–µ—В, —З—В–Њ —Б—А–µ–і–љ–µ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –°–∞ 1200вАУ1500 –Љ–≥/—Б—Г—В –≤ –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –≤–µ–і–µ—В –Ї –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ—Г –њ–Є–Ї—Г –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л [12вАУ14]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г –њ–Њ–ґ–Є–ї—Л—Е –ґ–µ–љ—Й–Є–љ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАУ 71 –≥–Њ–і) –µ–ґ–µ–і–љ–µ–≤–љ–Њ–µ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –њ–Є—Й–µ 1 –≥ –°–∞ (–≤ –≤–Є–і–µ —Б–Њ–ї–µ–є —Ж–Є—В—А–∞—В–∞ –Є–ї–Є –Ї–∞—А–±–Њ–љ–∞—В–∞) –Ї–∞–Ї –≤ –њ–µ—А–≤—Л–µ 8 —З, —В–∞–Ї –Є –њ–Њ—Б–ї–µ 3 –Љ–µ—Б. –њ—А–Є–µ–Љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ —Б –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –°–∞, –љ–Њ —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —Б–Ї–Њ—А–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, —З—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—А–Њ–≤–∞—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ю–Я [15, 16]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–ї–µ–є –°–∞ –≤ –њ–µ—А–≤—Л–µ –≥–Њ–і—Л –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –≤ 2 —А–∞–Ј–∞ –Ј–∞–Љ–µ–і–ї—П–µ—В —Б–Ї–Њ—А–Њ—Б—В—М –њ–Њ—В–µ—А–Є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –Ї–∞–Ї –≤–Њ –≤—Б–µ–Љ —Б–Ї–µ–ї–µ—В–µ, —В–∞–Ї –Є –≤ —И–µ–є–Ї–µ –±–µ–і—А–∞ –Є —В—А–Њ—Е–∞–љ—В–µ—А–µ —Б —В—А–Њ–µ–Ї—А–∞—В–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [17вАУ19].
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –°–∞ —Б –њ–Є—Й–µ–є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –≤ –°–®–Р –Њ–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–Њ—Б—М —Б 840 –Љ–≥ –≤ 1977 –≥. –і–Њ 634 –Љ–≥ –≤ 1992 –≥. –Ю—Б–Њ–±–µ–љ–љ–Њ —В—А–µ–≤–Њ–ґ–љ–∞ —Б–Є—В—Г–∞—Ж–Є—П —Б—А–µ–і–Є –і–µ–≤—Г—И–µ–Ї 15вАУ18 –ї–µ—В, —Г –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –°–∞ –≤ –њ–Є—Й–µ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 602 –Љ–≥/—Б—Г—В, –Є —В–Њ–ї—М–Ї–Њ 2% –ї–Є—Ж –Є–Ј —Н—В–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –°–∞ [12].
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –°–∞ –≤ —Г–Љ–µ—А–µ–љ–љ–Њ–є –і–Њ–Ј–µ (500 –Љ–≥) —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–њ–Њ–ї–љ—П–µ—В –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –°–∞ —Б –њ–Є—Й–µ–є, —Б–Њ–Ј–і–∞–≤–∞—П –µ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ 1200 –Є/–Є–ї–Є 1000 –Љ–≥/—Б—Г—В, –њ—А–Є—З–µ–Љ –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ –°–∞ –∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –Є–Ј —Ж–Є—В—А–∞—В–љ–Њ–є —Б–Њ–ї–Є (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ї–∞—А–±–Њ–љ–∞—В–љ–Њ–є) [20, 21]. –≠—В–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –Љ–∞—Б—Б—Г –Ї–Њ—Б—В–Є –њ—А–Є –Њ—В—А–µ–≥—Г–ї–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –±–µ–ї–Ї–∞, —Г–Љ–µ—А–µ–љ–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ—А–Є–µ–Љ–µ –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ —Г –ґ–µ–љ—Й–Є–љ. –Т –ґ–µ–љ—Б–Ї–Њ–є –Ї–Њ–≥–Њ—А—В–µ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —Б–Њ–ї—П—Е –°–∞ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –ї–∞–Ї—В–∞—Ж–Є–Є. –Я–ї–Њ–і –∞–Ї–Ї—Г–Љ—Г–ї–Є—А—Г–µ—В –њ—А–Є–Љ–µ—А–љ–Њ 30 –≥ –°–∞ –Є–Ј –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–≥–Њ —Б–Ї–µ–ї–µ—В–∞, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –°–∞ –Њ—В–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –≤ —Б–Ї–µ–ї–µ—В –њ–ї–Њ–і–∞ –≤ III —В—А–Є–Љ–µ—Б—В—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Т–Њ –≤—А–µ–Љ—П –ї–∞–Ї—В–∞—Ж–Є–Є 160вАУ300 –Љ–≥ –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–≥–Њ –°–∞ –µ–ґ–µ–і–љ–µ–≤–љ–Њ —В–µ—А—П–µ—В—Б—П —Б –Љ–Њ–ї–Њ–Ї–Њ–Љ. –Ф–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ –њ–Њ–Ї–∞–Ј–∞–ї–Є –±—Л—Б—В—А—Г—О –њ–Њ—В–µ—А—О –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є –≤–Њ –≤—А–µ–Љ—П –ї–∞–Ї—В–∞—Ж–Є–Є —Б –∞–Ї—В–Є–≤–љ—Л–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ –Љ–∞—Б—Б—Л –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Ї–Њ—А–Љ–ї–µ–љ–Є—П –≥—А—Г–і—М—О –Є –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є—П –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –ґ–µ–љ—Й–Є–љ–∞–Љ –≤ —Н—В–Є –њ–µ—А–Є–Њ–і—Л –ґ–Є–Ј–љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —Г–≤–µ–ї–Є—З–Є—В—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –°–∞ –і–Њ 1200вАУ1500 –Љ–≥/—Б—Г—В [12]. –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Љ–µ–ґ–і—Г –Љ–∞—Б—Б–Њ–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є —Г—А–Њ–≤–љ–µ–Љ –°–∞ –≤ –њ–Є—Й–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –ґ–µ–љ—Й–Є–љ –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –£–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є 17ќ≤вАУ—Н—Б—В—А–∞–і–Є–Њ–ї–∞ —Б—З–Є—В–∞–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–є –њ–Њ—В–µ—А–Є –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є, –љ–∞—З–Є–љ–∞—О—Й–µ–є—Б—П —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–є –Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–є—Б—П 6вАУ8 –ї–µ—В [22вАУ24]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П —Д–Є—В–Њ—Н—Б—В—А–Њ–≥–µ–љ–∞–Љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–∞–≤–Є–ї—М–љ–Њ–є –Љ–Њ–і—Г–ї—П—Ж–Є–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —В–Њ–ї—М–Ї–Њ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–љ–∞–ї–Њ–≥–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D [25]. –І–µ—А–µ–Ј 6 –Є –±–Њ–ї–µ–µ –ї–µ—В –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–Њ–ї–µ–є –°–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –њ–Њ—В–µ—А—О –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є –≤ –±–µ–і—А–µ –Є –Ј–∞–њ—П—Б—В—М–µ, —Г–Љ–µ–љ—М—И–∞–µ—В –Ї–Њ—Б—В–љ—Л–µ –њ–Њ—В–µ—А–Є –≤ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ [26, 27]. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б—З–Є—В–∞–µ—В –∞–і–µ–Ї–≤–∞—В–љ—Л–Љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ 1500 –Љ–≥ –°–∞, –∞ –њ—А–Є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Н—Б—В—А–Њ–≥–µ–љ-–≥–µ—Б—В–∞–≥–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є вАУ 1000 –Љ–≥/—Б—Г—В.
–Т–Ј—А–Њ—Б–ї—Л–µ –Љ—Г–ґ—З–Є–љ—Л —В–∞–Ї–ґ–µ –њ–Њ–і–≤–µ—А–ґ–µ–љ—Л –њ–µ—А–µ–ї–Њ–Љ–∞–Љ –±–µ–і—А–∞ –Є –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, —Е–Њ—В—П –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Љ–µ–љ—М—И–µ, —З–µ–Љ –ґ–µ–љ—Й–Є–љ—Л [28]. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ —Г –Љ—Г–ґ—З–Є–љ –Є–Љ–µ–µ—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Г—О –Ї–Њ—А—А–µ–ї—П—Ж–Є—О —Б –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –°–∞, –њ—А–Є—З–µ–Љ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —Б—З–Є—В–∞—О—В –і–Њ–Ј—Л 1000 –Љ–≥/—Б—Г—В [29, 30].
–Ю—Б–љ–Њ–≤–љ–Њ–є –Є—Б—В–Њ—З–љ–Є–Ї –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –°–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ вАУ —Н—В–Њ –Љ–Њ–ї–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л. –Ш–љ—Б—В–Є—В—Г—В–Њ–Љ –њ–Є—В–∞–љ–Є—П –†–Р–Ь–Э –≤ —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –љ–Њ—А–Љ—Л –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Љ–Њ–ї–Њ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –љ–∞ 1 —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ –≥–Њ–і, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ—Б—В–∞–≤–ї—П—О—В: —Ж–µ–ї—М–љ–Њ–µ –Љ–Њ–ї–Њ–Ї–Њ вАУ 116 –Ї–≥; –Љ–∞—Б–ї–Њ —Б–ї–Є–≤–Њ—З–љ–Њ–µ вАУ 6,1 –Ї–≥; —Б–Љ–µ—В–∞–љ–∞ вАУ 6,5 –Ї–≥; —В–≤–Њ—А–Њ–≥ вАУ 8,8 –Ї–≥; —Б—Л—А вАУ 6,1 –Ї–≥; –Љ–Њ—А–Њ–ґ–µ–љ–Њ–µ вАУ 8 –Ї–≥; –Љ–Њ–ї–Њ—З–љ—Л–µ –Ї–Њ–љ—Б–µ—А–≤—Л вАУ 3 –Ї–≥; –Њ–±–µ–Ј–ґ–Є—А–µ–љ–љ–Њ–µ –Љ–Њ–ї–Њ–Ї–Њ вАУ 12,3 –Ї–≥. –°—Г–Љ–Љ–∞—А–љ–∞—П –љ–Њ—А–Љ–∞ –Љ–Њ–ї–Њ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ (–≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ –Љ–Њ–ї–Њ–Ї–Њ) —Б–Њ—Б—В–∞–≤–ї—П–µ—В 340 –Ї–≥/–≥–Њ–і.
–Т —А–µ–∞–ї—М–љ–Њ–є –ґ–Є–Ј–љ–Є —Н—В–Є –љ–Њ—А–Љ—Л —Б–Њ–±–ї—О–і–∞—О—В—Б—П –≤—Б–µ —А–µ–ґ–µ –Є —А–µ–ґ–µ. –Р–љ–∞–ї–Є–Ј –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–є –њ–Њ—В—А–µ–±–Є—В–µ–ї–µ–є –≥–Њ–≤–Њ—А–Є—В –Њ —В–Њ–Љ, —З—В–Њ –ї—О–і–Є —Б—А–µ–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —З–∞—Й–µ –њ–Њ–Ї—Г–њ–∞—О—В —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –Ї–Є—Б–ї–Њ–Љ–Њ–ї–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л (–Ї–µ—Д–Є—А, —В–≤–Њ—А–Њ–≥ –Є –і—А.). –Ґ–∞–Ї, 27% —А–µ—Б–њ–Њ–љ–і–µ–љ—В–Њ–≤ —Н—В–Њ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –љ–µ —А–µ–ґ–µ 2-—Е —А./–љ–µ–і. –њ—М—О—В –Ї–µ—Д–Є—А. –°—А–µ–і–Є –Љ–Њ–ї–Њ–і–µ–ґ–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 20 –ї–µ—В —В–Њ–ї—М–Ї–Њ 17% —Г–њ–Њ—В—А–µ–±–ї—П—О—В —Н—В–Њ—В –њ—А–Њ–і—Г–Ї—В 2вАУ4 —А./–љ–µ–і. [31].
–Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –љ–∞–Љ–Є –∞–љ–Ї–µ—В–Є—А–Њ–≤–∞–љ–Є–µ 972 —Б—В—Г–і–µ–љ—В–Њ–≤ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАУ 19,8¬±1,4 –≥–Њ–і–∞) –Р–≥—А–∞—А–љ–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –≤ –≥. –Ъ—А–∞—Б–љ–Њ–і–∞—А–µ (–†–§) –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ 15% —А–µ—Б–њ–Њ–љ–і–µ–љ—В–Њ–≤ –≤–Њ–Њ–±—Й–µ –љ–µ —Г–њ–Њ—В—А–µ–±–ї—П—О—В –Љ–Њ–ї–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л, –∞ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–Њ–ї–Њ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–µ –љ–Њ—А–Љ–∞–Љ –Ш–љ—Б—В–Є—В—Г—В–∞ –њ–Є—В–∞–љ–Є—П, —Г–њ–Њ—В—А–µ–±–ї—П—О—В —В–Њ–ї—М–Ї–Њ 9,1% –Є–Ј –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Б—В—Г–і–µ–љ—В–Њ–≤. –Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –≤—Л—И–µ –і–∞–љ–љ—Л–µ –Њ–њ—А–µ–і–µ–ї—П—О—В –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Є–ї–Є –њ–Є—Й–µ–≤—Л—Е –і–Њ–±–∞–≤–Њ–Ї) –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –°–∞ –≤ –њ–Є—Й–µ. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–µ–љ —Д–∞–Ї—В, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–±—Б–Њ—А–±—Ж–Є–Є –°–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –µ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П, —Н—В–Њ—В –Ј–∞—Й–Є—В–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ —Б–љ–Є–ґ–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–є –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є [32вАУ34].
–°–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –≤ –ґ–Є–≤–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ–њ–Є—Б–∞–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –°–∞ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Ј–∞–≤–Є—Б—П—В –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D (–Є –µ–≥–Њ —Д–Њ—А–Љ—Л), –∞ —В–∞–Ї–ґ–µ –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і—А—Г–≥–Є—Е –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –Њ—Б—В–µ–Њ—В—А–Њ–њ–љ—Л–Љ (–Љ–∞–≥–љ–Є–є, —Ж–Є–љ–Ї, –Љ–µ–і—М, –Љ–∞—А–≥–∞–љ–µ—Ж, –±–Њ—А) —Г–і–µ–ї—П–µ—В—Б—П –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ.
–°–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤–Є—В–∞–Љ–Є–љ–∞ D –Є–Љ–µ–µ—В –љ–µ–Њ—Б–њ–Њ—А–Є–Љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –°–∞. –Ю–љ –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ –і–ї—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Љ—Л—И–µ—З–љ–Њ-—Б–Ї–µ–ї–µ—В–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —В. –Ї. —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –∞–±—Б–Њ—А–±—Ж–Є—О –њ–Є—Й–µ–≤–Њ–≥–Њ –°–∞ –≤ —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –Њ–њ–Њ—Б—А–µ–і—Г–µ—В –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є—О –Њ—Б—В–µ–Њ–Є–і–∞ –Є –Є–≥—А–∞–µ—В –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є —Д—Г–љ–Ї—Ж–Є–Є –Љ—Л—И—Ж [35, 36]. –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Њ–ї—М –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –µ—Й–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–Ј—Г—З–µ–љ–∞, –∞ –і–µ—Д–Є—Ж–Є—В –µ–≥–Њ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е —А–∞–љ–µ–µ –Ї–∞–Ї –≤–Є—В–∞–Љ–Є–љ-D-–Ј–∞–≤–Є—Б–Є–Љ—Л–µ [37]. –Ґ–∞–Ї–Є–µ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Ї–∞–Ї —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В (–°–Ф) 2-–≥–Њ —В–Є–њ–∞, —А–∞–Ї –Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ, –њ—А–Є —Н—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ D —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —А–µ–≥—Г–ї—П—В–Њ—А–Њ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ґ-–ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –µ–≥–Њ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –ї–µ—З–µ–љ–Є–Є —Н—В–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є [38вАУ40].
–°—Г—Й–µ—Б—В–≤—Г—О—Й–Є–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В (–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М) –≤–Є—В–∞–Љ–Є–љ–∞ D —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –њ–∞–љ–і–µ–Љ–Є—П, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–∞—П —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є [41вАУ44] –Є –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [45, 46].
–Э–∞—И–Є –љ–∞–±–ї—О–і–µ–љ–Є—П —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —Г –љ–∞—Б–µ–ї–µ–љ–Є—П —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ –Ъ—А–∞—Б–љ–Њ–і–∞—А—Б–Ї–Њ–≥–Њ –Ї—А–∞—П. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П 25(OH)D —Г –ґ–µ–љ—Й–Є–љ –њ—А–µ- –Є –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Ї–Њ–ї–µ–±–∞–ї–∞—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е 9,0вАУ47,0 –Љ–Ї–≥/–ї, –њ—А–Є—З–µ–Љ –µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –≤—Л—И–µ 30 –Љ–Ї–≥/–ї –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —В–Њ–ї—М–Ї–Њ –≤ 18,42% —Б–ї—Г—З–∞–µ–≤. –£ 44,74% –ґ–µ–љ—Й–Є–љ —Г—А–Њ–≤–µ–љ—М –≤–Є—В–∞–Љ–Є–љ–∞ D –±—Л–ї –≤—Л—И–µ 20 –Љ–Ї–≥/–ї (–≤ —Б—А–µ–і–љ–µ–Љ 23,95 –Љ–Ї–≥/–ї), –∞ —Г 36,84% (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАУ 61,64¬±2,7 –≥–Њ–і–∞) –Њ—В–Љ–µ—З–µ–љ–∞ –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–∞—П (15,5 –Љ–Ї–≥/–ї) –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D [47].
–Т –і–≤–Њ–є–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 7-–ї–µ—В–љ–µ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ 36 282 –ґ–µ–љ—Й–Є–љ–∞–Љ–Є –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ 1000 –Љ–≥ –°–∞ –Ї–∞—А–±–Њ–љ–∞—В–∞ –Є 400 –Ь–Х –≤–Є—В–∞–Љ–Є–љ–∞ D3 –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –њ–µ—А–µ–ї–Њ–Љ—Л –±–µ–і—А–∞ –Є –≤—В–Њ—А–Є—З–љ–Њ –≤—Б–µ –њ–µ—А–µ–ї–Њ–Љ—Л, –∞ —В–∞–Ї–ґ–µ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ї–∞ [48].
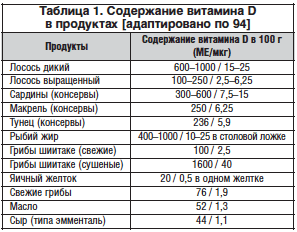
–Т–Є—В–∞–Љ–Є–љ D вАУ –ґ–Є—А–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–є –≤–Є—В–∞–Љ–Є–љ, —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–є –≤ 6 —Д–Њ—А–Љ–∞—Е; –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П –≤–Є—В–∞–Љ–Є–љ D2 (—Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї), –Ї–Њ—В–Њ—А—Л–є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ —Б–≤–µ—В–∞, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ —А–∞—Б—В–µ–љ–Є—П—Е, –Є –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—Г—В–µ–Љ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –≤ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ –Є–Ј –њ–Є—Й–µ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ (—В–∞–±–ї. 1), –Є –≤–Є—В–∞–Љ–Є–љ D3 (–Ї–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї), –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –≤ –Ї–Њ–ґ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П [42].
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –±–Њ–ї—М—И–Њ–є –∞—А—Б–µ–љ–∞–ї —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ –Є –∞–љ–∞–ї–Њ–≥–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D. –Я–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е —Б—А–µ–і—Б—В–≤, —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –Њ—Б–Њ–±—Л–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –љ–Є—Е. –Ґ–∞–Ї, —Б—З–Є—В–∞—О—В, —З—В–Њ –Ї–∞–ї—М—Ж–Є—Д–µ–і–Є–Њ–ї —Б–Њ–Ј–і–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –±—Л—Б—В—А—Л–є —Н—Д—Д–µ–Ї—В –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –љ–∞—А–∞—Б—В–∞—О—Й–Є—Е –і–Њ–Ј–∞—Е, –Њ–і–љ–∞–Ї–Њ –≤—Л—Б–Њ–Ї —А–Є—Б–Ї –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, —З—В–Њ —В—А–µ–±—Г–µ—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ —Г—А–Њ–≤–љ–µ–Љ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞. –Ъ–∞–ї—М—Ж–Є—В—А–Є–Њ–ї вАУ –∞–Ї—В–Є–≤–љ–∞—П —Д–Њ—А–Љ–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –°–∞ –Є —Б–љ–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞, –љ–Њ –Є–Љ–µ–µ—В –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є –і–∞–ґ–µ –≤ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е. –Р–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї, –њ–Њ–і–≤–µ—А–≥–∞—О—Й–Є–є—Б—П –і–µ–є—Б—В–≤–Є—О 25-–≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ–є —Д–Њ—А–Љ—Л, –њ–Њ–Ї–∞–Ј–∞–љ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Я —Г –ї—О–і–µ–є –±–µ–Ј –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї –Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –±–Њ–ї–µ–Ј–љ—П–Љ–Є –њ–Њ—З–µ–Ї –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–Є–Ј–Љ–∞ –Є –њ–Њ—З–µ—З–љ–Њ–є –Њ—Б—В–µ–Њ–і–Є—Б—В—А–Њ—Д–Є–Є. –Ф–Њ–Ї—Б–Є–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї, –Ї–Њ—В–Њ—А—Л–є —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Л–є –≥–Њ—А–Љ–Њ–љ –Є–Ј –≤–Є—В–∞–Љ–Є–љ–∞ D2 —Б –њ–Њ–Љ–Њ—Й—М—О 25-–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л, –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –ї–µ—З–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–Є–Ј–Љ–∞, –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Њ–±–ї–∞–і–∞–µ—В –Љ–µ–љ—М—И–Є–Љ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, —З–µ–Љ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї. –Я–∞—А–Є–Ї–∞–ї—М—Ж–Є—В–Њ–ї, –∞–љ–∞–ї–Њ–≥ –≤–Є—В–∞–Љ–Є–љ–∞ D2, –љ–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –Є –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О. –Ю–±—Б—Г–ґ–і–∞–µ—В—Б—П —В–∞–Ї–ґ–µ –љ–µ—Д—А–Њ- –Є –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ –∞–љ–∞–ї–Њ–≥–∞, –Њ–і–љ–∞–Ї–Њ —В—А–µ–±—Г–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Р–љ–∞–ї–Њ–≥ –≤–Є—В–∞–Љ–Є–љ–∞ D3 вАУ 22-–Њ–Ї—Б–Є–Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, –Њ–±–ї–∞–і–∞—О—Й–Є–є –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (–≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ—Б—В—Г–њ–µ–љ —В–Њ–ї—М–Ї–Њ –≤ –ѓ–њ–Њ–љ–Є–Є), –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞. –°—З–Є—В–∞—О—В, —З—В–Њ –њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–љ–∞–ї–Њ–≥–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –≤ –ї–µ—З–µ–љ–Є–Є —В–∞–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —А–∞–Ї –њ—А–Њ—Б—В–∞—В—Л) [49вАУ53].
–Ш–љ—В–µ—А–µ—Б–љ—Л –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ї–Њ—Б—В–љ–∞—П –Є —Б–Њ—Б—Г–і–Є—Б—В–∞—П —В–Ї–∞–љ–Є –Є–Љ–µ—О—В —А—П–і –Њ–±—Й–Є—Е –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е —Б–≤–Њ–є—Б—В–≤, –∞ –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—В —Б–Њ—Б—Г–і–Њ–≤ —Б–Њ—Б—В–Њ–Є—В –Є–Ј —В–µ—Е –ґ–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, —З—В–Њ –Є –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ —Б—Е–Њ–і—Б—В–≤–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Ю–Я –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –љ—Г–ґ–і–∞—О—В—Б—П –≤ –Є–Ј—Г—З–µ–љ–Є–Є –Є –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ—О—В—Б—П –љ–∞–±–ї—О–і–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–≤—Л—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –±–Њ–ї—М—И–Є—Е –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —Б–Њ–±—Л—В–Є–є, –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –Є–љ—Б—Г–ї—М—В–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ —Б–Њ–ї–µ–є –°–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ [54, 55]. –Я–Њ—Б–ї–µ–і–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –°–∞ –Љ–Њ–ґ–µ—В —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ –њ–Њ–≤—Л—И–∞—В—М —Г—А–Њ–≤–µ–љ—М –њ–µ–њ—В–Є–і–∞, –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–Њ–Љ (CGRP вАУ calcitonin gene-related peptide). –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –°–∞ –Є CGRP –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –±–µ–Ј –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Љ–Њ–Ј–≥–Њ–≤—Л–Љ –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–µ–њ—В–Є–і–Њ–Љ, –љ–Њ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П вАУ –Љ–µ–ґ–і—Г –њ–Њ—Б–ї–µ–і–љ–Є–Љ –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –°–∞. –Ь–µ–ґ–і—Г —В–µ–Љ –Ї–Њ—А–Њ—В–Ї–Є–µ (5 –і–љ–µ–є) –Ї—Г—А—Б—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –°–∞ –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ –≤–ї–Є—П–ї–Є –љ–∞ —Г—А–Њ–≤–µ–љ—М CGRP [56].
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ 1,000 –Љ–≥ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –°–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D3 400 –Ь–Х/—Б—Г—В —Г –ґ–µ–љ—Й–Є–љ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (–љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —А–∞—Б—Л) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О 25OHD3 –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—П–µ—В –ї–Є–њ–Є–і–љ—Л–є —Б–њ–µ–Ї—В—А, —Б–љ–Є–ґ–∞—П —Г—А–Њ–≤–µ–љ—М –ї–Є–њ–Є–і–Њ–≤ –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Є –њ–Њ–≤—Л—И–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є [57, 58]. –Ю—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–Њ–≤—Л—Е –∞–љ–∞–ї–Њ–≥–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ –≥–ї–∞–і–Ї—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є [59]. –Ф–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –±–µ–ї–Ї–∞ –Р–њ–Њ-1 [60], —З—В–Њ —В–∞–Ї–ґ–µ, –≤–µ—А–Њ—П—В–љ–Њ, –≤–ї–Є—П–µ—В –љ–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Б–Њ—Б—Г–і–Њ–≤. –Т —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є RECORD —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Б–≤—П–Ј—М –љ–Є–Ј–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П 25–Ю–ЭD3 —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —Б–Њ–±—Л—В–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–љ—Б—Г–ї—М—В [61]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ (11 –ї–µ—В) –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –°–∞ –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ –Њ—В–Љ–µ—З–∞—О—В —Б–љ–Є–ґ–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ –Є —А–∞–Ј–≤–Є—В–Є—П –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Њ–±—Й–µ–є –Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, —Е–Њ—В—П —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≤–µ—А—В–µ–±—А–∞–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Є —А–∞–Ї–∞ in situ –ї–µ–≥–Ї–Њ–≥–Њ [62вАУ64].
–Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –Є –Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–∞—Б—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–µ–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е (–љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е) —Н—Д—Д–µ–Ї—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –≥–µ–љ–Њ–Љ–љ—Л—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Љ–Љ—Г–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ —Б–Є—Б—В–µ–Љ—Л –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D [65]. –С—Л–ї–∞ —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —А–Њ–ї—М –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј, –°–Ф 1-–≥–Њ –Є 2-–≥–Њ —В–Є–њ–∞, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є —В–Є—А–µ–Њ–Є–і–Є—В, –±–Њ–ї–µ–Ј–љ—М –Р–і–і–Є—Б–Њ–љ–∞, –њ–Њ–ї–Є–Ї–Є—Б—В–Њ–Ј —П–Є—З–љ–Є–Ї–Њ–≤) [66вАУ69]. –Ю–і–љ–∞–Ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–µ –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–µ–≤—Л—И–µ–љ–Є—П —Б—А–µ–і–љ–µ–њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≤–Є—В–∞–Љ–Є–љ–∞ D –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —Н—В–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є. –Я–Њ–Ї–∞–Ј–∞–љ–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —А–∞–Ј–≤–Є—В–Є–µ–Љ –°–Ф 2-–≥–Њ —В–Є–њ–∞, –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Є –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –ґ–µ–љ—Й–Є–љ –≤ –Р–Љ–µ—А–Є–Ї–µ –Є –Ю–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –Р—А–∞–±—Б–Ї–Є—Е –≠–Љ–Є—А–∞—В–∞—Е [70вАУ72]. –Ч–љ–∞—З–Є–Љ—Л —А–∞–±–Њ—В—Л, –≤ –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ D —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л–Љ –°–Ф –±—Л–ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –≤ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є –њ–ї–∞–Ј–Љ—Л, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –Њ—Б–Њ–±–µ–љ–љ–Њ —Д—А–∞–Ї—Ж–Є–Є –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є, –Њ–і–љ–∞–Ї–Њ –љ–∞ —Г—А–Њ–≤–µ–љ—М –і—А—Г–≥–Є—Е —Д—А–∞–Ї—Ж–Є–є –ї–Є–њ–Є–і–Њ–≤ —Н—В–Њ –љ–µ –≤–ї–Є—П–ї–Њ. –Ґ–∞–Ї–ґ–µ –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤—Л—Б–Њ–Ї–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞, –њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Њ–±—Й–µ–≥–Њ –≥–ї—О—В–∞–Љ–∞—В–∞ [73].
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –њ—А–Є–≤–ї–µ–Ї–∞—О—В –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–µ–ї–Ї–∞ –Є –≤—Л—Б–Њ–Ї–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Љ–∞–Ї—А–Њ- –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–∞—Е –љ–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –њ–Є–Ї–Њ–≤–Њ–є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –ґ–Є–Ј–љ–Є [74вАУ76]. –°—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –і–µ—Д–Є—Ж–Є—В, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ —Б –њ–Є—Й–µ–є –Є–ї–Є –њ–Њ–љ–Є–ґ–µ–љ–љ—Л–Љ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ–Љ —Н—В–Є—Е –≤–µ—Й–µ—Б—В–≤ (–Љ–µ–і—М, –Љ–∞—А–≥–∞–љ–µ—Ж, —Ж–Є–љ–Ї, –±–Њ—А), –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –њ—А–Є—З–Є–љ–Њ–є —Г—Е—Г–і—И–µ–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Б—В—А–Њ–µ–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є [77]. –Ь–µ–і—М, –Љ–∞—А–≥–∞–љ–µ—Ж –Є —Ж–Є–љ–Ї –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —Б–Є–љ—В–µ–Ј–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –Є –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Ї–∞–Ї —Б–Њ—Б—В–∞–≤–љ–Њ–є —З–∞—Б—В–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ [78]. –¶–Є–љ–Ї –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –±–Њ–ї–µ–µ 300 —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –±–µ–ї–Ї–Њ–≤, –ґ–Є—А–Њ–≤, –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л—Е –Ї–Є—Б–ї–Њ—В. –Э–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –µ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є, –њ–Њ—А–Њ–Ї–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –њ–ї–Њ–і–∞. –Т –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б —Ж–Є—Б—В–µ–Є–љ–Њ–Љ —Ж–Є–љ–Ї —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —А–µ—Ж–µ–њ—В–Њ—А–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –≤–Є—В–∞–Љ–Є–љ–∞ D, —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞. –¶–Є–љ–Ї–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –і—А—Г–≥–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (–Є–љ—Б—Г–ї–Є–љ, –Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–Є–љ, —Б–Њ–Љ–∞—В–Њ—В—А–Њ–њ–Є–љ, –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ) [76]. –Т –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Б–Њ–і–µ—А–ґ–Є—В—Б—П –Њ–Ї–Њ–ї–Њ 30% –≤—Б–µ–≥–Њ —Ж–Є–љ–Ї–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –Є –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є —Б –њ–Є—Й–µ–є –Є–ї–Є –љ–∞—А—Г—И–µ–љ–Є–Є —Г—Б–≤–Њ–µ–љ–Є—П —Н—В–Њ—В –њ—Г–ї –Њ—З–µ–љ—М –±—Л—Б—В—А–Њ —А–∞—Б—Е–Њ–і—Г–µ—В—Б—П [79вАУ81]. –Я–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —Ж–Є–љ–Ї–µ —Г —Б—А–µ–і–љ–µ—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 7,5 –і–Њ 17,0 –Љ–≥/—Б—Г—В –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞. –Ш—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є —Ж–Є–љ–Ї–∞ —П–≤–ї—П—О—В—Б—П –≥–Њ–≤—П–і–Є–љ–∞, –њ–µ—З–µ–љ—М, –Љ–Њ—А–µ–њ—А–Њ–і—Г–Ї—В—Л (—Г—Б—В—А–Є—Ж—Л, —Б–µ–ї—М–і—М, –Љ–Њ–ї–ї—О—Б–Ї–Є), –њ—А–Њ—А–Њ—Б—И–Є–µ –Ј–µ—А–љ–∞ –Ј–ї–∞–Ї–Њ–≤, –Љ–Њ—А–Ї–Њ–≤—М, –≥–Њ—А–Њ—Е, –Њ—В—А—Г–±–Є, –Њ–≤—Б—П–љ–∞—П –Љ—Г–Ї–∞, –Њ—А–µ—Е–Є [82].
–Ф—А—Г–≥–Њ–є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В вАУ –Љ–µ–і—М –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —П–≤–ї—П—П—Б—М –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–Љ –і–ї—П –ї–Є–Ј–Є–ї–Њ–Ї—Б–Є–і–∞–Ј—Л, —Г—З–∞—Б—В–≤—Г—О—Й–µ–є –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞, –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Ї–µ–ї–µ—В–∞, —Б–Є–љ—В–µ–Ј–µ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –њ–Є–≥–Љ–µ–љ—В–Њ–≤ –Ї–Њ–ґ–Є, –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –ґ–µ–ї–µ–Ј–∞, —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —Г—Б–≤–Њ–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤ –Є —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –Ї–Є—Б–ї–Њ—А–Њ–і–љ–Њ–Љ –љ–∞—Б—Л—Й–µ–љ–Є–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Э–µ–і–Њ—Б—В–∞—В–Њ–Ї –Љ–µ–і–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –і–Є—Б–њ–ї–∞–Ј–Є–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –Є —А–∞–Ј–≤–Є—В–Є–Є –Ю–Я [83]. –Ш—Б—В–Њ—З–љ–Є–Ї–Є –Љ–µ–і–Є: —И–Њ–Ї–Њ–ї–∞–і, –Ї–∞–Ї–∞–Њ, –њ–µ—З–µ–љ—М, –Њ—А–µ—Е–Є, —Б–µ–Љ–µ—З–Ї–Є, –≥—А–Є–±—Л, –Љ–Њ–ї–ї—О—Б–Ї–Є, –ї–Њ—Б–Њ—Б—М, —И–њ–Є–љ–∞—В. –°—Г—В–Њ—З–љ–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Љ–µ–і–Є –≤–Њ–Ј—А–∞—Б—В-–Ј–∞–≤–Є—Б–Є–Љ–∞—П –Є –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 0,9 –і–Њ 3,0 –Љ–≥ [82].
–Х—Й–µ –Њ–і–Є–љ –љ–µ –Љ–µ–љ–µ–µ –≤–∞–ґ–љ—Л–є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В вАУ –Љ–∞—А–≥–∞–љ–µ—Ж –≤–ї–Є—П–µ—В –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞, —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Є –ї–Є–њ–Є–і–љ—Л–є –Њ–±–Љ–µ–љ, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ—З–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —Б–≤—П–Ј–Њ–Ї. –Ш—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –Љ–∞—А–≥–∞–љ—Ж–∞ (–Њ—В 1 –і–Њ 10 –Љ–≥/—Б—Г—В) —П–≤–ї—П—О—В—Б—П –Ј–µ–ї–µ–љ—Л–µ –ї–Є—Б—В–Њ–≤—Л–µ –Њ–≤–Њ—Й–Є, –њ—А–Њ–і—Г–Ї—В—Л –Є–Ј –љ–µ–Њ—З–Є—Й–µ–љ–љ–Њ–≥–Њ –Ј–µ—А–љ–∞, –Њ—А–µ—Е–Є, —З–∞–є [82]. –Ъ–ї—О—З–µ–≤—Л–Љ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–Љ, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ –њ—А–Њ—Ж–µ—Б—Б—Л –Њ—Б—В–µ–Њ–≥–µ–љ–µ–Ј–∞ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D, —А–µ–≥—Г–ї—П—Ж–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞, –Њ–±–Љ–µ–љ –°–∞, —Д–Њ—Б—Д–Њ—А–∞ –Є –Љ–∞–≥–љ–Є—П, —П–≤–ї—П–µ—В—Б—П –±–Њ—А. –°—Г—В–Њ—З–љ–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –±–Њ—А–µ –љ–µ–≤–µ–ї–Є–Ї–∞ вАУ 2вАУ3 –Љ–≥, –њ—А–Є—З–µ–Љ –Њ–љ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ –і–Њ—Б—В—Г–њ–љ—Л—Е –Ї–Њ—А–љ–µ–≤—Л—Е –Њ–≤–Њ—Й–∞—Е, –≤–Є–љ–Њ–≥—А–∞–і–µ, –≥—А—Г—И–∞—Е, —П–±–ї–Њ–Ї–∞—Е, –Њ—А–µ—Е–∞—Е [84].
–°–≤–µ–і–µ–љ–Є—П –Њ–± –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—В–∞—В—Г—Б–∞ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Ї–Њ—Б—В–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–Њ—Б—В–µ–Њ–њ–µ–љ–Є—П, –Ю–Я) —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л. –Ґ–µ–Љ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ–∞ –Р–і–≤–∞–љ—Б –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –≤–Ї–ї—О—З–∞–µ—В: —Б—Г–Љ–Љ–∞—А–љ—Л–є —Н–ї–µ–Љ–µ–љ—В–∞—А–љ—Л–є –°–∞ (–≤ —Д–Њ—А–Љ–µ —Ж–Є—В—А–∞—В–∞ –Є –Ї–∞—А–±–Њ–љ–∞—В–∞) 500 –Љ–≥, –≤–Є—В–∞–Љ–Є–љ D (–Ї–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї) 200 –Ь–Х, –Љ–∞–≥–љ–Є–є (–≤ —Д–Њ—А–Љ–µ –Њ–Ї—Б–Є–і–∞) 40 –Љ–≥, —Ж–Є–љ–Ї (–≤ —Д–Њ—А–Љ–µ –Њ–Ї—Б–Є–і–∞) 7,5 –Љ–≥, –Љ–µ–і—М (–≤ —Д–Њ—А–Љ–µ –Њ–Ї—Б–Є–і–∞) 1 –Љ–≥, –Љ–∞—А–≥–∞–љ–µ—Ж (–≤ —Д–Њ—А–Љ–µ —Б—Г–ї—М—Д–∞—В–∞) 1,8 –Љ–≥ –Є –±–Њ—А (–≤ —Д–Њ—А–Љ–µ –љ–∞—В—А–Є—П –±–Њ—А–∞—В–∞) 250 –Љ–Ї–≥. –Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ P.D. Saltman 2вАУ–ї–µ—В–љ–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–Є (–Ь–Я–Ъ) –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Г –ґ–µ–љ—Й–Є–љ, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –°–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Ж–Є–љ–Ї–Њ–Љ, –Љ–µ–і—М—О –Є –Љ–∞—А–≥–∞–љ—Ж–µ–Љ, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –ґ–µ–љ—Й–Є–љ, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ –°–∞, –Є–ї–Є —В–Њ–ї—М–Ї–Њ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В—Л, –Є–ї–Є —В–Њ–ї—М–Ї–Њ –њ–ї–∞—Ж–µ–±–Њ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ь–Я–Ъ, –њ—А–Є —Н—В–Њ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ [85].
–Т —А–∞–Љ–Ї–∞—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ¬Ђ–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б¬ї –≤ –Э–Ш–Ш —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –Є–Љ. –Т.–Р. –Э–∞—Б–Њ–љ–Њ–≤–Њ–є (–Ь–Њ—Б–Ї–≤–∞) –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ—В–Ї—А—Л—В–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –њ—А–Є –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є —Г 50 –ґ–µ–љ—Й–Є–љ 45вАУ65 –ї–µ—В –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є 50 –ґ–µ–љ—Й–Є–љ–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Ї–Њ—А—А–Є–≥–Є—А–Њ–≤–∞–ї–Є –і–µ—Д–Є—Ж–Є—В –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤ –њ–Є—В–∞–љ–Є–µ–Љ. –І–µ—А–µ–Ј 1 –≥–Њ–і —В–µ—А–∞–њ–Є–Є –≤ –≥—А—Г–њ–њ–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б —Б–Њ—Е—А–∞–љ—П–ї –Ь–Я–Ъ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Г–Љ–µ–љ—М—И–Є–ї—Б—П –≤–Њ –≤—Б–µ—Е –Ј–Њ–љ–∞—Е, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ. –Я—А–µ–њ–∞—А–∞—В –љ–µ –≤—Л–Ј—Л–≤–∞–ї –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—П —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –°–∞ —Б –Љ–Њ—З–Њ–є, —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–ї—Б—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є. –Я–Њ—Н—В–Њ–Љ—Г –µ–≥–Њ –Љ–Њ–ґ–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Ю–Я –Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ [86, 87].
–Т –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Р.–Ь. –Ы–Є–ї–∞ –Є –Т.–Ш. –Ь–∞–Ј—Г—А–Њ–≤ [88] —Б–і–µ–ї–∞–ї–Є –≤—Л–≤–Њ–і –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ю–Я –≤ –њ–µ—А–Є–Њ–і –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј—Л —Г –≤—Б–µ—Е –ґ–µ–љ—Й–Є–љ, –Є–Љ–µ—О—Й–Є—Е 2 –Є –±–Њ–ї–µ–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ю–Я. –Т—Е–Њ–і—П—Й–Є–µ –≤ —Б–Њ—Б—В–∞–≤ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б —Б–Њ–ї–Є –°–∞ –Є –і—А—Г–≥–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –і–∞—О—В –µ–Љ—Г —А—П–і –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤: —Ж–Є—В—А–∞—В –Є –Ї–∞—А–±–Њ–љ–∞—В –°–∞ —Г–Љ–µ–љ—М—И–∞—О—В –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—В —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –¶–Є—В—А–∞—В –°–∞ —В–Њ—А–Љ–Њ–Ј–Є—В —Б–µ–Ї—А–µ—Ж–Є—О –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞, –њ–Њ–≤—Л—И–∞–µ—В –∞–љ—В–Є—А–µ–Ј–Њ—А–±—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Є —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞. –Ф–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤ 3-–ї–µ—В–љ–µ–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–Њ–≤ –ї–µ—З–µ–±–љ–Њ-–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ —Г –ґ–µ–љ—Й–Є–љ —Б –Њ—Б—В–µ–Њ–њ–µ–љ–Є–µ–є, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 3 —Ж–µ–љ—В—А–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ю–Я –Є–Ј –Ш—А–Ї—Г—В—Б–Ї–∞, –Ь–Њ—Б–Ї–≤—Л –Є –ѓ—А–Њ—Б–ї–∞–≤–ї—П (–†–§). –Я–∞—Ж–Є–µ–љ—В–Ї–Є –±—Л–ї–Є —Б–ї—Г—З–∞–є–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л. –Ц–µ–љ—Й–Є–љ—Л –Є–Ј 1-–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б (–њ–Њ 1 —В–∞–±–ї–µ—В–Ї–µ 2 —А./—Б—Г—В), –∞ –Є–Ј 2-–є (–Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є) –≥—А—Г–њ–њ—Л –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –Є–Љ –Ї–Њ—А—А–Є–≥–Є—А–Њ–≤–∞–ї–Њ—Б—М –њ–Є—В–∞–љ–Є–µ. –І–µ—А–µ–Ј 12 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –Њ—Б—В–∞–≤–∞–ї–Є—Б—М —Б—В–∞–±–Є–ї—М–љ—Л–Љ–Є –Ь–Я–Ъ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –Є —Г–ї—Г—З—И–µ–љ–Є–µ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ. –Р–љ–∞–ї–Є–Ј –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ) –њ–Њ–Ї–∞–Ј–∞–ї –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Е–Њ—А–Њ—И—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б, –њ—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ –Э–ѓ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ —В–∞–Ї–Њ–≤—Г—О –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –і—А—Г–≥–Є—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [89]. –Т—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Ю–Я [90, 91].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ-–≤–Є—В–∞–Љ–Є–љ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –і–Њ–Ї–∞–Ј–∞–ї —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В–љ—Л—Е –њ–Њ –≤–Є—В–∞–Љ–Є–љ—Г D –Є –Љ–Є–љ–µ—А–∞–ї–∞–Љ —Б–Њ—Б—В–Њ—П–љ–Є–є.
–Т 2008 –≥. –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —Г—В–≤–µ—А–ґ–і–µ–љ—Л ¬Ђ–Э–Њ—А–Љ—Л —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤ —Н–љ–µ—А–≥–Є–Є –Є –њ–Є—Й–µ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤–∞—Е –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ –љ–∞—Б–µ–ї–µ–љ–Є—П¬ї [92], –≤ –Ї–Њ—В–Њ—А—Л—Е —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А—Г—О—В—Б—П —Б—А–µ–і–љ–µ–њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л–µ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –Є –≤–µ—А—Е–љ–Є–µ –њ—А–µ–і–µ–ї—Л –Њ—В–і–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –њ–Њ—Б—В—Г–њ–∞—О—Й–Є—Е —Б –њ–Є—Й–µ–є. –Я—А–Є–≤–Њ–і–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–µ –≤ —Н—В–Њ–Љ –і–Њ–Ї—Г–Љ–µ–љ—В–µ –і–Њ–Ј—Л –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤. –£—В–Њ—З–љ–µ–љ–љ–∞—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≤–Є—В–∞–Љ–Є–љ–µ D –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 10 –Љ–Ї–≥/—Б—Г—В, –і–ї—П –ї–Є—Ж —Б—В–∞—А—И–µ 60 –ї–µ—В вАУ 15 –Љ–Ї–≥/—Б—Г—В. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –і–ї—П –і–µ—В–µ–є вАУ 10 –Љ–Ї–≥/—Б—Г—В. –Т–µ—А—Е–љ–Є–є –і–Њ–њ—Г—Б—В–Є–Љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D вАУ 50 –Љ–Ї–≥/—Б—Г—В. –£—В–Њ—З–љ–µ–љ–љ–∞—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Ї–∞–ї—М—Ж–Є–Є –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е вАУ 1000 –Љ–≥/—Б—Г—В, –ї–Є—Ж —Б—В–∞—А—И–µ 60 –ї–µ—В вАУ 1200 –Љ–≥/—Б—Г—В, –і–ї—П –і–µ—В–µ–є вАУ –Њ—В 400 –і–Њ 1200 –Љ–≥/—Б—Г—В. –Т–µ—А—Е–љ–Є–є –і–Њ–њ—Г—Б—В–Є–Љ—Л–є —Г—А–Њ–≤–µ–љ—М вАУ 2500 –Љ–≥/—Б—Г—В. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Љ–∞–≥–љ–Є–Є –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 400 –Љ–≥/—Б—Г—В, –і–ї—П –і–µ—В–µ–є вАУ –Њ—В 55 –і–Њ 400 –Љ–≥/—Б—Г—В. –Т–µ—А—Е–љ–Є–є –і–Њ–њ—Г—Б—В–Є–Љ—Л–є —Г—А–Њ–≤–µ–љ—М –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Љ–µ–і–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,9вАУ2,3 –Љ–≥/—Б—Г—В. –Т–µ—А—Е–љ–Є–є –і–Њ–њ—Г—Б—В–Є–Љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П вАУ 5 –Љ–≥/—Б—Г—В. –Т–њ–µ—А–≤—Л–µ –≤–≤–µ–і–µ–љ—Л –љ–Њ—А–Љ—Л —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е (1,0 –Љ–≥/—Б—Г—В) –Є –і–ї—П –і–µ—В–µ–є (–Њ—В 0,5 –і–Њ 1,0 –Љ–≥/—Б—Г—В). –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Љ–∞—А–≥–∞–љ—Ж–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —В–∞–Ї–ґ–µ –≤–њ–µ—А–≤—Л–µ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е 2 –Љ–≥/—Б—Г—В –њ—А–Є –≤–µ—А—Е–љ–µ–Љ –і–Њ–њ—Г—Б—В–Є–Љ–Њ–Љ —Г—А–Њ–≤–љ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П 5 –Љ–≥/—Б—Г—В. –Я–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —Ж–Є–љ–Ї–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –≤ –і–Њ–Ј–µ 12 –Љ–≥/—Б—Г—В.
–Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є—В—Г–∞—Ж–Є–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–є —Б–Ї—А–Є–љ–Є–љ–≥ –і–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П [93]:
–Я—А–Є—З–Є–љ—Л –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ D:
вАУ —Б–љ–Є–ґ–µ–љ–Є–µ —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ (–≤ —В. —З. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Њ–ї–љ—Ж–µ–Ј–∞—Й–Є—В–љ—Л—Е —Б—А–µ–і—Б—В–≤, –≤–Њ–Ј—А–∞—Б—В, —Б–µ–Ј–Њ–љ, –њ–Є–≥–Љ–µ–љ—В—Л –љ–∞ –Ї–Њ–ґ–µ);
вАУ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ D (–≤ —В. —З. –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, —Б–Є–љ–і—А–Њ–Љ–µ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є);
вАУ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є–ї–Є –µ–≥–Њ –њ–Њ—В–µ—А—П (–≤ —В. —З. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤, —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є–ї–Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ);
вАУ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Є–ї–Є –ї–∞–Ї—В–∞—Ж–Є—П;
вАУ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ 25-(OH)D (–≤ —В. —З. –њ—А–Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є);
вАУ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ 1,25-(OH)2D (–≤ —В. —З. –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є).
–Я–Њ–≤–Њ–і –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ D:
вАУ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–µ–є (–Ю–Я, –Њ—Б—В–µ–Њ–Љ–∞–ї—П—Ж–Є—П, –љ–µ—В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–є –њ–µ—А–µ–ї–Њ–Љ, –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–Є–Ј–Љ);
вАУ –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В (—Б –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ);
вАУ —В–µ–Љ–љ–∞—П –Ї–Њ–ґ–∞ (–∞—Д—А–Є–Ї–∞–љ—Ж—Л, –∞–Ј–Є–∞—В—Л, –Є—Б–њ–∞–љ—Ж—Л);
вАУ –Њ–ґ–Є—А–µ–љ–Є–µ (–≤–Ј—А–Њ—Б–ї—Л–µ —Б –Є–љ–і–µ–Ї—Б–Њ–Љ –Љ–∞—Б—Б—Л —В–µ–ї–∞ >30 –Ї–≥/–Љ2, –і–µ—В–Є —Б –і—А—Г–≥–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –Є–ї–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є);
вАУ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Є–ї–Є –ї–∞–Ї—В–∞—Ж–Є—П —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ (–≤ —В. —З. —В–µ–Љ–љ–Њ–Ї–Њ–ґ–Є–µ –Є–ї–Є —Б –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –≤–µ—Б–Њ–Љ, –Є–ї–Є –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л–Љ –°–Ф, –Љ–∞–ї–Њ –±—Л–≤–∞—О—Й–Є–µ –љ–∞ —Б–Њ–ї–љ—Ж–µ –Є –љ–µ –њ–Њ–ї—Г—З–∞—О—Й–Є–µ –і–Њ–±–∞–≤–Ї–Є –≤–Є—В–∞–Љ–Є–љ–∞ D);
вАУ —Б–њ–Њ—А—В—Б–Љ–µ–љ—Л (–Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Б–µ –≤–Є–і—Л —Б–њ–Њ—А—В–∞ –≤ –Ј–∞–Ї—А—Л—В—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є—П—Е);
вАУ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї;
вАУ –њ–µ—З–µ–љ–Њ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М;
вАУ —Б–Є–љ–і—А–Њ–Љ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є (–≤ —В. —З. –±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞, —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ—Б–ї–µ –±–∞—А–Є–∞—В—А–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –Є–ї–Є —А–∞–і–Є–∞—Ж–Є–Њ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Є—И–µ—З–љ–Є–Ї–∞);
вАУ –ї–µ–Ї–∞—А—Б—В–≤–∞ (–њ—А–Њ—В–Є–≤–Њ—Б—Г–і–Њ—А–Њ–ґ–љ—Л–µ, –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–µ, –∞–љ—В–Є—А–µ—В—А–Њ–≤–Є—А—Г—Б–љ–∞—П —В–µ—А–∞–њ–Є—П, –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–∞—П —В–µ—А–∞–њ–Є—П, —Е–Њ–ї–µ—Б—В–Є—А–∞–Љ–Є–љ);
вАУ –≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є (—Б–∞—А–Ї–Њ–Є–і–Њ–Ј, —В—Г–±–µ—А–Ї—Г–ї–µ–Ј, –≥–Є—Б—В–Њ–њ–ї–∞–Ј–Љ–Њ–Ј, –±–µ—А–Є–ї–ї–Є–Њ–Ј).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Ј–≤–µ—Б—В–љ—Л –њ—А–Њ–±–ї–µ–Љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –њ—Г–ї–∞ –°–∞, –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞, –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —Б–Њ—Б—В–Њ—П–љ–Є—П, —В—А–µ–±—Г—О—Й–Є–µ —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є –њ—А–µ–њ–∞—А–∞—В (–Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б), –і–Њ–Ї–∞–Ј–∞–≤—И–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –і–µ—Д–Є—Ж–Є—В–∞ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤. –Ч–∞–і–∞—З–∞ –≤—А–∞—З–∞ вАУ –љ–µ –њ—А–Њ–њ—Г—Б—В–Є—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ—Г–ґ–і–∞—О—Й–Є—Е—Б—П –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Г—А–Њ–≤–љ–µ–є –°–∞, –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –Њ—Б—В–µ–Њ—В—А–Њ–њ–љ—Л—Е –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤, –Є –љ–∞–Ј–љ–∞—З–Є—В—М –Є–Љ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Beto J.A. The role of calcium in human aging // Clin Nutr Res. 2015. Vol. 4 (1). P. 1вАУ 8.
2. –Х–ї–Є—Б–µ–µ–≤–∞ –Ы.–Э., –Ф—Г–±—А–Њ–≤–Є–љ–∞ –Ш.–Э., –Я–Њ–ї—П–Ї–Њ–≤ –Я.–Я. –Ф–µ—Д–Є—Ж–Є—В –Љ–∞–≥–љ–Є—П —Г —Б—В—Г–і–µ–љ—В–Њ–≤: –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ—Г—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є: –Ь–∞—В-–ї—Л X —Б—К–µ–Ј–і–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ –Є –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Њ–≤ –Ѓ–§–Ю. –Ъ—А–∞—Б–љ–Њ–і–∞—А, 2011. –°. 79вАУ81.
3. –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –С–∞—А–Ї–Њ–≤–∞ –Ґ.–Т., –Ь–Є—Е–∞–є–ї–Њ–≤ –Х.–Х. —Б —Б–Њ–∞–≤—В. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Б—А–µ–і–Є –љ–∞—Б–µ–ї–µ–љ–Є—П –≥. –Ь–Њ—Б–Ї–≤—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 50 –ї–µ—В –Є —Б—В–∞—А—И–µ: –Ґ–µ–Ј. –і–Њ–Ї–ї. III –†–Њ—Б. —Б–Є–Љ–њ–Њ–Ј. –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г. –°–Я–±., 2000. –°. 73вАУ76.
4. –Х–ї–Є—Б–µ–µ–≤–∞ –Ы.–Э., –Я–Њ–ї—П–Ї–Њ–≤ –Я.–Я., –Ф—Г–±—А–Њ–≤–Є–љ–∞ –Ш.–Э., –С–ї–µ–і–љ–Њ–≤–∞ –Р.–Ѓ., –°–Є—А—Г–љ—П–љ—Ж –Р.–Р. –Ъ–Њ—А—А–µ–Ї—Ж–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Ј–і–Њ—А–Њ–≤—М—П —Б—В—Г–і–µ–љ—В–Њ–≤ –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–є –њ—Г—В—М –њ–Њ–≤—Л—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ // –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–є –ґ—Г—А–љ–∞–ї —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П. 2011. вДЦ 4. –°. 79вАУ84.
5. Peterlik M., Boonen S., Cross H.S., Lamberg-Allardt C. Vitamin D and calcium insufficiency-related chronic diseases: an emerging world-wide public health problem // Int J Environ Res Public Health. 2009. Vol. 6. P. 2585вАУ2607.
6. Rice B.H., Quann E.E., Miller G.D. Meeting and exceeding dairy recommendations: effects of dairy consumption on nutrient intakes and risk of chronic disease // Nutr Rev. 2013. Vol. 71. P. 209вАУ223.
7. Avenell A., Mak J.C., O'Connell D. Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men // Cochrane Database Syst Rev. 2014. Vol. 4.
8. –†–Њ–ґ–Є–љ—Б–Ї–∞—П –Ы.–ѓ. –°–Њ–ї–Є –Ї–∞–ї—М—Ж–Є—П –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ // –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –Њ—Б—В–µ–Њ–њ–∞—В–Є–Є. 1998. вДЦ 1.
9. Bonjour J.P., Kohrt W., Levasseur R., Warren M., Whiting S., Kraenzlin M. Biochemical markers for assessment of calcium economy and bone metabolism: application in clinical trials from pharmaceutical agents to nutritional products // Nutr Res Rev. 2014. Vol. 27 (2). P. 252вАУ267.
10. Matkovic V., Heaney R.P. Calcium Balance During Human Growth: Evidence for Threshold Behavior // Am. J. Clin. Nutr. 1992. Vol. 55. –†. 992вАУ996.
11. Blumberg J., Heaney R.P., Huncharek M. et al. Evidence-based criteria in the nutritional context // Nutr Rev. 2010. Vol. 68. P. 478вАУ484.
12. Optimal Calcium Intake // NIH Consens Statement Online. 1994. Vol. 12 (4). –†. 1вАУ31.
13. Jonston –°.–°.Jr. et al. Calcium Supplementation and Increases in Bone Mineral Density in Children // New Engl. J. Med. 1992. Vol. 327. вДЦ 2. –†. 82вАУ87.
14. Woodside J.V., Koletzko B.V., Patterson C.C. et al. Scientific standards for human intervention trials evaluating health benefits of foods, and their application to infants, children and adolescents // World Rev Nutr Diet. 2013. Vol. 108. P. 18вАУ31.
15. Bristow S.M., Gamble G.D., Stewart A., Horne L., House M.E., Aati O., Mihov B., Horne A.M., Reid I.R. Acute and 3-month effects of microcrystalline hydroxyapatite, calcium citrate and calcium carbonate on serum calcium and markers of bone turnover: a randomised controlled trial in postmenopausal women // Br J Nutr. 2014. Vol. 112 (10). P. 1611вАУ1620.
16. Syed F.A., Melim T. Rodent models of aging bone: an update // Curr Osteoporos Rep. 2011. Vol. 9. P. 219вАУ228.
17. Reid I.R. –µt al. Calcium Supplementation Reduce Bone Loss in Postmenopausal Women: 2-year Placebo-controlled Study // New Engl. J. Med. 1993. Vol. 328. P. 460вАУ464.
18. Reid I.R. –µt al. Long-term Effects of Calcium Supplementation on Bone Loss and Fractures in Postmenopausal Women: a Randomized Controlled Trial // JAMA. 1995. Vol. 98 (4). P. 331вАУ335.
19. Sornay-Rendu E., Munoz F., Garnero P. et al. Identification of osteopenic women at high risk of fracture: the OFELY study // J Bone Miner Res. 2005. Vol. 20. P. 1813вАУ1819.
12. Optimal Calcium Intake // NIH Consens Statement Online. 1994. Vol. 12 (4). –†. 1вАУ31.
20. Pecker R.R. –µt al. Bone Gain in Young Adult Women // JAMA. 1992. Vol. 268. –†. 2403вАУ2408.
21. Van der Velde R.Y., Brouwers J.R., Geusens P.P., Lems W.F., van den Bergh J.P. Calcium and vitamin D supplementation: state of the art for daily practice // Food Nutr Res. 2014. Aug 7. P. 58.
22. Heaney R.P. Age consideration in nutrient needs for bone health: older adults // J. Am. Coil. Nutr. 1996. Vol. 15. P. 570вАУ574.
23. Kinyami H.–Ъ., Gallagher J.–°. et all. Serum vitamin D metabolites and calcium absorption in normal young and elderly, free living women and women living in nursing homes // Am. J. Clin. Nutr. 1997. Vol. 65. P. 790вАУ797.
24. Garnero P., Hausherr E., Chapuy M.C. et al. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS Prospective Study // J Bone Miner Res. 1996. Vol. 11. P. 1531вАУ1538.
25. Somjen D., Katzburg S., Kohen F., Gayer B., Posner G.H., Yoles I., Livne E. The effects of native and synthetic estrogenic compounds as well as vitamin D less-calcemic analogs on adipocytes content in rat bone marrow // J Endocrinol Invest. 2011. Vol. 34 (2). –†. 106вАУ110.
26. Dowson-Hughers B. et al. A Controlled Trial of the Effect of Calcium Supplementation on Bone Density in Postmenopausal Women // New Engl. J. Med. 1990. Vol. 323. (13) –†. 878вАУ883.
27. Prentice R.L., Pettinger M.B., Jackson R.D., Wactawski-Wende J., Lacroix A.Z., Anderson G.L., Chlebowski R.T., Manson J.E., Van Horn L., Vitolins M.Z., Datta M., LeBlanc E.S., Cauley J.A., Rossouw J.E. Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study // Osteoporos Int. 2013. Vol. 24 (2). –†. 567вАУ580.
28. Willson T., Nelson S.D., Newbold J., Nelson R.E., LaFleur J.L. The clinical epidemiology of male osteoporosis: a review of the recent literature // Clin Epidemiol. 2015. Vol. 9 (7). P. 65вАУ76.
29. Vasikaran S., Eastell R., Bruyere O. et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards // Osteoporos Int. 2011. Vol. 22. P. 391вАУ420.
30. Crandall C.J., Newberry S.J., Diamant A., Lim Y.W., Gellad W.F., Suttorp M.J., Motala A., Ewing B., Roth B., Shanman R., Timmer M., Shekelle P.G. Treatment to prevent fractures in men and women with low bone density or osteoporosis: update of a 2007 report // Comparative Effectiveness Reviews. 2012. No. 53.
31. –†–Њ—Б–С–Є–Ј–љ–µ—Б–Ъ–Њ–љ—Б–∞–ї—В–Є–љ–≥. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А—Л–љ–Ї–Њ–≤. 2011. http://marketing.rbc.ru/ research/562949982175658.shtml.
32. Bjelakovic G., Gluud L.L., Nikolova D., Whitfield K., Wetterslev J., Simonetti R.G., Bjelakovic M., Gluud C. Vitamin D supplementation for prevention of mortality in adults // Cochrane Database Syst Rev. 2014. Jan 10. Vol. 1. CD007470.
33. Reid I.R. Cardiovascular effects of calcium supplements // Nutrients. 2013. Jul 5. Vol. 5 (7). –†. 2522вАУ2529.
34. Gumming R.G., Cummings S.R. et al. Calcium Intake and Fracture Risk: Results from the Study of Osteoporotic Fractures // Am. J. Epidemiol. 1997. Vol. 145. P. 929вАУ934.
35. Boonen S., Bischoff-Ferrari H.A., Cooper C. et al. Addressing the musculoskeletal components of fracture risk with calcium and vitamin D: a review of the evidence // Calcif Tissue Int. 2006. Vol. 78. P. 257вАУ270.
36. Bischoff-Ferrari H.A. Vitamin D and fracture prevention // Endocrinol Metab Clin North Am. 2010. Vol. 39. P. 347вАУ353.
37. Reichrath J., Reichrath S., Heyne K., Vogt T., Roemer K. Tumor suppression in skin and other tissues via cross-talk between vitamin D- and p53-signaling // Front. Physiol. 2014. 5:166 10.3389/fphys.2014.00166.
38. W√ґbke T.K., Sorg B.L., Steinhilber D. Vitamin D in inflammatory diseases // Front. Physiol. 2014. 5:244 10.3389/fphys.2014.00244.
39. Narvaez C.J., Matthews D., Laporta E., Simmons K.M., Beaudin S., Welsh J. The impact of vitamin D in breast cancer: genomics, pathways, metabolism // Front. Physiol. 2014. 5:213 10.3389/fphys.2014.00213.
40. Wang W.-L. W., Tenniswood M. Vitamin D, intermediary metabolism and prostate cancer tumor progression // Front. Physiol. 2014. 5:183 10.3389/fphys.2014.00183.
41. Holick M.F., Chen T.C. Vitamin D deficiency: a worldwide problem with health consequences // Am J Clin Nutr. 2008. Vol. 87. P. 1080вАУ1086.
42. Holick M.F. Vitamin D deficiency // N Engl J Med. 2007. Vol. 357. P. 266вАУ281.
43. Grigorie D., Sucaliuc A., Ivan M. et al. High prevalence of vitamin D deficiency in 1048 Romanian postmenopausal women with osteoporosis // Acta Endocrinologica (Buc). 2008. Vol. IV. P. 33вАУ45.
44. Bischoff-Ferrari H.A., Dietrich T., Orav E.J. et al. Positive association between 25-hydroxy vitamin D levels and bone mineral density: a population-based study of younger and older adults // Am J Med. 2004. Vol. 116. P. 634вАУ639.
45. Looker A.C., Dawson-Hughes B., Calvo M.S. et al. Serum 25-hydroxyvitamin D status of adolescents and adults in two seasonal subpopulations from NHANES III // Bone. 2002. Vol. 30. P. 771вАУ777.
46. Bischoff-Ferrari H.A., Dawson-Hughes B., Willett W.C. et al. Effect of Vitamin D on falls: a meta-analysis // JAMA. 2004. Vol. 291. P. 1999вАУ2006.
47. –Х–ї–Є—Б–µ–µ–≤–∞ –Ы.–Э., –†–µ–Ј–љ–Є–Ї–Њ–≤–∞ –Ы.–С., –Ґ–Є—Е–Њ–Љ–Є—А–Њ–≤–∞ –Э.–Ѓ., –Ь–∞—Б—В–µ—А–Є—Ж–Є–љ –Э.–Ъ., –Я—А–Њ—Б–µ–ї–Ї–Њ–≤ –Ѓ.–Х. –Я–µ—А–≤–Є—З–љ—Л–є —Б–Ї—А–Є–љ–Є–љ–≥ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Ъ—А–∞—Б–љ–Њ–і–∞—А—Б–Ї–Њ–≥–Њ –Ї—А–∞—П // –Р–Ї—В—Г–∞–ї—М–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ—Л —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є: –°–±. –љ–∞—Г—З. —А–∞–±. / –њ–Њ–і —А–µ–і. –∞–Ї–∞–і. –†–Р–Ь–Э –Р.–С. –Ч–±–Њ—А–Њ–≤—Б–Ї–Њ–≥–Њ. –Т–Њ–ї–≥–Њ–≥—А–∞–і, 2013. –Т—Л–њ. 30. –°. 36вАУ37.
48. Prentice R.L., Pettinger M.B., Jackson R.D., Wactawski-Wende J., Lacroix A.Z., Anderson G.L., Chlebowski R.T., Manson J.E., van Horn L., Vitolins M.Z., Datta M., LeBlanc E.S., Cauley J.A., Rossouw J.E. Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study // Osteoporos Int. 2013. Vol. 24 (2). P. 567вАУ580.
49. Mazzaferro S., Goldsmith D., Larsson T.E., Massy Z.A., Cozzolino M. Vitamin D metabolites and/or analogs: which D for which patient? // Curr Vasc Pharmacol. 2014. Vol. 12 (2). P. 339вАУ349.
50. Nadkarni S., Chodynski M., Corcoran A., Marcinkowska E., Brown G., Kutner A. Double Point Modified Analogs of Vitamin D as Potent Activators of Vitamin D Receptor // Curr Pharm Des. 2015. Vol. 21 (13). P. 1741вАУ1763.
51. Eastell R., Arnold A., Brandi M.L. et al. Diagnosis of asymptomatic primary hyperparathyroidism: proceedings of the third international workshop // J Clin Endocrinol Metab. 2009. Vol. 94. P. 340вАУ350.
52. Leyssens C., Verlinden L., Verstuyf A. The future of vitamin D analogs // Front. Physiol. 2014. Vol. 5. P. 122.
53. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –†–Њ–ї—М –Ї–∞–ї—М—Ж–Є—П, –≤–Є—В–∞–Љ–Є–љ–∞ D –Є —В–Є–∞–Ј–Є–і–љ—Л—Е –і–Є—Г—А–µ—В–Є–Ї–Њ–≤ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ // –†–Ь–Ц. 1997. вДЦ 5. –°. 978вАУ982.
54. Mao P.J., Zhang C., Tang L., Xian Y.Q., Li Y.S., Wang W.D., Zhu X.H., Qiu H.L., He J., Zhou Y.H. Effect of calcium or vitamin D supplementation on vascular outcomes: a meta-analysis of randomized controlled trials // Int J Cardiol. 2013. Vol. 169 (2). P. 106вАУ111.
55. Rice B.H. Dairy and cardiovascular disease: a review of recent observational research // Curr Nutr Rep. 2014. Vol. 3. P. 130вАУ138.
56. Hu F., Chen L., Che H., Fang J., Lv F., Li H., Zhang S., Guo C., Yin H., Zhang S., Zuo Y. Fasting serum CGRP levels are related to calcium concentrations, but cannot be elevated by short-term calcium/vitamin D supplementation // Neuropeptides. 2015. Vol. 49. P. 37вАУ45.
57. Schnatz P.F., Jiang X., Vila-Wright S., Aragaki A.K., Nudy M., O'Sullivan D.M., Jackson R., LeBlanc E., Robinson J.G., Shikany J.M., Womack C.R., Martin L.W., Neuhouser M.L., Vitolins M.Z., Song Y., Kritchevsky S., Manson J.E. Calcium/vitamin D supplementation, serum 25-hydroxyvitamin D concentrations, and cholesterol profiles in the Women's Health Initiative calcium/vitamin D randomized trial // Menopause. 2014. Vol. 21 (8). P. 823вАУ833.
58. Weaver C.M. Calcium supplementation: is protecting against osteoporosis counter to protecting against cardiovascular disease? // Curr Osteoporos Rep. 2014. Vol. 12. P. 211вАУ218.
59. Somjen D., Kulesza U., Sharon O., Knoll E., Stern N. New vitamin D less-calcemic analog affect human bone cell line and cultured vascular smooth muscle cells similar to other less-calcemic analogs // J Steroid Biochem Mol Biol. 2014. Vol. 140. P. 1вАУ6.
60. John W.G., Noonan K., Mannan N., Boucher B.J. Hypovitaminosis D is associated with reductions in serum apolipoprotein A-I but not with fasting lipids in British Bangladeshi // American Journal of Clinical Nutrition. 2005. Vol. 82 (3). P. 517вАУ522.
61. Ford J.A., MacLennan G.S., Avenell A., Bolland M., Grey A., Witham M. RECORD Trial Group. Cardiovascular disease and vitamin D supplementation: trial analysis, systematic review, and meta-analysis // Am J Clin Nutr. 2014. Vol. 100 (3). P. 746вАУ755.
62. Cauley J.A., Chlebowski R.T., Wactawski-Wende J., Robbins J.A., Rodabough R.J., Chen Z., Johnson K.C., O'Sullivan M.J., Jackson R.D., Manson J.E. Calcium plus vitamin D supplementation and health outcomes five years after active intervention ended: the Women's Health Initiative // J Womens Health (Larchmt). 2013. Vol. 22 (11). P. 915вАУ929.
63. Bolland M.J., Grey A., Gamble G.D., Reid I.R. The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis // Lancet Diabetes Endocrinol. 2014. Vol. 2 (4). P. 307вАУ320.
64. Bolland M.J., Grey A., Reid I.R. Differences in overlapping meta-analyses of vitamin D supplements and falls // J Clin Endocrinol Metab. 2014. Vol. 99 (11). P. 4265вАУ4272.
65. Chun R.F., Liu P.T., Modlin R.L., Adams J.S., Hewison M. Impact of vitamin D on immune function: lessons learned from genome-wide analysis // Front Physiol. 2014. Vol. 21 (5). –†. 151.
66. EURODIAB Study Group Vitamin D supplement in early childhood and risk for type I (insulin-dependent) diabetes mellitus. The EURODIAB Substudy 2 Study Group // Diabetologia. 1999. Vol. 42. P. 51вАУ54.
67. Muscogiuri G., Mitri J., Mathieu C., Badenhoop K., Tamer G., Orio F., Mezza T., Vieth R., Colao A., Pittas A. Mechanisms in endocrinology: vitamin D as a potential contributor in endocrine health and disease // Eur J Endocrinol. 2014. Vol. 171 (3). –†. 101вАУ110.
68. Eddington H., Hudson J.E., Oliver R.L. et al. Variability in parathyroid hormone assays confounds clinical practice in chronic kidney disease patients // Ann Clin Biochem. 2013. Vol. 51. P. 228вАУ236.
69. Ginde A.A., Wolfe P., Camargo C.A. Jr et al. Defining vitamin D status by secondary hyperparathyroidism in the U.S. population // J Endocrinol Invest. 2012. Vol. 35. P. 42вАУ48.
70. Sadiya A., Ahmed S.M., Skaria S., Abusnana S. Vitamin D status and its relationship with metabolic markers in persons with obesity and type 2 diabetes in the UAE: a cross-sectional study // J Diabetes Res. 2014. 2014:869307.
71. Zemel M.B. Regulation of adiposity and obesity risk by dietary calcium: mechanisms and implications // Journal of the American College of Nutrition. 2002. Vol. 21 (2). P. 146вАУ151.
72. Lee H.J., Cho J.I., Lee H.S., Kim C.I., Cho E. Intakes of dairy products and calcium and obesity in Korean adults: Korean National Health and Nutrition Examination Surveys ((KNHANES) 2007-2009 // PLoS One. 2014. Vol. 9. e99085.
73. Asemi Z., Hashemi T., Karamali M., Samimi M., Esmaillzadeh A. Effects of vitamin D supplementation on glucose metabolism, lipid concentrations, inflammation, and oxidative stress in gestational diabetes: a double-blind randomized controlled clinical trial // Am J Clin Nutr. 2013. Vol. 98 (6). P. 1425вАУ1432.
74. –°–Ї–∞–ї—М–љ—Л–є –Р.–Т., –†—Г–і–∞–Ї–Њ–≤ –Ш.–Р. –С–Є–Њ—Н–ї–µ–Љ–µ–љ—В—Л –≤ –Љ–µ–і–Є—Ж–Є–љ–µ. –Ь.: –Ю–љ–Є–Ї—Б 21 –≤–µ–Ї; –Ь–Є—А, 2004. 272 —Б.
75. –Ю–±–µ—А–ї–Є—Б –Ф., –•–∞—А–ї–∞–љ–і –С., –°–Ї–∞–ї—М–љ—Л–є –Р. –С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –Љ–∞–Ї—А–Њ- –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е. –°–Я–±.: –Э–∞—Г–Ї–∞, 2008. –°. 145вАУ418.
76. –°–њ–Є—А–Є—З–µ–≤ –Т.–С. –†–Њ–ї—М –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –≤ –Њ—Б—В–µ–Њ–≥–µ–љ–µ–Ј–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Њ—Б—В–µ–Њ–њ–∞—В–Є–є —Г –і–µ—В–µ–є // –Т–Њ–њ—А–Њ—Б—Л –і–µ—В—Б–Ї–Њ–є –і–Є–µ—В–Њ–ї–Њ–≥–Є–Є. 2003. вДЦ 1. –°. 40вАУ49.
77. –Ф—Л–і—Л–Ї–Є–љ–∞ –Ш.–°., –Ф—Л–і—Л–Ї–Є–љ–∞ –Я.–°., –Р–ї–µ–Ї—Б–µ–µ–≤–∞ –Ю.–У. –Т–Ї–ї–∞–і –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ (–Љ–µ–і–Є, –Љ–∞—А–≥–∞–љ—Ж–∞, —Ж–Є–љ–Ї–∞, –±–Њ—А–∞) –≤ –Ј–і–Њ—А–Њ–≤—М–µ –Ї–Њ—Б—В–Є: –≤–Њ–њ—А–Њ—Б—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ // –≠—Д—Д–µ–Ї—В–Є–≤–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П. –≠–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—П. –°–њ–µ—Ж–≤—Л–њ—Г—Б–Ї вДЦ 2. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. 2013. вДЦ 38. –°. 60вАУ67.
78. Persicov –Р.V., Brodsky B. Unstable molecules form stable tissues // Proc. Natl. Acad. Sci. USA. 2002. Vol. 99. вДЦ 3. P. 1101вАУ1103.
79. Moser-Veillon P.B. Zinc needs and homeostasis during lactation // Analyst. 1995. Vol. 120. вДЦ 3. P. 895 вАУ 897.
80. Calhoun N.R., Smith J.C., Becker K.L. The role of zinc in bone metabolism // Clin. Orthop. Relat. Res. 1974. Vol. 103. P. 212вАУ234.
81. Hurley L.S. Teratogenic aspects of manganese, zinc, and copper nutrition // Physiol. Rev. 1981. Vol. 61. вДЦ 2. P. 249вАУ295.
82. –Э–Њ—А–Љ—Л —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤ —Н–љ–µ—А–≥–Є–Є –Є –њ–Є—Й–µ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤–∞—Е –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є. –Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Ь–† 2.3.1.2432-8. http://75.rospotrebnadzor.ru/content/ metodicheskie-rekomendatsii-mr-2312432-08-normy-fiziologicheskikh-potrebnostei-v-energii-i-p.
83. Opsahl W., Zeronian H., Ellison M. et al. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon // J. Nutr. 1982. Vol. 112. вДЦ 4. P. 708вАУ716.
84. Nielsen F.N. Other elements // Trace Elements in Human and Animal Nutrition / eds. B. Boron, W. Merts. 5th ed. New York: Academic Press, 1986. Vol. 2. P. 420вАУ427.
85. Saltman P.D., Strause L.G. The role of trace minerals in osteoporosis // J. Am. Coll. Nutr. 1993.Vol. 12. вДЦ 4. P. 384вАУ389.
86. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш., –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –≤ –њ—А–∞–Ї—В–Є–Ї–µ —Б–µ–Љ–µ–є–љ–Њ–≥–Њ –≤—А–∞—З–∞ // –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. 2004. вДЦ 12. –°. 715вАУ718.
87. –Э–Є–Ї–Є—В–Є–љ—Б–Ї–∞—П –Ю.–Р., –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ю.–Р. –§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ // –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. 2008. –Ґ. 16. вДЦ 6. –°. 409вАУ413.
88. –Ы–Є–ї–∞ –Р.–Ь., –Ь–∞–Ј—Г—А–Њ–≤ –Т.–Ш. –†–Њ–ї—М –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ–∞ –∞–і–≤–∞–љ—Б –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (—А–µ–Ј—Г–ї—М—В–∞—В—Л 12-–Љ–µ—Б—П—З–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) // –†–Ь–Ц. 2007. –Ґ. 15. вДЦ 26. –°. 1991вАУ1996.
89. –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –Э–Є–Ї–Є—В–Є–љ—Б–Ї–∞—П –Ю.–Р., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Б –њ–Њ–Љ–Њ—Й—М—О —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П // –Э–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П. 2005. вДЦ 1. –°. 36вАУ39.
90. –Э–∞—Г–Љ–Њ–≤ –Р.–Т., –®–∞–Љ—Г–Є–ї–Њ–≤–∞ –Ь.–Ь., –Ч–∞–Є—З–µ–љ–Ї–Њ –Ф.–Ь. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –∞–њ–Њ–Ї–∞–ї–Є–њ—Б–Є—Б —Б–µ–≥–Њ–і–љ—П, –Є–ї–Є —В—А—Г–і–Њ–≤—Л–µ –±—Г–і–љ–Є –≤—А–∞—З–∞ // –Т–µ—Б—В–љ–Є–Ї —Б–µ–Љ–µ–є–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л. 2012. вДЦ 3. –°. 44вАУ53.
91. –Ы—Г–љ–µ–≤–∞ –°.–Э., –°—В–Њ–≥–Њ–≤ –Ь.–Т. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ—Л—В–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—А—В–Њ–њ–µ–і–Њ-—В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П: –°–±. –Ї–ї–Є–љ. –Є—Б—Б–ї. –њ–Њ –њ—А–µ–њ–∞—А–∞—В–∞–Љ –Ї–∞–ї—М—Ж–µ–Љ–Є–љ –Є –Ї–∞–ї—М—Ж–µ–Љ–Є–љ –∞–і–≤–∞–љ—Б. –Ь., 2010. –°. 33вАУ37.
92. –Э–Њ—А–Љ—Л —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤ —Н–љ–µ—А–≥–Є–Є –Є –њ–Є—Й–µ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤–∞—Е –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є / –Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –Ь–† 2.3.1.2432-08. 2008.
93. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline // J Clin Endocrinol Metab. 2011. Vol. 96. P. 1911вАУ1930.
94. Bischoff-Ferrari H.A., Keller U., Burckhardt P. et al. Recommandations de la Commission federale de lвАЩalimentation concernant lвАЩapport de vitamine D // Forum Med Suisse. 2012. Vol. 12. P. 775вАУ778.












