Онкологические заболевания сегодня являются второй причиной смертности после сердечно-сосудистых заболеваний̆. В 2012 г. в России было выявлено более 480 тыс. первичных онкобольных, умерло от злокачественных новообразований̆ 288 тыс. больных (14,9% в общей̆ структуре смертности). В структуре общей онкологической заболеваемости рак почки составляет 3,7% и занимает второе место среди онкологических заболеваний органов мочеполовой системы, уступая раку предстательной железы (5,5%); на третьем месте – рак мочевого пузыря (2,7%). В структуре онкозаболеваемости у мужчин опухоли почки составляют 4,5%, у женщин – 3,1%.
Онкологические заболевания сегодня являются второй причиной смертности после сердечно-сосудистых заболеваний̆. В 2012 г. в России было выявлено более 480 тыс. первичных онкобольных, умерло от злокачественных новообразований̆ 288 тыс. больных (14,9% в общей̆ структуре смертности). В структуре общей онкологической заболеваемости рак почки составляет 3,7% и занимает второе место среди онкологических заболеваний органов мочеполовой системы, уступая раку предстательной железы (5,5%); на третьем месте – рак мочевого пузыря (2,7%). В структуре онкозаболеваемости у мужчин опухоли почки составляют 4,5%, у женщин – 3,1%.
В России в 2012 г. число больных с впервые установленным диагнозом рака почки составило 19 675 человек (мужчин – 10 841, женщин – 8 834). В 1999 г. этот показатель был несколько ниже – 12 899 человек. Средний возраст больных, страдающих раком почки, – 61,7 (60,5 у мужчин и 63,2 у женщин) года. «Грубый» показатель среднегодового темпа роста опухоли почки в 2012 г. равнялся 3,27%. Динамика смертности от рака почки также неуклонно растет: если в 1999 г. этот показатель составлял 4,37%, то в 2012 г. он оказался выше – 5,80% (среднегодовой темп прироста – 0,89%) [1].
В настоящее время согласно рекомендациям Европейской ассоциации урологов 2014 г. [2] пациентам с начальной стадией рака почки (Т1) рекомендуется проведение органосохраняющей операции («золотой стандарт» – открытая или лапароскопическая резекция почки). Последние достижения медицины – минимально инвазивные методы лечения опухолей почки, такие как криоаблация, радиочастотная аблация (РЧА), микроволновая и лазерная аблация, а также аблация сфокусированным ультразвуком стали достойной альтернативой хирургическому лечению. Наиболее часто используются криоаблация и РЧА. Преимущества данных методик очевидны: меньшая кровопотеря и травматичность, чем при резекции почки, снижение морбидности, сокращение периода госпитализации, в ряде случаев – возможность проведения оперативного лечения амбулаторно. По сравнению с другими аблативными технологиями криоаблация отличается низким процентом повторных сеансов аблации и хорошими промежуточными онкологическими результатами.
В настоящее время криоаблация почки может быть проведена открытым, лапароскопическим или перкутанным доступами.
Метод открытой криоаблации опухоли почки безопасен в отношении повреждения соседних органов, позволяет точно расположить криозонды в опухоли и отслеживать процесс криоаблации, однако высокая морбидность является недостатком этого метода.
Перкутанная криоаблация почки чаще выполняется под контролем УЗИ при локализации опухоли по задней поверхности почки. Преимущества данного метода: возможность выполнения в амбулаторных условиях, более низкая стоимость по сравнению с лапароскопическим доступом и значительно меньшая морбидность [3]. Недостатками перкутанной криоаблации являются недостаточно хорошая визуализация процесса криоаблации, сложность оценки интенсивности кровотечения и невозможность мобилизации почки во время операции, поэтому размещение криозондов во многом зависит от позиционирования пациента [4].
Лапароскопический доступ при проведении криоаблации почки обладает рядом преимуществ: минимально инвазивный доступ, точность расположения криозондов, мониторинг процесса криоаблации в реальном времени, лучшая визуализация почки, опухоли и соседних органов, низкий риск местного рецидивирования.
Трансперитонеальный доступ позволяет проводить криоаблацию опухоли почки, располагающуюся по передней и переднемедиальной поверхности почки. Ретроперитонеальный доступ применяется при расположении опухоли по задней и заднелатеральной поверхностям [5].
По данным K. Sahadevan et al., лапароскопическая криоаблация предпочтительна у пожилых пациентов с небольшими опухолями почек. У всех пациентов было проведено 2 цикла замораживания/оттаивания, с достижением температуры внутри опухоли -70°С и -40°С по периферии. Состояние оперированной почки определялось при помощи компьютерной томографии (КТ) через 3, 6, 12, 18 и 24 мес., далее – ежегодно, а также путем периодического определения уровня креатинина сыворотки крови. Средний возраст пациентов составил 68 лет (39–81 год), средний размер опухоли равнялся 29 мм (19–45 мм). В послеоперационном периоде 2 пациентам потребовалось переливание крови, у 1 пациента развилась пневмония, еще у 1 пациента – некроз кожи в зоне введения криозондов. Продолжительность госпитализации составила 4 (2–14) дня. У 21 из 24 пациентов не было отмечено прогрессии заболевания (медиана наблюдения – 4–42 мес.) [6].
В исследовании Т. Klatte et al. было проведено сравнение лапароскопической криоаблации почки и открытой резекции почки (р<0,001). Пациенты, которым выполнялась криоаблация почки, были намного старше, средний размер опухоли у них был меньше, а медиана наблюдения – короче, чем у пациентов, перенесших резекцию почки. После криоаблации почки и ее резекции развитие местной прогрессии опухоли составило 8,5 и 1,9% соответственно (р<0,001). Общая частота осложнений была выше при резекции почки – 23,5% против 17% (р<0,001), серьезных осложнений – 19,2% против 10,2% (р<0,001). При многофакторном анализе риск развития общих и серьезных осложнений при резекции почки по сравнению с криоаблацией был выше в 4,6 раза (р=0,004) и 9,71 раза (р<0,001) соответственно. Авторами был сделан вывод о том, что криоаблация почки может быть альтернативой резекции почки только у определенной когорты пациентов, имеющих отягощенный соматический фон [7].
В другой работе был проведен анализ периоперационных осложнений, онкологических и функциональных результатов лапароскопической криоаблации почки (n=41) и открытой резекции почки (n=82). При медиане наблюдения 33,6 мес. безрецидивная выживаемость после лапароскопической криоаблации почки составила 83% против 100% (р=0,015). Снижение скорости клубочковой фильтрации после лапароскопической криоаблации составило 7,8±3,1 мл/мин/1,73 м2 и 9,8±2,3 мл/мин/1,73 м2 после открытой резекции почки (р=0,602) [8].
М.М. Desai et al. в своей работе сравнили результаты лечения больных, перенесших лапароскопическую резекцию почки (n=153) и лапароскопическую криоаблацию почки (n=78). Средний размер опухоли в обеих группах составил 3 см. Пациенты, которым выполнялась лапароскопическая резекция почки, были моложе (средний возраст – 60,6 против 65,6 года, р=0,005), исходный уровень креатинина был ниже (90,1 против 106,0 мкмоль/л, р=0,01), размер опухоли был незначительно больше (2,3 против 2,1 см, р=0,02). В группе больных, перенесших лапароскопическую резекцию почки, осложнения встречались чаще и включали большую степень кровопотери и большую частоту отсроченных осложнений, местный рецидив составил 0,6% (медиана наблюдения – 5,8 мес.). В группе больных, перенесших лапароскопическую криоаблацию почки, местный рецидив составил 3% (медиана наблюдения – 24,6 мес.) [9].
R.K. Goel et al. сообщили о применении одного многоканального лапароскопического порта (Single port access renal cryoablation (SPARC)) при выполнении криоаблации опухоли почки. В исследование были включены 6 пациентов, средний возраст которых составил 73 года, а размер опухоли равнялся 2,6 см. 4 пациентам порт был установлен в пупок во время трансперитонеального доступа, 2 пациентам – на конец 12 ребра при забрюшинном доступе. Интраоперационных осложнений отмечено не было, средний период пребывания в клинике составил 2,3 дня. Во всех 6 случаях криоаблация была выполнена без лапароскопической или открытой конверсии. Недостатком данной методики можно считать ограничение движений хирургического инструментария [10].
Сравнивая криоаблацию почки с РЧА почки, D.A. Kunkle и R.G. Uzzo проанализировали результаты лечения 1375 пациентов, 600 пациентам (1-я группа) из которых была выполнена лапароскопическая криоаблация почки, а 775 (2-я группа) – РЧА почки. Местный рецидив и отдаленное метастазирование чаще наблюдались во 2-й группе пациентов (12,9% против 5,2% (р<0,0001) и 2,5% против 1,0% (р=0,06)). В группе больных, перенесших РЧА, частота повторного сеанса аблации была больше (8,5% против 1,3%, р<0,0001) [11].
Материалы и методы
В период с марта 2010 г. по март 2014 г. в клинике урологии МГМСУ криоаблация почки с использованием системы 3-го поколения SeedNet (производитель – компания Galil Medical) проведена 15 больным почечно-клеточным раком (ПКР) в возрасте от 42 до 75 лет (средний возраст – 59,8 года) (табл. 1). Диаметр опухоли в среднем составил 2,7 см (1,3–3,5 см).
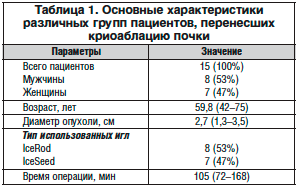
Всем пациентам диагноз ПКР был поставлен по данным магнитно-резонансной томографии (МРТ) и/или мультиспиральной КТ с контрастированием. У всех больных имела место клиническая стадия Т1аN0M0 (размер опухоли не превышал 4 см в диаметре).
Операции выполнялись под эндотрахеальным наркозом из лапароскопического доступа при помощи игл IceSeed (n=8) и IceRod (n=7) трансперитонеальным (n=13) или ретроперитонеальным (n=2) доступом.
Во время операции положение больного на операционном столе было на здоровом боку с подложенным под него валиком и опущенными головным и ножным концами стола. Ногу на стороне операции выпрямляли, а на здоровой стороне сгибали в коленном и тазобедренном суставах. Мочевой пузырь дренировали по уретре катетером Фолея 16 или 18 Fr (в среднем на 1 сут). После создания пневмоперитонеума до 12 мм вод. ст. в брюшную полость вводился лапароскоп и 2 инструмента через троакары диаметром 5 и 10 мм, используемые главным образом для проведения лапароскопического ультразвукового датчика, имеющего диаметр 10 мм.
Интраоперационно всем больным выполнялось УЗИ при помощи аппарата Bruel&Kjaer Medical Mileparken 34, DK 2730 Herlev REF TYPE 2202 и лапароскопического ультразвукового датчика с частотой 10 МГц – преобразователя B-K Medical REF TYPE 8666 с целью определения глубины расположения опухоли и ее размера.
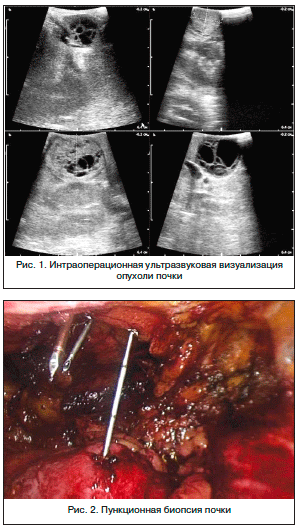
После выделения почки и визуализации опухоли из нее выполнялась пункционная биопсия (рис. 1, 2).
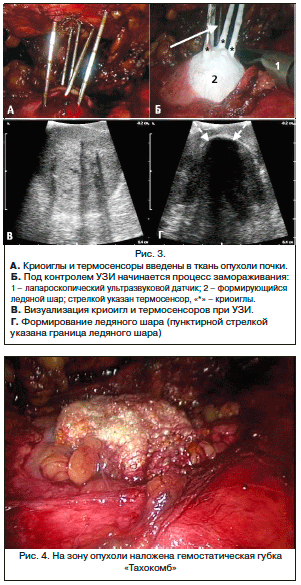
Затем в ткань опухоли вводились криоиглы и термосенсоры, количество которых зависело от размера опухоли. Расстановка криоигл осуществлялась под контролем УЗИ. Далее было проведено 2 цикла замораживания/оттаивания при помощи газов высокого давления: аргона (для замораживания) и гелия (для размораживания) также под контролем УЗИ (рис. 3).
После извлечения криоигл и термосенсоров зона введения криоигл укрывалась гемостатической губкой «Тахокомб» (рис. 4), устанавливался страховой дренаж.
Результаты и обсуждение
В настоящее время четких критериев оценки эффективности криоаблации почки не существует. Большинство авторов при наблюдении за пациентами рекомендуют выполнять КТ или МРТ через 3, 6, 12, 18 и 24 мес., далее – ежегодно. Отсутствие роста опухоли и накопления контрастного вещества при рентгенологическом исследовании может свидетельствовать об эффективности лечения.
В нашем случае при гистологическом исследовании в 14 из 15 случаев (92%) выявлен светлоклеточный ПКР 1–2 градации по Фурману; в 1 случае выявлена ангиомиолипома. Медиана наблюдения за больными в настоящее время составляет 1,5 года. Всем пациентам спустя 6 и 12 мес. после операции выполнялась мультиспиральная КТ с контрастированием, по данным которой у 1 пациента выявлен рецидив заболевания, у остальных больных накопления контрастного вещества в области проведения криоаблации отмечено не было.
По данным разных авторов, раково-специфическая выживаемость после перенесенной лапароскопической криоаблации почки составляет от 90 до 100% [12–16]. Результаты наиболее крупных исследований представлены в таблице 2.
В исследовании, проведенном M. Aron et al., проанализированы результаты лапароскопической криоаблации почки у 88 пациентов. Медиана наблюдения за пациентами составила 83 мес. (60–120 мес.), средний размер опухоли – 2,3 см. Пятилетняя раково-специфическая выживаемость составила 95% [17].
N.J. Hegarty et al. представили данные ретроспективного анализа лечения больных, перенесших лапароскопическую криоаблацию почки (n=164) и РЧА (n=82). Средний размер опухоли в группе больных, перенесших криоаблацию, был равен 2,56 см против 2,51 см в группе больных, перенесших РЧА. Среднее время операции при РЧА составило 19,3 мин (32,2 мин при криоаблации почки). Раково-специфическая выживаемость после криоаблации почки достигла 98% при среднем сроке наблюдения до 3 лет и 100% – после РЧА (срок наблюдения – 1 год) [18].
В 2010 г. G. Guazzoni et al. представили данные 8-летнего наблюдения за больными, перенесшими лапароскопическую криоаблацию почки (клиническая стадия Т1а). В исследование были включены 123 пациента (91 мужчина и 32 женщины). Средний размер опухоли составил 2,14 см (0,5–4 см). Средний период наблюдения – 46,04±25,75 мес. (12–96 мес.). У 44 пациентов при медиане наблюдения 61,3±13,76 мес. раково-специфическая выживаемость достигла 100%, общая выживаемость – 93,2% [19].
G.P. Haber et al. представили данные 5-летнего наблюдения за 78 пациентами с опухолью единственной почки, из которых в 48 случаях была выполнена лапароскопическая резекция почки, а в 30 – лапароскопическая криоаблация почки. В группе больных, перенесших лапароскопическую резекцию, кровопотеря составила 391 мл против 162 мл (p=0,003). Частота развития послеоперационных осложнений была также значительно больше в случае лапароскопической резекции (22,9% против 6,7%, р=0,07). Спустя 3 мес. после операции скорость клубочковой фильтрации снизилась на 14,5 и 7,3% после лапароскопической резекции почки и лапароскопической криоаблации почки соответственно (р=0,02). Местный рецидив был выявлен у 4 пациентов (13,3%), перенесших лапароскопическую криоаблацию почки (р=0,02). Общая безрецидивная выживаемось была выше в группе больных, перенесших лапароскопическую резекцию почки (р<0,05) [20].

Заключение
Криоаблация почки представляет собой эффективный и безопасный метод лечения локализованного ПКР. Криоаблация почки имеет сравнительно небольшое количество противопоказаний: ожидаемая продолжительность жизни менее 1 года, наличие метастазов, расположение опухоли в области ворот почки, центральной собирательной системы или проксимального отдела мочеточника. Криоаблация почки показана пациентам группы высокого хирургического риска, имеющим небольшую по размеру опухоль (не более 4 см), тяжелые сопутствующие заболевания, или пациентам, отказывающимся от хирургического вмешательства. К основным преимуществам криоаблации можно отнести меньшее количество осложнений по сравнению с остальными методиками лечения ПКР. В настоящее время мы обладаем наибольшим опытом проведения криоаблации почки, тем не менее оценка отдаленных онкологических и функциональных результатов данного вмешательства займет дополнительное время и потребует лечения большего числа больных.












