Для цитирования. Азимова Ю.Э., Нувахова М.Б., Рачин А.П. Боль в спине при фасеточном синдроме: контроверсии или консенсус? // РМЖ. 2015. No 24. С. 1446–1448.
Боль в спине является многофакторным заболеванием, и все больше исследователей и практикующих врачей обращают внимание на патологию фасеточных суставов как источник дорсалгии. Несмотря на то, что синдром впервые был описан в 1911 г. Golthwaite [16], консенсуса по диагностическим критериям и методам ведения пациентов не существует до настоящего времени. По данным разных исследований, распространенность фасеточного синдрома (ФС) в структуре причин боли в спине составляет от 5 до 90%, этот показатель существенно зависит от использующихся критериев диагностики [8, 12, 22, 24, 25, 30, 31, 36]. В крупных исследованиях с более строгими критериями отбора показано, что распространенность ФС среди пациентов с болью в спине составляет 5–15% [14, 26, 32, 38]. Во всех крупных исследованиях показано, что распространенность ФС существенно возрастает с возрастом.Фасеточные суставы являются парными и расположены сверху и снизу каждого тела позвонка, формируя основные суставные поверхности вдоль его диска, что обеспечивает движение позвоночника. Фасеточный сустав – истинный диартроидальный сустав, имеющий суставной хрящ и синовиальную капсулу с большим количеством ноцицепторов. В патогенезе ФС участвуют хроническое воспаление, микротравматизация сустава и повышенная нагрузка на сустав при дегенерации межпозвоночного диска. Дальнейшее прогрессирование приводит к нарушению подвижности, подвывихам, нестабильности и спондилолистезу. Может возникать стеноз межпозвонкового отверстия, отмечаться развитие корешковой боли [2].
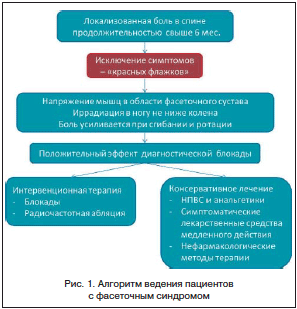
Клиническая картина ФС характеризуется прежде всего аксиальной болью, локализованной паравертебрально с 2 сторон. Боль тупая, характерна иррадиация в область бедра или паховую область. Боль от верхних поясничных фасеточных суставов иррадиирует в передне-боковую поверхность бедра, а от нижних поясничных фасеточных суставов – в заднюю поверхность бедра. Иррадиация боли ниже колена не характерна для ФС и является важным дифференциально-диагностическим критерием с корешковой болью [28].
Специфических объективных симптомов ФС не существует. Диагноз ставится на основании обследования двигательной функции. Так, наибольшая нагрузка на нижние поясничные суставы происходит во время наклона вбок и разгибания, при этом боль у пациента усиливается. На основании нейроортопедического обследования Revel [38] сформулировал критерии болевого синдрома при патологии фасеточных суставов:
• боль не усиливается при:
– кашле, чихании, натуживании;
– выпрямлении из положения флексии;
– разгибании с ротацией;
– гиперэкстензии;
• уменьшается при сгибании.
В дальнейшем экспертным советом [43] были выделены другие наиболее чувствительные критерии ФС:
• положительный эффект от блокады фасеточного сустава;
• локализованная двусторонняя боль в поясничной области;
• отсутствие корешковых симптомов;
• усиление боли при нажатии на область фасеточного сустава или поперечный отросток;
• боль возникает при разгибании, наклоне в сторону;
• болезненный мышечный спазм в области пораженного сустава;
• боль не иррадиирует ниже колена;
• боль уменьшается при флексии;
• радиологические признаки дегенерации фасеточных суставов.
Как и в случае неспецифической боли в спине, при дифференциальной диагностике ФС необходимо прежде всего обращать внимание на симптомы – «красные флажки». К таким симптомам относятся: нарушение тазовых функций, анестезия промежности, нижний парапарез (синдром конского хвоста), лихорадка, сыпь, иммуносупрессия (инфекция), длительный прием кортикостероидов, травма, остеопороз (перелом), начало после 50 лет, онкологические заболевания в анамнезе, необъяснимое снижение веса (опухоль), немеханический характер боли, нарастание или отсутствие улучшения в течение 6 нед., очаговый неврологический дефицит: прогрессирующий или выраженный. Также при дифференциальной диагностике аксиальной боли рассматриваются дискогенная боль, дисфункция крестцово-подвздошного сочленения, миофасциальный синдром.
Наиболее чувствительным дифференциально-диагностическим критерием ФС является положительный эффект лечебно-диагностической блокады. Инъекция проводится под рентгенологическим контролем внутрь сустава, или блокируется нерв, иннервирующий фасеточный сустав. Частота ложноположительных результатов составляет 15%, ложноотрицательных – 11% [10, 21]. Ложноположительные эффекты связывают с действием «сухой» пункции на миофасциальные триггеры, распространением локального анестетика в другие ткани, плацебо-эффектом. Ложноотрицательные результаты могут быть обусловлены повреждением суставной капсулы иглой, особенностями расположения медиальной ветви, абсорбцией активного препарата.
Лечение пациентов с ФС в идеальных условиях должно осуществляться мультидисциплинарной командой специалистов и включать фармакотерапию, когнитивно-поведенческую психотерапию, лечебную гимнастику, физиотерапевтические процедуры, а также интервенционные методы (рис. 1). Интересно, что, несмотря на высокую чувствительность и специфичность в качестве диагностической процедуры, блокады приносят лишь временный терапевтический эффект. Так, в исследовании Carette et al. эффективность блокады активным препаратом и плацебо через 6 мес. статистически не различалась (22 и 10% соответственно) [7]. В 2 обсервационных исследованиях было показано, что анальгетическое действие блокад сохраняется в течение лишь 3 мес. [13, 35]. Эффективность радиочастотной абляции, несмотря на ее широкое распространение для лечения боли в спине, также является дискутабельной. В метаанализе 6 контролируемых исследований было показано несомненное преимущество радиочастотной абляции перед плацебо [9]. Тем не менее продолжительность ее эффекта невелика. Так, в исследовании Gallagher et al. [15] эффект через 6 мес. был достоверно лучше, чем в группе плацебо, лишь в популяции пациентов, ответивших положительно на диагностическую блокаду. В другом исследовании van Kleef et al. продолжительность эффекта радиочастотной абляции составила 12 мес. [42]. Было предложено несколько методик хирургического лечения ФС, однако их эффективность не была доказана в контролируемых исследованиях. Таким образом, интервенционные методы обладают ограниченной продолжительностью эффекта, и необходимы другие, консервативные, методы ведения пациентов с ФС.
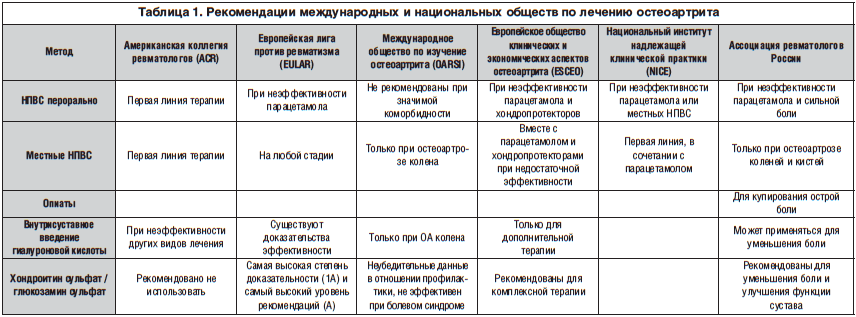
Поскольку специальных аналитических исследований эффективности консервативного лечения ФС не проводилось, эксперты предлагают экстраполировать рекомендации для неспецифической боли в спине и остеоартроза на модель ФС. Однако даже международные или национальные рекомендации содержат неоднозначные данные (табл. 1). Так, Американская коллегия ревматологов рекомендует использовать пероральные или местные НПВС как средства первой линии [18]. Согласно рекомендациям Европейской лиги против ревматизма, местные НПВС могут использоваться на любой стадии, пероральные НПВС – при неэффективности парацетамола [19]. Международное общество по изучение остеоартрита не рекомендует местные НПВС при ФС, а пероральные НПВС – при значимых коморбидных заболеваниях [27]. Европейское общество клинических и экономических аспектов остеоартрита и Национальный институт надлежащей клинической практики (Великобритания) рекомендуют использовать местные НПВС вместе с парацетамолом и хондропротекторами, а при неэффективности – пероральные НПВС [6]. Согласно рекомендациям Ассоциации ревматологов России, НПВС применяют в случае неэффективности парацетамола, а также при наличии признаков воспаления. При сильной боли в суставах лечение следует начинать сразу с НПВС. НПВС применяются в минимальной эффективной дозе, назначаются на максимально короткие сроки [4]. Согласно всем международным рекомендациям, при высоком гастроинтестинальном риске предпочтительны селективные ингибиторы ЦОГ-2, тогда как назначения неселективных НПВС необходимо избегать. При высоком кардиальном риске предпочтителен напроксен, необходимо избегать назначения высоких доз ибупрофена, диклофенака и селективных ингибиторов ЦОГ-2. При высоком ренальном риске назначение любых НПВС нежелательно.
Скепсис экспертов по отношению к симптоматическим лекарственным средствам замедленного действия (symptomatic slow-acting drugs for osteoarthritis (SySADOA)) значительно уменьшился в последние годы. Это связано с накоплением данных исследований, показавших эффективность хондропротекторов как для профилактики прогрессирования заболевания, так и для снятия болевого синдрома. В 2 контролируемых исследованиях внутрисуставное введение гиалуроновой кислоты приводило к уменьшению болевого синдрома и улучшению функции сустава [34, 40]. В то же время международные рекомендации по использованию хондроитин сульфата и глюкозамина исключительно противоречивы – от самой высокой степени доказательности до полной неэффективности. Положительное действие на восстановление хрящевой ткани препаратов хондроитин сульфата и глюкозамина, доказанное при помощи рентгенологических методов, было выявлено в 5 плацебо-контролируемых исследованиях [17, 20, 29, 33, 37]. Такое расхождение связано с рядом причин: недоступностью хондропротекторов в ряде стран, отсутствием стандартов в отношении дозы, длительности приема и показателей эффективности, гетерогенностью пациентов в исследованиях. Так, в одном исследовании с негативным результатом доза глюкозамина составила 500 мг 3 р./сут вместо рекомендованной производителем 1500 мг 1 р./сут, что повлияло на фармакокинетические свойства препарата [5]. В то же время Кохрейновский обзор [41] 20 контролируемых исследований показал уменьшение болевого синдрома на 28% при приеме глюкозамина по сравнению с плацебо и улучшение двигательной функции на 21%, что было статистически значимым. Необходимо подчеркнуть, что в контролируемых исследованиях анальгетический эффект SySADOA у пациентов с остеоартритом сопоставим с таковым при приеме анальгетиков, однако развивается гораздо позже – через 6–12 мес. от начала приема [11]. Таким образом, препараты группы SySADOA обладают несомненным терапевтическим эффектом, однако он развивается в течение месяцев, также для реализации эффекта необходимо строго придерживаться инструкции по приему средств. В исследовании Л.И. Алексеевой с соавт. [1] на примере использования препарата Терафлекс, содержащего 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата, было показано, что терапевтический эффект отмечается как при непрерывном приеме, так и при курсовом (3 мес. – прием, 3 мес. – перерыв, 3 мес. – прием), однако при курсовом приеме во время перерыва болевой синдром возобновлялся.
Насколько возможно экстраполировать данные эффективности модифицирующих средств замедленного действия на суставы позвоночника? Выводом недавно проведенного метаанализа [39] стало то, что в настоящее время, несмотря на множество проведенных исследований (148 работ), большинство из них имеют методологические недостатки. В условиях рутинной клинической практики специалисты отмечают несомненный эффект, улучшаются показатели оценочных шкал боли и функциональной активности, однако нейровизуализационные критерии эффективности на настоящий момент не разработаны.
Так, в одном из исследований [3] изучалась эффективность Терафлекса у пациентов с остеохондрозом. В исследование вошли 40 пациентов с дегенеративно-дистрофическими заболеваниями шейного, грудного и поясничного отделов позвоночника с острыми и хроническими болями различной интенсивности. Значимое улучшение состояния с регрессом болевого синдрома отмечалось у 75% больных. У 20% больных уменьшалась интенсивность болевого синдрома, эффект отсутствовал лишь у 5% больных. В том же исследовании было показано, что при сочетании Терафлекса с НПВС анальгетический эффект наступал в 2 раза быстрее, а потребность в терапевтических дозах НПВС снижалась.
Немедикаментозные методы лечения в обязательном порядке должны включаться в схемы лечения пациентов с ФС. Одним из базовых методов, включенных во все рекомендации, является обучение пациентов, в т. ч. врач должен дать рекомендации по изменению образа жизни, снижению веса и физическим нагрузкам, по приему лекарственных средств. Имеют доказательную базу и рекомендованы к применению тепловые процедуры, чрескожная электронейростимуляция, акупунктура [4]. Когнитивно-поведенческая психотерапия является неотъемлемой частью ведения пациентов с болевыми синдромами, в т. ч. и при ФС. Применение дополнительных ортопедических приспособлений или поясов недостаточно изучено.
Таким образом, ФС является распространенной причиной боли в спине, однако недостаточно диагностируется. Существуют определенные методологические сложности диагностики и ведения пациентов с патологией фасеточных суставов. Лечебные блокады и радиочастотная абляция высокоэффективны, но эффект проходит со временем. Пролонгированный эффект дает использование симптоматических лекарственных средств замедленного действия (например, Терафлекса), что позволяет замедлить прогрессирование заболевания, уменьшить потребность пациентов в НПВС и отсрочить инвазивные манипуляции.












