Цель исследования: оценить эффективность систематического лечения пирибедилом (Проноран®) и/или мемантином для снижения потери синаптических связей ВВК-СН, вызываемой шумом.
Материал и методы
В исследование были включены только здоровые самцы крыс Sprague Dawley с нормальным слухом, оцениваемым по КСВП. Вес тела на момент начала исследования составлял 306–385 г.Крысы были случайным образом распределены на 4 экспериментальные группы: 1) воздействие шума с инъекциями физиологического раствора (n=11); 2) воздействие шума с инъекциями пирибедила и мемантина (n=9); 3) воздействие шума и инъекции пирибедила (n=6); 4) воздействие шума и инъекции мемантина (n=9). Количество субъектов в группах варьировалось, поскольку некоторые животные удалялись по методологическим причинам при гистологической оценке. Плотность CTBP2 (С-конец связывающий белок, C-terminal-binding protein) в этих группах сравнивалась с базой данных CTBP2 для нормы, включая животных с симуляцией шумового воздействия (n=15). Физиологический раствор (ФР), пирибедил 10 мг/кг и/или мемантин 3 мг/кг вводились 7 дней подряд, начиная за 3 дня и за 1 ч перед воздействием шума. Дозировка основывалась на данных Chen et al. [11], Kutzing et al. [12] и Wroge et al. [13]. Инъекции ФР производились в эквивалентном объеме как для групп с пирибедилом, так и/или с мемантином.
Пирибедил (Проноран®) – это агонист допамина, воздействующий на латеральные эфферентные синапсы вблизи периферических процессов СН. Ранее было показано, что интраскалярная перфузия пирибедила при шумовом воздействии уменьшает смещение пороговых значений суммарного потенциала действия и сокращает эксайтотоксичное повреждение периферических процессов СН [14, 15]. Garrett et al. [16] также показали, что агонисты допамина могут уменьшать амплитуды суммарного потенциала действия.
Мемантин является блокатором открытых каналов NMDA-рецептора, который оказывает антиэксайтотоксичное воздействие в других системах [12, 13, 17–20]. Систематически пирибедил (Проноран®) или мемантин в настоящее время применяются в клинической практике при других нарушениях [21, 22] и могут использоваться для предотвращения вызываемых шумом эксайтотоксичности и потери синаптических связей ВВК-СН.
Воздействие шума. Экспериментальные группы субъектов подвергались воздействию шума в октавном диапазоне 4 кГц с эквивалентным уровнем непрерывного звукового давления 117 дБ (SPL) в вентилируемой камере звукового воздействия в течение 3 ч. Шумовое воздействие было выбрано для создания слабой потери НВК в среднем диапазоне улитки крысы. Камера оснащалась громкоговорителями (JBL: модель 2450H) через усилитель мощности (Parasound: HCA-750). Источником входного сигнала усилителя служил аудио CD-плейер (Marantz: PMD320). Звуковой диск был записан с помощью программного обеспечения для звукового монтажа (Adobe: Audition 1.5). Уровни звука были откалиброваны, а звуковой спектр проверен с помощью анализатора спектра (Stanford Research Systems: SR760) и микрофона (Bruel and Kjaer: тип 4136) во множестве мест внутри звуковой камеры для обеспечения однородности стимула. Интенсивность стимула изменялась максимум на 3 дБ в местах измерений в камере. Уровень звука проверялся перед звуковым воздействием и после него с помощью измерителя уровня шума (Quest Instruments: модель 2200). Микрофон измерителя уровня шума располагался над клетками и калибровался для записи на уровне головы животного при шумовом воздействии.
Стволомозговые слуховые вызванные потенциалы. Животным производилась анестезия ксилазином 10 мг/кг и кетамином 40 мг/кг IM, их помещали в электрически и акустически экранированную камеру (CA-Tegner AB, Швеция) на подушку с подогревом, с циркуляцией воды для поддержания температуры тела. Для подачи стимулов и записи откликов использовались аппаратура Tucker Davis Technologies (TDT) System III и программное обеспечение SigGen/BioSig (TDT, Alachua, FL). Данные о нейронной активности собирали через подкожно вводимые игольчатые электроды, размещаемые в верхней части черепа (активный) и вентрально для каждого уха. Функции стимул/отклик измерялись по отклику на 15 мс тоновые посылки через передатчик, вставленный на входе в ушной канал, начиная с интенсивности 80 дБ с понижением шагами по 10 дБ до определения порогового значения. Затем интенсивность повышалась с 90 дБ с шагом 10 дБ до 110 дБ, далее с ша-гом 5 дБ – до максимальной интенсивности 120 дБ при 20 кГц и до 125 дБ при 8, а затем при 4 кГц. Соответствующие 1024 отклика усреднялись для каждой интенсивности стимула. Дополнительную информацию по сбору данных КСВП можно найти в работе Le Prell et al. [11, 23]. Измерения КСВП с функциями стимул/отклик собирались перед включением в исследование и на 21-й день после шумового воздействия перед ликвидацией животного.
Площадь под кривой (AUC). Для определения AUC измеренная амплитуда (волна I из функций стимул/отклик) при каждом уровне интенсивности добавляется к амплитуде на следующем самом низком уровне и делится на 2. Результат умножается на разницу в уровнях интенсивности (5 или 10 дБ). Эти результаты суммируются для интенсивностей для данного субъекта, и определяется квадратный корень для каждого числа. Квадратные корни усредняются для каждой группы, и с помощью дисперсионного анализа с критериями множественного сравнения Даннетта для каждой группы определяется значимость.
Улитковая гистология и иммунное окрашивание. Крысы получали сильную анестезию в виде пентобарбитала натрия, а затем сосудистую перфузию через сердце с фосфатным буфером, позднее – 4% параформальдегидный фиксатор в фосфатном буфере. Улитка извлекалась и получала мягкую интраскалярную инфузию того же фиксатора через круглое окно и апикальное отверстие. Затем улитку погружали в фиксатор на 12–16 ч при 4° C. Затем улитка ополаскивалась в течение 30 мин в холодном фосфатно-солевом буферном растворе (PBS), после чего следовало частичное выщелачивание в 5% ЭТДК в фосфатном буфере 2–3 дня при комнатной температуре на ротаторе. Затем извлекалась слуховая капсула, а улитку помещали в 3% нормальную сыворотку козла в PBS плюс 0,3% Triton-X 100 в качестве блокировки. Ткани получали первичную инкубацию с мышиными анти-CTBP2 антителами (BD Transduction Laboratories), разведенными 1:200 в PBS плюс 0,1% TritonX-100 на 16–20 ч при 4° C, а затем 3 10-минутные ополаскивания в PBS. Ткани затем совместно окрашивались козьим антимышиным иммуноглобулином с флуоресцентной меткой Alexafluor 488 (Molecular Probes /Invitrogen), разведенным 1:1000 в PBS Triton X, и фаллоидином (Molecular Probes/Invitrogen) с флуоресцентной меткой Alexafluor 568, разведенным 1:100 на 2 ч при комнатной температуре, затем 3 полоскания в PBS, в темноте. Затем улитку рассекали на 3 сегмента: верхушка, база и крюк. Каждый сегмент отдельно помещали на предметное стекло с Prolong Diamond (Life Technologies) и накрывали покровным стеклом. До изучения стекла хранились при температуре 4° C.
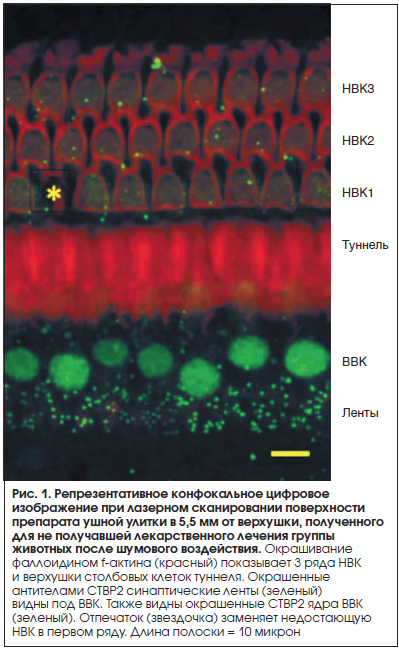
Оценка синаптических лент внутренней волосковой клетки СН. Окрашенные антителами CTBP2 синаптические ленты (рис. 1) использовались как метки для синапсов ВВК-СН у Kujawa и Liberman [4], Singer и et al. [10] и Altschuler et al. [7]. Недавние исследования дают основания предполагать, что до 5% окрашенных антителами CTBP2 лент могут быть «сиротами», а не соединяются с периферическими процессами с рецепторами глутамата, и поэтому использование окрашенных антителами CTBP2 лент в качестве меток для синаптических связей ВВК-СН потенциально ведет к избыточному подсчету в размере до 5% [24].
Для количественной оценки были выбраны 3 зоны вдоль улитковой спирали в 3,5, 5,5 и 6,5 мм от верхушки, близко к 8 и 20 кГц частотным зонам [25] соответственно для оценки КСВП. Для получения z-серий с 1 мкм срезами с интервалом 0,25 мкм для каждой зоны, представляющей интерес, использовался лазерный сканирующий конфокальный микроскоп Olympus FluoView 500 с объективом с кратностью 63. Длина улитковой спирали в каждой представляющей интерес зоне составляет примерно 0,2 мм, а различия возникают из-за разницы в кривизне спирали в разных местах. Цифровые изображения передавались на рабочую станцию анализа изображений Metamorph для количественного анализа, который был слепым по условиям лечения. Для каждой базы ВВК в представляющей интерес зоне было определено число окрашенных антителами CTBP2 точек, отвечающих критериям размера и формы и с интенсивностью маркировки не менее чем в 5 раз выше фона, а затем было определено среднее число точек для базы ВВК в зоне интереса.
Оценка потери волосковых клеток. Окрашивание волосковых клеток фаллоидином или замена пропущенных волосковых клеток звездочками (рис. 1) использовались для идентификации наличия или отсутствия ВВК и НВК. Подсчет волосковых клеток проводился под эфифлуоресцентной оптикой на флуоресцентном микроскопе Leica с объективом 50x и 0,19 мм окулярной сеткой. Число НВК в каждом ряду и число присутствующих или отсутствующих ВВК для каждой длины окулярной сетки 0,19 мм вводились в программу цитокохлеограммы [26, 27], начиная от верхушки и продвигаясь базально по всей длине улитковой спирали (9,7 мм в среднем). Программа сравнивает число волосковых клеток с базой данных для нормы. Программа может строить график потери волосковых клеток по позициям вдоль спирали для каждой улитки (цитокохлеограмма) и представлять анализ в абсолютных цифрах или в процентах общей потери волосковых клеток по каждому оцениваемому животному.
Статистическая обработка. Значимость тестировалась дисперсионным анализом (тест Крускала – Уоллиса для непараметрических результатов) в сопровождении двухвыборочного t-критерия для независимых выборок с поправками Бонферрони для множественных сравнений, с использованием программы Graphpad Prism.
Результаты
Внутренние волосковые клетки – Синаптические ленты СН. На рисунке 1 показано репрезентативное изображение окрашенных антителами CTBP2 синаптических лент ВВК у подвергавшегося шумовому воздействию животного без лечения. У животных, которые не получали лечение, после воздействия шумом на уровне 117 дБ в октавном диапазоне с центром в 4 кГц в течение 3 ч возникла серьезная (p<0,01) потеря синаптических лент ВВК на 21-й день после воздействия в 2-х из 3-х оценивавшихся областей спирали улитки: в 5,5 мм от верхушки (снижение на 26%) и 6,5 мм от верхушки (снижение на 38%), но не в 3,5 мм от верхушки (рис. 2, 3).

В 6,5 мм от верхушки обнаружены серьезные различия между группами «Норма» и «Шум без лечения» (p<0,01) и между группами «Шум без лечения» и «Шум с лечением пирибедилом и мемантином» (p<0,05) (рис. 3А).
В 5,5 мм от верхушки обнаружены серьезные различия между группами «Норма» и «Шум без лечения» (p<0,01), между группами «Шум без лечения» и «Шум с лечением пирибедилом и мемантином» (p<0,01), между группами «Шум без лечения» и «Шум с лечением пирибедилом» (p<0,01) (рис. 3В) в 3,5 мм от верхушки значимой разницы не обнаружено (рис. 3С).
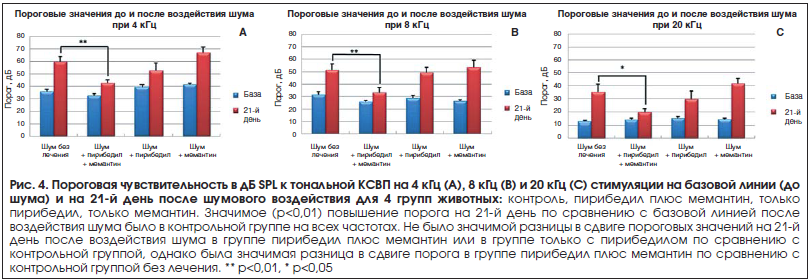
Пороговые значения КСВП. На рисунке 4 показаны базовая линия и измерения пороговых значений на 21-й день после шумового воздействия при 4, 8 и 20 кГц для всех групп. Базовые пороговые значения были схожими для всех групп, хотя и с некоторым повышением для групп с лечением только пирибедилом и только мемантином при самой низкой из частот тестирования (4 кГц, рис. 4). В группе без лекарственного лечения пороговые значения КСВП на 21-й день после шумового воздействия были существенно выше базовых значений: на 23 дБ (p<0,01), 20 дБ (p<0,01) и 23 дБ (p<0,01) при 4, 8, и 20 кГц соответственно. Средние пороговые значения после воздействия шумом в группах с лечением только пирибедилом и только мемантином были значительно (p>0,05) выше базовой линии на всех частотах тестирования, кроме частоты 4 кГц для группы с лечением только пирибедилом; и для этих 2–х групп с лечением только одним лекарственным средством пороговые значения после шумового воздействия не были значительно снижены по сравнению с наблюдавшимися в группе, не получавшей лечение после шумового воздействия, для всех частот тестирования. В группе, получавшей сочетанное лечение пирибедилом и мемантином, отмечено значительное (p<0,05) снижение вызванного шумом порогового значения по сравнению с группой без лечения при частотах 4 кГц (10 дБ против 24 дБ), 8 кГц (7 дБ против 20 дБ) и 20 кГц (6 дБ против 23 дБ).
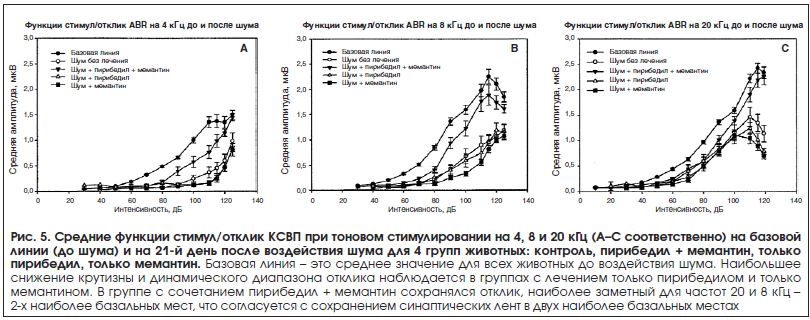
Функции стимул/отклик КСВП. На рисунке 5A-C показаны средние функции стимула/отклика КСВП, полученные, соответственно, для частот 4, 8 и 20 кГц до шумового воздействия (базовая линия), включая всех животных в исследовании, и на 21-й день после шумового воздействия по каждой лечебной группе, включая: без лечения, лечение пирибедилом и мемантином, только пирибедилом, только мемантином. Во всех случаях после шумового воздействия функции смещаются вправо (для эквивалентного отклика требуется более высокая интенсивность), со снижением максимальной амплитуды наблюдаемого отклика. Для количественного определения этих изменений нами оценивалась средняя площадь под кривой (AUC) для каждой функции с целью наилучшего отображения изменения в динамическом диапазоне отклика, и выполнялся дисперсионный анализ средних значений AUC. На рисунке 6 представлены график значений AUC и стандартная ошибка среднего. Уменьшение отклика после шумового воздействия по сравнению с базовой линией было наибольшим и значимым (p<0,01) у животных без лечения и у животных с лечением только пирибедилом и только мемантином для всех частот. Не наблюдалось значимого вызванного шумом снижения в отклике у животных, получавших пирибедил и мемантин, за исключением частоты 4 кГц (p=0,001). Была значимая разница (p<0,01) между лечением пирибедилом и мемантином в сравнении с лечением только мемантином на всех частотах, и только пирибедилом на частотах 4 и 8 кГц.

Обсуждение
Результат текущего исследования, обнаружившего, что систематическое применение пирибедила (Проноран®) может уменьшать вызываемую шумом потерю лент ВВК, согласуется с более ранним исследованием с использованием интраскалярного применения пирибедила при шумовом воздействии, в котором было обнаружено снижение разрыва периферических процессов слухового нерва [2, 14, 15]. В данном исследовании показано, что лечение пирибедилом (Проноран®) привело к значимому снижению потери синапсовых лент только в зонах 5,5 мм от верхушки (где была потеря 26% связей у крыс, не получавших лечение), тогда как в зоне 6,5 мм от верхушки (где была потеря 38% у крыс без лечения) снижение было статистически недостоверным. Лечение мемантином не дало достоверно значимого снижения потери в любой из зон, приближаясь к этому (p = 0,07) в зоне в 5,5 мм от верхушки, но не в зоне 6,5 мм.Большая потеря в зоне 6,5 мм свидетельствует о том, что эта зона сильнее разрушается при воздействии шума или более чувствительна к стрессу, что делает ее ответственной за недостаточность применения каждого из препаратов в отдельности. Сочетание пирибедила и мемантина при лечении значительно уменьшает потерю лент, вызванную шумом, в зоне 6,5 мм. Это может отражать синергическое взаимодействие двух различных механизмов, затрагиваемых каждым из препаратов. Однако возможно, что в соответствующей дозе будет достаточно только пирибедила или только мемантина. Было бы полезно в будущих исследованиях провести измерения отклика на дозировку для каждого препарата в различных зонах улитковой спирали. Также было бы полезно сравнить шумовое воздействие для различных спектров нагрузки.
Значительное снижение потери лент, вызванной шумом, в зоне 6,5 мм при лечении пирибедилом и мемантином, ассоциировалось с вызванной шумом значительной потерей сверхпороговых амплитуд (рис. 5). Это согласуется с прежними исследованиями, показывающими, что потеря синаптических связей ВВК-СН приводит к изменениям функций роста и сверхпороговых откликов на стимул [5]. Это дает основания предполагать, что сочетанное лечение пирибедилом и мемантином привело к предотвращению вызванной шумом потери волоконных соединений с низкой спонтанной скоростью, уменьшая потерю динамического диапазона. Интересно, что лечение сочетанием пирибедил + мемантин также привело к значительному уменьшению сдвига пороговых значений. Учитывая, что здесь не было значительного снижения потери волосковых клеток, уменьшение сдвига пороговых значений может отражать сохранение волокон со средней и высокой спонтанной скоростью, потеря которых, вызываемая шумом, могла бы повысить пороговые значения. Это также могло бы отражать дисфункцию остающихся наружных волосковых клеток. Имелись данные отоакустической эмиссии на частоте продукта искажения (DPOAE) для 6 животных, у которых были минимальная потеря НВК (менее 5%) и сдвиг порогов КСВП более 30 дБ. У 3-х из этих животных был минимальный (0–10 дБ) сдвиг DPOAE, соответствующий воздействию на средне- и низкопороговые волокна, а у других 3-х – сдвиг 15–40 дБ DPOAE, соответствующий тому, что некоторые остающиеся НВК утратили функции. В будущем было бы интересно специально провести оценку в сравнении волокон с высокой, средней и низкой спонтанной скоростью, если будут иметься специфические маркеры. Также в будущих исследованиях было бы интересно определить, влияет ли снижение потери соединений, выполненное в текущем исследовании, на развитие гиперакузии или тиннитуса, что связывалось с потерей синаптических лент и синаптических связей ВВК – СН в недавних исследованиях [6, 9, 10].
Шумовое воздействие в данном исследовании вызывало значительную потерю синаптических лент только в 2-х из оцениваемых наиболее базальных зонах улитковой спирали. Через 21 день после шумового воздействия не было значительной потери лент ВВК в более апикальных зонах улитковой спирали, где находился центр шумового воздействия. Это может отражать стресс и/или чувствительность к стрессу различных зон улитковой спирали. Также интересно рассмотреть данные, показывающие более высокие, чем нормальные, уровни NT-3 в улитке трансгенных мышей до слабого шумового воздействия, результатом которого стали значительная регенерация и восстановление потерянных синаптических связей ВВК-СН [28]. Как было показано, концентрация NT-3 повышается с приближением к верхушке [29–31]. Поэтому возможно, что эндогенные уровни NT-3 в более апикальных зонах достаточны для стимулирования некоторого восстановления потерянных связей, и было бы полезно изучить вызванные шумом изменения в синаптических связях ВВК-СН на более ранних этапах, чем 21-й день после шумового воздействия, как в данном исследовании, и определить, имеется ли здесь возможное восстановление связей. Если это так, то было бы интересно исследовать потенциальную защиту от потери на более ранних этапах после шумового воздействия.
Значительное вызванное шумом уменьшение динамического диапазона отклика КСВП (рис. 5A-C) как у животных, не получавших лечение, так и у животных, получавших только пирибедил и только мемантин, согласуется с данными предыдущих исследований, показывающими, что потеря синаптических связей ВВК-СН ведет к изменениям в функциях роста и более низким сверхпороговым откликам [5]. Отсутствие значительного снижения в отклике (при более высоких частотах) в группе с лечением пирибедил + мемантин согласуется с защитой от вызванной шумом потери синаптических связей ВВК-СН.
Оценка функции стимул/отклик основывается на измерении волны I КСВП, где площадь под волной хорошо коррелирует с числом активных волокон СН [23]. Хотя снижение амплитуды отклика на стимуляцию высокой интенсивности может отражать выборочное повреждение синапсов и волокон с высокой спонтанной скоростью и высоким пороговым значением [5], при такой высокой интенсивности имеется также значительная активация средне- и низкопороговых волокон из более базальных зон улитки. Эти волокна вносят вклад в амплитуду волны КСВП, а их вклад в отклики высокой интенсивности у нормальных животных, как и эти вызванные шумом изменения в отклике, требуют дополнительного раскрытия.
Реферат подготовлен редакцией «РМЖ»
по материалам статьи Altschuler R.A. et al.
Treatment with Piribedil and Memantine Reduces
Noise-Induced Loss of Inner Hair Cell Synaptic Ribbons // Scientific Reports. 2016. Vol. 6. Article number: 30821.












