Боль в пояснично–крестцовой области остается одним из самых распространенных болевых синдромов. Она развивается с одинаковой частотой у мужчин и женщин, а заболеваемость ею в течение жизни составляет до 85% [34,37]. Распространенность хронической боли в спине и шее составляет от 24 до 56,7% [11,24,50]. Полное выздоровление пациентов с хронической болью в спине отмечается редко [31] в связи с ограниченной эффективностью существующих методов лечения, которая, в свою очередь, зависит от недостаточно полной изученности механизмов формирования хронических болевых синдромов.
Традиционно боль может быть представлена тремя основными патофизиологическими составляющими – ноцицептивной, невропатической и психогенной [2,3]. Ноцицептивная боль в спине связана с активацией болевых рецепторов – ноцицепторов. Одним из наиболее часто встречающихся состояний, связанных с формированием ноцицептивной боли, является спондилоартропатический болевой синдром. Боль, являющаяся прямым следствием заболевания или повреждения соматосенсорной системы, называется невропатической [7,46]. Невропатическая боль в спине обычно связана с поражением корешков при формировании грыжи межпозвоночного диска. Она может возникать также при стенозе позвоночного канала, спондилолистезе, компрессии корешков спинномозговых нервов остеофитами и гипертрофированными фасеточными суставами. Как правило, боли иррадиируют в конечности и сопровождаются другими симптомами поражения корешков. Вклад каждого из этих компонентов может быть различным у отдельных пациентов, определяя особенности клинической картины и эффективность различных методов лечения. Психогенная боль в спине «в чистом виде» встречается редко. Она крайне сложна для диагностики, поскольку при наличии у пациента психических нарушений возможно также существование скелетно–мышечных и других неврологических расстройств, которые могут вызывать имеющуюся у больного симптоматику. Доказана коморбидность боли в поясничной области и других хронических болевых синдромов и эмоциональных, поведенческих и когнитивных нарушений [10,29]. Относительно хорошо изучена роль периферических ноцицептивных источников боли при наиболее часто встречающихся причинах боли в спине – скелетно–мышечных нарушениях [1,5,6,12,13,15]. У небольшой категории пациентов (до 10% пациентов с болью в пояснично–крестцовой области) значимую роль играет периферический невропатический компонент, связанный со сдавлением, растяжением, ишемией корешков спинномозговых нервов. Несмотря на значение в формировании боли в спине периферических источников болевой импульсации, имеется значительно больше данных, указывающих на то, что локальная боль в пояснично–крестцовой области прямо не связана со структурными изменениями позвоночника [16,23]. По данным отдельных авторов, точное выявление периферического источника хронической боли пояснично–крестцовой локализации возможно не более, чем у 15% пациентов [30]. Интенсивность боли различна у пациентов со сходными скелетно–мышечными нарушениями. Многие исследователи в настоящее время сходятся во мнении, что боль в поясничной области не может быть хорошо объяснена ни генетическими, ни средовыми факторами [21,25]. Некоторые формы хронической боли в пояснично–крестцовой области могут являться патогенетически близким состоянием к так называемым дисфункциональным болевым синдромам – фибромиалгии, синдрому раздраженной кишки, интерстициальному циститу и др. [20]. В ряде случаев, кроме известных патофизиологических составляющих боли – невропатической, ноцицептивной и психогенной, при хронической боли возможно выделение неврогенного дисфункционального механизма, отражающего ведущую роль центральных механизмов в формировании клинических симптомов, даже при наличии ноцицептивного или периферического невропатического компонента.
В отличие от хронической боли в спине острая боль в пояснично–крестцовой области является доброкачественным и самоограничивающимся состоянием. В подавляющем числе случаев она обусловлена скелетно–мышечными нарушениями. Предположительно микротравматизация и растяжение мышцы при выполнении «неподготовленного движения» являются причиной боли в спине у большинства пациентов (>70% случаев). Однако точный источник боли в спине выявляется с частотой около 15% без применения инвазивных диагностических вмешательств (например, блокад дугоотростчатых суставов с местным анестетиком). Трудность точного определения источника скелетно–мышечной боли была проиллюстрирована рядом исследований, показавших, что болевая импульсация от различных висцеральных структур, межпозвоночного диска, фасеточных суставов может имитировать отраженную боль и гипералгезию, сходную с таковой при миофасциальном болевом синдроме (МФБС) [14] и описанную в ранних работах по экспериментальному раздражению мышц. Для объяснения механизма формирования отраженной боли ряд исследователей используют теорию центральной сенситизации, согласно которой отмечается снижение порога возбуждения нейронов заднего рога, расширение их рецептивного поля, приводящего к их возбуждению в ответ на легкую тактильную стимуляцию в области, удаленной от зоны повреждения.
Поскольку основной задачей лечения острой скелетно–мышечной боли является купирование болевого синдрома (прием нестероидных противовоспалительных препаратов (НПВП), простых анальгетиков, миорелаксантов) и сохранение повседневной активности, направление пациента с острой болью в пояснично–крестцовой области для обследования узким специалистом (неврологом, травматологом, мануальным терапевтом и др.) и проведение диагностических блокад в каждом случае для выявления точного источника представляется неоправданным. Диагностический поиск в случаях острой боли в спине целесообразно проводить между: 1) потенциально опасными заболеваниями вертебрального и невертебрального происхождения (компрессия конского хвоста, травматическое, опухолевое, воспалительное и инфекционное поражение позвоночника, остеопороз и заболевания внутренних органов); 2) компрессионной радикулопатией и 3) доброкачественной скелетно–мышечной («неспецифической») болью. Как правило, во многих зарубежных странах ведением пациентов с так называемой «неспецифической» болью в спине успешно занимаются врачи общей практики [42,51].
При анализе первичной обращаемости к врачам общей практики по поводу острой боли в пояснично–крестцовой области ее скелетно–мышечные причины выявляются у 85% пациентов. «Дискогенная» боль (категория, самостоятельность которой в настоящее время нуждается в уточнении) и боль, связанная с дисфункцией дугоотростчатых (фасеточных) суставов, отмечается у 10% пациентов с острой болью в спине. Компрессионная радикулопатия пояснично–крестцовых корешков отмечается в 4%, а неврологические осложнения поясничного стеноза – в 3% случаев. Компрессионные переломы тел позвонков, связанные с остеопорозом, обнаруживаются в 4% обращений, а спондилолистез – в 2% случаев. Кроме этого, причиной боли в спине может быть травматическое поражение позвоночника, которое иногда приводит к переломам позвонков и разрывам дисков, но чаще – к растяжению капсулы суставов и связок позвоночного столба [37].
Основными потенциально опасными вертеброгенными причинами боли в спине, которые отмечаются у 1% пациентов, обращающихся за медицинской помощью по поводу боли в спине, являются первичные и метастатические опухоли позвоночника (0,7% случаев), воспалительные (спондилоартриты) и инфекционные (туберкулез, дисцит) его поражения (0,3 и 0,01% случаев соответственно). Воспалительные спондилоартриты (анкилозирующий спондилит – болезнь Бехтерева, псориатический артрит, реактивные артриты и др.) нередко сопровождаются энтезитами – воспалением в местах прикрепления сухожилий или связок к кости. Особенности наиболее распространенных вертеброгенных болевых синдромов будут рассмотрены ниже.
Невертеброгенные, связанные с соматической патологией боли в спине встречаются у 2% пациентов, обратившихся с жалобами на боль в спине, и обусловлены заболеваниями органов грудной и брюшной полости, таза и забрюшинного пространства [34,37].
При острой боли в спине нередко отмечается мышечно–тонический синдром. Его клинические характеристики описаны в работах Я.Ю. Попелянского (1997), В.П. Веселовского (1977), Г.А. Иваничева (2005), Ф.А. Хабирова (2006), А.А. Лиева (1995) и др. авторов [2,4,6,9,12,13]. Больные с мышечно–тоническими синдромами жалуются на боли в позвоночнике или в мышцах плечевого и тазового пояса, которые уменьшаются после отдыха, растирания, разминания и растяжения мышцы. Боль нередко носит «стягивающий» характер. Визуально можно определить изменение контура, «выбухание» мышцы, которая при пальпации может иметь повышенную плотность. Произвольные движения с вовлечением спазмированной мышцы совершаются в неполном объеме. Хроническое течение мышечно–тонических синдромов чаще всего отмечается в тех мышцах, которые испытывают позные перегрузки, например, при асимметрии конечностей, таза, выраженном сколиозе, патологии внутренних органов. Боль в этих случаях, как правило, имеет слабую или умеренную интенсивность. Пациенты предъявляют жалобы на ощущение «дискомфорта», «тяжести» после физической нагрузки, которые уменьшаются после разминания мышцы, ее согревания. Болезненность в спазмированной мышце возникает при ее активном сокращении и обычно отсутствует при растяжении. В англоязычной литературе наиболее близким к мышечно–тоническому синдрому термином является «мышечный спазм». При перерастяжении и микротравматизации мышцы на фоне ее перегрузки или при длительном вынужденном положении может возникать локальная боль. При этом в ответ на травму происходит сокращение как пораженной мышцы, так и тех мышц, которые ее окружают. Это защитное напряжение мышц обозначается, как рефлекторный мышечный спазм.
Таким образом, важной клинической задачей является выяснение механизма развития локального длительного мышечного напряжения – патологии внутренних органов, позвоночного двигательного сегмента, спровоцировавших спазм движения или длительной неудобной позы. Воздействие на основной патологический процесс в этом случае приведет к регрессу и мышечно–тонического синдрома. Точные механизмы формирования мышечно–тонических синдромов неизвестны. Мышечно–тонической синдром может выполнять саногенетическую функцию, ограничивая пораженную область от дальнейшего повреждения. Считается, что повышение активности паравертебральных мышц в ответ на боль направлено на повышение стабильности позвоночника и таза. Определенная роль отводится повышению возбудимости сегментарных спинальных структур в ответ на афферентную импульсацию от раздражения рецепторов синувертебрального нерва в области пораженного диска. К другим рефлекторным механизмам, приводящим к формированию мышечно–тонического синдрома, относятся так называемые «висцеромоторные» реакции в виде спазма мышцы в ответ на афферентацию из пораженного внутреннего органа («висцеро–соматический» рефлекс).
К сожалению, общепринятое упрощенное представление об изменении состояния мышечной системы в ответ на болевую стимуляцию – так называемый «порочный круг» «боль–мышечный спазм – боль» не получило достаточного подтверждения ни в экспериментальных работах, ни при клинических наблюдениях. Хорошо известно, что изменение активации мышц является неоднонаправленным. Если при острой боли в спине имеется тенденция к повышению активации паравертебральных мышц, то при хронической боли четких паттернов изменения ЭМГ–активации мышц не выявлено [19,28]. При остром повреждении ткани и связанной с ним боли, как правило, отмечается снижение активации глубоких и повышении активации поверхностных мышц спины [36]. Длительно сохраняющиеся изменения состояния паравертебральных мышц приводят к негативным последствиям в виде повышения нагрузки на костные и связочные структуры позвоночника и таза, нарушению выполнения сложных движений в пораженном сегменте. Интересно, что изменение состояния мышц часто сохраняется, даже если боль полностью регрессирует, и может способствовать ускорению дегенеративных изменений в структурах позвоночного столба и развитию повторных эпизодов боли в спине [32]. Известно, что наличие эпизода боли в поясничной области в анамнезе является фактором риска повторного возникновения боли в спине [26,35].
МФБС – хронический болевой синдром, при котором в различных частях тела возникает локальная или сегментарная боль. Патогномоничным признаком МФБС являются триггерные зоны (ТЗ). ТЗ – участок локального продольного уплотнения, расположенный по направлению мышечных волокон, при раздражении которого (пальпаторном, уколом, перкуссией) вызывается местная болезненность и иррадиации боли. Размер ТЗ составляет от 2 до 5 мм [14,44]. Хотя при МФБС, как правило, неврологической симптоматики, свидетельствующей о поражении нервной системы, не выявляется, пациенты могут жаловаться на ощущение «онемения», «ползание мурашек», покалывание в зоне иррадиации боли. Для каждой ТЗ характерна своя строго определенная область отраженной боли и парестезий.
Выделяют активные и латентные ТЗ. При наличии активных ТЗ определяется как спонтанная боль, возникающая обычно при нагрузке на заинтересованную мышцу, так и боль при пальпации мышцы в месте расположения ТЗ. Латентные ТЗ не сопровождаются спонтанной болью, но вызывают боль при их пальпации. Наиболее часто спонтанная боль в области ТЗ описывается пациентами как интенсивная и острая, а отраженная – как ноющая. Активным ТЗ нередко сопутствует повышенная утомляемость мышцы и ограничение объема движений. В случаях, когда между двумя ТЗ или между ТЗ и костной структурой располагается сосудисто–нервный пучок или нерв, создаются условия для невроваскулярной компрессии. Пациенты при этом нередко описывают сопутствующие ноющей боли онемение, парестезии, реже – гиперестезию в зоне иннервации соответствующего нерва. Может отмечаться отечность и ощущение скованности в дистальных отделах конечности. Нередко симптомы невроваскулярной компрессии регрессируют в течение нескольких минут после инактивации ТЗ путем введения в нее местного анестетика. Диагноз МФБС ставится на основе клинического обследования.
Проблема диагностики МФБС состоит и в том, что относительно большое количество мышц потенциально может принимать участие в развитии МФБС, и, соответственно, врач должен владеть методикой мануального исследования различных мышц. Затруднения связаны с различной конституцией пациентов, толщиной подкожной жировой клетчатки, глубиной залегания мышц. Особенно трудно доступны пальпации мышцы ног и ягодичной области (например, глубоко залегающая грушевидная мышца).
Точная причина развития МФБС остается неизвестной. Существует несколько теорий патогенеза миофасциальной боли. Так, согласно теории ишемического спазма исходным стимулом часто служит физическая травма мышцы, либо ее хроническое напряжение (мышечно–тонический синдром), что приводит к высвобождению внутриклеточного кальция и удлиненному ненормальному мышечному сокращению – спазму части мышцы. Этот спазм может вызывать боль и повреждение за счет высвобождения простагландинов и других медиаторов воспаления, которые, в свою очередь, возможно, дополнительно усиливают мышечный спазм. Такое продолженное сокращение может приводить к ишемии как на клеточном уровне за счет усиления анаэробного гликолиза и избыточного образования молочной кислоты, так и к снижению локального кровотока. Эта «модель энергетического кризиса» D. Simons [45] частично объясняет напряжение, имеющееся в плотных мышечных тяжах и сохраняющееся в покое. Однако маловероятно, что возникающая при МФБС хроническая боль носит ишемический характер, поскольку она не имеет характерных признаков острой ишемической боли. Также остается не ясным, почему мышечное повреждение при МФБС должно приводить к образованию ТЗ, в то время как другие его причины не вызывают формирования ТЗ. Продолжается дискуссия о том, являются ли ТЗ зонами патологического мышечного сокращения или же участками контрактуры, не генерирующими биоэлектрическую активность. Тем не менее, несмотря на эти вопросы, распространено убеждение, что МФБС каким–то образом связан с локальным мышечным спазмом. Длительная ноцицептивная афферентация вызывает нейропластические изменения, приводящие к центральной сенситизации в задних рогах спинного мозга и других отделах ноцицептивной системы, обеспечивающих восприятие боли. Это может приводить к функциональным и структурным изменениям в ЦНС, которые в последующем участвуют в формировании хронической боли, вегетативной дисфункции и психических расстройств. Именно вовлечением в патофизиологию МФБС структур центральной нервной системы (задних рогов спинного мозга, зрительного бугра, соматосенсорной коры и др.) объясняется распространение боли за пределы ТЗ (отраженные боли), вторичной гипералгезии и аллодинии. Повышенная возбудимость нейронов заднего рога спинного мозга – проявление центральной сенситизации – лишь первая ступень в формировании хронической боли, за которой следуют другие функциональные, а затем и структурные изменения как нейронов заднего рога, так и клеток глии. Показано, что афферентация от ноцицепторов мышц является более мощным индуктором возбудимости ЦНС, чем афферентация от ноцицепторов кожи [41].
Спондилоартопатический синдром (дегенеративное поражение дугоотростчатых (фасеточных) суставов) в подавляющем большинстве случаев – результат многолетней повторяющейся травматизации, связанной с неоптимальным объемом движений в суставах и повышением нагрузки на них вследствие дегенерации межпозвоночных дисков. Для диагностики фасеточного синдрома применяется блокада медиальной ветви задней первичной ветви спинномозгового нерва или внутрисуставные инъекции местного анестетика под контролем нейровизуализации. Исчезновение боли в течение нескольких минут после проведения диагностической блокады считается стандартом для связи боли в спине с патологией дугоотростчатых суставов. Показано, что диагностические блокады без соответствующего рентгенологического контроля приводят к ложноположительным результатам в 25–41% случаев [38,39].
Боль в поясничном отделе позвоночника без иррадиации в конечности у пациента моложе 50 лет, при отсутствии злокачественного новообразования в анамнезе, клинических и лабораторных признаков системного заболевания, без неврологического дефицита с вероятностью более 99% обусловлена доброкачественными скелетно–мышечными нарушениями (например, МФБС или суставно–связочной дисфункциeй). Тем не менее уже при первом обследовании пациента важно выявить симптомы, указывающие на то, что боль в спине может являться симптомом более серьезной, обычно соматической, патологии. Так, следует обращать внимание на наличие лихорадки, локальной болезненности и повышения местной температуры в паравертебральной области, которые характерны для инфекционного поражения позвоночника. Его риск повышен у пациентов, получавших иммуносупрессивную терапию, инфузии, у лиц, страдающих ВИЧ–инфекцией и наркоманией. О наличии опухоли (первичной или метастатической) может свидетельствовать беспричинное снижение веса, злокачественное новообразование любой локализации в анамнезе, сохранение боли в покое и ночью, а также возраст пациента старше 50 лет. Компрессионный перелом позвоночника чаще отмечается в случаях травм, при остеопорозе (при достаточно длительном использовании кортикостероидов и у пациентов старше 50 лет). Воспалительную спондилоартропатию можно заподозрить при наличии сопутствующего увеита и артралгий другой локализации (в том числе в анамнезе).
При неврологическом обследовании необходимо уточнить наличие и характер двигательных нарушений, чувствительных и трофических расстройств, изменение сухожильных рефлексов. При поражении шейных, грудных, поясничных и крестцовых корешков наряду с «позитивными» чувствительными нарушениями в виде боли, аллодинии, парестезий и дизестезий необходимо выявлять и «негативные» сенсорные симптомы (гипестезию, анестезию отдельных видов чувствительности: тактильной, болевой, температурной, вибрационной или суставно–мышечной). Как чувствительные, так и двигательные, и рефлекторные нарушения локализуются в зоне иннервации пораженного корешка.
Крайне важным представляется выявление симптомов поражения корешков конского хвоста у пациентов с болью в поясничном отделе позвоночника, которые включают нарушение чувствительности (анестезию) в аногенитальной области и дистальных отделах ног, периферический парез мышц голеней, выпадение ахилловых рефлексов и тазовые расстройства в виде отсутствия позыва на мочеиспускание/дефекацию, задержку или недержание мочи и кала. Для скелетно–мышечных болевых синдромов не характерны какие–либо изменения в неврологическом статусе пациента, однако в отдельных случаях МФБС, когда напряженная мышца сдавливает сосудисто–нервный пучок или нерв, отмечаются парестезии, реже – гипалгезия или гипералгезия в зоне иннервации соответствующего нерва. Могут отмечаться преходящие вегетативные расстройства и виде отечности и негрубого изменения окраски кожи в дистальных отделах конечности. Неанатомическое («ампутационное») распределение чувствительных и двигательных нарушений прежде всего отражает их психогенное происхождение.
В подавляющем числе случаев острая и хроническая боль в спине является «доброкачественным» состоянием, и большинство пациентов не нуждается в проведении дополнительных инструментальных исследований. Однако наличие выраженных неврологических и соматических расстройств может потребовать срочного параклинического обследования. Так, слабость в мышцах ног, снижение чувствительности в аногенитальной области («седловидная анестезия»), тазовые нарушения указывают на наличие компрессии корешков конского хвоста и требуют незамедлительного проведения МРТ или КТ позвоночника с последующим рассмотрением вопроса с нейрохирургом о необходимости срочного оперативного вмешательства. Отсутствие связи боли с движением, сохранение ее в ночное время, наличие в анамнезе злокачественного новообразования, ВИЧ–инфекции, применения иммунодепрессантов, внутривенных инфузий, беспричинное снижение веса, лихорадка и ночной гипергидроз, возраст больного менее 20 и старше 50 лет требуют проведения дополнительных методов исследования уже при первом обращении пациента с целью исключения в первую очередь инфекционного и опухолевого поражения позвоночника. Во всех перечисленных случаях необходима рентгенография позвоночника в прямой и боковой проекции, исследование общего анализа крови и мочи, а при подозрении на остеомиелит, эпидуральный абсцесс и поражение корешков конского хвоста – дополнительное проведение КТ или МРТ пояснично–крестцового отдела позвоночника. При необходимости (подозрении на онкологическое заболевание) уточнения состояния костных структур в ряде случаев после проведения рентгенографии показана сцинтиграфия. При подозрении на злокачественное новообразование предстательной железы необходимо исследовать уровень простат–специфического антигена. При наличии травмы в недавнем анамнезе (падение с высоты, дорожно–транспортные происшествия и т.д.), а также при длительном применении кортикостероидов и возрасте пациентов старше 55 лет необходимо провести рентгенографию позвоночника, а при недостаточной ее информативности и сохранении боли свыше 10 дней – сцинтиграфию или КТ позвоночника. Показания для костной денситометрии имеются у всех женщин в возрасте старше 65 лет, у женщин в постменопаузальном периоде моложе 65 лет при наличии факторов риска, у мужчин старше 70 лет, у взрослых с переломами при минимальной травме, при заболеваниях или состояниях, приводящих к снижению минеральной плотности костной ткани, приеме препаратов, снижающих костную массу. Всем пациентам с острым болевым синдромом длительностью свыше 1 мес, а также всем больным с хроническими болями в спине показано проведение рентгенографии позвоночника в прямой и боковой проекции с целью исключения опухолевого поражения позвоночника. При наличии клинических симптомов компрессии корешков или спинного мозга и в других диагностически сомнительных случаях показано проведение МРТ соответствующего отдела позвоночника для уточнения состояния структур позвоночного канала и определения дальнейшей тактики ведения пациента. При болях в поясничном отделах позвоночника и конечностях особое значение имеют методы визуализации, целесообразность применения которых определяется длительностью болевого синдрома, анамнестическими особенностями и наличием изменений в неврологическом и соматическом статусе пациентов. Рекомендации по оптимальному объему дообследования в зависимости от особенностей клинической картины приведены в таблице 1 [27].
Лечение дискогенной радикулопатии. В каждом случае компрессионной радикулопатии следует определиться, какую тактику лечения предпочесть: оперативные или консервативные методы воздействия. Целью оперативного лечения является быстрое устранение сдавления корешка спинномозгового нерва или его раздражения веществом диска, подвергшегося экструзии. Абсолютными показаниями к оперативному лечению пояснично–крестцовой радикулопатии следует считать сдавление корешков конского хвоста с парезом стопы, анестезией аногенитальной области, нарушением функций тазовых органов.
В остальных случаях имеющиеся клинические рекомендации предлагают считать динамику в период 6–8 недель течения заболевания определяющей тактику дальнейшего лечения [33]. Показано, что длительное консервативное лечение (более 18 недель) пациентов с компрессионной радикулопатией не влияет на эффективность проводимой в последующем микродискэктомии, по сравнению с оперативным вмешательством в более ранние сроки [43].
Относительными показаниями к хирургическому вмешательству при пояснично–крестцовой радикулопатии являются выраженный корешковый (невропатический) болевой синдром, не поддающийся адекватному консервативному лечению в течение 6 недель, а также нарастание неврологических нарушений. Пациентам этой группы необходимо проведение нейровизуализации (КТ, МРТ), а при выявлении клинически значимых изменений – рассмотрение вопроса об оперативном лечении.
Показано, что эффективность стандартной дискэктомии и микродискэктомии (удаление грыжи диска с применением специального микроскопа) при компрессионной радикулопатии пояснично–крестцовых корешков одинакова [40].
У пациентов с острой радикулопатией пояснично–крестцовых корешков постельный режим и сохранение повседневной активности с высокой степенью доказанности одинаково влияют на исход заболевания. Консервативное лечение включает применение вазоактивных препаратов (пентоксифиллин 100 мг в/в (5 мл 2% раствора) или 400 мг/сут перорально, диосмин 2 табл./сут) с целью уменьшения отека и улучшения микроциркуляции. При интенсивных, не купирующихся другими средствами болях возможно кратковременное применение наркотических анальгетиков (трамадол 100 мг/сут). Для лечения невропатической боли у пациентов с компрессионной радикулопатией может применяться габапентин (средняя эффективная доза –1800 мг/сут) [8].
При улучшении самочувствия пациента добавляют физиопроцедуры, направленные на уменьшение рефлекторного мышечного спазма (вакуумный массаж, фонофорез с местными анестетиками, массаж). В зависимости от состояния пациента уже на 3–5–е сутки можно подключать методы щадящей мануальной терапии (приемы на мобилизацию, релаксацию мышц), что, в свою очередь, ведет к уменьшению анталгического сколиоза и увеличению объема движений в позвоночнике. Мануальная терапия показала б|ольшую эффективность по сравнению с плацебо и тракционной терапией у пациентов с компрессионной радикулопатией пояснично–крестцовых корешков. Однако манипуляции могут приводить и к ухудшению состояния пациентов с шейной и пояснично–крестцовой радикулопатией, особенно в случаях, когда имеются относительные показания к оперативному лечению [40].
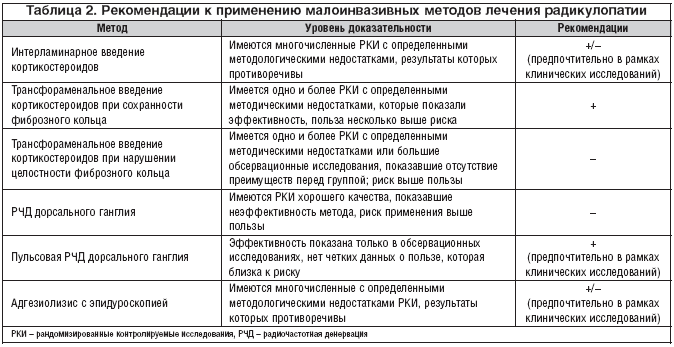
Достаточно широко применяемым в стационаре методом лечения поясничной или крестцовой радикулопатии является эпидуральное введение кортикостероидов. Введение кортикостероидов может осуществляться трансламинарным и трансфораменальным доступом. В таблице 2 приведены сведения об эффективности других малоинвазивных вмешательств, применяющихся при лечении пациентов с пояснично–крестцовой радикулопатией [47].
Лечение острой скелетно–мышечной боли в спине включает разъяснение пациенту доброкачественной природы заболевания и необходимости поддерживать оптимальный уровень повседневной активности (специальный буклет или устное информирование) [17,48]. «Препаратами выбора» для лечения острой боли в спине являются парацетамол и НПВП. Все НПВП условно можно разделить на группы, исходя из преимущественного воздействия на изоформы циклооксигеназы (ЦОГ): ЦОГ–1 и ЦОГ–2. Большинство «стандартных» НПВП (диклофенак, кетопрофен, индометацин и др.) относится к неселективным ингибиторам ЦОГ. К преимущественно селективным ингибиторам ЦОГ–2 относятся нимесулид и мелоксикам, к высокоселективным – коксибы. Поэтому при выборе НПВП необходимо принимать во внимание наличие и характер факторов риска нежелательных явлений, наличие сопутствующих заболеваний, характер взаимодействия с другими лекарственными средствами и стоимость.
Особое внимание привлекают НПВП, отличающиеся высокой анальгетической активностью, коротким периодом полувыведения, снижающим частоту побочных явлений, и быстрым наступлением анальгетического эффекта. С этой точки зрения отдельного внимания заслуживает препарат лорноксикам, принадлежащий к классу оксикамов и его форма с быстрым высвобождением лорноксикам рапид. Анальгетические свойства лорноксикама связаны с мощным ингибированием ЦОГ–2, а также торможением образования интерлейкина–6 и синтеза индуцибельного оксида азота [22]. Кроме того, лорноксикам стимулирует выработку эндогенного динорфина и эндорфина, что способствует физиологической активации антиноцицептивной системы. В отличие от других оксикамов лорноксикам отличается коротким периодом полувыведения (около 4 часов) по сравнению с более чем 24 часами при использовании других лекарственных препаратов этой группы.
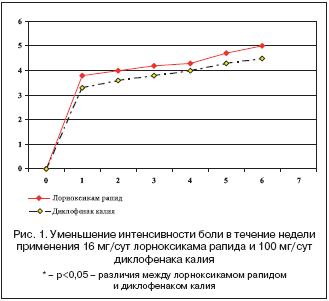
В 6 российских центрах проведено рандомизированное двойное слепое многоцентровое клиническое исследование по сравнению анальгетической эффективности и безопасности пероральных форм с быстрым высвобождением: лорноксикама (лорноксикам рапид) и диклофенака калия при лечении 220 пациентов с острой болью в нижней части спины [52]. Пациенты, включенные в исследование, страдали от острой боли в нижней части спины длительностью не более 5 дней, интенсивностью не менее 5 баллов по 11–балльной визуальной ранговой шкале (ВРШ) и нуждались в назначении анальгетика. Среднее время начала снижения интенсивности боли составило 29 и 36 мин для лорноксикама рапид и диклофенака калия соответственно, однако различия были статистически не достоверны. На фоне приема лорноксикама рапида отмечалось достоверно б|ольшее снижение интенсивности боли по сравнению с диклофенаком калия. Эти различия были получены уже через 1,5 часа после приема первой дозы препарата, когда в группе, получавшей лорноксикам рапид, интенсивность боли снизилась на 3,17 балла по ВРШ, а в группе, принимавшей диклофенак калия – на 2,50 балла. Степень облегчения от боли, оцениваемая по 5–балльной шкале, была достоверно выше в группе, получавшей лорноксикам рапид. Общая оценка пациентом принятого анальгетика была достоверно выше в группе, лорноксикама рапид (2,03±0,10 vs 1,68±0,07 в 1–й день лечения и 2,45±0,10 vs 2,15±0,09 на 7–й день лечения для лорноксикама рапида и диклофенака калия соответственно) (рис. 1) [18]. Таким образом, у лорноксикама рапид отмечается достоверно (p<0,05) большая степень анальгетического эффекта по показателям стандартной оценки уменьшения интенсивности боли по сравнению с диклофенаком калия, а скорость наступления анальгетического эффекта не уступает таковой форме диклофенака с быстрым высвобождением.
Лорноксикам назначается в суточной дозе 8–16 мг в 2–3 приема, максимальная суточная доза – 16 мг. Лорноксикам рапид – 8 или 16 мг в сутки. Максимальные рекомендуемые сроки применения пероральных НПВП при скелетно–мышечной боли в спине – 10–14 дней.
При острой боли в спине показана эффективность и миорелаксантов. Согласно современным клиническим рекомендациям их целесообразно назначать коротким курсом в виде монотерапии или в добавление к парацетамолу и НПВП при недостаточной эффективности последних. Основными побочными эффектами, ограничивающими применение миорелаксантов, являются сонливость и головокружение, которые отмечаются у 70% пациентов [48].
Относительно нелекарственных методов лечения острой боли в спине можно отметить, что мануальная терапия рекомендуется пациентам, не вернувшимся к нормальному уровню повседневной активности. Мультидисциплинарные программы лечения целесообразно применять у работающих пациентов с подострой болью в спине и ограничением активности более 4–8 недель. Обычно они включают образовательную программу («школа боли в спине»), ЛФК, изучение и, по–возможности, изменение условий труда, поведенческую психотерапию. При этом вклад каждого из указанных методов воздействия изучить невозможно. При острой боли в спине доказанно не эффективны тракции позвоночника, чрескожная электрическая нейростимуляция. Из–за недостаточности доказательной базы в программу лечения пациента с острой болью в поясничной области нецелесообразно включать физиотерапию, ношение согревающего пояса, применение психотерапии, посещение «школы боли в спине», назначение массажа. Имеется слабая доказательность эффективности акупунктуры при острой боли в пояснично–крестцовой области.
Таким образом, в подавляющем числе случаев острая боль в спине является доброкачественным самоограничивающимся состоянием, и большинство пациентов не нуждается в проведении дополнительных инструментальных обследований. Оптимальным считается активный подход к лечению. При необходимости медикаментозной терапии препаратами выбора являются НПВП и парацетамол. Пациентам, у которых не отмечается улучшение состояния в течение 4 недель лечения, необходим повторный скрининг на маркеры «потенциально опасных» заболеваний позвоночника, а также определение признаков психосоциального неблагополучия и коррекция терапии с учетом выявленных нарушений.
При лечении хронической боли в спине нужно стремиться максимально точно локализовать источник болевой импульсации, даже с применением при необходимости инвазивных методов (например, диагностических блокад) и обязательно учитывать роль психосоциальных факторов, оказывающих большое влияние на хронизацию боли в спине. Лечение должно быть направлено на коррекцию как периферических источников боли, так и сопутствующих психологических расстройств. При хронической боли в спине большое место в лечении уделяется методам немедикаментозного лечения. Хорошо доказано, что при хронической боли в пояснично–крестцовой области эффективна ЛФК [34,48]. Польза от массажа повышается при его комбинировании с ЛФК, образовательной программой и при его выполнении квалифицированным специалистом. Эффект сохраняется длительное время (до года). Показано, что применение мануальной терапии эффективнее, чем ее имитация.
Мультидисциплинарный подход к лечению пациентов с хронической болью в поясничной области подразумевает программы медикаментозного лечения, образования пациента, выполнение ЛФК и психотерапевтические воздействия, проводящиеся на регулярной основе (несколько часов в неделю) с участием нескольких специалистов (психотерапевта, инструктора по ЛФК, терапевта и др.). Мультдисциплинарный подход эффективен в отношении снижения интенсивности боли и степени инвалидизации [48].
Для уменьшения интенсивности боли применяются НПВП, опиоидные анальгетики, миорелаксанты, антидепрессанты (дулоксетин). Убедительных доказательств эффективности антиконвульсантов для лечения хронической боли в спине не получено.
При отсутствии точно установленного источника боли в спине нецелесообразно применение инвазивных методов лечения: нейрорефлексотерапии, радиочастотной и электротермальной денервации фасеточных суставов и др. Показано, что эффективность малоинвазивных вмешательств на позвоночнике повышается при выявлении «специфического» (суставного, дискогенного) источника боли в спине [49].

Литература
1. Алексеев В. В. Диагностика и лечение острых поясничных болей//Consilium Medicum – 2009 – том 11 – №2. – С.42–46.
2. Алексеев В. В., Яхно Н. Н. Боль. В кн.: «Болезни нервной системы. Руководство для врачей». Под ред. Н.Н. Яхно. – Москва. – Медицина. –2007. –Т.1.С.107–124
3. Алексеев В.В., Баринов А.Н., Кукушкин М.Л., Подчуфарова Е.В., Строков И.А., Яхно Н.Н. Боль. Руководство для врачей и студентов. Под редакцией академика РАМН Н.Н.Яхно – Москва – "МЕДпресс–информ" – 2009 – 303 стр.
4. Веселовский В.П. Формы люмбоишиальгии (клинико–экспериментальное, электрофизиологическое, биохимическое и биофизическое обоснование) – Казань, 1977. – дисс. соиск. д.м.н. – 427 С.
5. Есин Р.Г. Миогенная боль, центральные и периферические механизмы, терапия – 2006 – Казань дисс. докт. мед. наук. – 224 С.
6. Иваничев Г.А. Миофасциальная боль – Казань, 2007 – 392 С.
7. Кукушкин М.Л. Невропатическая боль у пациентов с хроническими болями в спине// Боль – 2008 – N3 – C.46–51.
8. Левин О.С., Мосейкин И.А. Эффективность габапентина при дискогенной пояснично–крестцовой радикулопатии //Журн. неврологии и психиатрии им. С.С.Корсакова – 2009 – N12 – C.60–65.
9. Лиев А.А. Варианты и формы вертеброгенных миофасциальных люмбоишиалгических синдромов // Автореф. дисс. … докт. мед. наук – Казань, 1995
10. Мелкумова К.А., Подчуфарова Е.В., Яхно Н.Н. Особенности когнитивных функций у пациентов с хронической болью в спине.// Журнал неврологии и психиатрии им. С.С.Корсакова. – 2009. – N.11. – C. 20–24.
11. Павленко С.С., Денисов В.Н., Фомин Г.И. Организация медицинской помощи больным с хроническими болевыми синдромами. – Новосибирcк.– 2002. – 221 с.
12. Подчуфарова Е.В., Н.Н.Яхно. Боль в спине– Москва«ГОЭТАР–Медиа»– 2010 – 368 С.
13. Попелянский Я.Ю. Ортопедическая неврология. – Т.1,2. – Казань, 1997.
14. Тревел Д.Г., Симонс Д.Г. Миофасциальные боли /пер. с англ. Москва, «Медицина»,1989, Т. 1–2.
15. Хабиров Ф.А. Руководство по клинической неврологии позвоночника. – Казань, «Медицина», 2006 – 518 С.
16. Черненко О.А, Ахадов Т.А., Яхно Н.Н. Соотношение клинических данных и результатов магнитно–резонансной томографии при болях в пояснице// Неврол. Журн. – 1996 – T.2. – C.12–16.
17. Эрдес Ш.Ф. и соавт. Неспецифическая боль в нижней части спины. Клинические рекомендации для участковых терапевтов и врачей общей практики, Москва, 2008 «КомплектСервис» – 70 С.
18. Яхно Н.Н., Подчуфарова Е.В.. Новые нестероидные противовоспалительные препараты в лечении острой боли в нижней части спины // Врач. – 2007. – №1. – С.47–51
19. Alexiev A.R. Some differences in the electromyographic erector spinae activity between normal subjects and low back pain patients during the generation of isometric trunk torque // Electromyogr Clin Neurophysiolog – 1994 – Vol.34 – P.495–499
20. Apkarian A., Robinson J.Low back pain // IASP Pain Clinical Updates – 2010 – Vol.XVIII, N.6.– P.1–6
21. Battie M., Videman T., Levalahti F. et al. Heritability of low back pain and the rple of disk degeneration // Pain – 2007 – Vol.131. – P.272–280
22. Berg J., Fellier H., Christoph T. et al. The analgesic NSAID lornoxicam inhibits cyclooxygenase (COX)–1/–2, inducible nitric oxide synthase (iNOS), and the formation of interleukin (IL)–6 in vitro // Inflammation Research. – 1999. – Vol.48. – P.369–379.
23. Boden S., Davis D., Dina T. Abnormal magnetic–resonance scans of lumbar spine in asymptomatic subjects // J Bone Joint Surg Am – 1990 – Vol.72. – P.403–408
24. Breivik Н., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment //European Journal of Pain – 2006 – Vol.10. – P. 287–333
25. Carragee E, Alamin T, Cheng I et al. Does minor trauma cause serious low back illness? // Spine – 2006 – Vol.1;31(25):2942–2049
26. Cholewicki J., Silfies S.P., Shah R.A. et al. Delayed trunk muscle reflex responses increase the risk of low back injuries // Spine – 2005. – Vol. 30. – P. 2614–2620.
27. Chou R., Qaseem A, Owens D. Diagnostic Imaging for Low Back Pain: Advice for High–Value Health Care From the American College of Physicians // Ann Intern Med. 2011;154:181–189.
28. Cohen M.J., Swanson G.A., Naliboff B.D. Comparison of electromyographic response patterns during posture and stress tasks in chronic low back pain patients and control // J Psychosom Res – 1986 – Vol.30. – P.135–141.
29. Creed F. Somatization and Pain Syndromes // Functional Pain Syndromes: presentation and pathophysiology Ed by Mayer E., Bushnell C.– IASP PRESS Seatle – 2009 – 227–245
30. Dillingham T. Evaluation and management of low back pain: and overview. State of the Art Reviews 1995;9(3):559–74
31. Dionne C.E. Psychological disteress confirmed as predictor of long–term back–related functional limitations in primary care settings// Journal of clinical epidemiology. – 2005. – N7. – P. 714–718.
32. Greene H., Cholewicki J., Galloway M.T. et al. A history of low back injury is a risk factor for recurrent back injuries in varsity athletes// Am J Sport Med – 2001 – Vol.29 – P.795–800.
33. Gregory D.S., Seto C. K. , Wortley G.C. Acute lumbar disk pain: navigating evaluation and treatment choices // Am Fam Physician –2008–Vol. 78(7) –P.835–842
34. Haldeman S, Dagenais S. A supermarket approach to the evidence–informed management of chronic low back pain. Spine J 2008;8(1):1–7.
35. Hides J.A., Jill G.A., Richardson C.A. Long term effects of specific stabilizing exercises for first episode low back pain // Spine – 2001 – Vol.26. – P.243–248.
36. Hodges P. Changes in sensorimotor control in low back pain / Fundamentals of musculosceletal pain ed. by Graven–Nielsen T., Arendt–Nielsen L., Mense S. – 2008. – IASP Press – Seattle – P.445–453
37. Kinkade S. Evaluation and treatment of acute low back pain. Am Fam Physician // 2007;75:1181–8, 1190–2.
38. Manchikanti L, Pampati V, Fellows B, Bakhit CE: Prevalence of lumbar facet joint pain in chronic low back pain // Pain Physician – 1999– Vol. 2 –P.59–64.
39. Manchikanti L., Pampati V., Fellows B., Bakhit C.E.: The diagnostic validity and therapeutic value of lumbar facet joint nerve blocks with or without adjuvant agents // Curr Rev Pain – 2000– Vol. 4 –P.337–344
40. Markova T., Dhillon B.S., Martin S.I.Treatment of Acute Sciatica // American Family Physician – 2007 – Vol 75, N. 1 – P.99–100
41. Mense S., Hoheisel U. Mechanisms of central nervous hyperexitability due to activation of muscle nociceptors / Fundamentals of musculoskeletal pain ed. by Graven–Nielsen T., Arendt–Nielsen L., Mense S. – 2008. – IASP Press – Seattle – P.61–73.
42. National Institute for Health and Clinical Excellence http://www.nice.org.uk/nicemedia/live/11887/44345/44345.pdf
43. Peul W.C., van Houwelingen H.C., van den Hout W.B. The Hague Spine Intervention Prognostic Study Group , et al: Surgery versus prolonged conservative treatment for sciatica // N Engl J Med – 2007 – Vol. 356. (22) – P. 2245–2256
44. Russell I.J. Myofascial pain syndrome and fibromyalgia syndrome in Raj's Practical Management of Pain, 4th ed. ed. H. Benzon: – 2008– Mosby Elsivier – Philadelphia – 1319 P.
45. Simons D.G. The Dead Horse, Like the Phoenix, Is Arising– // Pain Med –2008 – Vol.9(4) – P/469–470
46. Treede R.D., Jensen T.S., Campbell J.N. et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes // Neurology –2008 – Vol.70 – N.18 – 1630–1635
47. Van Boxem K., Cheng J., Patijn J. Evidence–Based Interventional Pain Medicine according to Clinical Diagnoses Lumbosacral Radicular Pain // Pain Practice, 2010 – Vol. 10. – Issue 4 – P. 339–358
48. van Tulder M, Becker А., Bekkering T. et al. European guidelines for the management of acute nonspecific low back pain in primary care // Eur. Spine J. – 2006. – Vol.15. – suppl. 2. – S.169–191.
49. Van Zundert J., Van Boxem Koen , Joosten E.A. Clinical trials in interventional pain management: Optimizing chances for success? – Pain – 2010 – Vol. 151 – P. 571–574
50. Von Korff, Deyo R.A, Cherkin D. et al. Back pain in primary care: outcomes at one year // Spine. – 1993 – Vol. 18 – N.7. – P.855–862
51. Waddell G. The back pain revolution eds. by – 2nd ed. – Edinburgh: Elsevier, 2004 – www.elsevierhealth.com
52. Yakhno N., Guekht A., Skoromets A. et al. Analgesic efficacy and safety of lornoxicam quick–release formulation compared with diclofenac potassium. Randomised, double–blind trial in acute low back pain // Clin Drug Invest. – 2006. – Vol.26. – P.267–277.












