
Патофизиология менструальной мигрени
Данные фундаментальных исследований, проведенных в последние годы, позволили во многом понять патофизиологию менструальной мигрени. Половые гормоны (эстроген, прогестерон, тестостерон) в значительной степени влияют на функцию мозга. Эстрогены могут модулировать нейрональную активность через эстрогенные рецепторы, широко представленные в центральной нервной системе (ЦНС), особенно в гипоталамусе [9].Эстрадиол синтезируется в нейронах различных областей головного мозга, которые участвуют в патогенезе мигрени. Так, уровень эстрогенов повышен в области таламуса, имеющей повышенную чувствительность к проведению болевых стимулов при мигрени, прилежащем ядре, регулирующем обеспечение механизма эмоционального подкрепления, миндалине, участвующей в развитии тревоги и страха [10–13]. Модулируя активность этих областей, эстрогены могут вызывать такие симптомы мигрени, как аллодиния, изменения настроения, нарушения пищевого поведения. Кроме этого, серотониновые нейроны среднего мозга, имеющие проекции в лобные доли, лимбическую, диэнцефальную области, спинной мозг и регулирующие как настроение, так и проведение боли, содержат рецепторы и к эстрогену и к прогестерону [14]. Полиморфизмы гена эстрогена ESR-1 594G>A и 325C> G увеличивают риск мигрени на 40–60% [15], а полиморфизмы CYP19A1 rs10046 и CYP19A1 rs4646 ароматазы, катализирующей синтез эстрогенов, увеличивают и уменьшают риск мигрени соответственно [16].
Прогестерон также широко представлен в ЦНС и, по-видимому, имеет противоположные эстрогену эффекты. Так, прогестерон обладает противосудорожным эффектом [17].
Предполагается, что тестостерон обладает противомигренозной активностью. Так, синтетические дериваты тестостерона улучшают течение мигрени как у мужчин, так и у женщин [18], видимо, через подавление распространяющейся корковой депрессии [19]. Кроме этого, распространенность мигрени выше среди гомосексуальных мужчин, у которых снижен уровень тестостерона, по сравнению с гетеросексуальными мужчинами (15,5% и 7,2% соответственно) [20].
Исследования половых гормонов при мигрени вызывают несомненный интерес. Так, у пациенток с «чистой» менструальной мигренью по сравнению со здоровыми лицами отмечается повышение уровня эстрогена и прогестерона во все фазы менструального цикла, особенно в лютеиновую фазу [21]. Исходя из этих данных, можно предположить, что при мигрени имеет место дисфункция гипоталамуса, не только продуцирующего половые гормоны и кортизол, но и регулирующего циркадные ритмы. Это подтверждает недавно проведенное нейровизуализирующее исследование А. May, которое показало, что «генератором» приступа мигрени является дисфункция гипоталамуса и его связей с субкортикальными и стволовыми структурами [22]. Каким образом половые гормоны могут быть связаны с приступом мигрени?
Гипоталамус продуцирует гонадотропный рилизинг-гормон, который выделяется с определенной периодичностью (рис. 1). Частота выделения гонадотропного рилизинг-гормона выше в фолликулярную фазу и период овуляции, тогда как в лютеиновую фазу отмечаются наибольшие колебания уровня этого гормона [23]. Эстроген регулирует выделение гонадотропного рилизинг-гормона по принципу отрицательной обратной связи. Гонадотропный рилизинг-гормон регулирует гормональные колебания во время цикла – пик эстрогена в позднюю фолликулярную фазу и пик прогестерона в середине лютеиновой фазы через повышение уровня лютеинизирующего и фолликулостимулирующего гормонов в середине цикла (день 14). Уровни половых гормонов (эстроген и прогестерон), а также их рилизинг-факторов – лютеинизирующего и фолликулостимулирующего гормонов падают к 28-му дню цикла (перед началом менструации) (см. рис. 1). Далее, в последующие 7 дней, эстроген и прогестерон находятся на стабильном низком уровне, тогда как с 14-го по 28-й день цикла уровни гормонов изменяются волнообразно. Эти волнообразные колебания половых гормонов в середине лютеиновой фазы приводят к повышению нейрональной возбудимости. Нейрональная возбудимость возрастает во время пиков эстрогенов – овуляторного и в середине лютеиновой фазы [24].
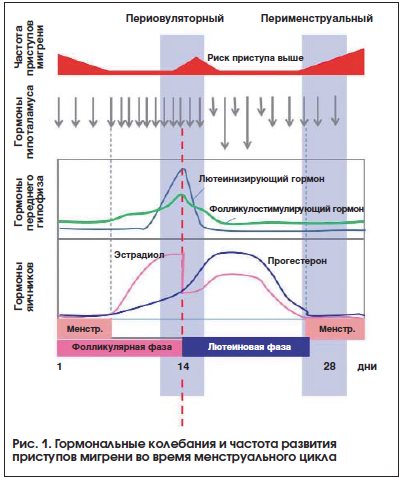
Эстрогены способны влиять на проведение боли на всех уровнях: на уровне твердой мозговой оболочки [25], тройничного нерва [26], тригеминального ганглия [27], тригеминального ядра [28], таламуса [29], корковых систем [30], а также нисходящих модулирующих систем [31]. Данные преклинических исследований показывают, что эстрогены играют важную роль в регуляции сенситизации тригеминальных нейронов через непосредственную активацию кальцитонин ген-родственного пептида [25]. В исследовании В. Barbosa Mde et al. были исследованы пороги болевой чувствительности у женщин в различные фазы менструального цикла (менструальную, фолликулярную, овуляторную, лютеиновую, предменструальную) [32]. Самые низкие пороги боли отмечались в предменструальную фазу. Еще одним фактором, обусловливающим развитие и клинические особенности менструальной мигрени, является дисфункция высших центров восприятия боли. N. Maleki et al. при помощи функциональной нейровизуализации было показано, что у женщин, страдающих мигренью, имеется повреждение париетальной коры (precuneus) и островка, по сравнению с мужчинами с такой же клинической картиной мигрени [33]. С учетом того, что половые гормоны могут повреждать нейрональные круги, регулирующие эмоции [34], можно предположить, что различные ответы на болевые стимулы у мужчин и женщин связаны именно с повреждением этих нейрональных кругов [35].
Клиническая картина менструальной мигрени
Менструальная мигрень имеет клинические особенности. Согласно анализу дневников, наиболее часто у большинства пациенток приступ мигрени возникает во 2–3-й дни менструации [36]. Как популяционные, так и клинические исследования показывают, что приступы менструальной и менструально-ассоциированной мигрени более интенсивные, более продолжительные, чаще сопровождаются тошнотой и рвотой, в большей степени дезадаптируют пациенток и хуже откликаются на лечение [5, 37–39]. Приступы, которые возникают за 2 дня до начала менструаций, – с самым высоким уровнем интенсивности. Вероятность их более высокой интенсивности в 2,1 раза выше, чем у приступов, развивающихся в первые 3 дня менструации, и в 3,4 раза выше, чем у мигренозных атак, отмечающихся в другие фазы цикла [40].Лечение менструальной мигрени
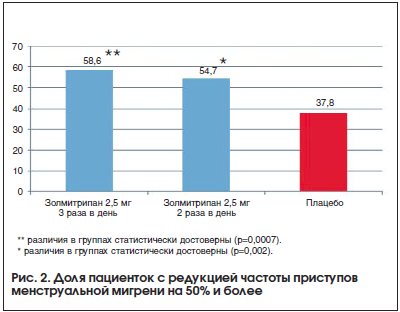
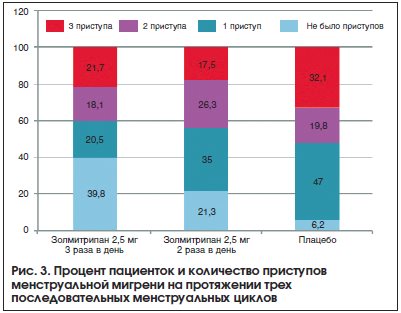
Лечение менструальной мигрени складывается из купирования приступов и профилактики. Для купирования менструальной мигрени могут использоваться те же препараты, что и для неменструальной мигрени, однако имеются определенные особенности. Поскольку приступы протекают гораздо тяжелее и хуже откликаются на терапию, то рекомендовано начинать терапию сразу с триптанов. Доказанным эффектом для снятия приступа менструальной мигрени обладают суматриптан [38], золмитриптан [41], олмотриптан [42], ризатриптан [36], наратриптан [36]. Наиболее изучены эффекты золмитриптана. Так, в рандомизированное проспективное параллельное двойное слепое плацебо-контролируемое исследование вошли 579 пациенток. Купирование или значительный регресс головной боли через 2 ч после приема отмечался у 48% пациенток, принимавших золмитриптан, и 27% пациенток, принимавших плацебо (р<0,0001) [41]. В данном исследовании золмитриптан превосходил плацебо уже через 30 мин после приема препарата.Профилактическая терапия менструальной мигрени может проводиться по тем же правилам, что и при неменструальной мигрени, а может быть краткосрочной, т. е. назначаться только в перименструальный период. Краткосрочная профилактика в большей степени подходит для истинной менструальной мигрени и рассматривается в случаях, когда триптаны неэффективны для купирования атак. Препарат для краткосрочной профилактики назначается за 2–3 дня до планируемого наступления менструации на 5–6 дней. Напроксен показал эффективность в небольшом открытом исследовании [43], однако в двойном слепом плацебо-контролируемом исследовании преимуществ по сравнению с плацебо получено не было [44]. Был показан эффект некоторых триптанов: суматриптана, золмитриптана, наратриптана и фроватриптана. Наиболее доказательным было исследование с золмитриптаном (рис. 2). Так, при приеме 2,5 мг золмитриптана 3 раза в день редукция приступов менструальной мигрени наполовину и более происходила у 58,6% пациенток, а при приеме 2,5 мг золмитриптана 2 раза в день – у 54,7%. Также при приеме золмитриптана происходило снижение количества приступов менструальной мигрени в трех последовательных менструальных циклах (рис. 3) [45]. В настоящее время пациенткам с менструальной мигренью может быть рекомендован доступный российский препарат Мигрепам.
Для краткосрочной профилактики также может быть использован эстрадиол (трансдермальный гель) в дозе 1,5 мг, назначаемый за 2 дня до начала планируемой менструации на 7 дней [46]. Существуют данные об эффективности приема пероральных препаратов магния, начиная с 15-го дня и до окончания менструации [28].
Если у пациенток менструально-ассоциированная мигрень или нерегулярный цикл, то лучше использовать постоянную профилактическую терапию бета-блокаторами, антиконвульсантами, антидепрессантами. При менструальной мигрени возможна также постоянная профилактика гормональными препаратами. Так, использование трансдермальных контрацептивов на протяжении 84 дней позволяло снизить количество дней с менструальной мигренью [46].












