Среди неврологических осложнений соматических заболеваний полинейропатический синдром занимает ведущее место. Нередко именно с поражением периферической нервной системы (ПНС) связаны ограничение трудоспособности и инвалидизация различных категорий больных и, как следствие, – нарушение качества их жизни. Симптомы полинейропатий обусловлены одновременным поражением большего или меньшего количества периферических нервов. Большое число нозологических форм полинейропатий объясняется тем, что, по сути, это заболевание – проявление системного поражения ПНС при различных неблагоприятных условиях [1].
Диабетические нейропатии являются самым частым вариантом соматических нейропатий. Поражение ПНС у больных сахарным диабетом (СД) встречается в 20–40% случаев. Уремическая нейропатия возникает при хронической почечной недостаточности. Нейропатии при системных заболеваниях обусловлены в первую очередь васкулитом. Среди заболеваний этой группы нейропатии наиболее часто встречаются при узелковом периартериите (у 25% больных) и ревматоидном артрите (у 10% пациентов).
Алкогольная полинейропатия по частоте занимает второе место после диабетической нейропатии среди соматических нейропатий. Клинические проявления поражения периферического отдела нервной системы у пациентов, страдающих алкоголизмом, возникают, по данным различных авторов, в 12,5–29,6% случаев. Многие лекарства имеют нейротоксичные побочные эффекты, среди которых наиболее частым является поражение ПНС (полинейропатии). Классическим вариантом лекарственной нейропатии является изониазидная полинейропатия. Эта сенсомоторная нейропатия возникает как следствие дефицита витамина В6, вызванного изониазидом у лиц с генетически детерминированным нарушением метаболизма данного витамина. Назначение совместно с изониазидом пиридоксина позволило практически избавить больных туберкулезом от данного вида нейропатии.
Некоторые лекарственные препараты, используемые для лечения угрожающих жизни состояний, при онкологических заболеваниях, ВИЧ-инфекции, в качестве побочных эффектов вызывают развитие нейропатий.
Клиническая картина полинейропатий зависит от того, какие волокна вовлекаются в процесс и какие морфологические изменения в них развиваются. Как известно, существуют три типа волокон: двигательные, являющиеся толстыми миелинизированными; чувствительные (волокна, проводящие глубокую чувствительность, также толстые миелинизированные; волокна, проводящие болевую и температурную чувствительность – тонкие миелинизированные и немиелинизированные); вегетативные, которые являются тонкими немиелинизированными. Морфологические изменения, возникающие при полинейропатиях, характеризуются либо демиелинизацией, либо аксональной дегенерацией, либо их сочетанием. Демиелинизация развивается при аутоиммунных процессах, в возникновении аксональной дегенерации участвуют токсико-дисметаболические, микроциркуляторные нарушения, а также нарушения энергетического метаболизма и повышение перекисного окисления липидов [1, 2].
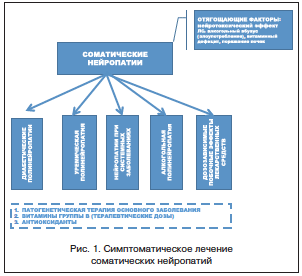
Основой терапии является лечение основного заболевания, приведшего к развитию нейропатии. В редких случаях успешная компенсация основного заболевания приводит к спонтанному регрессу нейропатии. Другим важным направлением лечения полинейропатии является воздействие на известные звенья патогенеза и дополнительные факторы, влияющие на течение нейропатии: витаминотерапия (витамины группы В), вазоактивные препараты, антиоксидантная терапия. Отдельного внимания заслуживает симптоматическое лечение, в основном направленное на коррекцию болевого синдрома (рис. 1).
Клинико-фармакологическое обоснование применения витаминов группы В для лечения болевого синдрома
В экспериментальной работе по изучению эффектов комбинации витаминов В1, В6 и В12 при болях показано ингибирование ноцицептивных ответов, вызванных формальдегидом, не меняющееся после введения налоксона. Выдвинуто предположение, что антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов [3]. Было показано, что комплекс витаминов группы В усиливает действие норадреналина и серотонина – главных антиноцицептивных нейромедиаторов. Кроме того, в эксперименте обнаружено подавление ноцицептивных ответов не только в заднем роге, но и в зрительном бугре. Также выявлено, что комплекс витаминов группы В в высоких терапевтических дозировках способен усиливать антиноцицептивные эффекты неопиоидных анальгетиков в исследовании защитных рефлексов.
В эксперименте изучено потенцирование антиноцицептивного эффекта диклофенака витаминами группы В на модели каррагенин-индуцированной гипералгезии в тесте сдавления крысиного хвоста. Было показано, что только высокие дозы комплекса витаминов (667 мг/кг – B1 и B6, 6,7 мг/кг – B12) обладали собственной ноцицептивной активностью. Тем не менее, более низкие дозы (100–250 мг/кг – B1 и B6, 1–2,5 мг/кг – B12) дозозависимо потенцировали антиноцицептивную активность диклофенака. В этой экспериментальной модели показано, что назначение витаминов группы В одновременно с диклофенаком позволяет снизить дозы нестероидных противовоспалительных препаратов (НПВП), не уменьшая их эффективность [4].
В Мексике проведено исследование по изучению синергического взаимодействия между диклофенаком и витаминами группы В (100:100:1 B1, B6 и B12 соответственно) на модели формалинового теста у крыс. Диклофенак (0,31–316 мг/кг), витамины группы В (32–178 мг/кг) или комбинация витаминов и диклофенака назначались перорально, и изучался антиноцицептивный эффект. В результате было показано, что пероральное назначение диклофенака и витаминов группы В обладает синергическими свойствами по уменьшению воспалительной боли и может применяться у пациентов клинически [5].
Клинико-фармакологическое обоснование применения витаминов группы В в комбинации с НПВП для лечения болевого синдрома
Фармакокинетический компонент в действии лекарственных препаратов не отличается значительной специфичностью и в большей степени способен поддаваться регулирующим воздействиям по сравнению с фармакодинамическим компонентом, который жестко детерминирован химической структурой вещества [6].
Важнейшим элементом фармакокинетики является биотрансформация, которая во многих случаях определяет выраженность фармакологического эффекта вещества и его токсичность, т. к. может привести как к образованию биологически неактивных метаболитов, так и к появлению активных и реакционноспособных метаболитов. Особенно важное значение имеют процессы биотрансформации для проявления эффекта диклофенака и других ненаркотических анальгетиков. Одной из задач фармакологии является целенаправленный поиск индукторов и ингибиторов биотрансформации лекарственных веществ, модуляторов биологической активности ксенобиотиков.
Для целенаправленной регуляции биотрансформации лекарственных веществ наиболее пригодны природные регуляторы-витамины и коферменты, которые являются естественными компонентами внутренней среды, отличаются безвредностью и физиологичностью действия.
В отдельных исследованиях была установлена возможность участия витаминов в процессах биотрансформации ксенобиотиков, причем действие витаминов может осуществляться классическим путем (т. е. через коферментные функции), а также, благодаря влиянию на структуру и функции мембран, на участки ферментативного сопряжения обмена витаминов и ксенобиотиков. Таким образом, витамины и коферменты могут выступать в роли средств регуляции биотрансформации и фармакологического действия лекарственных веществ. Биотрансформация является тем звеном фармакокинетики, воздействуя на которое можно влиять на эффективность проводимой терапии.
Недостаточность тиамина и его дополнительное введение оказывают значительное влияние на активность микросомальных ферментов метаболизма ксенобиотиков. В ряде экспериментальных работ продемонстрировано, что дополнительное введение тиамина оказывает тормозящее действие на активность микросомальных монооксигеназ и редуктаз.
Изучено влияние тиамина и его производных на активность цитохром-Р450-зависимых и флавинсодержащих монооксигеназ печени крыс. Было показано, что назначение тиамина (101 мг/кг/сут, внутрибрюшинно, 6 сут) снижает активность NADPH-цитохром-С-редуктазы, метанол-О-деметилазы и содержание цитохрома b5. Введение бенфотиамина (115 мг/кг/сут, внутрижелудочно, 6 сут) приводило к активации NADPH-оксидазы и флавинсодержащих монооксигеназ (субстрат имипрамин). Назначение тиохрома (25 мг/кг/сут, внутрибрюшинно, 6 сут) вызывало ингибирование NADH-специфичной микросомальной электрон-транспортной цепи, этилморфин-N-деметилазы и значительную активацию флавинсодержащих монооксигеназ (субстраты имипрамин, триметиламин, N,N-диметиланилин) в микросомальной фракции печени крыс. Учеными установлена достоверная корреляционная взаимосвязь между скоростью окисления NADPH-оксидазы в присутствии тиамина и скоростью окисления NADPH в присутствии субстратов флавинсодержащих монооксигеназ – имипрамина, триметиламина и N,N-диметиланилина. Таким образом, были получены экспериментальные данные о том, что флавинсодержащие монооксигеназы печени участвуют в биотрансформации тиамина и его производных [7].
Тиамин и его производные оказывают ингибирующее действие на активность ферментов метаболизма ксенобиотиков, причем деметилазная и гидроксилазная активности угнетаются более значительно, чем другие ферменты. Наиболее выраженным ингибирующим действием по отношению к микросомальным монооксигеназам обладали фосфорилированные производные тиамина – тиаминмонофосфат и, в особенности, – тиаминдифосфат (ТДФ). Эффект ТДФ проявлялся даже в минимальных концентрациях, а большие концентрации препарата практически полностью тормозили активность гидроксилазы и деметилазы. Значительным ингибирующим действием обладал и тиаминбромид. NADH-редуктаза оказалась более устойчивой к действию тиамина и его производных. Г-s-Г и АлДГ-ферменты, не связанные с микросомальными мембранами, практически не ингибировались под влиянием тиамина и его производных. Была выявлена особенность в действии тиамина и его производных на активность микросомальных ферментов. Их ингибирующее влияние оказывалось более сильным в том случае, если они прибавлялись к микросомам, выделенным из печени тиамин-дефицитных животных [8].
Результаты собственных исследований
С целью изучения влияния витаминов группы В на биотрансформацию диклофенака путем изменения активности ферментов метаболизма препарата были проведены экспериментальные электрохимические исследования. Исследовано влияние тиамина на активность цитохрома Р450 3А4. Показано, что тиамин не является субстратом этой формы цитохрома Р450 и блокирует (в концентрации 1,5 мМ) каталитические свойства цитохрома Р450 3А4 по отношению к диклофенаку. Поскольку молекула тиамина содержит азот с неподеленной парой электронов в составе пиримидинового гетероцикла и серу в составе тиазола, можно предположить, что тиамин взаимодействует с железом гема, ингибируя связывание кислорода. Кислород является косубстратом цитохрома Р450, участвуя в реакции монооксигенирования, поэтому отсутствие кислорода ингибирует каталитический цикл, где он связывается с восстановленным железом гема. Таким образом, тиамин можно отнести к неконкурентным по отношению к органическому субстрату (диклофенаку) обратимым ингибиторам. Результаты позволили предположить, что, ингибируя каталитическую активность цитохрома Р450 3А4 по отношению к диклофенаку, тиамин может замедлять метаболизм этого лекарственного препарата при совместном назначении.
В опытах с диклофенаком в качестве субстрата и пиридоксином (витамин В6) методом электрохимического анализа (КВВА) регистрировалось увеличение каталитического тока в присутствии пиридоксина (PR), а также наблюдалось отсутствие каталитической реакции с диклофенаком [9].
Таким образом, по результатам электрохимического анализа можно сделать вывод о влиянии витаминов группы В на активность цитохрома Р450 3А4, что в свою очередь может привести к изменению метаболизма НПВП, например диклофенака, при назначении в комплексной терапии с витаминами группы В.
В связи с выявленным влиянием витаминов группы В (В1, и В6) на активность ферментов системы метаболизма и наличием клинического опыта, описанного в литературе по комплексному применению нагрузочных доз витаминов группы В одновременно с НПВП, и усилением при этом фармакодинамических эффектов последних нами были проведены фармакокинетические исследования при однократном разовом приеме диклофенака и однократном приеме диклофенака на фоне курсовой терапии с применением и без применения нагрузочных доз витаминов группы В.
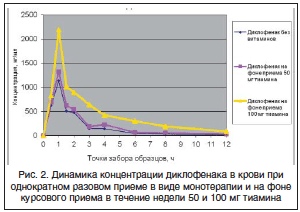
Во всех трех схемах приема диклофенака (прием только диклофенака, прием препарата на фоне 50 мг тиамина и прием препарата на фоне 100 мг тиамина) максимальное значение его концентрации в крови было достигнуто через 1 ч после приема. В случае использования диклофенака без витаминов оно составило 1137,2±82,4 нг/мл. При приеме на фоне 50 мг тиамина максимальная концентрация составила 1326,7±122,5 нг/мл, а при приеме на фоне 100 мг тиамина – 2200,4±111,3 нг/мл. При этом было получено, что величина значения максимальной концентрации диклофенака при однократном разовом приеме статистически достоверно ниже величины значения максимальной концентрации при приеме диклофенака на фоне курсового применения как 50, так и 100 мг тиамина (рис. 2).
Полученные нами данные подтверждаются исследованиями зарубежных ученых, в которых применяли уменьшенную дозу диклофенака в количестве 75 мг/сут. Из 45 больных, закончивших терапию досрочно после 3–4 дней в связи с полным регрессом болевого синдрома, 30 принадлежали к группе комбинированной терапии, а 15 – группе монотерапии диклофенаком (р<0,05) [10].
В другом контролируемом исследовании комбинированного применения диклофенака (50 мг) и комплекса витаминов группы В (В1 – 50 мг, В6 – 50 мг, В12 – 0,25 мг) на протяжении 2 нед. было показано, что 29 пациентов досрочно прекратили лечение в связи с полной регрессией боли. Из них 65% пациентов получали комбинированную терапию, а 35% – только диклофенак. Отмечено также, что в комбинированной группе уже через 3 дня лечения уменьшилась острота боли по субъективному отчету больных [11].
Таким образом, роль витаминов группы В в усилении обезболивающего эффекта НПВП очевидна. Приведенные результаты исследований подтверждают целесообразность применения витаминов группы В в нагрузочных дозах одновременно с НПВП для более эффективного обезболивания при нейропатии, а также с целью повышения безопасности проводимой фармакотерапии, т. к. делают возможным использование более низких доз НПВП с неменьшей эффективностью.
В комплексной фармакотерапии боли одновременно с НПВП с успехом, особенно в острой ситуации, может быть использован препарат Витаксон, который предназначен для инъекционного применения. Действующими веществами являются: тиамина гидрохлорид, пиридоксина гидрохлорид, цианокобаламин. 1 мл раствора содержит тиамина гидрохлорида в пересчете на 100% безводное вещество – 50 мг, пиридоксина гидрохлорида в пересчете на 100% сухое вещество – 50 мг, цианокобаламина в пересчете на 100% сухое вещество – 0,5 мг. Препарат показан к применению в комплексной терапии следующих заболеваний: нейропатическая боль, вызванная полинейропатией (в т. ч. диабетической и алкогольной); невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия); болевой синдром, вызванный заболеваниями позвоночника (дорсалгия, люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника). В целях быстрого достижения высоких плазменных концентраций при тяжелых и острых болевых состояниях в течение первых дней препарат вводят по 2 мл/сут. По мере стихания состояния и в более легких случаях – по 2,0 мл 2–3 раза в неделю.
Нейротропные эффекты витаминов группы В
При любом тяжелом соматическом и/или длительно текущем соматическом заболевании, особенно при его декомпенсации, развиваются нарушения в обмене водорастворимых витаминов (тиамина, пиридоксина, рибофлавина, никотиновой и пантотеновой кислот) и соответствующих коферментов (тиаминпирофосфата, НАД, кофермента А и др.). В ПНС недостаток коферментов приводит к нарушению окислительного фосфорилирования и нарастанию дефицита энергии, при этом накапливаются пировиноградная и молочная кислоты, страдает целостность миелиновой оболочки периферических нервных окончаний [12].
Активные компоненты, входящие в состав препарата Витаксон, являются нейротропными витаминами.
Витамин В1 (тиамин) играет ключевую роль в энергообеспечении организма. При нарушениях углеводного обмена, наблюдаемых при СД, потребность в этом витамине возрастает, и создаются условия для развития его дефицита. У животных с экспериментальным СД высокие дозы тиамина предупреждают развитие диабетической кардиомиопатии за счет подавления пути биосинтеза гексозамина. Возрастание потребления белка, на практике наблюдаемое у больных СД, приводит к увеличению потребности в витамине В6. Пиридоксальфосфат играет жизненно важную роль в функционировании около 100 ферментов, которые катализируют необходимые химические реакции в организме человека. Например, пиридоксальфосфат функционирует в качестве кофермента для гликоген-фосфорилазы – фермента, который катализирует высвобождение глюкозы из гликогеновых депо. Большая часть пиридоксальфосфата в человеческом организме находится в мышцах, связанная с гликоген-фосфорилазой. Пиридоксальфосфат является также коферментом для реакций глюконеогенеза – генерации глюкозы из аминокислот [12]. Синтез нейромедиатора серотонина из аминокислоты триптофан катализируется пиридоксальфосфат-зависимым ферментом. Другие нейромедиаторы, такие как допамин, норэпинефрин и гамма-аминомасляная кислота, также синтезируются при участии пиридоксальфосфат-зависимых ферментов.
Неврологические симптомы дефицита витамина В12 включают в себя онемение и покалывание в руках и, чаще, в ногах, трудности при ходьбе, потерю памяти, дезориентацию, слабоумие с изменением настроения или без. Как правило, прогрессирование неврологических осложнений происходит постепенно. Неврологические симптомы не всегда обратимы при лечении дефицита витамина В12, особенно если они присутствовали в течение длительного времени. Неврологические осложнения в 25% случаев являются единственным клиническим симптомом дефицита витамина В12. Как известно, дефицит витамина В12 ведет к повреждению миелиновой оболочки черепных, спинномозговых и периферических нервов [12].
Назначение комбинации нейротропных витаминов широко практикуется для лечения полинейропатий различной этиологии. Нейротропный комплекс оказался эффективным при диабетической нейропатии в отношении не только симптомов, но и функционального состояния нервных волокон. В другом рандомизированном плацебо-контролируемом исследовании назначение нейротропного комплекса витаминов группы В привело к достоверному улучшению по данным электронейромиографии состояния сенсорных и моторных нервных волокон. На фоне лечения была зафиксирована достоверная положительная динамика по сравнению с плацебо по результатам анализа вариабельности частоты сердечных сокращений, что свидетельствует о позитивном влиянии нейротропных витаминов на состояние автономной нервной системы [13].
Комбинация тиамина с пиридоксином вообще является традиционным компонентом терапии большинства неврологических заболеваний. Данное сочетание в течение многих десятилетий продолжает использоваться терапевтическими школами многих стран. И это является обоснованным, поскольку пиридоксин в качестве кофермента участвует в декарбоксилировании и переаминировании аминокислот, обмене фолиевой кислоты и фосфорилировании гликогена, синтезе g-аминомасляной кислоты, катехоламинов, гистамина, увеличивает внутриклеточные запасы магния, а также принимает участие в метаболизме жирных кислот. Как известно, дефицит пиридоксина может способствовать развитию осложнений СД.
Витамины В1, В6 и В12, входящие в состав препарата Витаксон, являются нейротропными, обеспечивают физиологическую структуру и функцию нервных клеток и препятствуют их повреждению при соматических заболеваниях.
Липоевая (тиоктовая) кислота
Патогенез полинейропатии различается в зависимости от этиологии. Так, в условиях гипергликемии снижение активности натрий-калиевой АТФ-азы способствует повышению внутриклеточного уровня натрия, что приводит к уменьшению скорости распространения возбуждения по нервному волокну и его структурным изменениям. А по мере накопления сорбитола прогрессирует осмотический отек аксонов и других структур нервной клетки, в результате чего стартуют дистальные симметричные сенсорные или моторные расстройства в конечностях. Алкоголь оказывает токсическое действие непосредственно на нервные стволы, хотя раньше считалось, что алкогольная полинейропатия связана с возникающим дефицитом витамина В1 и по природе своей напоминает таковую при болезни бери-бери [14].
И все же есть патогенетическое звено, которое в последнее время рассматривается как ведущее в формировании любой полинейропатии. В последние годы в неврологии все большее значение придается нарушению процессов перекисного окисления липидов – оксидантному стрессу, объясняющему патогенетические механизмы большинства острых и хронических дегенеративных, сосудистых и инфекционных заболеваний нервной системы, в т. ч. и полинейропатий.
Избыточное образование продуктов перекисного окисления оказывает повреждающее действие на уровне нейронов непосредственно или опосредованно, через нарушение интраневрального кровотока, поскольку эндотелий сосудов особенно чувствителен к их действию. Увеличение продукции свободных радикалов сопровождается снижением эффективности эндогенных антиоксидантных защитных систем. Патологические нарушения формируют замкнутый круг. Эндоневральная микроангиопатия и аксональная гипоксия ведут к усилению окислительного стресса, который в свою очередь может индуцировать нейроваскулярные дефекты. Важным направлением лечения таких пациентов является назначение препаратов с антиоксидантными свойствами. Они уменьшают продукцию свободных радикалов, ограничивая тем самым их повреждающее действие и предупреждая развитие патологического каскада реакций.
Липоевая (тиоктовая) кислота является мощным природным антиоксидантом, она инактивирует пероксид водорода, синглетный кислород, гидроксильный радикал, нитрооксидный радикал, гипохлорную кислоту, пероксинитрит и проявляет интактность в отношении пероксильного и супероксидного радикала.
В 1966 г. клиницисты Германии впервые начали использовать a-липоевую кислоту для лечения диабетической полинейропатии. Эффективность ее применения при данном заболевании доказана в ходе многочисленных крупномасштабных исследований – ALADIN I-III, DEKAN, ORPIL, SYDNEY, NATHAN II. Метаанализ результатов этих испытаний, включающий данные 1258 больных СД, с высокой степенью достоверности показал, что кратковременное внутривенное введение 600 мг/сут тиоктовой кислоты в течение 3 нед. уменьшает выраженность симптомов диабетической полинейропатии, а пероральный прием препарата в течение 4–7 мес. – диабетической полинейропатии и кардионейропатии. Данные об эффективности и профиле безопасности позволяют рассматривать a-липоевую кислоту как препарат первой линии патогенетически ориентированной терапии диабетической полинейропатии [15].
Необходимо акцентировать, что a-липоевая кислота относится к группе тиоловых антиоксидантных препаратов, способных активировать процессы биосинтеза восстановленного глутатиона – основного компонента систем детоксикации и антирадикальной защиты. a-липоевая кислота ингибирует экспрессию провоспалительных цитокинов, адгезивных молекул и препятствует адгезии лимфоцитов к эндотелию сосудов.
Таким образом, препараты a-липоевой кислоты обладают антиоксидантными и противовоспалительными свойствами и могут быть использованы в качестве патогенетической терапии при лечении практически всех соматообусловленных полинейропатий, в т. ч. и при демиелинизирующих процессах в ПНС.
Представляет интерес препарат Нейролипон, который выпускается в виде концентрата для приготовления раствора для инфузий и в виде капсул. 1 мл раствора препарата Нейролипон содержит 30,0 мг тиоктовой кислоты в виде меглюмина тиоктата; 1 капсула содержит 300 мг тиоктовой кислоты. Препарат применяется для лечения диабетической и алкогольной полинейропатии. Внутривенно препарат применяют у взрослых в дозе 600 мг/сут (в тяжелых случаях – до 1200 мг). Вводят медленно – не более 50 мг тиоктовой кислоты (1,7 мл раствора для инфузий) в минуту. Курс лечения – от 2 до 4 нед. После этого переходят на поддерживающую терапию лекарственными формами тиоктовой кислоты для перорального приема в дозе 300–600 мг/сут на протяжении 1–3 мес. Для закрепления эффекта лечения курс терапии Нейролипоном рекомендуется проводить 2 раза в год.
В конце 2003 г. в клинике Института эндокринологии и обмена веществ им. В.П. Комисаренко были проведены клинические испытания нового препарата a-липоевой кислоты Диалипон, зарегистрированного на территории РФ как Нейролипон (регистрационный номер ЛП-001253).
Целью исследования была оценка эффективности и переносимости указанного препарата у больных СД, страдающих диабетической полинейропатией. Пациенты основной группы получали Нейролипон в виде внутривенных инфузий 3% раствора препарата (600 мг) в 100–200 мл 0,9% раствора натрия хлорида ежедневно 1 р./сут в течение 20 дней. Пациенты группы сравнения принимали другой препарат a-липоевой кислоты в виде внутривенных инфузий 600 мг по аналогичной схеме. В исследование включались пациенты с наличием выраженной периферической симметричной сенсомоторной полинейропатии (NDS-Score >5). Сопутствующая терапия не включала препараты, содержащие серу, и витамины группы В.
При оценке эффективности лечения в основной и группе сравнения было отмечено, что по всем показателям результаты лечения были сопоставимы. Кроме того, в основной группе отмечалась более эффективная коррекция сенсомоторных нарушений по шкале NDS (на 7–10-е сут терапии имело место достоверное снижение баллов с 8,4±0,3 до 7,4±0,4 (р<0,05)). В целом эффективность Нейролипона практически во всех случаях была оценена как высокая, т. к. улучшение показателей NSS и NDS составило от 40% до 80%.
Заключение
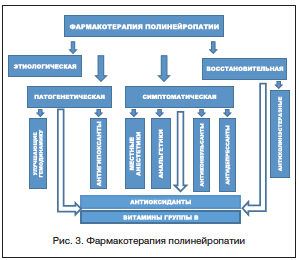
a-липоевая кислота и витамины группы В при применении их в терапевтических дозах с учетом рассмотренных механизмов действия, экспериментальных данных и результатов клинических наблюдений могут быть эффективно использованы при лечении полинейропатий, как в составе патогенетической терапии, направленной на коррекцию основных механизмов, приводящих к развитию болезни, так и в составе симптоматической и восстановительной терапии. Включение этих компонентов в медикаментозное лечение полинейропатий способствует повышению эффективности и безопасности лекарственной терапии (рис. 3).
Всестороннее изучение влияния факторов, обусловливающих эффективность фармакологического вещества, исследование характера взаимодействия с другими лекарственными препаратами лежит в основе оптимизации фармакотерапии полинейропатий различного генеза путем использования в комбинированной терапии витаминов группы В и a-липоевой кислоты.












