Резюме
В статье впервые представлены оригинальные свойства Фенотропила, позволившие сформулировать основные положения инновационной модуляторной концепции. Приведенные данные свидетельствуют о том, что активность Фенотропила, как модуляторного препарата, реализует базовые принципы модуляторной концепции: соразмерность, реверсивность, сопряженность и консолидация.
Анализ проведенных фундаментальных исследований доказывает наличие у Фенотропила как специфической – нейромодуляторной, так и универсальной – юнимодуляторной активности. Универсальное модуляторное действие препарата приобретает особую актуальность в аспекте возможности реализации широты спектра его клинико–фармакологического эффектов, позволяющей оптимизировать подходы к терапии различных заболеваний.
Выделение модуляторной активности как одного из базовых свойств фармакологических препаратов способствует решению назревшей к настоящему времени проблеме классификации лекарственных средств.
Ключевые слова: модуляция, модуляторная концепция, соразмерность, реверсивность, сопряженность, консолидация, фенотропил
Abstract
Modulator concept as an innovative trend
in medicine
R.V. Akhapkin1, V.I. Akhapkina2
1 The Serbsky State Research Center for Social and Forensic Psychiatry
2 «Valenta Pharmaceuticals»
The paper presents the original property of Phenotropil, which allowed formulating the fundamental principles of a modulator concept. The data suggest that the Phenotropil activity as modulator drug implements the basic principles of the modulator concept: commensurability, reversibility, coupling, and consolidation.
The analysis of the fundamental research proves the presence of a specific – neuromodulator , and universal – unimodulator activity of Phenotropil. The universal modulator effect of the drug is of particular relevance in the aspect of the feasibility of the wide range of its clinical and pharmacological effects, which allows optimizing the approaches to the treatment of various diseases.
Emphasizing the modulator activity as one of the basic properties of pharmaceuticals contributes to solving the urgent problem of the drugs classification.
Keywords: modulation, modulator concept, commensurability, reversibility, coupling, consolidation, Phenotropil
Модуляторная концепция, заявленная впервые В.И. Ахапкиной (2006) в специальном докладе на ХIII Российском национальном конгрессе «Человек и лекарство», определила третий (наряду со стимуляцией/активацией и подавлением/супрессией) основополагающий – модуляторный подход в терапии полиморфных регуляторных расстройств1 [2]. Согласно предлагаемой концепции, модуляторная активность (от лат. modulatio – мерность, размерность) – это соразмерное побуждение процессов и стимуляции, и подавления, их соразмерно консолидированное сопряжение и соразмерная реверсивность. Модуляторная концепция направлена на оптимизацию подходов к профилактике и лечению широкого спектра заболеваний, а также создает условия для современной интерпретации классификации лекарственных средств.
Долгое время стимуляция и подавление казались очевидными и единственными путями коррекции гипо– и гиперфункциональных состояний, позволяющими скомпенсировать недостаток какой–либо функции за счет ее активации, а избыток – путем подавления. Так, классическое представление о возбуждающей функции одних нейромедиаторов и тормозных свойствах других во многом предопределило взгляд на патогенез нервно–психических расстройств с точки зрения избыточности или недостаточности отдельных нейротрансмиттеров2. При этом действие психотропных средств сводилось либо к стимулирующей (психоаналептики), либо к затормаживающей (психолептики) активности. Эти положения оказались настолько устойчивыми, что анатомо–терапевтическо–химическая (АТХ) классификация лекарственных средств до сих пор использует устаревший дихотомический подход (психолептики/психоаналептики), несмотря на то, что современная нейронаука продвинулась далеко за его пределы.
На современном уровне знаний однонаправленность воздействия препаратов в пределах одной медиаторной системы не обеспечивает полноценного восстановления доболезненных функций ввиду отсутствия единственного патогенетического субстрата патологического состояния. Данная проблема актуальна не только в отношении нейротрансмиттеров, но и гормонов, факторов иммунитета или генов, которые пытаются представить единолично ответственными за те или иные заболевания [17]. Поиск альтернативных путей эффективной фармакотерапевтической коррекции должен учитывать сложность структурно–функциональной контекстуальности действия лекарственного вещества [20].
Результаты фундаментальных исследований последних десятилетий наглядно свидетельствуют, что передача и обработка информации в нервной системе не ограничивается прямой нейротрансмиссией. Открытие способности большинства моноаминергических и холинергических нейронов головного мозга выделять нейромедиаторы во внеклеточный матрикс [15,16,22], выявление нейроактивных свойств у пептидов, гормонов и других молекул, не являющихся трансмиттерами [10,31,34], а также обнаружение на нейронах разнообразных внесинаптических рецепторов [21,39,41] – все это привело, с одной стороны, к представлению о многообразии межнейрональных связей, а с другой – породило сложность в их дифференциации. При этом на протяжении длительного времени для обозначения подобных коммуникаций широко использовался не имеющий до сих пор общепризнанной дефиниции термин «нейромодуляция».
Понятие «модуляторного вещества» впервые предложено E. Florey (1967) для обозначения «любых соединений клеточного, но не синаптического происхождения, влияющих на возбудимость нервных клеток и являющихся связующим звеном в регуляторных механизмах деятельности нервной системы» [19]. Попытка разграничить нейротрансмиссию и нейромодуляцию, исключая способность модуляторного влияния синаптических веществ, характеризовала в большой степени действие нейрогормонов, чем нейромодуляторов в целом. Позднее нейромодуляцией стали обозначать способность нейрона изменять свои внутриклеточные и электрические свойства в ответ на синаптическую или гормональную стимуляцию [23,26]. Такая трактовка не позволяет в полной мере разделить два понятия – нейромодуляции и нейротрансмиссии, так как прямая синаптическая передача (т.е. нейротрансмиссия) также оказывает влияние на свойства нейрона, изменяя проводимость мембраны.
Дискуссионность взглядов на нейромодуляцию сохраняется вплоть до настоящего времени. Исследователи, считающие нейротрансмиссию первичным и основным путем сообщения между нейронами, рассматривают другие межнейрональные взаимодействия лишь как способ изменения первичного сигнала, сводя понятие нейромодуляции к модуляции синаптической передачи [13,24]. Альтернативная позиция заключается в широком представлении о нейромодуляции, как о любом вызванном выделением химических веществ межнейрональном взаимодействии, не являющимся быстрым, точечным и не приводящим к непосредственному возбуждению или торможению [25].
Одно из последних определений нейромодуляции базируется на ее возможности реализации исключительно посредством метаботропных трансмембранных рецепторов [35]. Несмотря на то, что изучение морфофункциональных особенностей такого типа рецепторов изменило теорию рецепторной передачи сигналов, преодолевшую путь от линейной модели к сетевой3 [27], нейромодуляция может реализовываться и с помощью ионотропных рецепторов, ассоциируемых в большинстве случаев с прямой нейротрансмиссией. Так, например, активация пресинаптических нейрональных н–холинорецепторов (nAChR), открывая ионный канал для тока ионов Са2+ внутрь терминали аксона, не приводит к возникновению потенциала действия или экзоцитозу нейротрансмиттера. Дополнительный приток Са2+ позволяет высвободить большее количество медиатора в случае прихода очередного потенциала действия в нервное окончание. В сущности, эффекты пресинаптических нейрональных nAChR изменяют состояние клетки, что соответствует классическому пониманию нейромодуляторного действия [28].
Сложность строгого размежевания понятий нейротрансмиссии и нейромодуляции в их традиционном понимании обусловлено, на наш взгляд, рядом причин.
Во–первых, разнообразие связей между нейронами представляет собой, по всей видимости, континуум коммуникационных форм, в котором относящиеся к нейротрансмиссии и нейромодуляции элементы часто пересекаются [25]. Нейромедиаторы могут выступать в роли нейромодуляторов и наоборот. Один и тот же тип рецепторов в одних случаях может реализовывать нейротрансмиссию, а в других – нейромодуляцию. Кроме того, процессы нейротрансмиссии и нейромодуляции происходят согласованно и являются взаимовлияющими. Так, модуляторное действие может изменить проводимость мембраны или свойства синапса, что приводит либо к затуханию, либо к возникновению потенциалов действия. Вместе с тем вызванное модуляторным действием накопление медиатора не окажет эффекта до тех пор, пока не произойдет активация синапса.
Во–вторых, все попытки противопоставления нейромодуляции и нейротрансмиссии до настоящего времени строились лишь на разнице характеристик (по способу, времени, локализации) однонаправленных коммуникативных связей, исходя из общности принципа дискретности передачи сигнала. В результате нейромодуляция продолжает так же рассматриваться как стимуляция или подавление, только опосредованные.
Представление о модуляции, на наш взгляд, невозможно без учета реципрокности регуляторных процессов. Если рассматривать все происходящие в организме реакции как следствие сопряженного взаимодействия активирующих и подавляющих процессов, то ответ нервной клетки в виде потенциала действия есть результат «борьбы противоположностей» возбуждающих и тормозных сигналов, полученных ею в момент времени. Следовательно, одним из универсальных значений модуляции является ее ведущая роль в распределении баланса между разнонаправленными силами, обеспечивающая вероятностность итога их взаимодействия. Иными словами, модуляция осуществляет триггерную функцию.
Другим важным свойством модуляции является обеспечение клеточной пластичности за счет широкой коммуникативной вариабельности, при которой межклеточные сигналы отличаются не только по интенсивности, времени и месту возникновения, но и по способности изменять свойства самих клеток. В свою очередь пластичность, обусловливая гибкость процессов саморегуляции на разных уровнях самоорганизации, реализует способность организма (как сложноорганизованной открытой системы [7,9]) к адаптации в динамичных условиях существования. Таким образом, модуляция выполняет и адаптационную функцию.
В контексте адаптационной системы болезнь для организма является нежелательным процессом самоорганизации, когда болезненные факторы значительно усиливают неравновесность и приводят к быстрому накоплению отклонений, которые не успевают устраняться системой саморегуляции, в результате чего происходит переход в новое – болезненное – структурно–функциональное состояние. Безудержный рост числа отклонений может полностью нарушить стабильность и целостность всей системы. Терапевтическое влияние на звенья саморегуляции лучше всего было бы осуществлять с помощью препаратов–модуляторов, поддерживающих саморегуляцию, а не прямых активаторов или подавителей нарушенных функций, так как последние, несмотря на оказываемый в какой–то момент терапевтический эффект, со временем сами усиливают нестабильность системы.
К модуляторам относятся вещества или комплексы веществ природного и синтетического происхождения, обладающие соразмерно побуждающей и соразмерно консолидирующей активностью.
Модуляторное действие принципиально отличается от простого стимулирующего или подавляющего влияния. Активность модуляторов проявляется в одних случаях преимущественно стимулирующим, а в других – преимущественно подавляющим влиянием на функцию/–и (показатель/–и) в зависимости от его/их исходного состояния в организме. Так, при гиперфункциональном состоянии будет обнаруживаться подавляющий эффект модуляторов, а при гипофункциональном – стимулирующий (принцип реверсивности), в отличие от простых стимуляторов/прессоров, чье действие характеризуется однонаправленностью. Некоторые стимуляторы/прессоры могут проявлять противоположные эффекты, однако эти эффекты зависят от дозы вещества (например, стимуляция при низких дозах, угнетение – при высоких), но не от исходного состояния организма.
Степень выраженности модуляторного действия также будет зависеть от величины исходного изменения, при этом вне зависимости от модальности модуляторной активности (будь то стимуляция или подавление) она всегда в конечном итоге ограничивается регуляторными (гомеостатическими) пределами (принцип соразмерности). Другими словами, модуляторы возвращают измененный показатель в пределы так называемой нормы без риска его инверсии, характерного для стимуляторов/прессоров, особенно в больших дозах. Следствием этого является еще одно отличие модуляторов от стимуляторов/прессоров – при исходно нормальном уровне функционирования выраженность эффектов модуляторов останется в пределах нормы.
Обеспечение соразмерности и реверсивности модуляторной активности возможно, если модулятор оказывает реципрокное воздействие на стимуляцию и подавление, при котором одно лимитируется другим (принцип сопряжения). Сопряжение процессов стимуляции и подавления подразумевает под собой консолидированную активацию нескольких центров и связей между ними (принцип консолидации).
Таким образом, действие модуляторов, направленное на восстановление нарушенных регуляторных процессов, по сути, является патогенетическим, а не симптоматическим, осуществляемым при участии препаратов с однонаправленной активностью, – стимуляторов/прессоров.
Классификация модуляторов может иметь развитую структуру. Препараты, влияющие на универсальные для многих клеток пути сигнальной трансдукции, следует относить к юнимодуляторам. Средства с органо– и системоспецифическим модуляторным действием подразделяются с использованием соответствующих префиксов, например: нейромодуляторы, иммуномодуляторы, инкретомодуляторы.
Чтобы вещество можно было отнести к модуляторам, оно должно соответствовать всем облигатным критериям (сопряжение, реверсивность, соразмерность и консолидация). Это предъявляет определенные требования к методикам проведения фармакологических и клинических исследований. В частности, для выявления реверсивности модуляторного действия требуется сравнение экспериментальных моделей с супротивными исходными состояниями. Определение только однонаправленных эффектов не позволит установить различия между модуляторами и стимуляторами/прессорами. Для установления соразмерности модуляторного действия необходима оценка влияния препарата в условиях нормы по сравнению с активным контролем, так как плацебо–контроль в данном случае не позволит обнаружить разницы.
Первым препаратом, у которого была выявлена модуляторная активность и на модели которого была сформулирована модуляторная концепция, стал Фенотропил – (RS)–2–(2–оксо–4–фенилпирролидин–1–ил) ацетамид. В спектре его фармакологической активности были выявлены противоположные эффекты, такие как психостимулирующий и противосудорожный, или психостимулирующий и анксиолитический, что вызвало большой исследовательский интерес [3]. Изучение влияния Фенотропила на связывание с рецепторами мозга крыс in vitro показало, что препарат обладает достаточно высоким аффинитетом (ЕС50=5,86±0,17 мкМ) к никотиновым ацетилхолиновым (nACh) рецепторам гиппокампа крыс. К дофаминовым D1, D2 и D3, серотониновым 5–HT2 и глутаматным NMDA рецепторам сродства у Фенотропила выявлено не было (ЕС50>10–3M) [5]. Вместе с тем после 7–кратного в/б введения препарата в дозе 100 мг/кг/сут. характеристики рецепторного связывания существенно изменились: величины Вmax (максимальная плотность рецепторов) для D1 и 5–HT2 рецепторов уменьшались в сравнении с контролем на 20 и 18% соответственно. Аналогичные показатели для D3, nACh и NMDA рецепторов, напротив, существенно возросли: на 30, 58 и 67% соответственно. Во всех случаях значения Kd (величина аффинитета лиганда к рецептору) не отличались от таковых в контроле. Нейрональные пресинаптические nACh–рецепторы модулируют высвобождение дофамина, серотонина, глутамата, ГАМК и самого ацетилхолина в головном мозге [45]. Этим объясняется тот факт, что, связываясь с nAChR, Фенотропил изменяет плотность рецепторов к другим нейромедиаторам, что доказывает его способность влиять на эндогенные нейромодуляторные механизмы.
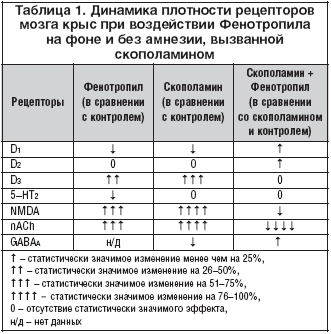
Специфическое модуляторное действие Фенотропила как лекарственного препарата исследовалось на мембранных препаратах, выделенных из различных компетентных структур мозга крыс (стриатум, фронтальная кора, гиппокамп), после научения животных в тесте УРПИ в норме и на фоне амнезии, вызванной м–холиноблокатором скополамином. Ex vivo оценивалось влияние Фенотропила на группы рецепторов дофамина (D1, D2 и D3), серотонина (5–HT2), глутамата (NMDA), ГАМК (GABAA) и ацетилхолина (nACh). Животные были разделены на три основные группы: контрольная группа (I), группа животных, подвергнутых амнестическому воздействию скополамина (II), и группа животных, получавших Фенотропил (100 мг/кг, в/б) на фоне скополаминовой амнезии (III).
Установлено, что скополамин вызывает существенные изменения во всех изученных рецепторных системах нейромедиаторов ЦНС крыс, за исключением 5–HT2 и D2 рецепторов. Эти изменения проявлялись в увеличении плотности Bmax дофаминовых рецепторов подгруппы D3 в стриатуме (на 62% по сравнению с контролем), глутаматных NMDA рецепторов гиппокампа (на 93%), nACh рецепторов коры (на 95%), а также в уменьшении плотности стриатных рецепторов подгруппы D1 (на 20%) и бензодиазепиновых мест связывания GABAA рецепторов (на 17%).
У животных III группы под воздействием препарата наблюдалась полная или частичная реверсия показателя Bmax большинства рецепторных подгрупп в сторону контрольных значений. Так, плотность nACh и GABAA рецепторов коры и D1 рецепторов стриатума восстанавливалась до нормы полностью, количество NMDA рецепторов гиппокампа обращалось в сторону контрольного значения на 24%. Во всех случаях значения аффинитета Кd не отличались значимо от таковых в контроле.
Сопоставление данных первого и второго исследований показывает (табл. 1), что воздействие Фенотропила отличается противоположными эффектами на плотность nACh, NMDA и D1 рецепторов в зависимости от наличия или отсутствия патологии (амнезии, вызванной скополамином), реализуя принцип реверсивности модуляторного действия. Выраженность эффектов Фенотропила соразмерна степени влияния скополамина и направлена на их нивелирование вплоть до исходного состояния. Сопряженность процессов активации и подавления обеспечивает повышение плотности одних рецепторов и уменьшение других, а включение нескольких нейромедиаторных систем свидетельствует о консолидации модуляции. Таким образом, Фенотропил соответствует всем четырем облигатным критериям модуляторной активности, в данном случае – нейромодуляции.
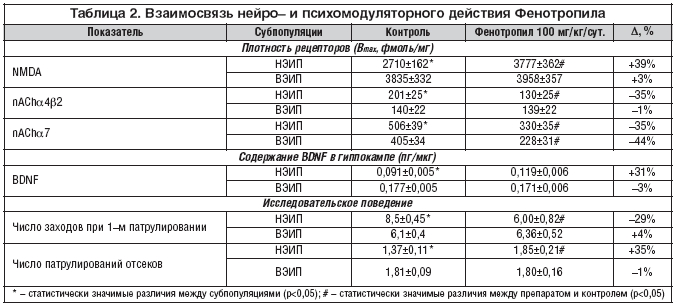
Корреляция между нейромодуляторным и психомодуляторным эффектами Фенотропила была установлена в сравнительном исследовании действия препарата у мышей с различной врожденной исследовательской активностью. Исходная популяция генетически гетерогенных аутбредных мышей линии 1CR была разделена на две субпопуляции: с высокой (ВЭИП) и низкой (НЭИП) эффективностью исследовательского поведения по результатам тестирования в крестообразном лабиринте. Статистически значимо различаясь по числу заходов в отсеки и по общему числу патрулирований, выделенные субпопуляции не отличались по показателям, характеризующим двигательную активность (продолжительность пребывания мышей в центральном и тупиковом отсеках) и степень тревожности (время латентного периода 1–го захода и продолжительность 1–го захода в боковой отсек), что дало основание использовать данный метод разделения в качестве неинвазивной модели когнитивного дефицита. В обеих субпопуляциях животным посредством внутрибрюшинных инъекций в течение 5 дней 1 раз/сут. вводили Фенотропил либо физиологический раствор, затем их повторно тестировали в лабиринте, после чего проводили эксперименты ex vivo [8].
Как показал радиолигандный анализ, у мышей с НЭИП плотность NMDA рецепторов в гиппокампе была значительно меньше (в 1,4 раза), а высокоаффинных nACh типа α4β2 и низкоаффинных nACh типа α7 в коре – значительно больше (в 1,4 и в 1,2 раза соответственно), чем у мышей с ВЭИП (табл. 2). Действие Фенотропила на 39% увеличило плотность NMDA рецепторов и на 35% понизило плотность nACh рецепторов у мышей с НЭИП, приведя эти показатели к значениям, изначально свойственным животным с ВЭИП. В то же время у мышей с ВЭИП применение препарата не оказало существенного влияния на плотность NMDA и высокоаффинных nACh рецепторов. Методом иммуноферментного анализа было установлено, что субпопуляция мышей с ВЭИП отличается большим содержанием BDNF в гиппокампе, чем субпопуляция с НЭИП (на 94%). В группе животных с ВЭИП, получавших Фенотропил, достоверного изменения уровня BDNF в гиппокампе не обнаружено. Напротив, в группе с НЭИП под действием препарата установлено статистически значимое увеличение уровня BDNF.
Результаты нейрохимических исследований соотносились с оценками исследовательского поведения животных. Так, в результате применения Фенотропила мыши с НЭИП в среднем выполняли тест на уровне средних показателей мышей с ВЭИП, тогда как у последних каких–либо значимых изменений поведения после приема препарата не происходило.
Таким образом, в данном исследовании была выявлена связь между эффективностью исследовательского поведения и функциональным состоянием нейронов. Кроме того, было продемонстрировано, что общим между нейротропными (нейропластические процессы) и психотропными (влияние на поведение) эффектами Фенотропила является их модуляторный характер. Действие препарата – как нейро–, так и психомодуляторное – зависело от исходного уровня функционирования организма и проявлялось особенно выраженно там, где имели место функциональные отклонения.
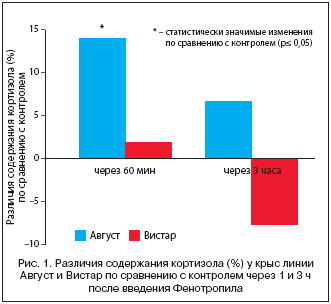
Ранее было установлено, что в условиях негативного стресса Фенотропил снижает повышенный уровень кортизола [1] – важного звена в гипоталамо–гипофизарно–надпочечниковой системе реагирования на стресс [37]. Для выявления модуляторного влияния препарата на уровень кортизола было предпринято исследование оценки его действия в отсутствие стресса при внутрибрюшинном введении половозрелым белым крысам самцам линий Август (генетически низкоустойчивых к стрессу) и Вистар (генетически высокоустойчивых к стрессу). Контрольным животным вводилась дистиллированная вода. В контрольных группах животных не было выявлено достоверного изменения уровня кортизола в крови по сравнению с группой интактных крыс ни через 60 мин., ни по истечении 3 ч после введения дистиллированной воды, что является фактом, указывающим на отсутствие стресс–негативной реакции на саму процедуру введения препаратов в исследуемый период. Уровень кортизола в контрольной группе Август (39,6±1,7 нмоль/л) был на 20,2% ниже, чем у животных линии Вистар (49,6±3,4 нмоль/л), то есть у генетически низкоустойчивых к стрессу животных кортизол был исходно снижен. Введение Фенотропила в группе Август через 60 мин. дало величины кортизола в среднем на 14,1% больше по сравнению с контролем, а в группе Вистар показатель лишь на 2% отличался от контрольного. Через 3 ч после введения препарата в группе Август сохранился более высокий уровень кортизола по сравнению с контролем (на 6,8%), а в группе Вистар величина кортизола была на 7,6% меньше, чем у контрольных животных (рис. 1).
Результаты исследований влияния Фенотропила на уровень кортизола у крыс выявляют реверсивное действие препарата в отношении гормона. Если в условиях стресса Фенотропил снижает повышенный уровень кортизола, то при отсутствии стресса препарат значительно действует на уровень кортизола только у животных с исходно низким уровнем гормона, соразмерно повышая его до величины, характерной для стресс–устойчивой линии, что свидетельствует о наличии у препарата инкретомодуляторной активности, направленной на повышение стресс–устойчивости.
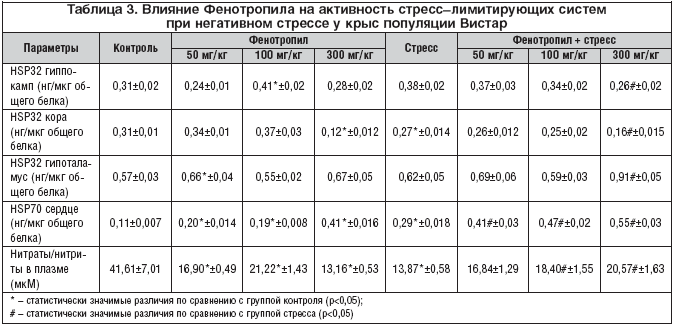
Были проведены исследования влияния Фенотропила на клеточные компоненты противодействия окислительному (оксидативному) стрессу, к которым относятся, в частности, белки теплового шока (HSP) и система продукции оксида азота (NO). Препарат способствовал увеличению уровня HSP32, гем–оксигеназы, защищающей клетки от окислительного повреждения «свободным» гемом, в структурах головного мозга у крыс линии Вистар по сравнению с контролем. При этом в гиппокампе и коре эффект был более выражен при дозе 100 мг/кг, а в гипоталамусе – при дозе 50 мг/кг. Стресс вызывал у крыс незначительное повышение HSP32 в гиппокампе, значимое снижение – в коре и незначительное влияние на ее содержание – в гипоталамусе. Действие Фенотропила при стрессе в дозе 50 мг/кг и 100 мг/кг проявлялось тенденцией к сохранению уровня HSP32 в коре, гиппокампе и гипоталамусе на том же уровне, который возник при стрессе. В дозе 300 мг/кг препарат, по всей видимости, сам усиливал отрицательные влияния окислительного стресса, судя по однонаправленному падению уровня HSP32 в коре и гиппокампе и росту – в гипоталамусе как у интактных животных, так и при стрессе (табл. 3).
Кроме HSP32, среди шаперонов большее внимание привлекают белки семейства HSP70, включающие как конституциональные, так и индуцибельные формы. Увеличение экспрессии HSP70 обеспечивает устойчивость клетки к температурному воздействию, гипоксии, ишемии и воспалению, а ингибирование накопления HSP70 с помощью блокирующих агентов нарушает эту устойчивость [30].
Оценка влияния Фенотропила на содержание HSP70 в сердце у крыс показала, что препарат в дозах 50 мг/кг и 100 мг/кг незначительно повышает его уровень по сравнению с контролем у интактных животных. При этом разницы между эффектами двух доз препарата не отмечается. В условиях стресса Фенотропил дозозависимо повышает содержание HSP70 в два и более раза как по сравнению со своим действием у интактных животных, так и по сравнению с влиянием одного стресса. Полученные результаты позволяют утверждать, что Фенотропил является ко–индуктором HSP70 с потенциальным кардиопротекторным эффектом (табл. 3).
К числу защитных систем организма относят также систему генерации оксида азота (NO), являющегося универсальным физиологическим регулятором многих процессов, протекающих в организме. Важной особенностью системы генерации NO является способность ограничивать избыточный синтез NO, высокая концентрация которого является токсичной. Ограничение гиперпродукции NO осуществляется по принципу отрицательной обратной связи самим же NO. Благодаря наличию такого механизма адаптивное усиление синтеза NO оказывает благоприятное действие не только при его дефиците, но и может предупреждать нарушения, связанные с его избытком [6].
Как показало исследование, в котором продукцию NO оценивали по уровню нитритов/нитратов в плазме периферической крови, негативный стресс вызывал значительное снижение метаболитов оксида азота в организме у крыс Вистар. Такое влияние на NO могут оказывать как гипоксия, так и кортизол, чьи уровни возрастают при стрессе. Результаты влияния Фенотропила на содержание метаболитов NO показывают, что препарат, с одной стороны, снижает уровень NO (в наименьшей степени – в дозе 100 мг/кг) у интактных животных, а с другой – ограничивает снижение уровня NO, вызванное стрессом (табл. 3). Снижение содержания нитритов/нитратов на фоне действия Фенотропила не может быть объяснено усилением гипоксии и повышением уровня кортизола, так как для препарата доказаны обратные эффекты. По всей видимости, Фенотропил влияет на депонирование NO, что объясняет снижение содержания нитритов/нитратов у интактных животных, а в условиях дефицита NO, вызванного, например, стрессом, происходит высвобождение ранее запасенного NO, что и ограничивает его стресс–индуцированное падение.
Влияние разных доз Фенотропила на показатели стресс–лимитирующией системы организма характеризовалось тем, что повышение устойчивости к стрессу у интактных животных наряду со стресс–лимитирующим действием при стрессе свидетельствует о соразмерной реверсивности действия препарата – разнонаправленности эффектов в зависимости от исходного состояния организма – оптимально выраженной в дозе 100 мг/кг.
Впервые представленные оригинальные свойства Фенотропила позволили сформулировать основные положения инновационной модуляторной концепции. Приведенные выше данные свидетельствуют о том, что активность Фенотропила как модуляторного препарата реализует базовые принципы модуляторной концепции: соразмерность (коррекция как измененных воздействием негативного стресса, так и первоначально отклоненных от нормальных пределов параметров), реверсивность (диаметрально противоположная модальность эффектов в зависимости от исходного состояния организма), сопряженность (реципрокное взаимодействие процессов активации и подавление) и консолидация (опосредованное влияние на структурно–функциональные центры и связи, их образующие).
Анализ проведенных фундаментальных исследований доказывает наличие у Фенотропила как специфической – нейромодуляторной, так и универсальной – юнимодуляторной активности. Универсальное модуляторное действие препарата приобретает особую актуальность в аспекте возможности реализации широты спектра его клинико–фармакологического эффектов (психостимулирующий, антиастенический, антиамнестический, мнемотропный, анксиолитический, вегетостабилизирующий, антидепрессивный, нейролептический, противосудорожный, антигипоксический, антиишемический, антитоксический, противовоспалительный, слендерный, антиапоптозный, реювенационный и др.), позволяющей оптимизировать подходы к терапии различных заболеваний.
Выделение модуляторной активности как одного из базовых свойств фармакологических препаратов способствует решению назревшей к настоящему времени проблемы классификации лекарственных средств. s
© Материалы статьи защищены авторскими правами и правами интеллектуальной собственности в соответствии с законодательством РФ и международными
правовыми актами.
Материалы не подлежат перепечатке.
При использовании материалов для научных публикаций и иной информации ссылка на авторов
и источник информации обязательна.
1 Регуляторные расстройства – нарушения, связанные с антенатально или постнатально обусловленными дефектами регуляторных механизмов энергообеспечения тканей и органов в снижении приспособительных возможностей и ограничений адаптационных резервов организма [4].
2 Концепция «нейромедиаторных систем», играющих самостоятельные роли в функционировании нервной системы, стала следствием так называемого «принципа Дейла» [18], в котором утверждалось, что один нейрон может содержать лишь один нейротрансмиттер, оказывающий либо возбуждающее, либо тормозное действие. Данный постулат сформировался во времена, когда многие медиаторы еще не были открыты, а функции рецепторов не были изучены. С позиций современной нейробиологии медиаторы не определяют в полной мере информационное содержание тех сигналов, в передаче которых они участвуют. Практически любой нейротрансмиттер может оказывать как возбуждающее, так и тормозное действие в зависимости от места, времени и условий своей активности [11,29,42,43]. При этом основная сигнальная роль принадлежит, по–видимому, рецепторам, полиморфизм которых и предопределяет сигнальную дифференциацию [27,40].
3 Первоначально предполагалось существование лишь однонаправленной связи одного рецептора с одним G–белком, обладающей единственной эффекторной характеристикой. Последующие исследования доказали стохастический характер взаимодействий между рецепторами, G–белками и их эффекторами [36]. Концепция сигнальных биохимических сетей обосновывает взаимодействие рецепторов с одним или несколькими G–белками, связанными в свою очередь с одним или несколькими эффекторами, перекрестные влияния которых сказываются на регуляции клеточных функций как на поверхности мембраны, так и в цитозоле, а также во многих клеточных компартментах, включая ядро [32,44]. В результате даже небольшие изменения в структуре рецепторов, обусловленные, например, полиморфизмом кодирующих их генов, могут иметь серьезные последствия для сигнальных путей и приводить к глубоким плейотропным изменениям в функционировании клетки [12].
Литература
1. Ахапкина В.И. Адаптогеннное действие ноотропных лекарственных средств при экспериментальном стрессе у животных // Фарматека. 2004. № 14. С. 121–125.
2. Ахапкина В.И. Выявление и оценка нейромодуляторной активности фенотропила // Материалы IX Всероссийского съезда неврологов, Ярославль.. 2006. C. 551.
3. Ахапкина В.И., Воронина Т.А. Спектр фармакологических эффектов фенотропила // Фенотропил. Экспериментально–клиническая фармакология и практическое применение. М., 2006. С. 2–10.
4. Вейн А.М. Заболевания вегетативной нервной системы // Под ред. А.М. Вейна. М.: Медицина, 1991. 624 с.
5. Ковалев Г.И., Ахапкина В.И., Абаимов Д.А., Фирстова Ю.Ю. Фенотропил как рецепторный модулятор синаптическойнейропередачи // Атмосфера, Нервные болезни. 2007. № 4. С. 22–26.
6. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота // Биохимия. 1998. Т. 63, №7. С. 992–1006.
7. Трубецков Д.И., Мчедлова Е.С., Красичников Л.В. Введение в теорию самоорганизации открытых систем. – 2–е изд. – М.: Физматлит, 2005. – 212 с.
8. Фирстова Ю.Ю., Салимов Р.М., Ковалев Г.И. Влияние фенотропила на нейрохимические особенности и поведение у мышей с высокой и низкой эффективностью исследовательского поведения в лабиринте // Материалы III съезда фармакологов России «Фармакология – практическому здравоохранению». СПб., 2007. С. 1992.
9. Bertalanffy L. von. General System Theory – A Critical Review // General Systems. 1962. Vol. VII. P. 1–20.
10. Bohlen und Halbach O., Dermietzel R. Neurotransmitters and Neuromodulators: Handbook of Receptors and Biological Effects. 2002. 292 p.
11. Cherubini E., Gaiarsa J. L., Ben–Ari Y. GABA: an excitatory transmitter in early postnatal life. // Trends in Neurosciences. 1991. Vol. 14 (12). P. 515–519.
12. Clapham D.E. Mutations in G protein–linked receptors: Novel insights on disease // Cell. 1993. Vol. 75. P. 1237–1239.
13. Cooper J.R., Bloom F.E., Roth R.H. The biochemical basis of neuropharmacology. New York, 2002. 416 p.
14. De Robertis E., Bennett H. S. // Fed. Prec. 1954. Vol. 13. P. 35.
15. Descarries L., Beaudet A., Watkins K.C. Serotonin nerve terminals in adult rat neocortex // Brain Res. 1975. Vol. 100. P. 563–588.
16. Descarries L., Watkins K.C., Lapierre Y. Noradrenergic axon terminals in the cerebral cortex of rat. III. Topometricultrastructural analysis // Brain Res. 1977. Vol. 133. P. 197–222.
17. Dunn A.J., Swiergiel A.H., de Beaurepaire R. Cytokines as mediators of depression: what can we learn from animal studies? // NeurosciBiobehav Rev. 2005. Vol. 29 (4–5). P. 891–909.
18. Eccles J.C., Fatt P., Koketsu K. Cholinergic and inhibitory synapses in a pathway from motor–axon collaterals to motoneurones // J Physiol (Lond). 1954. Vol. 126. P. 524–562.
19. Florey E. Neurotransmitters and modulators in the animal kingdom // Federation. Proc. 1967. Vol. 26. P. 1164–1178.
20. Greenfield S. Brain drugs of the future // BMJ. 1998. Vol. 317. P. 1698–1701.
21. Herkenham M. Mismatch between neurotransmitter and receptor localisation in brain: observations and implications // Neuroscience, 1987. Vol. 23. P. 1–38.
22. Hokfelt T. In vitro studies on central and peripheral monoamine neurons at the ultrastructural level // Z ZellforschMikrosk Anat. 1968. Vol. 91. P. 1–74.
23. Kaczmarek L.K., Levitan I.B. Neuromodulation. The Biochemical Control of Neuronal Excitability. New York, 1987. 286 p.
24. Kandel E.R., Schwartz J.H., Jessell T.M. Principles of Neural Science, 4th ed., McGraw–Hill. New York, 2000. P. 229–250.
25. Katz P.S. Beyond Neurotransmission: Neuromodulation and Its Importance for Information Processing . 1999. 391 p.
26. Kupfermann I. Modulatory actions of neurotransmitters // Ann. Rev. Neurosci. 1979. Vol. 2. P. 447–465.
27. Limbird L.E. The receptor concept: a continuing evolution // Molecular Interventions, ASPET. 2004. Vol. 4 (6). P. 326–336.
28. McGehee D.S., Role L.W. Presynaptic ionotropic receptors // Current Opinion in Neurobiology. 1996. Vol. 6. P. 342–349.
29. Michelson H., Wong R.K.S. Excitatory synaptic responses mediated by GABAA receptors in the hippocampus // Science. 1991. Vol. 253. P. 1420–1423.
30. Mizzen L.A., Welch W.J. Characterization of the thermotolerant cell. I. Effects on protein synthesisactivity and the regulation of heat–shock protein 70 expression // J. Cell Biol. 1988. Vol. 106. P. 1105–1116.
31. Moore M.R., Black P.M. Neuropeptides // Neurosurg Rev. 1991. Vol. 14(2). P. 97–110.
32. Neves S.R., Ram P.T., Iyengar R. G protein pathways // Science. 2002. Vol. 296. P. 1636–1639.
33. Palade G. E. // Anat. Re?. 1954. Vol. 118. P. 335.
34. Paul S.M., Purdy R.H. Neuroactive steroids // FASEBJ. 1992. Vol. 6. P. 2311–2322.
35. Pfluger H.–J., Buschges A. Neuromodulation of Microcircuits in Motor Systems: Invertebrates // Report of the 93rd Dahlem Workshop on Microcircuits: The Interface between Neurons and Global Brain Function. Berlin, 2004. P. 60.
36. Rohrer D.K., Kobilka B.K. Insights from in vivo modification of adrenergic receptor gene expression // Annu. Rev. Pharmacol. Toxicol. 1998. Vol. 38. P. 351–373.
37. Selye H. Hormones and Resistance // Journal of Pharmaceutical Sciences, 1971. Vol. 60 (1). P. 1–28.
38. Sherrington C.S. The Integrative Action of the Nervous System. Scribner. New York, 1906.
39. Silva D.G., Ross G., Osborne L.W. Adrenergic innervation of the ileum of the cat // Am J Physiol. 1971. Vol. 220. P. 347–352.
40. Simon M.I., Strathmann M.P., Gautam N. Diversity of G proteins in signal transduction // Science. 1991. Vol. 252 (5007). P. 802–808.
41. Vizi E.S., Fekete A., Karoly R., Mike A. Non–synaptic receptors and transporters involved in brain functions and targets of drug treatment // Br J Pharmacol. 2010. Vol. 160 (4). P. 785–809.
42. Wagner S., Castel M., Gainer H., Yarom Y. GABA in the mammalian suprachiasmatic nucleus and its role in diurnal rhythmicity // Nature. 1997. Vol. 387. P. 598–603.
43. Wang Z., Orchard I., Lange A. B., Chen X., Starratt A. N. A single receptor transduces both inhibitory and stimulatory signals of FMRFamide–related peptides // Peptides. 1995. Vol. 16. P. 1181–1186.
44. Weng G., Bhalla U.S., Iyengar R. Complexity in biological systems // Science. 1999. Vol. 284. P. 92–96.
45. Wonnacott S., Mogg A., Bradly A., Jones I. Presynaptic nicotinic acetylcholine receptors: subtypes mediating neurotransmitter release // Nicotinic Receptors in the Nervous System (Frontiers in Neuroscience). 2001. P. 30.












